5.2.4硝酸 课件(共23张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.4硝酸 课件(共23张ppt)化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 32.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-09 20:11:04 | ||
图片预览







文档简介
(共23张PPT)
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
5.1.4 HNO3
学习目标
1. 能运用氧化还原反应知识理解硝酸的氧化性;
2. 结合实验探究,认识硝酸在相关反应中体现的不稳定性和强氧化性,知道硝酸是重要的化工原料;
3.了解SO2、NO2对大气质量的影响,特别是酸雨的成因、危害及防治措施。
《本草纲目拾遗》记载:(硝酸)西洋人所造,性最猛,能蚀五金。王怡堂先生云:其水至强,五金八石皆能穿滴,惟玻璃可盛。
HNO3=H++NO3- (强酸)
硝酸的物理性质
纯硝酸是无色、易挥发(沸点是83℃)、有刺激性气味的液体,
硝酸可以与水以任意比互溶,质量分数为98%以上的硝酸叫发烟硝酸。
【思考】浓硝酸久置后呈黄色,为什么?
浓硝酸见光或受热时发生反应
1、浓HNO3的不稳定性
一般将浓硝酸保存在棕色试剂瓶中,并避光放置于阴凉处
4HNO3(浓) ===== 4NO2↑+O2↑+2H2O
或光照
△
硝酸的化学性质
实验如何保存浓硝酸?
问题:
浓度越大,越易分解
硝酸泄漏
浓硝酸见光或受热会分解生成NO2,
NO2溶于浓硝酸使溶液显黄色。
如何去除浓硝酸的黄色?
2、硝酸的酸性
HNO3=H++NO3-
①与指示剂反应:
稀硝酸使石蕊溶液由紫色变为红色,
浓硝酸使紫色石蕊溶液先变红(酸性)后褪色(强氧化性)
②与碱反应:
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O
③与碱性氧化物反应:
CuO+2HNO3=Cu(NO3)2+H2O
④与弱酸盐反应:
CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O
硝酸的化学性质
HNO3与Fe(OH)2如何反应?
问题:
3、硝酸的强氧化性
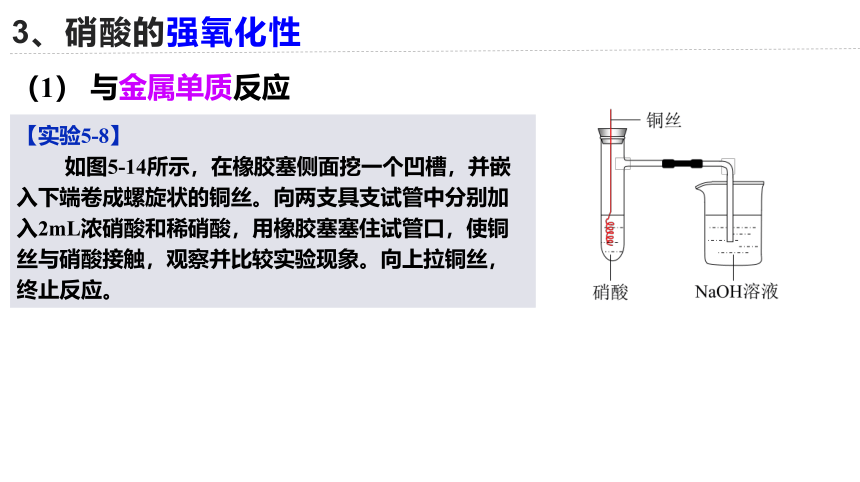
【实验5-8】
如图5-14所示,在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
(1) 与金属单质反应
硝酸与铜
HNO3与金属反应:氧化性、酸性
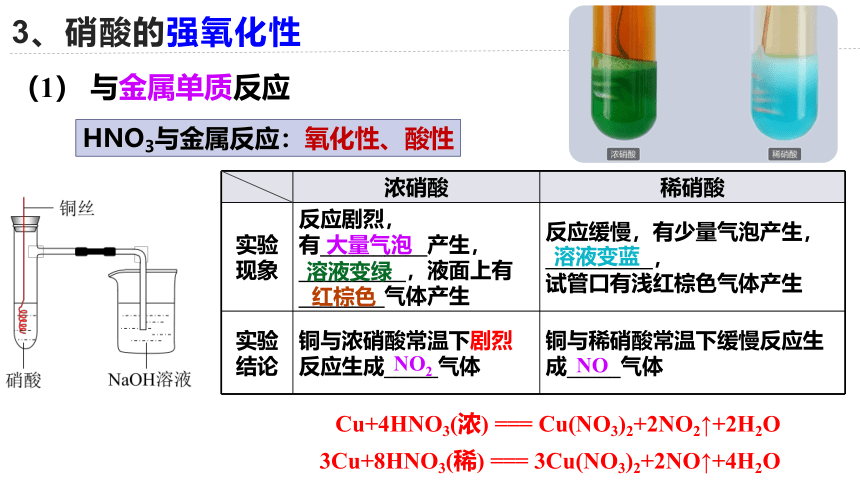
3、硝酸的强氧化性
(1) 与金属单质反应
浓硝酸 稀硝酸
实验 现象 反应剧烈, 有__________产生,__________,液面上有________气体产生 反应缓慢,有少量气泡产生,__________,
试管口有浅红棕色气体产生
实验 结论 铜与浓硝酸常温下剧烈反应生成_____气体 铜与稀硝酸常温下缓慢反应生成_____气体
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
溶液变蓝
NO
大量气泡
溶液变绿
红棕色
NO2
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
NO、NO2的混合气体
Cu + 4HNO3(浓) === Cu(NO3)2 + 2NO2↑ + 2H2O
2. 教材“硝酸具有很强的氧化性,硝酸的浓度不同,与金属反应的产物也不同”,浓硝酸、稀硝酸与Cu的反应产物分别为NO2、NO,反应中,稀硝酸中氮元素的化合价降低较多,说明稀硝酸的氧化性比浓硝酸强,对吗
3Cu + 8HNO3(稀) === 3Cu(NO3)2 + 2NO↑+ 4H2O
深度思考
1. 足量的铜与一定量的浓硝酸反应,得到气体的成分是什么?
氧化性:浓硝酸 > 稀硝酸
浓HNO3反应更剧烈
3. 铜投入到稀硫酸中不会溶解,再向溶液中投入KNO3固体,
铜会不会溶解?为什么?
深度思考
4. 若铜与硝酸反应后,硝酸不足而铜剩余,向反应体系中加入稀硫酸,
铜是否继续溶解?若溶解,发生什么反应?
常温下浓硝酸能使Fe、Al发生钝化
加热时:
Al + 6HNO3(浓) === Al(NO3)3+ 3NO2↑+ 3H2O
△
Fe+6HNO3(浓) === Fe(NO3)3+3NO2↑+3H2O
△
3、硝酸的强氧化性
(1) 与金属单质反应
问题:
Fe与稀硝酸反应放出无色气体,溶液变棕黄色。
你能写出Fe与稀硝酸反应的方程式吗?
Fe + 4HNO3(稀) == Fe(NO3)3 + NO↑ + 2H2O ( Fe少量)
Fe + 4H+ + NO3- == Fe3+ + NO↑ + 2H2O ( Fe少量)
①Fe与稀硝酸的反应中,为什么有的同学会观察到红棕色气体?
②还有的同学发现当铁粉过量时溶液会成浅绿色?
2NO+O2 = 2NO2
铁粉少量
Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O
Fe + 2Fe(NO3)3 = 3Fe(NO3)2
+
×2
铁粉过量
3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O
深度思考
3Fe + 8H+ + 2NO3- = Fe2+ + 2NO↑ + 4H2O
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
金属与硝酸反应一般不产生H2,
一般浓硝酸被还原为NO2,稀硝酸被还原为NO
浓、稀硝酸都有强氧化性,氧化性:浓硝酸>稀硝酸
能氧化绝大部分金属生成硝酸盐 (除Pt、Au),
硝酸既体现强氧化性,又体现酸性。
3、硝酸的强氧化性
(1) 与金属单质反应
C+4HNO3(浓) = 2H2O+4NO2↑+CO2↑
△
HNO3与非金属单质反应:氧化性
试一试:硝酸具有强氧化性,试写出浓硝酸与S、C的反应
3、硝酸的强氧化性
(2) 与非金属单质反应
(3)与还原性离子的反应
硝酸可以氧化某些还原剂(如H2S, HI, HBr, SO2, Na2SO3, Fe2+等)
S+6HNO3(浓) = H2SO4+6NO2↑+2H2O
△
二战时期 玻尔巧藏金奖章
实验探究
浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水,能使一些不溶于硝酸的金属如金、铂等溶解。
资料卡片——王水
VHNO3:VHCl = 1:3 组成的混合物
记忆方法 :“三言(盐)一笑(硝)”
Au + HNO3 + 4HCl == H[AuCl4] + NO↑ + 2H2O
3Pt + 4HNO3 + 18HCl == 3H2[PtCl6] + 4NO↑ + 8H2O
在pH=1 溶液中,能大量共存的离子组是( )
A. NH4+、I- 、NO3-、Br- B. S2-、Na+ 、SO32 - 、NO3-
C. Cu2+、NO3-、Na+ 、Cl- D. Fe2+ 、K+ 、NO3- 、SO42–
在酸性溶液中(H+),NO3-具有强氧化性,与S2-、SO32- 、I- 、Fe2+、Br- 等不能共存。
C
课堂练习
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,
铜粉溶解的是( )
① FeCl3 ② Fe2O3 ③ Cu(NO3) 2 ④ KNO3
A.只有①或②
B.只有②或④
C.只有①或②或③
D.①②③④中任意一种
D
课堂练习
课堂练习
【教材P18 T5】
物质类别
化合价
氢化物
单质
氧化物
酸
盐
-3
0
+2
+5
+4
N2
HNO3
NO
NO2
NH3
硝酸盐
NH3·H2O
酸
NH4+
N元素的价类二维图
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是 ( )
① ② ③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
D
课堂练习
g.mol-1
M=m/n
Na
6.02X1023mol-1
n=N/M
摩尔(mol)
n
M
课后练习:
《学法大视野》P15 预习·自主整理《学法大视野》P17 [练3]
《学法大视野》P17 练习·效果测评 T3、T6
《课时作业》P128 T4
《课时作业》P129 T8、T9、T12
《课时作业》P130 T14、T15
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
5.1.4 HNO3
学习目标
1. 能运用氧化还原反应知识理解硝酸的氧化性;
2. 结合实验探究,认识硝酸在相关反应中体现的不稳定性和强氧化性,知道硝酸是重要的化工原料;
3.了解SO2、NO2对大气质量的影响,特别是酸雨的成因、危害及防治措施。
《本草纲目拾遗》记载:(硝酸)西洋人所造,性最猛,能蚀五金。王怡堂先生云:其水至强,五金八石皆能穿滴,惟玻璃可盛。
HNO3=H++NO3- (强酸)
硝酸的物理性质
纯硝酸是无色、易挥发(沸点是83℃)、有刺激性气味的液体,
硝酸可以与水以任意比互溶,质量分数为98%以上的硝酸叫发烟硝酸。
【思考】浓硝酸久置后呈黄色,为什么?
浓硝酸见光或受热时发生反应
1、浓HNO3的不稳定性
一般将浓硝酸保存在棕色试剂瓶中,并避光放置于阴凉处
4HNO3(浓) ===== 4NO2↑+O2↑+2H2O
或光照
△
硝酸的化学性质
实验如何保存浓硝酸?
问题:
浓度越大,越易分解
硝酸泄漏
浓硝酸见光或受热会分解生成NO2,
NO2溶于浓硝酸使溶液显黄色。
如何去除浓硝酸的黄色?
2、硝酸的酸性
HNO3=H++NO3-
①与指示剂反应:
稀硝酸使石蕊溶液由紫色变为红色,
浓硝酸使紫色石蕊溶液先变红(酸性)后褪色(强氧化性)
②与碱反应:
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O
③与碱性氧化物反应:
CuO+2HNO3=Cu(NO3)2+H2O
④与弱酸盐反应:
CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O
硝酸的化学性质
HNO3与Fe(OH)2如何反应?
问题:
3、硝酸的强氧化性
【实验5-8】
如图5-14所示,在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
(1) 与金属单质反应
硝酸与铜
HNO3与金属反应:氧化性、酸性
3、硝酸的强氧化性
(1) 与金属单质反应
浓硝酸 稀硝酸
实验 现象 反应剧烈, 有__________产生,__________,液面上有________气体产生 反应缓慢,有少量气泡产生,__________,
试管口有浅红棕色气体产生
实验 结论 铜与浓硝酸常温下剧烈反应生成_____气体 铜与稀硝酸常温下缓慢反应生成_____气体
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
溶液变蓝
NO
大量气泡
溶液变绿
红棕色
NO2
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
NO、NO2的混合气体
Cu + 4HNO3(浓) === Cu(NO3)2 + 2NO2↑ + 2H2O
2. 教材“硝酸具有很强的氧化性,硝酸的浓度不同,与金属反应的产物也不同”,浓硝酸、稀硝酸与Cu的反应产物分别为NO2、NO,反应中,稀硝酸中氮元素的化合价降低较多,说明稀硝酸的氧化性比浓硝酸强,对吗
3Cu + 8HNO3(稀) === 3Cu(NO3)2 + 2NO↑+ 4H2O
深度思考
1. 足量的铜与一定量的浓硝酸反应,得到气体的成分是什么?
氧化性:浓硝酸 > 稀硝酸
浓HNO3反应更剧烈
3. 铜投入到稀硫酸中不会溶解,再向溶液中投入KNO3固体,
铜会不会溶解?为什么?
深度思考
4. 若铜与硝酸反应后,硝酸不足而铜剩余,向反应体系中加入稀硫酸,
铜是否继续溶解?若溶解,发生什么反应?
常温下浓硝酸能使Fe、Al发生钝化
加热时:
Al + 6HNO3(浓) === Al(NO3)3+ 3NO2↑+ 3H2O
△
Fe+6HNO3(浓) === Fe(NO3)3+3NO2↑+3H2O
△
3、硝酸的强氧化性
(1) 与金属单质反应
问题:
Fe与稀硝酸反应放出无色气体,溶液变棕黄色。
你能写出Fe与稀硝酸反应的方程式吗?
Fe + 4HNO3(稀) == Fe(NO3)3 + NO↑ + 2H2O ( Fe少量)
Fe + 4H+ + NO3- == Fe3+ + NO↑ + 2H2O ( Fe少量)
①Fe与稀硝酸的反应中,为什么有的同学会观察到红棕色气体?
②还有的同学发现当铁粉过量时溶液会成浅绿色?
2NO+O2 = 2NO2
铁粉少量
Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O
Fe + 2Fe(NO3)3 = 3Fe(NO3)2
+
×2
铁粉过量
3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O
深度思考
3Fe + 8H+ + 2NO3- = Fe2+ + 2NO↑ + 4H2O
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
金属与硝酸反应一般不产生H2,
一般浓硝酸被还原为NO2,稀硝酸被还原为NO
浓、稀硝酸都有强氧化性,氧化性:浓硝酸>稀硝酸
能氧化绝大部分金属生成硝酸盐 (除Pt、Au),
硝酸既体现强氧化性,又体现酸性。
3、硝酸的强氧化性
(1) 与金属单质反应
C+4HNO3(浓) = 2H2O+4NO2↑+CO2↑
△
HNO3与非金属单质反应:氧化性
试一试:硝酸具有强氧化性,试写出浓硝酸与S、C的反应
3、硝酸的强氧化性
(2) 与非金属单质反应
(3)与还原性离子的反应
硝酸可以氧化某些还原剂(如H2S, HI, HBr, SO2, Na2SO3, Fe2+等)
S+6HNO3(浓) = H2SO4+6NO2↑+2H2O
△
二战时期 玻尔巧藏金奖章
实验探究
浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水,能使一些不溶于硝酸的金属如金、铂等溶解。
资料卡片——王水
VHNO3:VHCl = 1:3 组成的混合物
记忆方法 :“三言(盐)一笑(硝)”
Au + HNO3 + 4HCl == H[AuCl4] + NO↑ + 2H2O
3Pt + 4HNO3 + 18HCl == 3H2[PtCl6] + 4NO↑ + 8H2O
在pH=1 溶液中,能大量共存的离子组是( )
A. NH4+、I- 、NO3-、Br- B. S2-、Na+ 、SO32 - 、NO3-
C. Cu2+、NO3-、Na+ 、Cl- D. Fe2+ 、K+ 、NO3- 、SO42–
在酸性溶液中(H+),NO3-具有强氧化性,与S2-、SO32- 、I- 、Fe2+、Br- 等不能共存。
C
课堂练习
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,
铜粉溶解的是( )
① FeCl3 ② Fe2O3 ③ Cu(NO3) 2 ④ KNO3
A.只有①或②
B.只有②或④
C.只有①或②或③
D.①②③④中任意一种
D
课堂练习
课堂练习
【教材P18 T5】
物质类别
化合价
氢化物
单质
氧化物
酸
盐
-3
0
+2
+5
+4
N2
HNO3
NO
NO2
NH3
硝酸盐
NH3·H2O
酸
NH4+
N元素的价类二维图
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是 ( )
① ② ③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
D
课堂练习
g.mol-1
M=m/n
Na
6.02X1023mol-1
n=N/M
摩尔(mol)
n
M
课后练习:
《学法大视野》P15 预习·自主整理《学法大视野》P17 [练3]
《学法大视野》P17 练习·效果测评 T3、T6
《课时作业》P128 T4
《课时作业》P129 T8、T9、T12
《课时作业》P130 T14、T15
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
