2.3.3分子间的作用力 课件(共26张ppt)化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.3分子间的作用力 课件(共26张ppt)化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-09 20:13:51 | ||
图片预览





文档简介
(共26张PPT)
第二章 分子结构与性质
第三节 分子结构与物质性质
第3课时 分子间的作用力
1、创意菜中干冰除了制造烟雾效果外还可以保持低温,为什么?
2、干冰汽化有没有破坏化学键?为什么会吸热呢?
干冰汽化吸收热量
没有,说明干冰分子之间存在着相互作用力
想
想
一
研究表明分子之间普遍存在着相互作用力,而荷兰物理学家范德华是最早研究这种作用力的科学家,因而把这种分子间作用力称为范德华力。
一、范德华力
1、概念:范德华力是固体、液体和气体中分子之间普遍存在的一种相互作用力。
例如:共价化合物(CO2、H2SO4、HF、 H2O、 AlCl3等)
非金属单质(H2、P4、S8、C60等)
稀有气体
金刚石、单质硅和SiO2中只有共价键,不存在分子!
2、本质:是分子之间的一种静电作用。
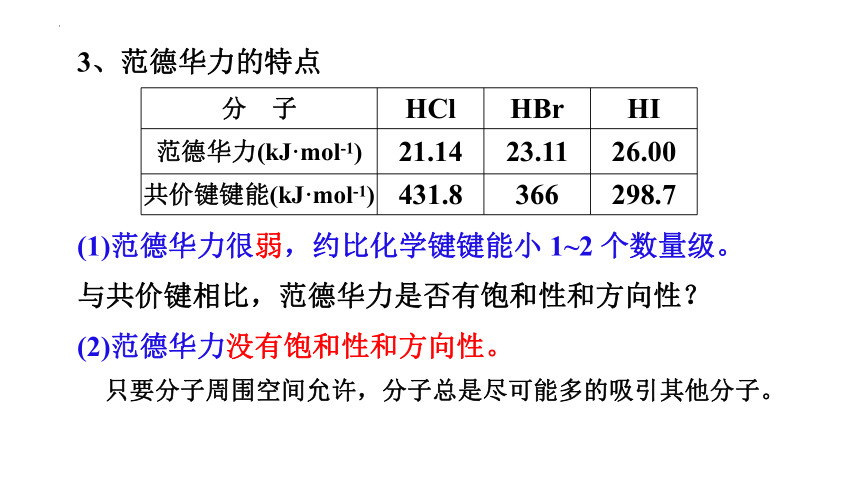
3、范德华力的特点
分 子 HCl HBr HI
范德华力(kJ·mol-1) 21.14 23.11 26.00
共价键键能(kJ·mol-1) 431.8 366 298.7
(1)范德华力很弱,约比化学键键能小 1~2 个数量级。
与共价键相比,范德华力是否有饱和性和方向性?
(2)范德华力没有饱和性和方向性。
只要分子周围空间允许,分子总是尽可能多的吸引其他分子。
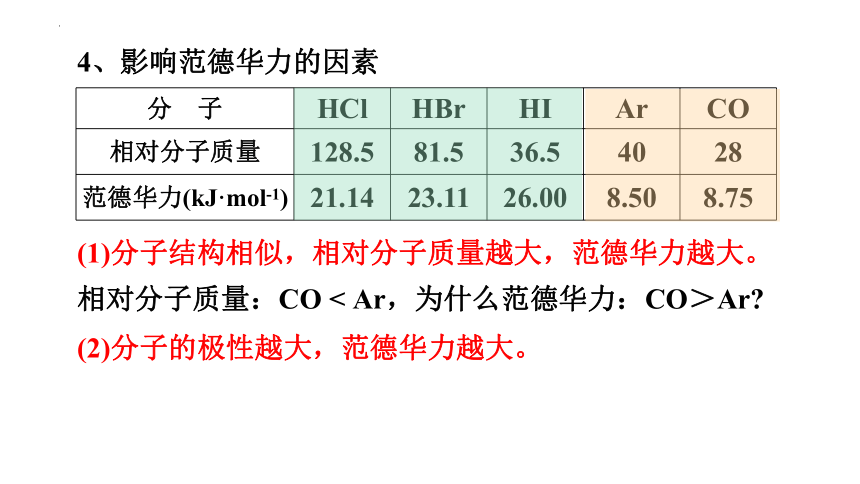
4、影响范德华力的因素
分 子 HCl HBr HI Ar CO
相对分子质量 128.5 81.5 36.5 40 28
范德华力(kJ·mol-1) 21.14 23.11 26.00 8.50 8.75
(1)分子结构相似,相对分子质量越大,范德华力越大。
(2)分子的极性越大,范德华力越大。
相对分子质量:CO < Ar,为什么范德华力:CO>Ar
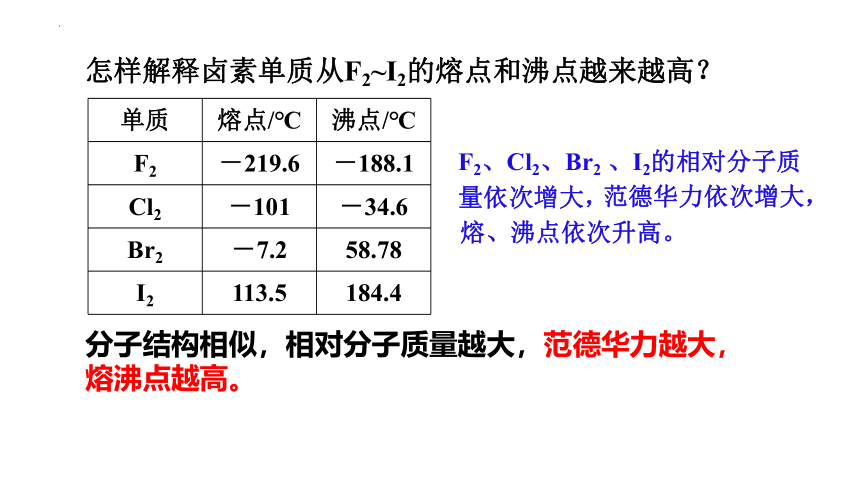
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
怎样解释卤素单质从F2~I2的熔点和沸点越来越高?
分子结构相似,相对分子质量越大,范德华力越大,熔沸点越高。
F2、Cl2、Br2 、I2的相对分子质量依次增大,
范德华力依次增大,
熔、沸点依次升高。
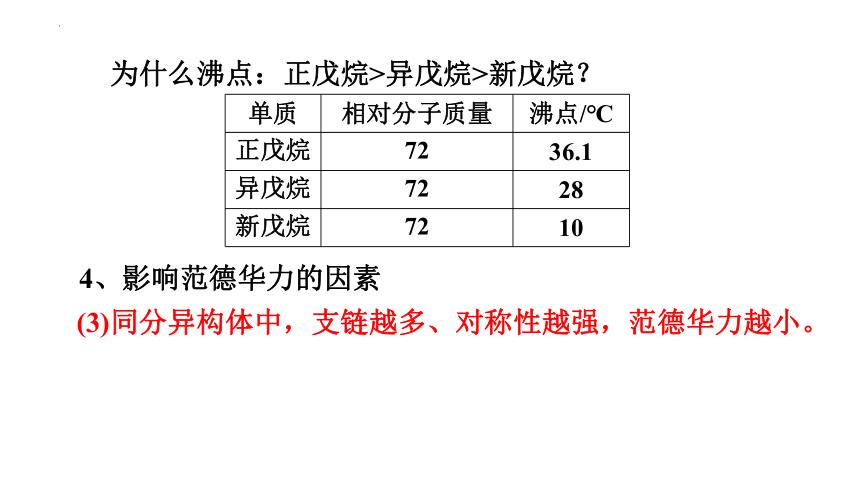
单质 相对分子质量 沸点/℃
正戊烷 72 36.1
异戊烷 72 28
新戊烷 72 10
为什么沸点:正戊烷>异戊烷>新戊烷?
4、影响范德华力的因素
(3)同分异构体中,支链越多、对称性越强,范德华力越小。
填写下列空格:
(1)N2的沸点比CO的沸点___(填“高”或“低”),其原因是________________________________________________________________________________。
(2)BCl3的沸点比BF3的___(填“高”或“低”),其原因是___________________________________________________。
低
N2为非极性分子,CO为极性分子,且二者相对分子质量相近,极性分子间的范德华力较强,沸点更高。
高
BCl3与BF3的结构相似,BCl3的相对分子质量大,范德华力强
(3)下列变化或事实与范德华力无关的是___(填字母)。
A.CO2气体加压或降温时变成干冰
B.CS2的沸点高于N2 C.食盐熔化
C
(4)比较下列物质熔、沸点高低:D2O_____H2O CH4_____SiH4 HCl、HBr、HI:______________
>
<
HCl(5)比较HCl、HBr、HI的稳定性顺序:____________,由分子构成的物质的稳定性与范德华力是否相关:___________________________________________。
HCl>HBr>HI
键能大小影响分子的热稳定性,
范德华力的大小影响物质的熔、沸点。
夏天经常见到许多壁虎在墙壁或天花板上爬却掉不下来,为什么?
科学 技术 社会
解析:壁虎不能掉下的根本原因是壁虎足上的大量细毛与天花板之间存在范德华力。
范德华力的应用
思考1:预测第IVA族元素的简单氢化物的沸点相对大小
与预测结果相符
一般规律:同一主族非金属氢化物,从上到下,相对分子质量逐渐增大,熔沸点逐渐升高。
思考2:HF、H2O、NH3的沸点为什么反常?
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他分子间作用力。
氢键
H
H
H
H
δ+
δ-
在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,大大加强了水分子间的作用力,使水的熔沸点较高。这种静电作用就是氢键。
静电吸引
氢键
二、氢键
1、概念:它是由已经与电负性很大的原子形成共价键的H原子与另一分子中电负性很大的原子之间的作用力。
2、表示方法:X—H Y
共价键
氢键
X、Y为N、O、F
3、形成条件:
即含有N—H键、O—H键、F—H键中的一种。
一种静电吸引作用
: 不属于化学键!
4、氢键的特点:
方向性:X-H···Y尽可能在同一条直线上
饱和性:一个X-H只能和一个Y原子结合
共价键键能(kJ·mol-1) 范德华力(kJ·mol-1) 氢键(kJ·mol-1)
冰 462.8 23.11 26.00
5、氢键的强弱:
氢键比化学键的键能小1~2个数量级,但比范德华力强。
强度:化学键 > 氢键 > 范德华力
5、氢键的强弱:
电负性越大,氢键越强。
如:F原子电负性最大,因而F-H…F是最强的氢键;
原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > N-H…N
C原子吸引电子能力较弱,一般不形成氢键。
X—H···Y的强弱,与X和Y的电负性有关。
6、氢键的类型
邻羟基苯甲醛
对羟基苯甲醛
分子间氢键
分子内氢键
熔点:-7 ℃
熔点:115 ℃
熔、沸点升高
熔、沸点降低
7、氢键的对物质性质的影响
(1)熔、沸点
形成分子内氢键:
形成分子间氢键:
(2)溶解度
溶质和溶剂分子间形成氢键:
溶解度增大
溶质分子间形成氢键:
溶解度减小
如:NH3极易溶于水的原因之一是NH3与H2O分子间能形成氢键
如溶解度:NaHCO37、氢键的对物质性质的影响
(3)水结冰后体积膨胀,浮在水面
常温下液态水中除了含有简单H2O外,还含有通过氢键联系在一起的缔合分子(H2O)n等。一个水分子的氧原子与另一个水分子的氢原子沿该氧原子的一个sp3杂化轨道的方向形成氢键,因此当所有H2O全部缔合——结冰后,所有的H2O按一定的方向全部形成了氢键,成为晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
冰的结构
生物大分子中的氢键:
——DNA双螺旋通过氢键使得碱基互补配对
生物大分子中的氢键
下列事实与氢键有关的是( )
①NH3的熔、沸点比PH3的高
②乙醇、醋酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HCl比HI的沸点低
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.①②③④⑤ B.①②③⑤
C.①②③④ D.①②④⑤
B
过氧化氢(H2O2)是一种医用杀菌消毒剂,已知H2O2分子的结构如下图所示。H2O2分子不是直线形,两个H原子犹如在半展开的书的两面纸上,书面夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。试回答:
(1)下列关于的说法正确的是_______。
a.该分子中有极性键
b.该分子中有非极性键
c.该分子中氧原子的轨道发生sp2杂化
d.该分子是非极性分子
(2)H2O2分子间易形成氢键,该氢键的表示式是_____________。
(3)H2O2难溶于CS2,主要原因是_____________________________。
(4)H2O2易溶于水,主要原因是_______________________________。
ab
O—H···O
H2O2为极性分子,CS2为非极性分子
H2O2易与H2O分子间形成氢键且H2O和H2O2均为极性分子
化学键 范德华力 氢键
存在范围 分子内,原子间 分子之间 分子之间
作用力 强弱 较强 比化学键的键能小1~2个数量级 比化学键的键能小1~2个数量级
对物质性质的影响 主要影响 化学性质 主要影响物理性质(如熔、沸点) 主要影响物理性质
(如熔、沸点)
【归纳小结】
第二章 分子结构与性质
第三节 分子结构与物质性质
第3课时 分子间的作用力
1、创意菜中干冰除了制造烟雾效果外还可以保持低温,为什么?
2、干冰汽化有没有破坏化学键?为什么会吸热呢?
干冰汽化吸收热量
没有,说明干冰分子之间存在着相互作用力
想
想
一
研究表明分子之间普遍存在着相互作用力,而荷兰物理学家范德华是最早研究这种作用力的科学家,因而把这种分子间作用力称为范德华力。
一、范德华力
1、概念:范德华力是固体、液体和气体中分子之间普遍存在的一种相互作用力。
例如:共价化合物(CO2、H2SO4、HF、 H2O、 AlCl3等)
非金属单质(H2、P4、S8、C60等)
稀有气体
金刚石、单质硅和SiO2中只有共价键,不存在分子!
2、本质:是分子之间的一种静电作用。
3、范德华力的特点
分 子 HCl HBr HI
范德华力(kJ·mol-1) 21.14 23.11 26.00
共价键键能(kJ·mol-1) 431.8 366 298.7
(1)范德华力很弱,约比化学键键能小 1~2 个数量级。
与共价键相比,范德华力是否有饱和性和方向性?
(2)范德华力没有饱和性和方向性。
只要分子周围空间允许,分子总是尽可能多的吸引其他分子。
4、影响范德华力的因素
分 子 HCl HBr HI Ar CO
相对分子质量 128.5 81.5 36.5 40 28
范德华力(kJ·mol-1) 21.14 23.11 26.00 8.50 8.75
(1)分子结构相似,相对分子质量越大,范德华力越大。
(2)分子的极性越大,范德华力越大。
相对分子质量:CO < Ar,为什么范德华力:CO>Ar
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
怎样解释卤素单质从F2~I2的熔点和沸点越来越高?
分子结构相似,相对分子质量越大,范德华力越大,熔沸点越高。
F2、Cl2、Br2 、I2的相对分子质量依次增大,
范德华力依次增大,
熔、沸点依次升高。
单质 相对分子质量 沸点/℃
正戊烷 72 36.1
异戊烷 72 28
新戊烷 72 10
为什么沸点:正戊烷>异戊烷>新戊烷?
4、影响范德华力的因素
(3)同分异构体中,支链越多、对称性越强,范德华力越小。
填写下列空格:
(1)N2的沸点比CO的沸点___(填“高”或“低”),其原因是________________________________________________________________________________。
(2)BCl3的沸点比BF3的___(填“高”或“低”),其原因是___________________________________________________。
低
N2为非极性分子,CO为极性分子,且二者相对分子质量相近,极性分子间的范德华力较强,沸点更高。
高
BCl3与BF3的结构相似,BCl3的相对分子质量大,范德华力强
(3)下列变化或事实与范德华力无关的是___(填字母)。
A.CO2气体加压或降温时变成干冰
B.CS2的沸点高于N2 C.食盐熔化
C
(4)比较下列物质熔、沸点高低:D2O_____H2O CH4_____SiH4 HCl、HBr、HI:______________
>
<
HCl
HCl>HBr>HI
键能大小影响分子的热稳定性,
范德华力的大小影响物质的熔、沸点。
夏天经常见到许多壁虎在墙壁或天花板上爬却掉不下来,为什么?
科学 技术 社会
解析:壁虎不能掉下的根本原因是壁虎足上的大量细毛与天花板之间存在范德华力。
范德华力的应用
思考1:预测第IVA族元素的简单氢化物的沸点相对大小
与预测结果相符
一般规律:同一主族非金属氢化物,从上到下,相对分子质量逐渐增大,熔沸点逐渐升高。
思考2:HF、H2O、NH3的沸点为什么反常?
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他分子间作用力。
氢键
H
H
H
H
δ+
δ-
在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,大大加强了水分子间的作用力,使水的熔沸点较高。这种静电作用就是氢键。
静电吸引
氢键
二、氢键
1、概念:它是由已经与电负性很大的原子形成共价键的H原子与另一分子中电负性很大的原子之间的作用力。
2、表示方法:X—H Y
共价键
氢键
X、Y为N、O、F
3、形成条件:
即含有N—H键、O—H键、F—H键中的一种。
一种静电吸引作用
: 不属于化学键!
4、氢键的特点:
方向性:X-H···Y尽可能在同一条直线上
饱和性:一个X-H只能和一个Y原子结合
共价键键能(kJ·mol-1) 范德华力(kJ·mol-1) 氢键(kJ·mol-1)
冰 462.8 23.11 26.00
5、氢键的强弱:
氢键比化学键的键能小1~2个数量级,但比范德华力强。
强度:化学键 > 氢键 > 范德华力
5、氢键的强弱:
电负性越大,氢键越强。
如:F原子电负性最大,因而F-H…F是最强的氢键;
原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > N-H…N
C原子吸引电子能力较弱,一般不形成氢键。
X—H···Y的强弱,与X和Y的电负性有关。
6、氢键的类型
邻羟基苯甲醛
对羟基苯甲醛
分子间氢键
分子内氢键
熔点:-7 ℃
熔点:115 ℃
熔、沸点升高
熔、沸点降低
7、氢键的对物质性质的影响
(1)熔、沸点
形成分子内氢键:
形成分子间氢键:
(2)溶解度
溶质和溶剂分子间形成氢键:
溶解度增大
溶质分子间形成氢键:
溶解度减小
如:NH3极易溶于水的原因之一是NH3与H2O分子间能形成氢键
如溶解度:NaHCO3
(3)水结冰后体积膨胀,浮在水面
常温下液态水中除了含有简单H2O外,还含有通过氢键联系在一起的缔合分子(H2O)n等。一个水分子的氧原子与另一个水分子的氢原子沿该氧原子的一个sp3杂化轨道的方向形成氢键,因此当所有H2O全部缔合——结冰后,所有的H2O按一定的方向全部形成了氢键,成为晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
冰的结构
生物大分子中的氢键:
——DNA双螺旋通过氢键使得碱基互补配对
生物大分子中的氢键
下列事实与氢键有关的是( )
①NH3的熔、沸点比PH3的高
②乙醇、醋酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HCl比HI的沸点低
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.①②③④⑤ B.①②③⑤
C.①②③④ D.①②④⑤
B
过氧化氢(H2O2)是一种医用杀菌消毒剂,已知H2O2分子的结构如下图所示。H2O2分子不是直线形,两个H原子犹如在半展开的书的两面纸上,书面夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。试回答:
(1)下列关于的说法正确的是_______。
a.该分子中有极性键
b.该分子中有非极性键
c.该分子中氧原子的轨道发生sp2杂化
d.该分子是非极性分子
(2)H2O2分子间易形成氢键,该氢键的表示式是_____________。
(3)H2O2难溶于CS2,主要原因是_____________________________。
(4)H2O2易溶于水,主要原因是_______________________________。
ab
O—H···O
H2O2为极性分子,CS2为非极性分子
H2O2易与H2O分子间形成氢键且H2O和H2O2均为极性分子
化学键 范德华力 氢键
存在范围 分子内,原子间 分子之间 分子之间
作用力 强弱 较强 比化学键的键能小1~2个数量级 比化学键的键能小1~2个数量级
对物质性质的影响 主要影响 化学性质 主要影响物理性质(如熔、沸点) 主要影响物理性质
(如熔、沸点)
【归纳小结】
