2023年中考化学二轮复习 专题二 实验探究题课件(共56张PPT)
文档属性
| 名称 | 2023年中考化学二轮复习 专题二 实验探究题课件(共56张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-10 11:08:03 | ||
图片预览








文档简介
(共56张PPT)
模块二 二轮复习·专题强化
专题二 实验探究题
类型1 物质成分、性质的探究
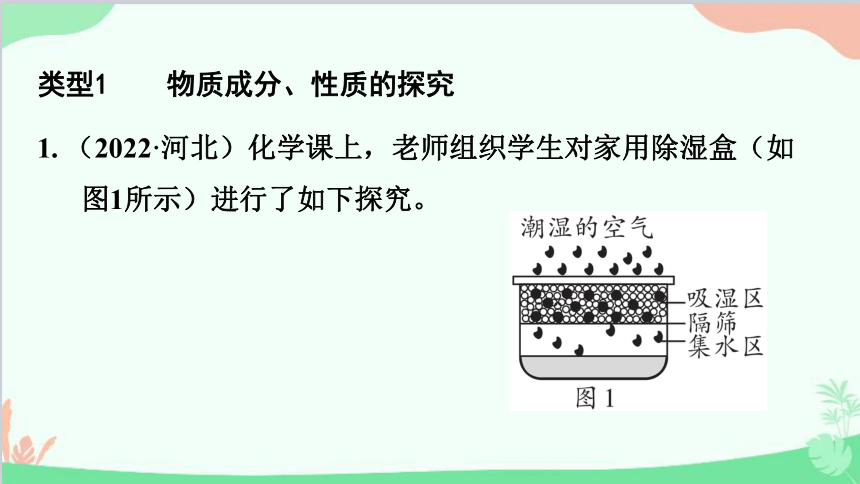
1. (2022·河北)化学课上,老师组织学生对家用除湿盒(如图1所示)进行了如下探究。
【资料信息】
◆吸湿区内黑色颗粒是活性炭,白色颗粒是初中化学一种常见物质。
◆使用一段时间后,集水区内有大量液体和少量固体,且气温越低固体越多。
【知识应用】除湿盒内活性炭的作用是除去空气中的异味,利用了其________性。
【提出问题】白色颗粒是什么物质?
【作出猜想】猜想Ⅰ:氧化钙 猜想Ⅱ:氢氧化钠
猜想Ⅲ:氯化钙
猜想依据:氧化钙能与水反应,氢氧化钠和氯化钙在空气中容易________水分。
【交流讨论】从安全性考虑,因为氢氧化钠具有强烈的________,所以否定了猜想Ⅱ。
吸附
吸收
腐蚀性
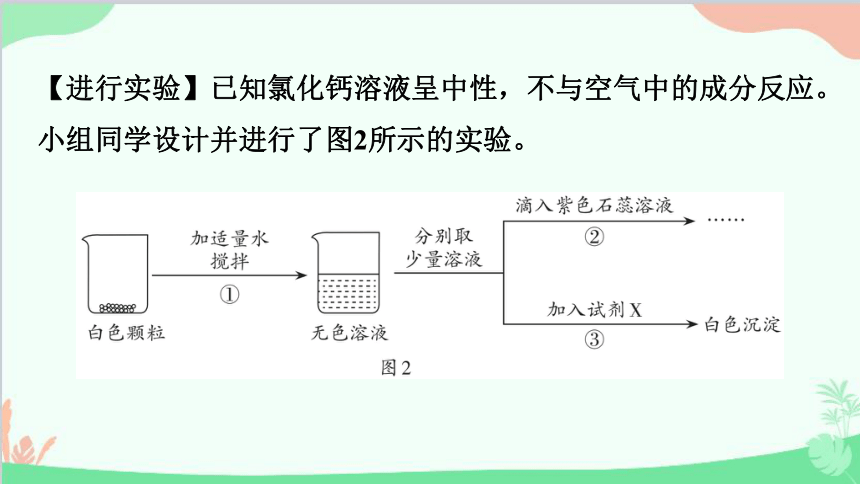
【进行实验】已知氯化钙溶液呈中性,不与空气中的成分反应。小组同学设计并进行了图2所示的实验。
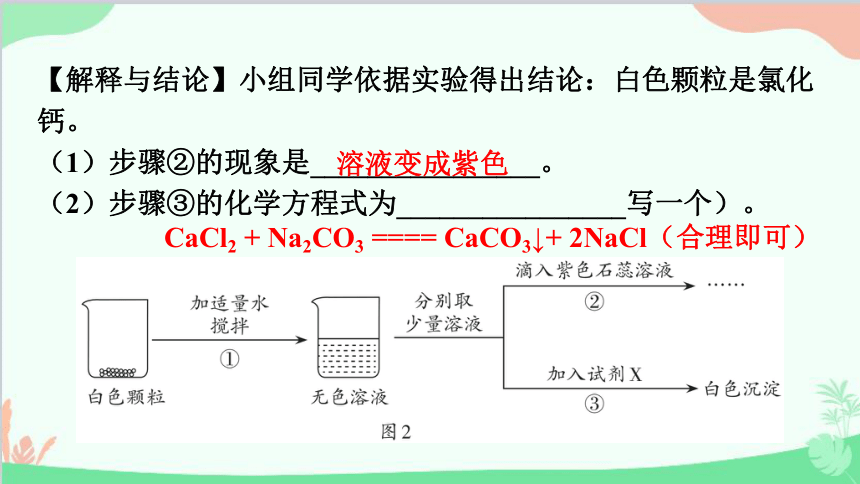
【解释与结论】小组同学依据实验得出结论:白色颗粒是氯化钙。
(1)步骤②的现象是________________。
(2)步骤③的化学方程式为________________写一个)。
溶液变成紫色
CaCl2 + Na2CO3 ==== CaCO3↓+ 2NaCl(合理即可)
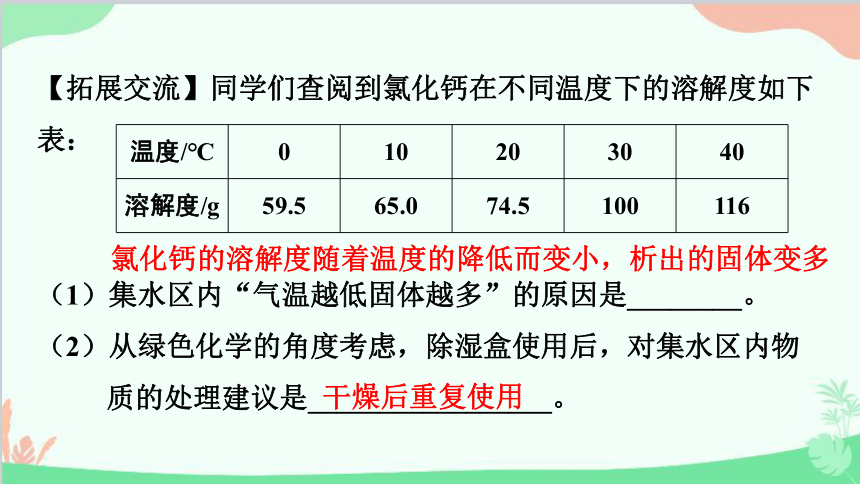
【拓展交流】同学们查阅到氯化钙在不同温度下的溶解度如下表:
(1)集水区内“气温越低固体越多”的原因是________。
(2)从绿色化学的角度考虑,除湿盒使用后,对集水区内物质的处理建议是_________________。
温度/℃ 0 10 20 30 40
溶解度/g 59.5 65.0 74.5 100 116
氯化钙的溶解度随着温度的降低而变小,析出的固体变多
干燥后重复使用
2. (2022·百色)在校园“消防日”活动中,老师带领学生使用干粉灭火器进行模拟灭火演练。化学兴趣小组收集灭火后残留的白色固体,探究其成分。(不考虑杂质的影响)
【查阅资料】①干粉灭火器的主要成分为NaHCO3。②NaHCO3受热分解生成Na2CO3、二氧化碳和水;Na2CO3受热不分解。③NaHCO3溶液呈碱性,且不与BaCl2溶液发生反应。
【提出猜想】猜想一:固体成分为NaHCO3;
猜想二:固体成分为________;
猜想三:固体成分为NaHCO3和Na2CO3。
【进行实验】
Na2CO3
实验步骤 实验现象 实验结论
小东同学取少量白色固体于试管中,加水溶解,再滴入无色酚酞溶液 无色酚酞溶液变红 猜想一成立
【提出质疑】小玫认为小东得出的结论不准确,理由是_____________________________________________________。
【实验探究】兴趣小组的同学继续进行实验。
碳酸氢钠溶液和碳酸钠溶液都是碱性溶液,都能使酚酞溶液变红
实验步骤 实验现象 实验结论
①________ 澄清石灰水变浑浊 固体中含有 NaHCO3
②另取少量白色固体于试管中,加水使之完全溶解,再滴加BaCl2溶液 ______________ 发生反应的化学方程为________________,固体中含有Na2CO3
取少量白色固体于试管中并加热,将生成的气体通入澄清石灰水中
产生白色沉淀
Na2CO3 + BaCl2 == BaCO3↓+ 2NaCl
【实验结论】猜想三正确。
【拓展延伸】上述实验步骤②________(填“能”或“不能”)用Ba(NO3)2溶液代替BaCl2溶液,理由是________。
能
碳酸钠和硝酸钡也能发生反应生成碳酸钡白色沉淀和硝酸钠
3. (2022·广州)某校学生用盐酸和碳酸钙制备CO2,产生了大量废液。兴趣小组通过以下研究固定废液处理方案:
(1)废液成分的确定:
①写出制备CO2的化学方程式____________________________。
②推测废液所含溶质。推测一:______________
推测二:CaCl2和HCl
③若要用一种药品验证哪种推测成立,可选择的有哪些? ________(填标号)。
A. 石蕊溶液 B. AgNO3溶液 C. 锌粒 D. CuO粉末
CaCO3 + 2HCl ==== CaCl2 + H2O + CO2↑
CaCl2
ACD
(2)废液的处理:实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3除去它们。
【提出问题】如何估算Na2CO3固体的用量?
【进行实验】取100 mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。
【结果讨论】①a~b阶段,观察到烧杯中的现象是__________。
②b点后曲线平缓阶段,反应的化学方程式为________________________________________。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成。说明处理100 mL废液,所需5.3%的Na2CO3溶液的体积________120 mL
(填“大于”“等于”或“小于”)。
有气泡产生
CaCl2 + Na2CO3 ==== CaCO3↓+ 2NaCl
小于
④将烧杯中的沉淀过滤、洗涤、干燥、称重,质量为4 g。若处理10 L该废液,理论上需要Na2CO3固体________g。(实验所用Na2CO3溶液的密度近似看作1 g/cm3)
530
4. (2022·娄底)节日晚会上,小英同学表演魔术“滴水生火”,向包裹着过氧化钠(Na2O2)的脱脂棉上滴几滴水,脱脂棉着火燃烧,魔术表演成功。同学们很感兴趣,对此进行了探究,请你协助完成以下问题。
【查阅资料】①2Na2O2 + 2H2O ==== 4NaOH + O2↑,反应放出热量;
②BaCl2、CaCl2溶液显中性,Na2CO3溶液显碱性。
(1)同学们通过认真分析,从燃烧条件的角度得出了脱脂棉能燃烧的原因是________________________________________________。
(2)将燃烧后的残留固体放在烧杯中敞口放置一段时间后,加足量水溶解,无气泡产生,同学们得出结论,残留固体中不含________;同时有同学认为残留固体中可能含有Na2CO3,请用化学方程式说明理由 __________________________________。
过氧化钠与水反应生成氧气,且放出热量,使温度达到了脱脂棉的着火点
Na2O2
CO2 + 2NaOH ==== Na2CO3 + H2O
序号 实验操作 实验现象 实验结论
① 取少量滤液于试管中,滴加过量_________________________溶液 有白色沉淀产生 滤液中的溶质为Na2CO3
② 将①所得的混合液,静置,往上层清液中滴加2~3滴酚酞溶液 ________
(3)同学们将(2)所得混合液过滤,并设计实验对滤液的溶质成分进行了探究。
氯化钙(或氯化钡)
溶液不变色
(4)部分同学认为往滤液中滴加足量的稀盐酸,若产生气泡,也能得出同样的结论。你认为是否正确并说明理由__________________________________________________________________________________________________。
不正确,因为滤液中若含有氢氧化钠和碳酸钠,加入足量的稀盐酸也能产生气泡
CO2和SO2
【实验设计】
【现象与分析】
(1)装置B中酸性高锰酸钾溶液颜色变浅,说明气体中含有____________________。装置B中高锰酸钾溶液必须足量的原因是______________________________________。
(2)装置C中澄清石灰水变浑浊,说明气体中含有CO2,请写出反应的化学方程式_____________________________。
【实验结论】猜想三成立。
二氧化硫(或SO2)
使SO2完全除去,排除对CO2检验的干扰
【反思交流】
(3)若装置B与装置C位置互换,该实验设计________(填“合理”或“不合理”),理由是________________________________________________。
(4)有同学认为,木炭与浓硫酸加热后生成的产物中,除上述已验证的物质外,至少还有一种产物,理由是____________________________________________________________________________________________________。
不合理
SO2也会与Ca(OH)2反应生成沉淀,不能确定气体成分
根据质量守恒定律,反应物中有氢元素,反应产物中也一定有氢元素,则至少还有一种产物
类型2 定量数据测定的探究
6. (2022·云南节选)化学是一门以实验为基础的科学。现有一新制的碳酸钙产品,某同学设计如图所示的实验,通过测定反应生成的BaCO3的质量来确定该产品中CaCO3的含量(图中夹持仪器已略去,杂质不与盐酸反应,碱石灰是NaOH和CaO的固体混合物)。
(1)关闭止水夹,打开分液漏斗活塞,缓慢滴加盐酸至不再有气泡产生;关闭分液漏斗活塞,打开止水夹,缓缓通入空气。通入空气的作用是________________________________________________。
排净残留在装置中的CO2,以使生成的CO2完全被吸收
【解析】通入空气的作用是把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收,即排净残留在装置中的CO2,以使生成的CO2完全被吸收。
(2)装置D的作用是________________________________________________。
防止空气中的二氧化碳气体进入装置C中,产生误差
(3)实验时,称取的碳酸钙产品的质量为m1 g,反应后得到BaCO3的质量为m2 g,则该产品中CaCO3的质量分数为 ____________(用含m1和m2的代数式表示)。
7. (2022·宁波)久置的镁带表面会有一层灰黑色固体。为了测量久置镁带中金属镁的质量分数,同学们提出了两种实验方法:
物理方法:取一定质量的镁带,用砂纸打磨,除尽表面的灰黑色固体,根据剩余固体质量计算金属镁的质量分数。
化学方法:取一定质量的镁带,与足量的稀硫酸反应,根据测得生成气体的体积计算金属镁的质量分数。
(1)经讨论,同学们否定了物理方法。理由是:打磨过程中 ________________________。
(2)常温常压下氢气密度已知,因此大家认为化学方法可行。同学们从下列装置中选择合适的装置,组装并进行实验。
老师提示:镁与稀硫酸反应放热;灰黑色固体除了氧化镁之外,还存在少量碱式碳酸镁[MgCO3·Mg(OH)2],它与酸反应会产生CO2气体;碱石灰是CaO和NaOH的混合物。
可能会除去部分镁
①图C、D虚线框内有一种测量体积的仪器(未画出),该仪器是________。
②完成该实验应选择的装置为________(填字母)。
量筒
ABC
③结合实验方法和选择的装置分析,会造成实验结果不准确的是________。(填字母)
A. 加入稀硫酸不足,镁带有剩余 B. 装置气密性不好 C. 反应结束,立即读数
ABC
【解析】(2)②镁带与硫酸反应是固液不加热型,用A做发生装置,由于灰黑色固体除了氧化镁之外,还存在少量碱式碳酸镁[MgCO3·Mg(OH)2],它与酸反应会产生CO2气体,故可用碱石灰吸收二氧化碳,选B,用装置C收集氢气,氢气密度比水小,难溶于水,从短管进入,水从长管排出到量筒,量筒内水的体积即为生成氢气的体积。故选ABC。③A. 加入稀硫酸不足,镁带有剩余,导致生成的氢气的体积偏小,金属镁的质量分数偏小;B. 装置气密性不好,氢气的体积测量不准确,求得镁的质量不准确,会造成实验结果不准确;C. 镁与稀硫酸反应放热,反应结束,立即读数,氢气的体积偏大,会造成实验结果不准确。故选ABC。
8. (2022·成都)劳动实践课上同学们用草木灰给农作物施肥。课后同学查阅资料,得知草木灰是一种重要的农家肥,碳酸钾含量高。
【提出问题】如何测定草木灰中碳酸钾的含量?
【查阅资料】①常见草木灰钾含量(以碳酸钾表示)如下表:
草木灰种类 小灌木灰 稻草灰 小麦秆灰 棉壳灰 棉秆灰 向日葵秆灰
K2CO3(%) 8.66 2.63 20.26 32.28 16.44 51.97
②提取碳酸钾的主要过程:秸秆→草木灰→滤液→固体。
(1)表格中钾含量最高的草木灰是____________,同学们选用这种秸秆灰提取碳酸钾。
【设计与实验】实验一:提取碳酸钾。
第一步:燃烧秸秆,收集草木灰,称取20.00 g。
向日葵秆灰
第二步:用60 ℃水浸洗草木灰(如图1)并过滤,浸洗滤渣2次,合并滤液。
第三步:蒸发滤液,烘干得到9.90 g固体。
( 2)图1实验中,用60 ℃的温水而不用冷水浸洗的原因是_______________________________________________。
(3)根据图2,搅拌器转速控制在每分钟________转,浸取时间为________分钟,比较适宜。
相同时间内,水温高碳酸钾溶解得更快、更多,提高溶解效率
500
20
实验二:测定碳酸钾的含量。
取实验一中所得固体3.30 g进行图3实验。
(4)实验中需缓慢滴入稀硫酸,原因是______________________________________。
(5)装置B的作用是__________________。
有利于二氧化碳被氢氧化钠溶液充分吸收
吸收气体中的水蒸气
【数据与解释】(6)称量图3中反应前后烧杯和其中溶液的总质量,增重0.92 g。则草木灰中碳酸钾的质量分数为______%,与表格中数据相比明显偏低,原因可能是______(填字母)。
a. 烧杯中溶液与空气接触 b. 固体含有其他钾盐
c. 固体含有氯化钠
【反思与评价】(7)我国秸秆产量巨大,可作为生物质发电的原料,还可利用其燃烧发电产生的草木灰提取碳酸钾,其优点有____________________________(写一条)。
43.28
bc
资源综合利用(合理即可)
【解析】(3)由图2可知,钾浸取率较高时,搅拌器的转速为每分钟500转,由于时间在20分钟以后,浸取率上升不大,因此搅拌器转速控制在每分钟500转,浸取时间为20分钟时,较为适宜。(5)A中出来的二氧化碳中会带有水蒸气,为了使实验结果更加准确,装置C中增加的质量只能是二氧化碳的质量,因此B装置的作用是吸收气体中的水蒸气。(6)图3中反应前后烧杯和其中溶液的总质量,增重0.92 g,3.3 g固体和稀硫酸反应生成二氧化碳的质量为0.92 g,根据碳酸钾与产生的二氧化碳的关系,
类型3 反应条件及影响因素的探究
9. (2022·北京)絮凝剂常用于水的净化,实验小组探究用絮凝剂净水时影响净化效果的因素。
【查阅资料】絮凝剂溶于水后能够吸附水中悬浮物并发生沉降,从而达到净水目的。硫酸铁是一种常见的絮凝剂。
【进行实验】Ⅰ. 配制水样和絮凝剂溶液
配制水样:向10 L水中加入25 g高岭土,搅拌、静置,取上层液作为水样。
配制絮凝剂溶液:用100 mL水和5 g硫酸铁进行配制。
Ⅱ. 探究影响水样净化效果的因素:取水样,向其中加入絮凝剂溶液,搅拌,测定静置不同时间水样的浊度,并计算浊度去除率(浊度去除率越高代表净化效果越好)。实验记录如下:
实验序号 水样的体积/mL 加入絮凝剂溶液的体积/mL 静置时间/min 浊度去除率/%
① 200 0 20 12.48
② 200 0.2 20 76.54
③ 200 0.3 20 84.60
④ 200 0.4 5 64.45
⑤ 200 0.4 10 70.85
⑥ 200 0.4 15 81.04
⑦ 200 0.4 20 86.02
⑧ 200 0.5 20 88.15
⑨ 200 0.6 20 86.49
【解释与结论】
(1)配制絮凝剂溶液的操作如图所示。正确的操作顺序是 ________(填字母),B中用玻璃棒搅拌的目的是 ____________。
CDAB
加快溶解速率
(2)②中浊度去除率比①高的原因是_________________。
(3)依据④~⑦得出的结论是________________________________________________。
(4)探究等量水样中加入絮凝剂溶液的体积对净化效果影响的实验是________________(填序号)。
【反思与评价】(5)依据实验数据,不能得出“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”的结论,其证据是__________________。
加入了絮凝剂
其他条件相同时,静置时间越长,浊度去除率越高
②③(或⑦⑧⑨)
⑧⑨中,静置时间相同,等量水样中加入絮凝剂溶液的体积越大,浊度去除率越低
10. (2022·福建)ZB是常用的阻燃剂。已知:
Ⅰ. 用硼酸(H3BO3)与ZnO、H2O合成ZB,ZB的组成会受温度等合成条件的影响。
Ⅱ. ZB受热,先释放出水;当温度高于350 ℃,生成ZnO和B2O3固体;继续升温到400 ℃以上,B2O3熔化为玻璃态物质。
(1)ZB能起阻燃作用的原因是________(写一种)。
B2O3熔化为玻璃态物质能隔绝空气或氧气(合理即可)
(2)为研究温度对合成的ZB组成的影响,研究小组在不同温度下制取ZB。实验如下:
x、y分别为________和________。
m(H3BO3)/g m(ZnO)/g V(H2O)/mL t/℃
实验1 28 10 100 94
实验2 x 10 100 98
实验3 28 y 100 102
28
10
(3)为检测102 ℃时合成的ZB含水的质量分数,某同学利用如图1装置(夹持仪器已略)进行实验。
①需要不断通入干燥的空气的目的是______________________。
②实验时,需要称量获得的数据有:ZB样品的质量、________的质量。
使产生的水蒸气全部从玻璃管中排出
含样品的玻璃直管加热前后(合理即可)
①低于200 ℃时,两份木材粉末质量均保持不变的原因是 ________________。
②图中曲线______(填“a”或“b”)对应的
木材粉末是经ZB处理的,
判断的理由是______________________________。
(5)为寻找阻燃性能最佳的ZB的合成温度,应开展的实验是 ________。
木材还没有燃烧
a
曲线a对应的固体残留率比b的大
在相同条件下,分别取不同温度下合成的ZB,进行木材粉末灼烧残重实验
【解析】(2)要研究温度对合成的ZB组成的影响,根据控制变量法,变量只有一个温度,其他量相同,故x = 28;y = 10。(4)②ZB能起阻燃作用,故固体残留率大,故a对应的木材粉末是经ZB处理的,判断的理由是曲线a对应的固体残留率比b的大。
类型4 实验操作中异常现象的探究
11. (2022·丽水)小丽和小科在做“金属与酸反应”的实验时,他们分别将镁条投入盛有稀盐酸的试管中,小丽加入少量镁条,而小科加入了足量镁条。一段时间后,小科的试管底部“意外”地出现了灰白色固体。为探究该固体是什么物质,他们开展了如下探究:
【提出问题】足量镁和稀盐酸反应生成的灰白色固体是什么?
【查阅资料】氢氧化镁和碱式氯化镁[Mg(OH)Cl]都难溶于水,但都能与稀硝酸反应,后者能生成Mg(NO3)2和HCl。
【建立假设】假设1:未溶解完的氯化镁;假设2:氢氧化镁;假设3:碱式氯化镁;……
【进行实验】将灰白色固体过滤、充分洗涤后进行如下实验:
序号 实验操作 实验现象 实验结论
实验一 取少量灰白色固体于试管中,加入足量蒸馏水,充分振荡 固体不溶解 假设1 ________
实验二 取少量灰白色固体于试管中,加入足量稀硝酸,充分振荡 固体溶解 假设2不成立
往上述溶液中滴加硝酸银溶液 ________
不成立
产生白色沉淀
【评价交流】小丽认为该灰白色固体一定是碱式氯化镁。小科认为上述探究还不足以说明该固体就是碱式氯化镁,其理由是_____________________________________________________。
【继续探究】……
只证明了氯元素的存在,未证明碱式氯化镁中的其他元素
谢谢大家!
模块二 二轮复习·专题强化
专题二 实验探究题
类型1 物质成分、性质的探究
1. (2022·河北)化学课上,老师组织学生对家用除湿盒(如图1所示)进行了如下探究。
【资料信息】
◆吸湿区内黑色颗粒是活性炭,白色颗粒是初中化学一种常见物质。
◆使用一段时间后,集水区内有大量液体和少量固体,且气温越低固体越多。
【知识应用】除湿盒内活性炭的作用是除去空气中的异味,利用了其________性。
【提出问题】白色颗粒是什么物质?
【作出猜想】猜想Ⅰ:氧化钙 猜想Ⅱ:氢氧化钠
猜想Ⅲ:氯化钙
猜想依据:氧化钙能与水反应,氢氧化钠和氯化钙在空气中容易________水分。
【交流讨论】从安全性考虑,因为氢氧化钠具有强烈的________,所以否定了猜想Ⅱ。
吸附
吸收
腐蚀性
【进行实验】已知氯化钙溶液呈中性,不与空气中的成分反应。小组同学设计并进行了图2所示的实验。
【解释与结论】小组同学依据实验得出结论:白色颗粒是氯化钙。
(1)步骤②的现象是________________。
(2)步骤③的化学方程式为________________写一个)。
溶液变成紫色
CaCl2 + Na2CO3 ==== CaCO3↓+ 2NaCl(合理即可)
【拓展交流】同学们查阅到氯化钙在不同温度下的溶解度如下表:
(1)集水区内“气温越低固体越多”的原因是________。
(2)从绿色化学的角度考虑,除湿盒使用后,对集水区内物质的处理建议是_________________。
温度/℃ 0 10 20 30 40
溶解度/g 59.5 65.0 74.5 100 116
氯化钙的溶解度随着温度的降低而变小,析出的固体变多
干燥后重复使用
2. (2022·百色)在校园“消防日”活动中,老师带领学生使用干粉灭火器进行模拟灭火演练。化学兴趣小组收集灭火后残留的白色固体,探究其成分。(不考虑杂质的影响)
【查阅资料】①干粉灭火器的主要成分为NaHCO3。②NaHCO3受热分解生成Na2CO3、二氧化碳和水;Na2CO3受热不分解。③NaHCO3溶液呈碱性,且不与BaCl2溶液发生反应。
【提出猜想】猜想一:固体成分为NaHCO3;
猜想二:固体成分为________;
猜想三:固体成分为NaHCO3和Na2CO3。
【进行实验】
Na2CO3
实验步骤 实验现象 实验结论
小东同学取少量白色固体于试管中,加水溶解,再滴入无色酚酞溶液 无色酚酞溶液变红 猜想一成立
【提出质疑】小玫认为小东得出的结论不准确,理由是_____________________________________________________。
【实验探究】兴趣小组的同学继续进行实验。
碳酸氢钠溶液和碳酸钠溶液都是碱性溶液,都能使酚酞溶液变红
实验步骤 实验现象 实验结论
①________ 澄清石灰水变浑浊 固体中含有 NaHCO3
②另取少量白色固体于试管中,加水使之完全溶解,再滴加BaCl2溶液 ______________ 发生反应的化学方程为________________,固体中含有Na2CO3
取少量白色固体于试管中并加热,将生成的气体通入澄清石灰水中
产生白色沉淀
Na2CO3 + BaCl2 == BaCO3↓+ 2NaCl
【实验结论】猜想三正确。
【拓展延伸】上述实验步骤②________(填“能”或“不能”)用Ba(NO3)2溶液代替BaCl2溶液,理由是________。
能
碳酸钠和硝酸钡也能发生反应生成碳酸钡白色沉淀和硝酸钠
3. (2022·广州)某校学生用盐酸和碳酸钙制备CO2,产生了大量废液。兴趣小组通过以下研究固定废液处理方案:
(1)废液成分的确定:
①写出制备CO2的化学方程式____________________________。
②推测废液所含溶质。推测一:______________
推测二:CaCl2和HCl
③若要用一种药品验证哪种推测成立,可选择的有哪些? ________(填标号)。
A. 石蕊溶液 B. AgNO3溶液 C. 锌粒 D. CuO粉末
CaCO3 + 2HCl ==== CaCl2 + H2O + CO2↑
CaCl2
ACD
(2)废液的处理:实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3除去它们。
【提出问题】如何估算Na2CO3固体的用量?
【进行实验】取100 mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。
【结果讨论】①a~b阶段,观察到烧杯中的现象是__________。
②b点后曲线平缓阶段,反应的化学方程式为________________________________________。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成。说明处理100 mL废液,所需5.3%的Na2CO3溶液的体积________120 mL
(填“大于”“等于”或“小于”)。
有气泡产生
CaCl2 + Na2CO3 ==== CaCO3↓+ 2NaCl
小于
④将烧杯中的沉淀过滤、洗涤、干燥、称重,质量为4 g。若处理10 L该废液,理论上需要Na2CO3固体________g。(实验所用Na2CO3溶液的密度近似看作1 g/cm3)
530
4. (2022·娄底)节日晚会上,小英同学表演魔术“滴水生火”,向包裹着过氧化钠(Na2O2)的脱脂棉上滴几滴水,脱脂棉着火燃烧,魔术表演成功。同学们很感兴趣,对此进行了探究,请你协助完成以下问题。
【查阅资料】①2Na2O2 + 2H2O ==== 4NaOH + O2↑,反应放出热量;
②BaCl2、CaCl2溶液显中性,Na2CO3溶液显碱性。
(1)同学们通过认真分析,从燃烧条件的角度得出了脱脂棉能燃烧的原因是________________________________________________。
(2)将燃烧后的残留固体放在烧杯中敞口放置一段时间后,加足量水溶解,无气泡产生,同学们得出结论,残留固体中不含________;同时有同学认为残留固体中可能含有Na2CO3,请用化学方程式说明理由 __________________________________。
过氧化钠与水反应生成氧气,且放出热量,使温度达到了脱脂棉的着火点
Na2O2
CO2 + 2NaOH ==== Na2CO3 + H2O
序号 实验操作 实验现象 实验结论
① 取少量滤液于试管中,滴加过量_________________________溶液 有白色沉淀产生 滤液中的溶质为Na2CO3
② 将①所得的混合液,静置,往上层清液中滴加2~3滴酚酞溶液 ________
(3)同学们将(2)所得混合液过滤,并设计实验对滤液的溶质成分进行了探究。
氯化钙(或氯化钡)
溶液不变色
(4)部分同学认为往滤液中滴加足量的稀盐酸,若产生气泡,也能得出同样的结论。你认为是否正确并说明理由__________________________________________________________________________________________________。
不正确,因为滤液中若含有氢氧化钠和碳酸钠,加入足量的稀盐酸也能产生气泡
CO2和SO2
【实验设计】
【现象与分析】
(1)装置B中酸性高锰酸钾溶液颜色变浅,说明气体中含有____________________。装置B中高锰酸钾溶液必须足量的原因是______________________________________。
(2)装置C中澄清石灰水变浑浊,说明气体中含有CO2,请写出反应的化学方程式_____________________________。
【实验结论】猜想三成立。
二氧化硫(或SO2)
使SO2完全除去,排除对CO2检验的干扰
【反思交流】
(3)若装置B与装置C位置互换,该实验设计________(填“合理”或“不合理”),理由是________________________________________________。
(4)有同学认为,木炭与浓硫酸加热后生成的产物中,除上述已验证的物质外,至少还有一种产物,理由是____________________________________________________________________________________________________。
不合理
SO2也会与Ca(OH)2反应生成沉淀,不能确定气体成分
根据质量守恒定律,反应物中有氢元素,反应产物中也一定有氢元素,则至少还有一种产物
类型2 定量数据测定的探究
6. (2022·云南节选)化学是一门以实验为基础的科学。现有一新制的碳酸钙产品,某同学设计如图所示的实验,通过测定反应生成的BaCO3的质量来确定该产品中CaCO3的含量(图中夹持仪器已略去,杂质不与盐酸反应,碱石灰是NaOH和CaO的固体混合物)。
(1)关闭止水夹,打开分液漏斗活塞,缓慢滴加盐酸至不再有气泡产生;关闭分液漏斗活塞,打开止水夹,缓缓通入空气。通入空气的作用是________________________________________________。
排净残留在装置中的CO2,以使生成的CO2完全被吸收
【解析】通入空气的作用是把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收,即排净残留在装置中的CO2,以使生成的CO2完全被吸收。
(2)装置D的作用是________________________________________________。
防止空气中的二氧化碳气体进入装置C中,产生误差
(3)实验时,称取的碳酸钙产品的质量为m1 g,反应后得到BaCO3的质量为m2 g,则该产品中CaCO3的质量分数为 ____________(用含m1和m2的代数式表示)。
7. (2022·宁波)久置的镁带表面会有一层灰黑色固体。为了测量久置镁带中金属镁的质量分数,同学们提出了两种实验方法:
物理方法:取一定质量的镁带,用砂纸打磨,除尽表面的灰黑色固体,根据剩余固体质量计算金属镁的质量分数。
化学方法:取一定质量的镁带,与足量的稀硫酸反应,根据测得生成气体的体积计算金属镁的质量分数。
(1)经讨论,同学们否定了物理方法。理由是:打磨过程中 ________________________。
(2)常温常压下氢气密度已知,因此大家认为化学方法可行。同学们从下列装置中选择合适的装置,组装并进行实验。
老师提示:镁与稀硫酸反应放热;灰黑色固体除了氧化镁之外,还存在少量碱式碳酸镁[MgCO3·Mg(OH)2],它与酸反应会产生CO2气体;碱石灰是CaO和NaOH的混合物。
可能会除去部分镁
①图C、D虚线框内有一种测量体积的仪器(未画出),该仪器是________。
②完成该实验应选择的装置为________(填字母)。
量筒
ABC
③结合实验方法和选择的装置分析,会造成实验结果不准确的是________。(填字母)
A. 加入稀硫酸不足,镁带有剩余 B. 装置气密性不好 C. 反应结束,立即读数
ABC
【解析】(2)②镁带与硫酸反应是固液不加热型,用A做发生装置,由于灰黑色固体除了氧化镁之外,还存在少量碱式碳酸镁[MgCO3·Mg(OH)2],它与酸反应会产生CO2气体,故可用碱石灰吸收二氧化碳,选B,用装置C收集氢气,氢气密度比水小,难溶于水,从短管进入,水从长管排出到量筒,量筒内水的体积即为生成氢气的体积。故选ABC。③A. 加入稀硫酸不足,镁带有剩余,导致生成的氢气的体积偏小,金属镁的质量分数偏小;B. 装置气密性不好,氢气的体积测量不准确,求得镁的质量不准确,会造成实验结果不准确;C. 镁与稀硫酸反应放热,反应结束,立即读数,氢气的体积偏大,会造成实验结果不准确。故选ABC。
8. (2022·成都)劳动实践课上同学们用草木灰给农作物施肥。课后同学查阅资料,得知草木灰是一种重要的农家肥,碳酸钾含量高。
【提出问题】如何测定草木灰中碳酸钾的含量?
【查阅资料】①常见草木灰钾含量(以碳酸钾表示)如下表:
草木灰种类 小灌木灰 稻草灰 小麦秆灰 棉壳灰 棉秆灰 向日葵秆灰
K2CO3(%) 8.66 2.63 20.26 32.28 16.44 51.97
②提取碳酸钾的主要过程:秸秆→草木灰→滤液→固体。
(1)表格中钾含量最高的草木灰是____________,同学们选用这种秸秆灰提取碳酸钾。
【设计与实验】实验一:提取碳酸钾。
第一步:燃烧秸秆,收集草木灰,称取20.00 g。
向日葵秆灰
第二步:用60 ℃水浸洗草木灰(如图1)并过滤,浸洗滤渣2次,合并滤液。
第三步:蒸发滤液,烘干得到9.90 g固体。
( 2)图1实验中,用60 ℃的温水而不用冷水浸洗的原因是_______________________________________________。
(3)根据图2,搅拌器转速控制在每分钟________转,浸取时间为________分钟,比较适宜。
相同时间内,水温高碳酸钾溶解得更快、更多,提高溶解效率
500
20
实验二:测定碳酸钾的含量。
取实验一中所得固体3.30 g进行图3实验。
(4)实验中需缓慢滴入稀硫酸,原因是______________________________________。
(5)装置B的作用是__________________。
有利于二氧化碳被氢氧化钠溶液充分吸收
吸收气体中的水蒸气
【数据与解释】(6)称量图3中反应前后烧杯和其中溶液的总质量,增重0.92 g。则草木灰中碳酸钾的质量分数为______%,与表格中数据相比明显偏低,原因可能是______(填字母)。
a. 烧杯中溶液与空气接触 b. 固体含有其他钾盐
c. 固体含有氯化钠
【反思与评价】(7)我国秸秆产量巨大,可作为生物质发电的原料,还可利用其燃烧发电产生的草木灰提取碳酸钾,其优点有____________________________(写一条)。
43.28
bc
资源综合利用(合理即可)
【解析】(3)由图2可知,钾浸取率较高时,搅拌器的转速为每分钟500转,由于时间在20分钟以后,浸取率上升不大,因此搅拌器转速控制在每分钟500转,浸取时间为20分钟时,较为适宜。(5)A中出来的二氧化碳中会带有水蒸气,为了使实验结果更加准确,装置C中增加的质量只能是二氧化碳的质量,因此B装置的作用是吸收气体中的水蒸气。(6)图3中反应前后烧杯和其中溶液的总质量,增重0.92 g,3.3 g固体和稀硫酸反应生成二氧化碳的质量为0.92 g,根据碳酸钾与产生的二氧化碳的关系,
类型3 反应条件及影响因素的探究
9. (2022·北京)絮凝剂常用于水的净化,实验小组探究用絮凝剂净水时影响净化效果的因素。
【查阅资料】絮凝剂溶于水后能够吸附水中悬浮物并发生沉降,从而达到净水目的。硫酸铁是一种常见的絮凝剂。
【进行实验】Ⅰ. 配制水样和絮凝剂溶液
配制水样:向10 L水中加入25 g高岭土,搅拌、静置,取上层液作为水样。
配制絮凝剂溶液:用100 mL水和5 g硫酸铁进行配制。
Ⅱ. 探究影响水样净化效果的因素:取水样,向其中加入絮凝剂溶液,搅拌,测定静置不同时间水样的浊度,并计算浊度去除率(浊度去除率越高代表净化效果越好)。实验记录如下:
实验序号 水样的体积/mL 加入絮凝剂溶液的体积/mL 静置时间/min 浊度去除率/%
① 200 0 20 12.48
② 200 0.2 20 76.54
③ 200 0.3 20 84.60
④ 200 0.4 5 64.45
⑤ 200 0.4 10 70.85
⑥ 200 0.4 15 81.04
⑦ 200 0.4 20 86.02
⑧ 200 0.5 20 88.15
⑨ 200 0.6 20 86.49
【解释与结论】
(1)配制絮凝剂溶液的操作如图所示。正确的操作顺序是 ________(填字母),B中用玻璃棒搅拌的目的是 ____________。
CDAB
加快溶解速率
(2)②中浊度去除率比①高的原因是_________________。
(3)依据④~⑦得出的结论是________________________________________________。
(4)探究等量水样中加入絮凝剂溶液的体积对净化效果影响的实验是________________(填序号)。
【反思与评价】(5)依据实验数据,不能得出“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”的结论,其证据是__________________。
加入了絮凝剂
其他条件相同时,静置时间越长,浊度去除率越高
②③(或⑦⑧⑨)
⑧⑨中,静置时间相同,等量水样中加入絮凝剂溶液的体积越大,浊度去除率越低
10. (2022·福建)ZB是常用的阻燃剂。已知:
Ⅰ. 用硼酸(H3BO3)与ZnO、H2O合成ZB,ZB的组成会受温度等合成条件的影响。
Ⅱ. ZB受热,先释放出水;当温度高于350 ℃,生成ZnO和B2O3固体;继续升温到400 ℃以上,B2O3熔化为玻璃态物质。
(1)ZB能起阻燃作用的原因是________(写一种)。
B2O3熔化为玻璃态物质能隔绝空气或氧气(合理即可)
(2)为研究温度对合成的ZB组成的影响,研究小组在不同温度下制取ZB。实验如下:
x、y分别为________和________。
m(H3BO3)/g m(ZnO)/g V(H2O)/mL t/℃
实验1 28 10 100 94
实验2 x 10 100 98
实验3 28 y 100 102
28
10
(3)为检测102 ℃时合成的ZB含水的质量分数,某同学利用如图1装置(夹持仪器已略)进行实验。
①需要不断通入干燥的空气的目的是______________________。
②实验时,需要称量获得的数据有:ZB样品的质量、________的质量。
使产生的水蒸气全部从玻璃管中排出
含样品的玻璃直管加热前后(合理即可)
①低于200 ℃时,两份木材粉末质量均保持不变的原因是 ________________。
②图中曲线______(填“a”或“b”)对应的
木材粉末是经ZB处理的,
判断的理由是______________________________。
(5)为寻找阻燃性能最佳的ZB的合成温度,应开展的实验是 ________。
木材还没有燃烧
a
曲线a对应的固体残留率比b的大
在相同条件下,分别取不同温度下合成的ZB,进行木材粉末灼烧残重实验
【解析】(2)要研究温度对合成的ZB组成的影响,根据控制变量法,变量只有一个温度,其他量相同,故x = 28;y = 10。(4)②ZB能起阻燃作用,故固体残留率大,故a对应的木材粉末是经ZB处理的,判断的理由是曲线a对应的固体残留率比b的大。
类型4 实验操作中异常现象的探究
11. (2022·丽水)小丽和小科在做“金属与酸反应”的实验时,他们分别将镁条投入盛有稀盐酸的试管中,小丽加入少量镁条,而小科加入了足量镁条。一段时间后,小科的试管底部“意外”地出现了灰白色固体。为探究该固体是什么物质,他们开展了如下探究:
【提出问题】足量镁和稀盐酸反应生成的灰白色固体是什么?
【查阅资料】氢氧化镁和碱式氯化镁[Mg(OH)Cl]都难溶于水,但都能与稀硝酸反应,后者能生成Mg(NO3)2和HCl。
【建立假设】假设1:未溶解完的氯化镁;假设2:氢氧化镁;假设3:碱式氯化镁;……
【进行实验】将灰白色固体过滤、充分洗涤后进行如下实验:
序号 实验操作 实验现象 实验结论
实验一 取少量灰白色固体于试管中,加入足量蒸馏水,充分振荡 固体不溶解 假设1 ________
实验二 取少量灰白色固体于试管中,加入足量稀硝酸,充分振荡 固体溶解 假设2不成立
往上述溶液中滴加硝酸银溶液 ________
不成立
产生白色沉淀
【评价交流】小丽认为该灰白色固体一定是碱式氯化镁。小科认为上述探究还不足以说明该固体就是碱式氯化镁,其理由是_____________________________________________________。
【继续探究】……
只证明了氯元素的存在,未证明碱式氯化镁中的其他元素
谢谢大家!
同课章节目录
