1.3氧化还原反应(第一课时) 课件(共27张PPT)2022-2023学年高一上学期化学人教版(2019)必修第一册+
文档属性
| 名称 | 1.3氧化还原反应(第一课时) 课件(共27张PPT)2022-2023学年高一上学期化学人教版(2019)必修第一册+ |  | |
| 格式 | pptx | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-10 15:35:50 | ||
图片预览








文档简介
(共27张PPT)
元素化合价规律:
1.单质化合价规定为0
2.化合物中金属元素只显正价,无负价
3.化合物中非金属元素化合价有正有负
4.化合物中正负化合价代数和为0
5.先确定常见元素化合价,再根据代数和为0,计算陌生元素化合价。
知识回顾
第3节 氧化还原反应
第一章 物质及其变化
高中人教版新教材化学必修一
第1课时
【学习目标】
1、通过对氧化还原反应本质的认识过程,初步建立氧化还原反应的认知模型。
2、能用双线桥和单线桥表示氧化还原反应的电子转移情况。
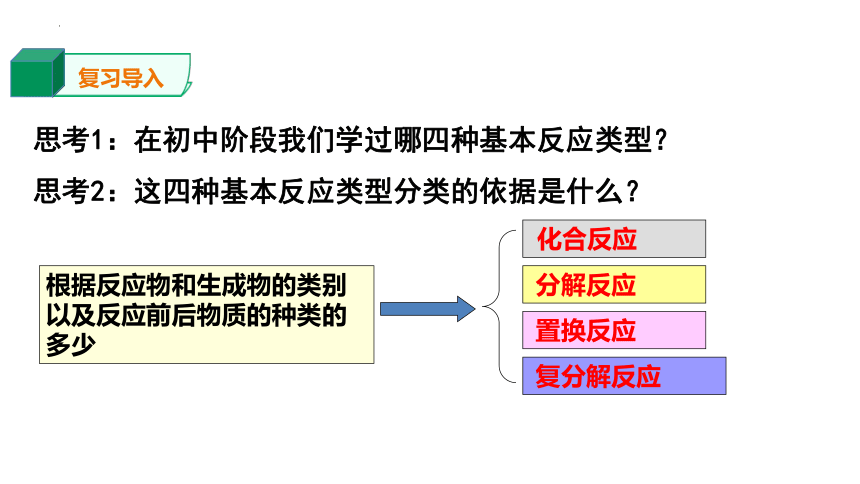
思考1:在初中阶段我们学过哪四种基本反应类型?
思考2:这四种基本反应类型分类的依据是什么?
根据反应物和生成物的类别以及反应前后物质的种类的多少
化合反应
分解反应
置换反应
复分解反应
复习导入
一、氧化还原反应的概念的发展
1. Fe2O3+3CO====2Fe+3CO2属于四大基本反应类型中的哪一种
化学反应是否还有其他的分类标准?
高温
思考与交流一
氧化反应:物质得到氧的反应
还原反应:物质失去氧的反应
根据氧元素的得失
一、氧化还原反应的概念的发展
Fe2O3+3CO====2Fe+3CO2
高温
一种物质得到氧发生氧化反应,必然有一种物质失氧发生还原反应。氧化反应和还原反应在一个反应中同时发生,这样的反应称氧化还原反应
物 质 反应物 发生的反应(氧化反应或还原反应)
得氧物质
失氧物质
CO
Fe2O3
氧化反应
还原反应
3. 氧化反应和还原反应是分别独立进行的吗?为什么?
2CuO + C 2Cu + CO2↑
C
CuO
2. 完成课本P21【思考与讨论】(1)(2)
拉瓦锡 Lavoisier
1774年
燃烧的氧化学说
一、氧化还原反应的概念的发展
弗兰克兰 Frankland
1852年
化合价概念
Fe2O3 + 3CO 2Fe + 3CO2
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
化合价降低
化合价升高
+3
+2
0
+4
完成课本P21【思考与讨论】(3)
思考与交流二
2CuO + C 2Cu + CO2↑
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
+2
0
0
+4
化合价降低
化合价升高
一、氧化还原反应的概念的发展
弗兰克兰 Frankland
1852年
化合价概念
反应前后有元素的化合价发生变化,
是氧化还原反应的重要特征。
2CuO + C 2Cu + CO2↑
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
+2
0
0
+4
化合价降低
化合价升高
Fe2O3 + 3CO 2Fe + 3CO2
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
化合价降低
化合价升高
+3
+2
0
+4
判断依据
一、氧化还原反应的概念的发展
弗兰克兰 Frankland
1852年
化合价概念
反应前后有元素的化合价发生变化,
是氧化还原反应的重要特征。
Fe2O3 + 3CO 2Fe + 3CO2
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
化合价降低
化合价升高
+3
+2
0
+4
判断依据
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
一、氧化还原反应的概念的发展
《创新设计》P22【实践应用】第1、2题。
课堂练习
一、氧化还原反应的概念的发展
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
判断下面反应是否属于氧化还原反应,若是,分别指出发生氧化反应的物质和发生还原反应的物质。
Na+
Cl-
电子转移
不稳定
稳定
失去电子 ,化合价升高,被氧化
得到电子,化合价降低,被还原
化合价升降原因之一:电子的得失
分别以NaCl和HCl的形成过程为例,分析氧化还原反应中元素电子变化情况。
2Na + Cl2 = 2NaCl
△
一、氧化还原反应的概念的发展
H Cl
+1 -1
化合价升降原因之二:共用电子对的偏移
2
8
7
+17
+1
1
H
Cl
e
e
H
H2+Cl2 === 2HCl
点燃
-1
+1
共用电子对偏向,化合价降低,被还原
共用电子对偏离,化合价升高,被氧化
一、氧化还原反应的概念的发展
电子得失
电子偏移
氧化还原反应的本质:电子转移(得失或偏移)
氧化还原中一定存在着电子转移,这是氧化还原反应的本质。
总结与归纳
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
一、氧化还原反应的概念的发展
拉瓦锡 Lavoisier
1774年
燃烧的氧化学说
弗兰克兰 Frankland
1852年
化合价概念
汤姆森 J.J.Thomson
1897年
电子转移
本质
特征
一、氧化还原反应的概念的发展
《创新设计》P22【实践应用】第3题。
课堂练习
一、氧化还原反应的概念的发展
化合反应
分解反应
化合反应
置换反应
分解反应
复分解反应
是
是
是
是
判断下列反应各属于四种基本反应类型中的哪一种?
是否属于氧化还原反应?
(1)2Mg + O2 ===2MgO
(2)CO2 + Na2O == Na2CO3
(3)2KMnO4 == K2MnO4 + MnO2 + O2↑
(4)2NaHCO3 === Na2CO3 + CO2↑+ H2O
(5)Fe + CuSO4 == FeSO4 + Cu
(6)CaCl2 + Na2CO3 == CaCO3↓+ 2NaCl
(7)
点燃
△
△
Cl2 + 2KOH == KCl + KClO + H2O
否
否
否
课堂练习
一、氧化还原反应的概念的发展
氧化还原反应与四种基本反应类型的关系
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
一、氧化还原反应的概念的发展
1、从得氧、失氧分析
2、从化合价升降分析
3、从电子转移(得失或偏移)分析
表观特征:反应前后有元素的化合价发生变化。
实质
氧化还原反应中的基本概念及转化关系
一、氧化还原反应的概念的发展
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
一、氧化还原反应的概念的发展
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
得
电子
3e-
Fe
2
×
有2个Fe被还原
1个Fe得到3e-
失3×2e-
双线桥法
标价态
正确标出反应前后各元素化合价明确变价元素的化合价升降关系
连双线
一条线始于反应物中的降价元素,止于产物中同种元素
另一条线始于反应物中的升价元素,止于产物中同种元素
注得失
正确标出反应前后“得到”电子或“失去”电子总数
基本步骤
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
价态变化原子个数 × 每个原子得失电子数
二、电子转移的表示方法
电子得失守恒
化合价升降守恒
得到2x3e-,化合价降低,被还原
失去2x3e-,化合价升高,被氧化
0 +2 +2 0
失去2e-,
化合价升高,
被氧化
被还原
化合价降低,
得到2e-,
二、电子转移的表示方法
课堂练习
二、电子转移的表示方法
电子得失守恒
+4 -1 +2 0
得到2 e-,
化合价降低,
被还原
被氧化
化合价升高,
失去2×e-,
《创新设计》P23【实践应用】第4题。
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
单线桥法
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
Fe
6e-
标价态
正确标出反应前后各元素化合价
明确变价元素的化合价升降关系
连单线
始于反应物中的升价元素,止于反应物中降价元素
注意:要用箭头标明电子转移的方向
注数目
正确标出反应中转移的电子总数
基本步骤
表示反应物中同种元素或不同元素原子间的电子转移情况。
注意:不需要标明“得到”或“失去”
二、电子转移的表示方法
课堂练习
二、电子转移的表示方法
《创新设计》P23【实践应用】第5题。
1、从得氧、失氧分析
2、从化合价升降分析
3、从电子转移(得失或偏移)分析
表观特征:反应前后有元素的化合价发生变化。
实质
氧化还原反应中的基本概念及转化关系
一、氧化还原反应的概念的发展
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
二、电子转移的表示方法
表示电子转移的方法
单线桥法
双线桥法
【练习】判断氧化还原反应的关键是准确判断化合价的变化,请标出下列物质中元素的化合价:
H2O H2O2 KMnO4 SO2 H2SO4 CH4
SO32- HNO3 NO2 NH3 CaC2 NaH
NH4+ HClO Ca(ClO)2 KClO3 H2SO3 K2Cr2O7
KI KIO3 Na2O2 Fe2(SO4)3 NH4NO3
-2
-1
+7
+4
+6
-4
一、氧化还原反应的概念的发展
【练习】判断氧化还原反应的关键是准确判断化合价的变化,请标出下列物质中元素的化合价:
H2O H2O2 KMnO4 SO2 H2SO4 CH4
SO32- HNO3 NO2 NH3 CaC2 NaH
NH4+ HClO Ca(ClO)2 KClO3 H2SO3 K2Cr2O7
KI KIO3 Na2O2 Fe2(SO4)3 NH4NO3
-2 -1 +7 +4 +6 -4
+4 +5 +4 -3 -1 -1
-3 +1 +1 +5 +4 + 6
-1 +5 -1 +3 -3 + 5
一、氧化还原反应的概念的发展
元素化合价规律:
1.单质化合价规定为0
2.化合物中金属元素只显正价,无负价
3.化合物中非金属元素化合价有正有负
4.化合物中正负化合价代数和为0
5.先确定常见元素化合价,再根据代数和为0,计算陌生元素化合价。
知识回顾
第3节 氧化还原反应
第一章 物质及其变化
高中人教版新教材化学必修一
第1课时
【学习目标】
1、通过对氧化还原反应本质的认识过程,初步建立氧化还原反应的认知模型。
2、能用双线桥和单线桥表示氧化还原反应的电子转移情况。
思考1:在初中阶段我们学过哪四种基本反应类型?
思考2:这四种基本反应类型分类的依据是什么?
根据反应物和生成物的类别以及反应前后物质的种类的多少
化合反应
分解反应
置换反应
复分解反应
复习导入
一、氧化还原反应的概念的发展
1. Fe2O3+3CO====2Fe+3CO2属于四大基本反应类型中的哪一种
化学反应是否还有其他的分类标准?
高温
思考与交流一
氧化反应:物质得到氧的反应
还原反应:物质失去氧的反应
根据氧元素的得失
一、氧化还原反应的概念的发展
Fe2O3+3CO====2Fe+3CO2
高温
一种物质得到氧发生氧化反应,必然有一种物质失氧发生还原反应。氧化反应和还原反应在一个反应中同时发生,这样的反应称氧化还原反应
物 质 反应物 发生的反应(氧化反应或还原反应)
得氧物质
失氧物质
CO
Fe2O3
氧化反应
还原反应
3. 氧化反应和还原反应是分别独立进行的吗?为什么?
2CuO + C 2Cu + CO2↑
C
CuO
2. 完成课本P21【思考与讨论】(1)(2)
拉瓦锡 Lavoisier
1774年
燃烧的氧化学说
一、氧化还原反应的概念的发展
弗兰克兰 Frankland
1852年
化合价概念
Fe2O3 + 3CO 2Fe + 3CO2
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
化合价降低
化合价升高
+3
+2
0
+4
完成课本P21【思考与讨论】(3)
思考与交流二
2CuO + C 2Cu + CO2↑
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
+2
0
0
+4
化合价降低
化合价升高
一、氧化还原反应的概念的发展
弗兰克兰 Frankland
1852年
化合价概念
反应前后有元素的化合价发生变化,
是氧化还原反应的重要特征。
2CuO + C 2Cu + CO2↑
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
+2
0
0
+4
化合价降低
化合价升高
Fe2O3 + 3CO 2Fe + 3CO2
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
化合价降低
化合价升高
+3
+2
0
+4
判断依据
一、氧化还原反应的概念的发展
弗兰克兰 Frankland
1852年
化合价概念
反应前后有元素的化合价发生变化,
是氧化还原反应的重要特征。
Fe2O3 + 3CO 2Fe + 3CO2
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
化合价降低
化合价升高
+3
+2
0
+4
判断依据
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
一、氧化还原反应的概念的发展
《创新设计》P22【实践应用】第1、2题。
课堂练习
一、氧化还原反应的概念的发展
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
判断下面反应是否属于氧化还原反应,若是,分别指出发生氧化反应的物质和发生还原反应的物质。
Na+
Cl-
电子转移
不稳定
稳定
失去电子 ,化合价升高,被氧化
得到电子,化合价降低,被还原
化合价升降原因之一:电子的得失
分别以NaCl和HCl的形成过程为例,分析氧化还原反应中元素电子变化情况。
2Na + Cl2 = 2NaCl
△
一、氧化还原反应的概念的发展
H Cl
+1 -1
化合价升降原因之二:共用电子对的偏移
2
8
7
+17
+1
1
H
Cl
e
e
H
H2+Cl2 === 2HCl
点燃
-1
+1
共用电子对偏向,化合价降低,被还原
共用电子对偏离,化合价升高,被氧化
一、氧化还原反应的概念的发展
电子得失
电子偏移
氧化还原反应的本质:电子转移(得失或偏移)
氧化还原中一定存在着电子转移,这是氧化还原反应的本质。
总结与归纳
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
一、氧化还原反应的概念的发展
拉瓦锡 Lavoisier
1774年
燃烧的氧化学说
弗兰克兰 Frankland
1852年
化合价概念
汤姆森 J.J.Thomson
1897年
电子转移
本质
特征
一、氧化还原反应的概念的发展
《创新设计》P22【实践应用】第3题。
课堂练习
一、氧化还原反应的概念的发展
化合反应
分解反应
化合反应
置换反应
分解反应
复分解反应
是
是
是
是
判断下列反应各属于四种基本反应类型中的哪一种?
是否属于氧化还原反应?
(1)2Mg + O2 ===2MgO
(2)CO2 + Na2O == Na2CO3
(3)2KMnO4 == K2MnO4 + MnO2 + O2↑
(4)2NaHCO3 === Na2CO3 + CO2↑+ H2O
(5)Fe + CuSO4 == FeSO4 + Cu
(6)CaCl2 + Na2CO3 == CaCO3↓+ 2NaCl
(7)
点燃
△
△
Cl2 + 2KOH == KCl + KClO + H2O
否
否
否
课堂练习
一、氧化还原反应的概念的发展
氧化还原反应与四种基本反应类型的关系
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
一、氧化还原反应的概念的发展
1、从得氧、失氧分析
2、从化合价升降分析
3、从电子转移(得失或偏移)分析
表观特征:反应前后有元素的化合价发生变化。
实质
氧化还原反应中的基本概念及转化关系
一、氧化还原反应的概念的发展
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
一、氧化还原反应的概念的发展
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
得
电子
3e-
Fe
2
×
有2个Fe被还原
1个Fe得到3e-
失3×2e-
双线桥法
标价态
正确标出反应前后各元素化合价明确变价元素的化合价升降关系
连双线
一条线始于反应物中的降价元素,止于产物中同种元素
另一条线始于反应物中的升价元素,止于产物中同种元素
注得失
正确标出反应前后“得到”电子或“失去”电子总数
基本步骤
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
价态变化原子个数 × 每个原子得失电子数
二、电子转移的表示方法
电子得失守恒
化合价升降守恒
得到2x3e-,化合价降低,被还原
失去2x3e-,化合价升高,被氧化
0 +2 +2 0
失去2e-,
化合价升高,
被氧化
被还原
化合价降低,
得到2e-,
二、电子转移的表示方法
课堂练习
二、电子转移的表示方法
电子得失守恒
+4 -1 +2 0
得到2 e-,
化合价降低,
被还原
被氧化
化合价升高,
失去2×e-,
《创新设计》P23【实践应用】第4题。
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
单线桥法
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
Fe
6e-
标价态
正确标出反应前后各元素化合价
明确变价元素的化合价升降关系
连单线
始于反应物中的升价元素,止于反应物中降价元素
注意:要用箭头标明电子转移的方向
注数目
正确标出反应中转移的电子总数
基本步骤
表示反应物中同种元素或不同元素原子间的电子转移情况。
注意:不需要标明“得到”或“失去”
二、电子转移的表示方法
课堂练习
二、电子转移的表示方法
《创新设计》P23【实践应用】第5题。
1、从得氧、失氧分析
2、从化合价升降分析
3、从电子转移(得失或偏移)分析
表观特征:反应前后有元素的化合价发生变化。
实质
氧化还原反应中的基本概念及转化关系
一、氧化还原反应的概念的发展
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
氧化反应:元素失去电子(或共用电子对偏离),元素化合价升高
还原反应:元素得到电子(或共用电子对偏向),元素化合价降低
二、电子转移的表示方法
表示电子转移的方法
单线桥法
双线桥法
【练习】判断氧化还原反应的关键是准确判断化合价的变化,请标出下列物质中元素的化合价:
H2O H2O2 KMnO4 SO2 H2SO4 CH4
SO32- HNO3 NO2 NH3 CaC2 NaH
NH4+ HClO Ca(ClO)2 KClO3 H2SO3 K2Cr2O7
KI KIO3 Na2O2 Fe2(SO4)3 NH4NO3
-2
-1
+7
+4
+6
-4
一、氧化还原反应的概念的发展
【练习】判断氧化还原反应的关键是准确判断化合价的变化,请标出下列物质中元素的化合价:
H2O H2O2 KMnO4 SO2 H2SO4 CH4
SO32- HNO3 NO2 NH3 CaC2 NaH
NH4+ HClO Ca(ClO)2 KClO3 H2SO3 K2Cr2O7
KI KIO3 Na2O2 Fe2(SO4)3 NH4NO3
-2 -1 +7 +4 +6 -4
+4 +5 +4 -3 -1 -1
-3 +1 +1 +5 +4 + 6
-1 +5 -1 +3 -3 + 5
一、氧化还原反应的概念的发展
