全册综合复习模拟训练 (含解析)2022——2023学年上学期高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 全册综合复习模拟训练 (含解析)2022——2023学年上学期高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 511.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-10 16:38:57 | ||
图片预览



文档简介
全册综合复习模拟训练
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.配制一定物质的量浓度的NaOH溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平和称量纸称量NaOH固体
B.容量瓶中有少量蒸馏水
C.容量瓶盛过NaOH溶液,使用前未洗涤
D.定容时,仰视刻度线
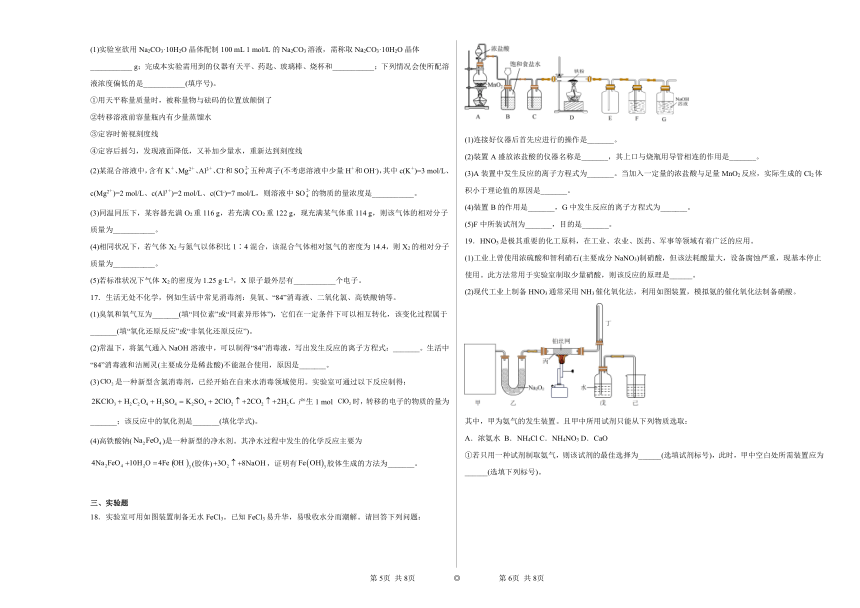
2.某溶液稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线如图,根据图中数据分析得出a的值为(忽略溶液混合时体积的变化)
A.0.8 B.1.2 C.1.6 D.2.0
3.下列实验现象或结论描述不正确的是
选项 实验 现象或结论
A 在氯化铁溶液中加入铜粉 棕黄色溶液变成蓝色溶液,说明Fe3+具有氧化性
B 紫色石蕊溶液中通入足量的Cl2 溶液先变红色,后褪色,说明氯水有酸性和漂白性
C 往AlCl3溶液中滴加足量NaOH溶液 产生大量白色沉淀
D 加热放在坩埚中的小块钠 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体
A.A B.B C.C D.D
4.下列说法正确的是
①氯气、液氯、氯水是同一种物质
②钠的化学性质活泼,可从硫酸铜溶液中置换出铜
③金属钠着火不能用水、干粉灭火剂、泡沫灭火剂等扑灭
④和长期置于空气中,最终产物相同
⑤干燥氯气可以使鲜花褪色
⑥钠、氢气都能在氯气中燃烧生成白雾
A.①②③ B.①③④ C.③④⑤ D.③④⑥
5.硫酸亚铁铵受热分解的反应方程式为2(NH4)2Fe(SO4)2Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O,用NA表示阿佛加德罗常数的值。下列说法正确的是
A.1L0.1mol L-1(NH4)2Fe(SO4)2溶液中Fe2+的数目为0.1NA
B.将1molSO2和1molO2充分反应后,其分子总数为1.5NA
C.标准状况下,每生成15.68L气体转移电子数目为0.8NA
D.常温常压下,3.0g15N2中含有的中子总数为1.4NA
6.下列反应的离子方程式或方程式书写正确的是
A.稀硫酸与溶液反应:
B.钠与水反应的离子方程式:
C.溶液中滴加少量稀盐酸:
D.溶液中滴入少量溶液:
7.若在加入铝粉能放出H2的溶液中,下列各组离子一定不能大量共存的是
A.Na+、Fe3+、SO、Cl- B.Ba2+、Mg2+、HCO、NO
C.Na+、K+、NO、CO D.K+、NO、AlO、OH-
8.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是
A.
B.
C.
D.
9.某无色透明溶液中可能含有下列离子中的几种:、、、、、、。现进行如下实验:
①取少量溶液用红色石蕊试纸检验,试纸变蓝色;
②另取少量溶液逐滴滴加盐酸至过量,无气体放出;
③另取少量溶液用硝酸酸化后,加入溶液有白色沉淀生成。下列说法错误的是
A.不用进行实验,就可判断出原溶液中一定无
B.由实验①可知:原溶液中一定不存在
C.实验②中,首先发生的反应为
D.由实验③可知:AgCl不溶于硝酸
10.将一定量的氯气缓慢通入30mL 10.00氢氧化钠溶液中,加热一段时间后,得到溶质仅为NaCl、NaClO、的混合溶液。下列说法正确的是
A.通入氯气的体积为3.36L
B.反应后的溶液中含有钠元素的总质量为6.9g
C.当参与反应的时,生成物
D.往反应后的溶液中加入适量硝酸酸化的硝酸银溶液,无沉淀生成
11.如图是一种综合处理SO2废气的工艺流程。下列说法正确的是
A.操作Ⅱ发生反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O
B.溶液b中阳离子只有Fe2+
C.溶液a转化为溶液b的反应中,SO2被还原
D.加入FeO可以使溶液c转化为溶液a
12.如图是N、S及其化合物的“价—类”二维图,下列说法正确的是
A.在一定条件下,a可将c、d还原为b
B.c'使品红褪色的原理与HClO的漂白原理相同
C.a与浓e、a'与浓e'均能发生氧化还原反应
D.常温下,Fe与浓e和浓e'均不反应
13.下列由实验现象所得结论正确的是
A.向BaCl2溶液中通入X气体,产生白色沉淀,则X气体可能是SO2或CO2
B.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则原溶液中一定有Ag+
C.某溶液中加入Na2CO3溶液有白色沉淀,再滴加盐酸沉淀消失,则原溶液中一定有Ca2+
D.某溶液中加入稀盐酸产生使品红溶液褪色的气体,则原溶液中可能含SO或HSO
14.用NA代表阿伏伽德罗常数的数值,下列说法正确的是
A.浓盐酸与足量MnO2反应生成11.2 L Cl2,转移电子数为NA
B.将1 mol Cl2通入足量水中,HClO、Cl-、ClO-微粒数之和为2NA
C.有铁粉参加的反应,若生成2 mol Fe2+,则转移电子数一定为4NA
D.0.1 mol FeCl3加入沸水中完全反应生成Fe(OH)3胶体粒子数小于0.1NA
15.化学与人类生产、生活密切相关,下列叙述中正确的是
A.京东方生产的可折叠柔性屏中的灵魂材料——纳米银与硝酸不会发生化学反应
B.在葡萄酒酿制过程中,添加适量二氧化硫可以起到杀菌作用
C.硅是制作光导纤维的主要材料
D.“超轻海绵”使用的石墨烯是新型有机高分子材料
二、填空题
16.回答下列问题
(1)实验室欲用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,需称取Na2CO3·10H2O晶体___________ g;完成本实验需用到的仪器有天平、药匙、玻璃棒、烧杯和___________;下列情况会使所配溶液浓度偏低的是___________(填序号)。
①用天平称量质量时,被称量物与砝码的位置放颠倒了
②转移溶液前容量瓶内有少量蒸馏水
③定容时俯视刻度线
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(2)某混合溶液中,含有K+、Mg2+、Al3+、Cl-和SO五种离子(不考虑溶液中少量H+和OH-),其中c(K+)=3 mol/L、c(Mg2+)=2 mol/L、c(Al3+)=2 mol/L、c(Cl-)=7 mol/L,则溶液中SO的物质的量浓度是___________。
(3)同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则该气体的相对分子质量为___________。
(4)相同状况下,若气体X2与氮气以体积比1∶4混合,该混合气体相对氢气的密度为14.4,则X2的相对分子质量为___________。
(5)若标准状况下气体X2的密度为1.25 g·L-1,X原子最外层有___________个电子。
17.生活无处不化学,例如生活中常见消毒剂:臭氧、“84”消毒液、二氧化氯、高铁酸钠等。
(1)臭氧和氧气互为_______(填“同位素”或“同素异形体”),它们在一定条件下可以相互转化,该变化过程属于_______(填“氧化还原反应”或“非氧化还原反应”)。
(2)常温下,将氯气通入NaOH溶液中,可以制得“84”消毒液,写出发生反应的离子方程式:_______。生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是_______。
(3)是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:。产生1 mol 时,转移的电子的物质的量为_______;该反应中的氧化剂是_______(填化学式)。
(4)高铁酸钠()是一种新型的净水剂。其净水过程中发生的化学反应主要为(胶体),证明有胶体生成的方法为_______。
三、实验题
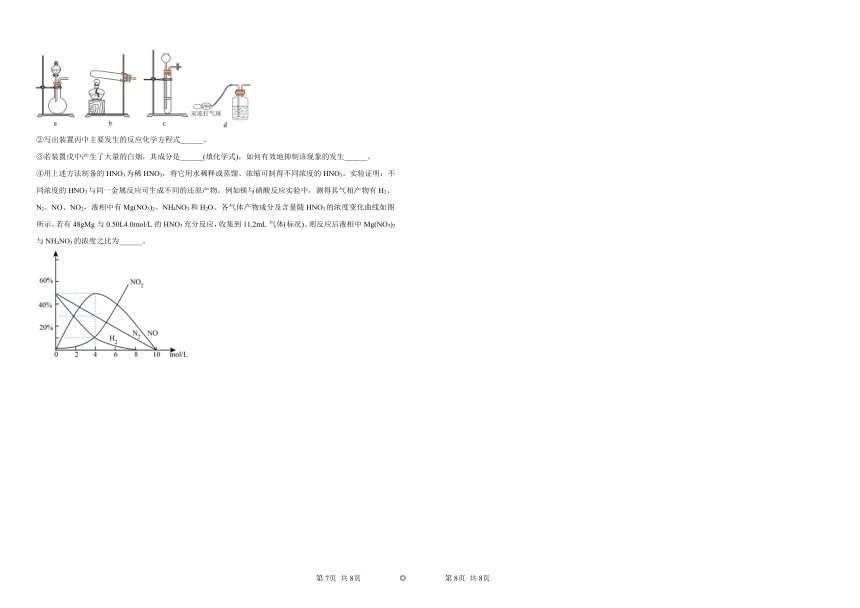
18.实验室可用如图装置制备无水FeCl3。已知FeCl3易升华,易吸收水分而潮解。请回答下列问题:
(1)连接好仪器后首先应进行的操作是_______。
(2)装置A盛放浓盐酸的仪器名称是_______,其上口与烧瓶用导管相连的作用是_______。
(3)A装置中发生反应的离子方程式为_______。当加入一定量的浓盐酸与足量MnO2反应,实际生成的Cl2体积小于理论值的原因是_______。
(4)装置B的作用是_______,G中发生反应的离子方程式为_______。
(5)F中所装试剂为_______,目的是_______。
19.HNO3是极其重要的化工原料,在工业、农业、医药、军事等领域有着广泛的应用。
(1)工业上曾使用浓硫酸和智利硝石(主要成分NaNO3)制硝酸,但该法耗酸量大,设备腐蚀严重,现基本停止使用。此方法常用于实验室制取少量硝酸,则该反应的原理是______。
(2)现代工业上制备HNO3通常采用NH3催化氧化法,利用如图装置,模拟氨的催化氧化法制备硝酸。
其中,甲为氨气的发生装置。且甲中所用试剂只能从下列物质选取:
A.浓氨水 B.NH4Cl C.NH4NO3 D.CaO
①若只用一种试剂制取氨气,则该试剂的最佳选择为______(选填试剂标号),此时,甲中空白处所需装置应为______(选填下列标号)。
②写出装置丙中主要发生的反应化学方程式______。
③若装置戊中产生了大量的白烟,其成分是______(填化学式),如何有效地抑制该现象的发生______。
④用上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相中有Mg(NO3)2、NH4NO3和H2O。各气体产物成分及含量随HNO3的浓度变化曲线如图所示。若有48gMg与0.50L4.0mol/L的HNO3充分反应,收集到11.2mL气体(标况)。则反应后液相中Mg(NO3)2与NH4NO3的浓度之比为______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.氢氧化钠具有潮解性吸收空气中水且能和空气中二氧化碳反应,使得称量物质中氢氧化钠量偏小,导致所配溶液浓度偏低,故A不符合题意;
B.容量瓶中有少量蒸馏水,不影响所配溶液浓度,故B不符合题意;
C.容量瓶盛过NaOH溶液,使用前未洗涤使得溶液中溶质增大,导致所配溶液浓度偏高,故C符合题意;
D.定容时,仰视刻度线,使得溶液体积增大,导致所配溶液浓度偏低,故D不符合题意;
故选C。
2.C
【详解】根据图像,当溶液体积为0.5L时浓度为4mol/L,当溶液体积为aL时浓度为1.25mol/L,根据稀释前后溶质物质的量不变,0.5L×4mol/L=aL×1.25mol/L,a=1.6L,故选C。
3.C
【详解】A.在氯化铁溶液中加入铜粉,氯化铁溶液与铜粉反应生成氯化亚铁和氯化铜,棕黄色溶液变成蓝色溶液,说明Fe3+将Cu氧化为Cu2+,说明Fe3+具有氧化性,故A正确;
B.氯气与水反应生成盐酸,酸性使得石蕊变红,后褪色是因为生成盐酸(HCl)的同时还生成了次氯酸(HClO),次氯酸有漂白的作用使得有机酸碱指示剂石蕊褪色成无色,故B正确;
C.往AlCl3溶液中滴加足量NaOH溶液生成NaAlO2溶液,不会产生大量白色沉淀,故C错误;
D.加热放在坩埚中的小块钠,钠熔点低,先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体Na2O2,故D正确;
故选C。
4.C
【详解】①氯气、液氯都是单质氯,氯水是氯气的水溶液,这三者不是同一种物质,①错误;
②钠易和水反应,不能从硫酸铜溶液中置换出铜,②错误;
③金属钠可以和水反应,可以和干粉灭火剂产生的二氧化碳反应,可以和泡沫灭火剂产生的水分反应,故金属钠着火不能用水、干粉灭火剂、泡沫灭火剂等扑灭,③正确;
④和长期置于空气中,最终都会生成碳酸钠,产物相同,④正确;
⑤鲜花中含有水分,则干燥氯气可以使鲜花褪色,⑤正确;
⑥钠在氯气中燃烧产生白烟,⑥错误;
正确的是:③④⑤;
故选C。
5.C
【详解】A.由于水解,溶液中的数目小于,选项A错误;
B.与反应属于可逆反应,所以和充分反应后,其分子总数大于,选项B错误;
C.标准状况下,气体为,其中占、占,占,根据反应可知,生成转移电子,生成则转移电子,数目为,选项C正确;
D.的中子数,为,含有的中子总数,选项D错误;
答案选C。
6.D
【详解】A.稀硫酸与溶液反应:,故A错误;
B.钠与水反应的离子方程式:,故B错误;
C.溶液中滴加少量稀盐酸:,故C错误;
D.溶液中滴入少量,两者1:1恰好完全反应,离子方程式为:,故D正确;
故选:D。
7.B
【分析】铝粉能放出H2的溶液,可能是酸溶液,也可能是碱溶液。
【详解】A.Na+、Fe3+、SO、Cl-在酸中能大量共存,在碱中,OH-与Fe3+反应,故A不符合题意;
B.Mg2+与OH-反应生成沉淀,HCO与OH-反应生成水和碳酸根,HCO与氢离子反应生成水和二氧化碳,故B符合题意;
C.Na+、K+、NO、CO在碱中大量共存,CO与氢离子反应生成水和二氧化碳,故C不符合题意;
D.K+、NO、AlO、OH-在碱中大量共存,AlO、OH-与氢离子反应,故C不符合题意。
综上所述,答案为B。
8.A
【详解】A.有元素化合价变化,属于氧化还原反应,不是化合反应,不是分解反应,不是置换反应,故选A;
B.是化合反应,不属于阴影部分,故不选B;
C.是分解反应,不属于阴影部分,故不选C;
D.是置换反应,不属于阴影部分,故不选D;
选A。
9.C
【详解】A.含有离子的溶液呈蓝色,无色溶液中一定不含,故A正确;
B.取少量溶液用红色石蕊试纸检验,试纸变蓝色,说明溶液呈碱性,可能含有、中的一种或两种,均与产生沉淀,可知:原溶液中一定不存在,故B正确;
C.另取少量溶液逐滴滴加盐酸至过量,无气体放出,说明溶液中不含,故C错误;
D.、Ag+反应生成AgCl沉淀,另取少量溶液用硝酸酸化后,加入溶液有白色沉淀生成,可知AgCl不溶于硝酸,故D正确;
选C。
10.B
【详解】A.溶质仅为NaCl、NaClO、,n(Na)=n(Cl)= 0.03L ×10.00=0.3mol,所以通入氯气的物质的量为0.15mol,没有明确是否为标准状况,通入氯气的体积不一定为3.36L,故A错误;
B.根据钠元素守恒,反应后的溶液中含有钠元素的总质量为0.03L ×10.00×23g/mol=6.9g,故B正确;
C.氧化产物有NaClO、两种,还原产物为NaCl,不能判断NaCl、NaClO的比,故C产物;
D.反应后的溶液中含有氯离子,往反应后的溶液中加入适量硝酸酸化的硝酸银溶液,有氯化银沉淀生成,故D错误;
选B。
11.A
【分析】溶液a中通入SO2,转化为溶液b,化学方程式为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4;溶液b中通入空气,转化为溶液c,化学方程式为4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O。
【详解】A.由分析可知,操作Ⅱ中,FeSO4被O2氧化,生成Fe2(SO4)3等,反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O,A正确;
B.溶液b中,阳离子有Fe2+、H+,可能含有Fe3+,B错误;
C.溶液a转化为溶液b的过程中,SO2转化为H2SO4,SO2失电子被氧化,C错误;
D.由分析可以看出,溶液c中含有Fe2(SO4)3、H2SO4,加入FeO后,FeO和H2SO4反应会生成FeSO4,D错误;
故答案为:A。
12.A
【分析】根据图示,a为NH3、b为N2、c为NO、d为NO2、e为HNO3;a'为H2S、b'为S、c'为SO2、d'为H2SO3、e'为H2SO4,据此解答。
【详解】A. a为NH3、b为N2、c为NO、d为NO2,根据化合价以及氧化还原规律,一定条件下,a可将c、d还原为b,A正确,
B .c'使品红褪色的原理为与有色物质生成不稳定的无色物质,HClO的漂白原理为将有色物质氧化为无色物质,原理不相同,B错误;
C.氨气和浓硝酸不能发生氧化还原反应,H2S可以和浓硫酸发生氧化还原反应,C错误;
D.常温下,Fe与浓硝酸和浓硫酸发生钝化反应,阻止反应进一步进行,不是不反应,D错误;
故选A。
13.D
【详解】A.二氧化硫、二氧化碳和氯化钡不反应,不能生成沉淀,A错误;
B.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,也可能是钡离子生成的不溶于水的硫酸钡沉淀,不能说明原溶液中一定有Ag+,B错误;
C.若原溶液中含有钡离子也会生成碳酸钡沉淀,加入盐酸出现同样现象,C错误;
D.二氧化硫气体具有漂白性,能使品红溶液褪色,亚硫酸根离子、亚硫酸氢根离子和盐酸生成二氧化硫气体;某溶液中加入稀盐酸产生使品红溶液褪色的气体,则原溶液中可能含SO或HSO,D正确;
故选D。
14.D
【详解】A.气体状态未知,不能计算转移电子数,A错误;
B.氯气溶于水,部分以氯气分子存在,HClO、Cl-、ClO-微粒数之和小于2NA,B错误;
C.有铁粉参加的反应,若生成2 mol Fe2+,则转移电子数不一定为4NA,如Fe+2Fe3+=3Fe2+,C错误;
D.Fe(OH)3胶体是多个Fe(OH)3的集合体,0.1 mol FeCl3加入沸水中完全反应生成Fe(OH)3胶体粒子数小于0.1NA,D正确;
故选D。
15.B
【详解】A.纳米银本质也为银单质,能与硝酸发生氧化还原反应生成硝酸银和氮的氧化物,A错误;
B.二氧化硫具有还原性,在葡萄酒酿制过程中,添加适量二氧化硫可以起到抗氧化作用,防止食物氧化变质;同时二氧化硫还能起到杀菌作用,B正确;
C.硅是制作计算机芯片的主要材料,光导纤维的主要成分是二氧化硅,C错误;
D.“超轻海绵”使用的石墨烯是碳单质,为无机非金属材料,D错误;
故答案选B。
16.(1) 28.6 100 mL容量瓶、胶头滴管 ①④
(2)3 mol/L
(3)28
(4)32
(5)5
【详解】(1)用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,需称取Na2CO3·10H2O晶体的质量m=cVM=0.1L ×1 mol/L×286g/mol=28.6g。完成本实验的步骤有:计算、称量、溶解、移液、洗涤、定容、摇匀,需用到的仪器有天平、药匙、玻璃棒、烧杯和100 mL容量瓶、胶头滴管;
①用天平称量质量时,被称量物与砝码的位置放颠倒了,称取溶质的质量偏小,所配溶液浓度偏低,故选①;
②转移溶液前容量瓶内有少量蒸馏水,对溶质物质的量、溶液体积均无影响,对所配溶液浓度无影响,故不选②;
③定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏高,故不选③;
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,溶液体积偏大,所配溶液浓度偏低,故选④;
选①④。
(2)根据阳离子所带正电荷总数等于阴离子所带负电荷总数,则c(K+)+ 2c(Mg2+)+ 3c(Al3+) = c(Cl-)+2 c(SO),c(SO)=(3 mol/L+2mol/L×2+2mol/L×3-7mol/L)÷2=3 mol/L;
(3)同温同压下,同体积的气体,物质的量相等,设所盛气体的物质的量为xmol,容器的质量为ag,某容器充满O2重116 g,若充满CO2重122 g,则 ,解得a=100、x=0.5,现充满某气体重114 g,某气体质量为14g、物质的量为0.5mol,则该气体的相对分子质量为。
(4)相同状况下,若气体X2与氮气以体积比1∶4混合,该混合气体相对氢气的密度为14.4,混合气体的平均相对分子质量为28.8,设X2的相对分子质量为a,,a=32。
(5)若标准状况下气体X2的密度为1.25 g·L-1,则X2的摩尔质量为1.25 g·L-1×22.4L/mol=28g/mol,X的相对原子质量为14, X是N原子,X原子最外层有5个电子。
17.(1) 同素异形体 非氧化还原反应
(2) Cl2+2OH-=ClO-+Cl-+H2O “84”消毒液和洁厕灵两者发生反应,生成有毒气体氯气
(3) 1mol KClO3
(4)让一束光(或用红色激光笔照射)通过制得的液体,从侧面能观察到一条光亮的“通路”,说明制得的液体是胶体
【详解】(1)臭氧的化学式为O3,氧气的化学式为O2,臭氧和氧气均是有氧元素组成不同结构的单质,因此臭氧和氧气互为同素异形体;它们之间的转化没有化合价的变化,因此该变化过程不属于氧化还原反应;故答案为同素异形体;非氧化还原反应;
(2)“84”消毒液的有效成分是NaClO,氯气与NaOH溶液反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O;“84”消毒液的有效成分是NaClO,能与盐酸反应NaClO+2HCl=NaCl+Cl2↑+H2O,氯气有毒,因此两者不能混合使用;故答案为Cl2+2OH-=ClO-+Cl-+H2O;“84”消毒液和洁厕灵两者发生反应,生成有毒气体氯气;
(3)根据反应方程式,Cl元素化合价由+5价降低为+4价,C元素化合价由+3价升高为+4价,因此生成1molClO2时,转移电子物质的量为1mol×(5-4)=1mol;氧化剂的化合价降低,因此KClO3为氧化剂;故答案为1mol;KClO3;
(4)检验胶体的方法是丁达尔效应,具体操作是让一束光(或用红色激光笔照射)通过制得的液体,从侧面能观察到一条光亮的“通路”,说明制得的液体是胶体;故答案为让一束光(或用红色激光笔照射)通过制得的液体,从侧面能观察到一条光亮的“通路”,说明制得的液体是胶体。
18.(1)检查装置的气密性
(2) 分液漏斗 让液体能顺利流下
(3) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 盐酸浓度降低到一定值后反应停止
(4) 检验后续装置是否堵塞(平衡气压)并除掉Cl2中的HCl气体 Cl2+2OH-=Cl-+ClO-+H2O
(5) 浓硫酸 防止G中的水蒸气进入导致FeCl3吸水潮解
【分析】实验室用如图装置制备无水FeCl3时,装置A用于制取Cl2,装置B用于除去Cl2中的HCl,并检查后续装置是否发生堵塞,装置C用于干燥氯气,防止装置D中生成的FeCl3发生潮解;装置E用于收集反应生成的FeCl3,装置F用于防止G中产生的水蒸气进入装置E,导致FeCl3发生潮解,装置G用于吸收Cl2,防止污染环境。
【详解】(1)连接好仪器后,需要清楚装置是否漏气,则首先应进行的操作是检查装置的气密性。答案为:检查装置的气密性;
(2)装置A盛放浓盐酸的仪器带有活塞,则其名称是分液漏斗,其上口与烧瓶用导管相连,可保证分液漏斗内外压强相等,则其作用是:让液体能顺利流下。答案为:分液漏斗;让液体能顺利流下;
(3)A装置中,MnO2与浓盐酸反应生成Cl2、MnCl2等,发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。随着反应的进行,浓盐酸转化为稀盐酸,而稀盐酸与MnO2不能发生反应,则当加入一定量的浓盐酸与足量MnO2反应,实际生成的Cl2体积小于理论值的原因是:盐酸浓度降低到一定值后反应停止。答案为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;盐酸浓度降低到一定值后反应停止;
(4)由分析可知,装置B的作用是:检验后续装置是否堵塞(平衡气压)并除掉Cl2中的HCl气体,G中Cl2与NaOH发生反应生成NaCl、NaClO等,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。答案为:检验后续装置是否堵塞(平衡气压)并除掉Cl2中的HCl气体;Cl2+2OH-=Cl-+ClO-+H2O;
(5)F装置的作用是防止G中产生的水蒸气进入E装置,导致氯化铁潮解,则F中所装试剂为浓硫酸,目的是:防止G中的水蒸气进入导致FeCl3吸水潮解。答案为:浓硫酸;防止G中的水蒸气进入导致FeCl3吸水潮解。
【点睛】若分液漏斗内气体与外界没有物质交换,随着液体的不断流出,漏斗内产生负压,液体难以继续流出。
19.(1)高沸点难挥发性酸制取低沸点易挥发性酸(或书写方程式NaNO3+H2SO4(浓)=NaHSO4+HNO3↑或2NaNO3+H2SO4(浓)=Na2SO4+2HNO3↑)
(2) A d 4NH3+5O24NO+6H2O NH4NO3 在丙装置后增加装有P2O5或无水氯化钙的干燥管(吸收氨气的装置) 10∶1
【详解】(1)工业上曾使用浓硫酸和智利硝石(主要成分NaNO3)制硝酸,原理是高沸点难挥发性酸制取低沸点易挥发性酸(或书写方程式NaNO3+H2SO4(浓)=NaHSO4+HNO3↑或2NaNO3+H2SO4(浓)=Na2SO4+2HNO3↑);
(2)①若只用一种试剂制取氨气,则该试剂的最佳选择为浓氨水,此时,甲中空白处所需装置应为d,空气吹出氨气;
②装置丙中主要发生的反应为铂作催化剂发生催化氧化:4NH3+5O24NO+6H2O;
③若装置戊中产生了大量的白烟,原因是未反应完的氨气和生成的硝酸反应生成NH4NO3,在丙装置后增加装有P2O5或无水氯化钙的干燥管(吸收氨气的装置)可有效地抑制该现象的发生;
④48gMg为2mol,0.50L4.0mol/L的HNO3为2.0mol,由图像可知n(NO)∶n(N2)∶n(H2)∶n(NO2)=5∶3∶1∶1;同时还原产物还有NH,2mol镁失去电子总数为4mol,生成气体为标况下11.2L即0.5mol,结合比例可知各种气体的物质的量为n(NO)=0.25mol、n(N2)=0.15mol、n(H2)=0.05mol、n(NO2) =0.05mol,气体得电子总数为0.25mol3+0.1525+0.052+0.051=2.4mol,根据得失电子守恒知,生成的NH时氮元素得电子数为4mol-2.4mol=1.6mol,所以n(NH)==n(NH4NO3),镁元素守恒,反应后液相中n[Mg(NO3)2]=2mol,故反应后液相中Mg(NO3)2与NH4NO3的浓度之比为2mol∶0.2mol=10∶1。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.配制一定物质的量浓度的NaOH溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平和称量纸称量NaOH固体
B.容量瓶中有少量蒸馏水
C.容量瓶盛过NaOH溶液,使用前未洗涤
D.定容时,仰视刻度线
2.某溶液稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线如图,根据图中数据分析得出a的值为(忽略溶液混合时体积的变化)
A.0.8 B.1.2 C.1.6 D.2.0
3.下列实验现象或结论描述不正确的是
选项 实验 现象或结论
A 在氯化铁溶液中加入铜粉 棕黄色溶液变成蓝色溶液,说明Fe3+具有氧化性
B 紫色石蕊溶液中通入足量的Cl2 溶液先变红色,后褪色,说明氯水有酸性和漂白性
C 往AlCl3溶液中滴加足量NaOH溶液 产生大量白色沉淀
D 加热放在坩埚中的小块钠 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体
A.A B.B C.C D.D
4.下列说法正确的是
①氯气、液氯、氯水是同一种物质
②钠的化学性质活泼,可从硫酸铜溶液中置换出铜
③金属钠着火不能用水、干粉灭火剂、泡沫灭火剂等扑灭
④和长期置于空气中,最终产物相同
⑤干燥氯气可以使鲜花褪色
⑥钠、氢气都能在氯气中燃烧生成白雾
A.①②③ B.①③④ C.③④⑤ D.③④⑥
5.硫酸亚铁铵受热分解的反应方程式为2(NH4)2Fe(SO4)2Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O,用NA表示阿佛加德罗常数的值。下列说法正确的是
A.1L0.1mol L-1(NH4)2Fe(SO4)2溶液中Fe2+的数目为0.1NA
B.将1molSO2和1molO2充分反应后,其分子总数为1.5NA
C.标准状况下,每生成15.68L气体转移电子数目为0.8NA
D.常温常压下,3.0g15N2中含有的中子总数为1.4NA
6.下列反应的离子方程式或方程式书写正确的是
A.稀硫酸与溶液反应:
B.钠与水反应的离子方程式:
C.溶液中滴加少量稀盐酸:
D.溶液中滴入少量溶液:
7.若在加入铝粉能放出H2的溶液中,下列各组离子一定不能大量共存的是
A.Na+、Fe3+、SO、Cl- B.Ba2+、Mg2+、HCO、NO
C.Na+、K+、NO、CO D.K+、NO、AlO、OH-
8.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是
A.
B.
C.
D.
9.某无色透明溶液中可能含有下列离子中的几种:、、、、、、。现进行如下实验:
①取少量溶液用红色石蕊试纸检验,试纸变蓝色;
②另取少量溶液逐滴滴加盐酸至过量,无气体放出;
③另取少量溶液用硝酸酸化后,加入溶液有白色沉淀生成。下列说法错误的是
A.不用进行实验,就可判断出原溶液中一定无
B.由实验①可知:原溶液中一定不存在
C.实验②中,首先发生的反应为
D.由实验③可知:AgCl不溶于硝酸
10.将一定量的氯气缓慢通入30mL 10.00氢氧化钠溶液中,加热一段时间后,得到溶质仅为NaCl、NaClO、的混合溶液。下列说法正确的是
A.通入氯气的体积为3.36L
B.反应后的溶液中含有钠元素的总质量为6.9g
C.当参与反应的时,生成物
D.往反应后的溶液中加入适量硝酸酸化的硝酸银溶液,无沉淀生成
11.如图是一种综合处理SO2废气的工艺流程。下列说法正确的是
A.操作Ⅱ发生反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O
B.溶液b中阳离子只有Fe2+
C.溶液a转化为溶液b的反应中,SO2被还原
D.加入FeO可以使溶液c转化为溶液a
12.如图是N、S及其化合物的“价—类”二维图,下列说法正确的是
A.在一定条件下,a可将c、d还原为b
B.c'使品红褪色的原理与HClO的漂白原理相同
C.a与浓e、a'与浓e'均能发生氧化还原反应
D.常温下,Fe与浓e和浓e'均不反应
13.下列由实验现象所得结论正确的是
A.向BaCl2溶液中通入X气体,产生白色沉淀,则X气体可能是SO2或CO2
B.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则原溶液中一定有Ag+
C.某溶液中加入Na2CO3溶液有白色沉淀,再滴加盐酸沉淀消失,则原溶液中一定有Ca2+
D.某溶液中加入稀盐酸产生使品红溶液褪色的气体,则原溶液中可能含SO或HSO
14.用NA代表阿伏伽德罗常数的数值,下列说法正确的是
A.浓盐酸与足量MnO2反应生成11.2 L Cl2,转移电子数为NA
B.将1 mol Cl2通入足量水中,HClO、Cl-、ClO-微粒数之和为2NA
C.有铁粉参加的反应,若生成2 mol Fe2+,则转移电子数一定为4NA
D.0.1 mol FeCl3加入沸水中完全反应生成Fe(OH)3胶体粒子数小于0.1NA
15.化学与人类生产、生活密切相关,下列叙述中正确的是
A.京东方生产的可折叠柔性屏中的灵魂材料——纳米银与硝酸不会发生化学反应
B.在葡萄酒酿制过程中,添加适量二氧化硫可以起到杀菌作用
C.硅是制作光导纤维的主要材料
D.“超轻海绵”使用的石墨烯是新型有机高分子材料
二、填空题
16.回答下列问题
(1)实验室欲用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,需称取Na2CO3·10H2O晶体___________ g;完成本实验需用到的仪器有天平、药匙、玻璃棒、烧杯和___________;下列情况会使所配溶液浓度偏低的是___________(填序号)。
①用天平称量质量时,被称量物与砝码的位置放颠倒了
②转移溶液前容量瓶内有少量蒸馏水
③定容时俯视刻度线
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(2)某混合溶液中,含有K+、Mg2+、Al3+、Cl-和SO五种离子(不考虑溶液中少量H+和OH-),其中c(K+)=3 mol/L、c(Mg2+)=2 mol/L、c(Al3+)=2 mol/L、c(Cl-)=7 mol/L,则溶液中SO的物质的量浓度是___________。
(3)同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则该气体的相对分子质量为___________。
(4)相同状况下,若气体X2与氮气以体积比1∶4混合,该混合气体相对氢气的密度为14.4,则X2的相对分子质量为___________。
(5)若标准状况下气体X2的密度为1.25 g·L-1,X原子最外层有___________个电子。
17.生活无处不化学,例如生活中常见消毒剂:臭氧、“84”消毒液、二氧化氯、高铁酸钠等。
(1)臭氧和氧气互为_______(填“同位素”或“同素异形体”),它们在一定条件下可以相互转化,该变化过程属于_______(填“氧化还原反应”或“非氧化还原反应”)。
(2)常温下,将氯气通入NaOH溶液中,可以制得“84”消毒液,写出发生反应的离子方程式:_______。生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是_______。
(3)是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:。产生1 mol 时,转移的电子的物质的量为_______;该反应中的氧化剂是_______(填化学式)。
(4)高铁酸钠()是一种新型的净水剂。其净水过程中发生的化学反应主要为(胶体),证明有胶体生成的方法为_______。
三、实验题
18.实验室可用如图装置制备无水FeCl3。已知FeCl3易升华,易吸收水分而潮解。请回答下列问题:
(1)连接好仪器后首先应进行的操作是_______。
(2)装置A盛放浓盐酸的仪器名称是_______,其上口与烧瓶用导管相连的作用是_______。
(3)A装置中发生反应的离子方程式为_______。当加入一定量的浓盐酸与足量MnO2反应,实际生成的Cl2体积小于理论值的原因是_______。
(4)装置B的作用是_______,G中发生反应的离子方程式为_______。
(5)F中所装试剂为_______,目的是_______。
19.HNO3是极其重要的化工原料,在工业、农业、医药、军事等领域有着广泛的应用。
(1)工业上曾使用浓硫酸和智利硝石(主要成分NaNO3)制硝酸,但该法耗酸量大,设备腐蚀严重,现基本停止使用。此方法常用于实验室制取少量硝酸,则该反应的原理是______。
(2)现代工业上制备HNO3通常采用NH3催化氧化法,利用如图装置,模拟氨的催化氧化法制备硝酸。
其中,甲为氨气的发生装置。且甲中所用试剂只能从下列物质选取:
A.浓氨水 B.NH4Cl C.NH4NO3 D.CaO
①若只用一种试剂制取氨气,则该试剂的最佳选择为______(选填试剂标号),此时,甲中空白处所需装置应为______(选填下列标号)。
②写出装置丙中主要发生的反应化学方程式______。
③若装置戊中产生了大量的白烟,其成分是______(填化学式),如何有效地抑制该现象的发生______。
④用上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相中有Mg(NO3)2、NH4NO3和H2O。各气体产物成分及含量随HNO3的浓度变化曲线如图所示。若有48gMg与0.50L4.0mol/L的HNO3充分反应,收集到11.2mL气体(标况)。则反应后液相中Mg(NO3)2与NH4NO3的浓度之比为______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.氢氧化钠具有潮解性吸收空气中水且能和空气中二氧化碳反应,使得称量物质中氢氧化钠量偏小,导致所配溶液浓度偏低,故A不符合题意;
B.容量瓶中有少量蒸馏水,不影响所配溶液浓度,故B不符合题意;
C.容量瓶盛过NaOH溶液,使用前未洗涤使得溶液中溶质增大,导致所配溶液浓度偏高,故C符合题意;
D.定容时,仰视刻度线,使得溶液体积增大,导致所配溶液浓度偏低,故D不符合题意;
故选C。
2.C
【详解】根据图像,当溶液体积为0.5L时浓度为4mol/L,当溶液体积为aL时浓度为1.25mol/L,根据稀释前后溶质物质的量不变,0.5L×4mol/L=aL×1.25mol/L,a=1.6L,故选C。
3.C
【详解】A.在氯化铁溶液中加入铜粉,氯化铁溶液与铜粉反应生成氯化亚铁和氯化铜,棕黄色溶液变成蓝色溶液,说明Fe3+将Cu氧化为Cu2+,说明Fe3+具有氧化性,故A正确;
B.氯气与水反应生成盐酸,酸性使得石蕊变红,后褪色是因为生成盐酸(HCl)的同时还生成了次氯酸(HClO),次氯酸有漂白的作用使得有机酸碱指示剂石蕊褪色成无色,故B正确;
C.往AlCl3溶液中滴加足量NaOH溶液生成NaAlO2溶液,不会产生大量白色沉淀,故C错误;
D.加热放在坩埚中的小块钠,钠熔点低,先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体Na2O2,故D正确;
故选C。
4.C
【详解】①氯气、液氯都是单质氯,氯水是氯气的水溶液,这三者不是同一种物质,①错误;
②钠易和水反应,不能从硫酸铜溶液中置换出铜,②错误;
③金属钠可以和水反应,可以和干粉灭火剂产生的二氧化碳反应,可以和泡沫灭火剂产生的水分反应,故金属钠着火不能用水、干粉灭火剂、泡沫灭火剂等扑灭,③正确;
④和长期置于空气中,最终都会生成碳酸钠,产物相同,④正确;
⑤鲜花中含有水分,则干燥氯气可以使鲜花褪色,⑤正确;
⑥钠在氯气中燃烧产生白烟,⑥错误;
正确的是:③④⑤;
故选C。
5.C
【详解】A.由于水解,溶液中的数目小于,选项A错误;
B.与反应属于可逆反应,所以和充分反应后,其分子总数大于,选项B错误;
C.标准状况下,气体为,其中占、占,占,根据反应可知,生成转移电子,生成则转移电子,数目为,选项C正确;
D.的中子数,为,含有的中子总数,选项D错误;
答案选C。
6.D
【详解】A.稀硫酸与溶液反应:,故A错误;
B.钠与水反应的离子方程式:,故B错误;
C.溶液中滴加少量稀盐酸:,故C错误;
D.溶液中滴入少量,两者1:1恰好完全反应,离子方程式为:,故D正确;
故选:D。
7.B
【分析】铝粉能放出H2的溶液,可能是酸溶液,也可能是碱溶液。
【详解】A.Na+、Fe3+、SO、Cl-在酸中能大量共存,在碱中,OH-与Fe3+反应,故A不符合题意;
B.Mg2+与OH-反应生成沉淀,HCO与OH-反应生成水和碳酸根,HCO与氢离子反应生成水和二氧化碳,故B符合题意;
C.Na+、K+、NO、CO在碱中大量共存,CO与氢离子反应生成水和二氧化碳,故C不符合题意;
D.K+、NO、AlO、OH-在碱中大量共存,AlO、OH-与氢离子反应,故C不符合题意。
综上所述,答案为B。
8.A
【详解】A.有元素化合价变化,属于氧化还原反应,不是化合反应,不是分解反应,不是置换反应,故选A;
B.是化合反应,不属于阴影部分,故不选B;
C.是分解反应,不属于阴影部分,故不选C;
D.是置换反应,不属于阴影部分,故不选D;
选A。
9.C
【详解】A.含有离子的溶液呈蓝色,无色溶液中一定不含,故A正确;
B.取少量溶液用红色石蕊试纸检验,试纸变蓝色,说明溶液呈碱性,可能含有、中的一种或两种,均与产生沉淀,可知:原溶液中一定不存在,故B正确;
C.另取少量溶液逐滴滴加盐酸至过量,无气体放出,说明溶液中不含,故C错误;
D.、Ag+反应生成AgCl沉淀,另取少量溶液用硝酸酸化后,加入溶液有白色沉淀生成,可知AgCl不溶于硝酸,故D正确;
选C。
10.B
【详解】A.溶质仅为NaCl、NaClO、,n(Na)=n(Cl)= 0.03L ×10.00=0.3mol,所以通入氯气的物质的量为0.15mol,没有明确是否为标准状况,通入氯气的体积不一定为3.36L,故A错误;
B.根据钠元素守恒,反应后的溶液中含有钠元素的总质量为0.03L ×10.00×23g/mol=6.9g,故B正确;
C.氧化产物有NaClO、两种,还原产物为NaCl,不能判断NaCl、NaClO的比,故C产物;
D.反应后的溶液中含有氯离子,往反应后的溶液中加入适量硝酸酸化的硝酸银溶液,有氯化银沉淀生成,故D错误;
选B。
11.A
【分析】溶液a中通入SO2,转化为溶液b,化学方程式为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4;溶液b中通入空气,转化为溶液c,化学方程式为4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O。
【详解】A.由分析可知,操作Ⅱ中,FeSO4被O2氧化,生成Fe2(SO4)3等,反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O,A正确;
B.溶液b中,阳离子有Fe2+、H+,可能含有Fe3+,B错误;
C.溶液a转化为溶液b的过程中,SO2转化为H2SO4,SO2失电子被氧化,C错误;
D.由分析可以看出,溶液c中含有Fe2(SO4)3、H2SO4,加入FeO后,FeO和H2SO4反应会生成FeSO4,D错误;
故答案为:A。
12.A
【分析】根据图示,a为NH3、b为N2、c为NO、d为NO2、e为HNO3;a'为H2S、b'为S、c'为SO2、d'为H2SO3、e'为H2SO4,据此解答。
【详解】A. a为NH3、b为N2、c为NO、d为NO2,根据化合价以及氧化还原规律,一定条件下,a可将c、d还原为b,A正确,
B .c'使品红褪色的原理为与有色物质生成不稳定的无色物质,HClO的漂白原理为将有色物质氧化为无色物质,原理不相同,B错误;
C.氨气和浓硝酸不能发生氧化还原反应,H2S可以和浓硫酸发生氧化还原反应,C错误;
D.常温下,Fe与浓硝酸和浓硫酸发生钝化反应,阻止反应进一步进行,不是不反应,D错误;
故选A。
13.D
【详解】A.二氧化硫、二氧化碳和氯化钡不反应,不能生成沉淀,A错误;
B.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,也可能是钡离子生成的不溶于水的硫酸钡沉淀,不能说明原溶液中一定有Ag+,B错误;
C.若原溶液中含有钡离子也会生成碳酸钡沉淀,加入盐酸出现同样现象,C错误;
D.二氧化硫气体具有漂白性,能使品红溶液褪色,亚硫酸根离子、亚硫酸氢根离子和盐酸生成二氧化硫气体;某溶液中加入稀盐酸产生使品红溶液褪色的气体,则原溶液中可能含SO或HSO,D正确;
故选D。
14.D
【详解】A.气体状态未知,不能计算转移电子数,A错误;
B.氯气溶于水,部分以氯气分子存在,HClO、Cl-、ClO-微粒数之和小于2NA,B错误;
C.有铁粉参加的反应,若生成2 mol Fe2+,则转移电子数不一定为4NA,如Fe+2Fe3+=3Fe2+,C错误;
D.Fe(OH)3胶体是多个Fe(OH)3的集合体,0.1 mol FeCl3加入沸水中完全反应生成Fe(OH)3胶体粒子数小于0.1NA,D正确;
故选D。
15.B
【详解】A.纳米银本质也为银单质,能与硝酸发生氧化还原反应生成硝酸银和氮的氧化物,A错误;
B.二氧化硫具有还原性,在葡萄酒酿制过程中,添加适量二氧化硫可以起到抗氧化作用,防止食物氧化变质;同时二氧化硫还能起到杀菌作用,B正确;
C.硅是制作计算机芯片的主要材料,光导纤维的主要成分是二氧化硅,C错误;
D.“超轻海绵”使用的石墨烯是碳单质,为无机非金属材料,D错误;
故答案选B。
16.(1) 28.6 100 mL容量瓶、胶头滴管 ①④
(2)3 mol/L
(3)28
(4)32
(5)5
【详解】(1)用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,需称取Na2CO3·10H2O晶体的质量m=cVM=0.1L ×1 mol/L×286g/mol=28.6g。完成本实验的步骤有:计算、称量、溶解、移液、洗涤、定容、摇匀,需用到的仪器有天平、药匙、玻璃棒、烧杯和100 mL容量瓶、胶头滴管;
①用天平称量质量时,被称量物与砝码的位置放颠倒了,称取溶质的质量偏小,所配溶液浓度偏低,故选①;
②转移溶液前容量瓶内有少量蒸馏水,对溶质物质的量、溶液体积均无影响,对所配溶液浓度无影响,故不选②;
③定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏高,故不选③;
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,溶液体积偏大,所配溶液浓度偏低,故选④;
选①④。
(2)根据阳离子所带正电荷总数等于阴离子所带负电荷总数,则c(K+)+ 2c(Mg2+)+ 3c(Al3+) = c(Cl-)+2 c(SO),c(SO)=(3 mol/L+2mol/L×2+2mol/L×3-7mol/L)÷2=3 mol/L;
(3)同温同压下,同体积的气体,物质的量相等,设所盛气体的物质的量为xmol,容器的质量为ag,某容器充满O2重116 g,若充满CO2重122 g,则 ,解得a=100、x=0.5,现充满某气体重114 g,某气体质量为14g、物质的量为0.5mol,则该气体的相对分子质量为。
(4)相同状况下,若气体X2与氮气以体积比1∶4混合,该混合气体相对氢气的密度为14.4,混合气体的平均相对分子质量为28.8,设X2的相对分子质量为a,,a=32。
(5)若标准状况下气体X2的密度为1.25 g·L-1,则X2的摩尔质量为1.25 g·L-1×22.4L/mol=28g/mol,X的相对原子质量为14, X是N原子,X原子最外层有5个电子。
17.(1) 同素异形体 非氧化还原反应
(2) Cl2+2OH-=ClO-+Cl-+H2O “84”消毒液和洁厕灵两者发生反应,生成有毒气体氯气
(3) 1mol KClO3
(4)让一束光(或用红色激光笔照射)通过制得的液体,从侧面能观察到一条光亮的“通路”,说明制得的液体是胶体
【详解】(1)臭氧的化学式为O3,氧气的化学式为O2,臭氧和氧气均是有氧元素组成不同结构的单质,因此臭氧和氧气互为同素异形体;它们之间的转化没有化合价的变化,因此该变化过程不属于氧化还原反应;故答案为同素异形体;非氧化还原反应;
(2)“84”消毒液的有效成分是NaClO,氯气与NaOH溶液反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O;“84”消毒液的有效成分是NaClO,能与盐酸反应NaClO+2HCl=NaCl+Cl2↑+H2O,氯气有毒,因此两者不能混合使用;故答案为Cl2+2OH-=ClO-+Cl-+H2O;“84”消毒液和洁厕灵两者发生反应,生成有毒气体氯气;
(3)根据反应方程式,Cl元素化合价由+5价降低为+4价,C元素化合价由+3价升高为+4价,因此生成1molClO2时,转移电子物质的量为1mol×(5-4)=1mol;氧化剂的化合价降低,因此KClO3为氧化剂;故答案为1mol;KClO3;
(4)检验胶体的方法是丁达尔效应,具体操作是让一束光(或用红色激光笔照射)通过制得的液体,从侧面能观察到一条光亮的“通路”,说明制得的液体是胶体;故答案为让一束光(或用红色激光笔照射)通过制得的液体,从侧面能观察到一条光亮的“通路”,说明制得的液体是胶体。
18.(1)检查装置的气密性
(2) 分液漏斗 让液体能顺利流下
(3) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 盐酸浓度降低到一定值后反应停止
(4) 检验后续装置是否堵塞(平衡气压)并除掉Cl2中的HCl气体 Cl2+2OH-=Cl-+ClO-+H2O
(5) 浓硫酸 防止G中的水蒸气进入导致FeCl3吸水潮解
【分析】实验室用如图装置制备无水FeCl3时,装置A用于制取Cl2,装置B用于除去Cl2中的HCl,并检查后续装置是否发生堵塞,装置C用于干燥氯气,防止装置D中生成的FeCl3发生潮解;装置E用于收集反应生成的FeCl3,装置F用于防止G中产生的水蒸气进入装置E,导致FeCl3发生潮解,装置G用于吸收Cl2,防止污染环境。
【详解】(1)连接好仪器后,需要清楚装置是否漏气,则首先应进行的操作是检查装置的气密性。答案为:检查装置的气密性;
(2)装置A盛放浓盐酸的仪器带有活塞,则其名称是分液漏斗,其上口与烧瓶用导管相连,可保证分液漏斗内外压强相等,则其作用是:让液体能顺利流下。答案为:分液漏斗;让液体能顺利流下;
(3)A装置中,MnO2与浓盐酸反应生成Cl2、MnCl2等,发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。随着反应的进行,浓盐酸转化为稀盐酸,而稀盐酸与MnO2不能发生反应,则当加入一定量的浓盐酸与足量MnO2反应,实际生成的Cl2体积小于理论值的原因是:盐酸浓度降低到一定值后反应停止。答案为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;盐酸浓度降低到一定值后反应停止;
(4)由分析可知,装置B的作用是:检验后续装置是否堵塞(平衡气压)并除掉Cl2中的HCl气体,G中Cl2与NaOH发生反应生成NaCl、NaClO等,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。答案为:检验后续装置是否堵塞(平衡气压)并除掉Cl2中的HCl气体;Cl2+2OH-=Cl-+ClO-+H2O;
(5)F装置的作用是防止G中产生的水蒸气进入E装置,导致氯化铁潮解,则F中所装试剂为浓硫酸,目的是:防止G中的水蒸气进入导致FeCl3吸水潮解。答案为:浓硫酸;防止G中的水蒸气进入导致FeCl3吸水潮解。
【点睛】若分液漏斗内气体与外界没有物质交换,随着液体的不断流出,漏斗内产生负压,液体难以继续流出。
19.(1)高沸点难挥发性酸制取低沸点易挥发性酸(或书写方程式NaNO3+H2SO4(浓)=NaHSO4+HNO3↑或2NaNO3+H2SO4(浓)=Na2SO4+2HNO3↑)
(2) A d 4NH3+5O24NO+6H2O NH4NO3 在丙装置后增加装有P2O5或无水氯化钙的干燥管(吸收氨气的装置) 10∶1
【详解】(1)工业上曾使用浓硫酸和智利硝石(主要成分NaNO3)制硝酸,原理是高沸点难挥发性酸制取低沸点易挥发性酸(或书写方程式NaNO3+H2SO4(浓)=NaHSO4+HNO3↑或2NaNO3+H2SO4(浓)=Na2SO4+2HNO3↑);
(2)①若只用一种试剂制取氨气,则该试剂的最佳选择为浓氨水,此时,甲中空白处所需装置应为d,空气吹出氨气;
②装置丙中主要发生的反应为铂作催化剂发生催化氧化:4NH3+5O24NO+6H2O;
③若装置戊中产生了大量的白烟,原因是未反应完的氨气和生成的硝酸反应生成NH4NO3,在丙装置后增加装有P2O5或无水氯化钙的干燥管(吸收氨气的装置)可有效地抑制该现象的发生;
④48gMg为2mol,0.50L4.0mol/L的HNO3为2.0mol,由图像可知n(NO)∶n(N2)∶n(H2)∶n(NO2)=5∶3∶1∶1;同时还原产物还有NH,2mol镁失去电子总数为4mol,生成气体为标况下11.2L即0.5mol,结合比例可知各种气体的物质的量为n(NO)=0.25mol、n(N2)=0.15mol、n(H2)=0.05mol、n(NO2) =0.05mol,气体得电子总数为0.25mol3+0.1525+0.052+0.051=2.4mol,根据得失电子守恒知,生成的NH时氮元素得电子数为4mol-2.4mol=1.6mol,所以n(NH)==n(NH4NO3),镁元素守恒,反应后液相中n[Mg(NO3)2]=2mol,故反应后液相中Mg(NO3)2与NH4NO3的浓度之比为2mol∶0.2mol=10∶1。
答案第1页,共2页
答案第1页,共2页
