河南省南阳市邓州春雨国文学校2022-2023学年高二下学期6月月考化学试题卷(pdf版含解析)
文档属性
| 名称 | 河南省南阳市邓州春雨国文学校2022-2023学年高二下学期6月月考化学试题卷(pdf版含解析) |  | |
| 格式 | |||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-10 19:12:56 | ||
图片预览




文档简介
春雨国文学校 高二化学六月月考试卷
一、单选题
1.某高分子化合物 的单体是 ( )
A. B.
A.T1 T2 放热反应 B.T1 T2 吸热反应 C.T1 T2 吸热反应 D.T1 T2 放热反应
6.下列操作中,能使水的电离平衡向右移动,而且所得溶液显酸性的是( )
C. D.
A.在水中加入少量氯化钠,并加热到 100 ℃ B.在水中滴入稀硫酸
2.下列物质的分类组合全部正确的是( ) C.在水中加入小苏打 D.在水中加入氯化铝固体
选项 强电解质 弱电解质 非电解质 7.下列各组离子在溶液中能大量共存,加入足量盐酸既有沉淀析出又有气体放出的是( )
A 2- 2- .Na+、Ag+、CO + -3 、NO 3 B.K 、OH 、SO 3 、AlO 2
A NaCl HCl CO2
C Na+ SO 2 SiO 2-. 、 4 、 3 、CO
2-
3 D.NH 4 、Ca2+、Cl-、HCO 3
B NaHCO3 NH3·H2O CCl4
8.β -紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素 A。下列说法正确的是
C BaCO3 Ba(OH)2 Cu ( )
D H2SO4 NaOH C2H5OH
A.A B.B C.C D.D
3.下列过程或现象与盐类的水解无关的是( )
A.加热氯化铁溶液的颜色变深 B.CaCO3的饱和溶液 pH 约为 9.3 A.β—紫罗兰酮可能有属于芳香烃类的同分异构体 B.1 mol 维生素 A 最多能与 4 mol H2发生加成反应
C.0.1mol/LAlCl3 溶液中 c(Al3+)<0.1mol/L D.NaHCO3 做发酵粉时加入柠檬酸后效果更好 C.维生素 A 的分子式为 C20H30O D.β—紫罗兰酮与中间体 X 互为同分异构体
4.已知 25℃、101kPa 下,1mol水蒸发为水蒸气需要吸热 44.01kJ
9.山梨酸( )是一种高效安全的防腐保鲜剂。有关山梨酸
2H2O(l) 2H2 (g) O2 (g) ΔH= 571.66kJ mol
1
C(s) H2O(g) CO(g) H2 (g) ΔH= 131.29kJ mol
1
的说法正确的是( )
则反应 2C(s)+O2(g)=2CO(g)的反应热为( ) A.属于二烯烃 B.和Br2 加成,可能生成 4 种物质
A.ΔH=-396.36kJ·mol-1 B.ΔH=-110.53kJ·mol-1 C.ΔH=-154.54kJ·mol-1 D.ΔH=-221.06kJ·mol-1
C.1mol 可以和 3mol H2 反应 D.和CH CH
18
3 2 OH H
18
反应,生成 2 O
5.可逆反应mA(s) nB(g) pC(g) qD(g)中,当其它条件不变时,C 的质量分数与温度(T)的关系如图,则下
列说法正确的是 10.对氨基苯甲酸( 是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸
( )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法不正确的是( )
第 1页 共 8页 ◎ 第 2页 共 8页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
C.用 Na2CO3溶液处理锅炉中水垢:CaSO4 CO
2 3 CaCO3 SO
2
4
D.氨水与过量H2C2O4 溶液反应:H2C2O4 2NH3 H2O=C2O
2
4 2NH
4 2H2O
14.25℃ -9 -5时,某酸 HA的Ka = 1.0×10 (醋酸的Ka = 1.8×10 ),下列说法正确的是( )
A.相同温度下,等 pH 的 NaA 溶液和 CH3COONa 溶液中,c(Na+)前者大于后者
B.加热浓度均为 0.1mol·L-1 的 NaA 溶液和 NaOH 溶液(溶液体积均保持不变),两种溶液的 pH 均变大
C.25℃时,向 0.1mol·L-1 的 HA 溶液中加少量 NaA 固体,水的电离程度变小
D.25℃时,将 HA 溶液与 NaOH 溶液混合测得 pH=9,此时溶液中 c(A-)=c(HA)
A.X 为 H2 B.反应结束后阳极区 pH 不变 15.室温下过氧化铬( CrO5 )在硝酸酸化的戊醇中会溶解并发生反应:
C.阴极的主要电极反应式为: +6e-+6H+= +2H2O 4CrO5 12HNO3 4Cr NO3 7O 3 13 2 g 6H2O。在 5m11 10 mol L 的过氧化铬戊醇溶液中滴入一定量的稀硝
D.电流由电源正极经金属阳极 DSA、电解质溶液、铝合金,回到电源负极
酸,在不同时刻测得过氧化铬浓度如下表:
11.常温下,用1mol/L 的 NaOH 溶液滴定10m11mo1/ L的H2A 溶液,溶液的 pH 与 NaOH 的体积关系如图所示。
时间/min 4 6 8 10 t 20 25 35
(H2A 的电离常数为Ka1和Ka2 )下列说法正确的是( )
c CrO5 / 10 5 mol L 1 4.230 2.510 1.790 1.350 1.240 1.130 1.110 1.100
A.水的电离程度:C>B
下列叙述正确的是( )
B.C 点, c Na c HA 2c A2
A.4~6min 6 1 1内过氧化铬分解的平均速率 v H2O =8.6 10 mol L min
C.D 点, 2c Na c H2A c HA c A2
B.8~10min 内过氧化铬分解释放的O2体积为 0.86mL(标准状况)
D.若 A 点的纵坐标为 3,则Ka1 Ka 2 10
9
C.推测表中 t 的取值范围为:1012.有机物 俗称苦杏仁酸,在医药工业上可用于合成头孢羟唑、羟苄唑、匹莫林等的中间体。下列 D.若升高温度后重新实验发现 20min 时过氧化铬浓度为1.120 10 5 mol L 1,则证明反应的△H>0
16.在 25℃时,将 1.0Lwmol·L-1CH3COOH 溶液与 0.1molNaOH 固体混合,充分反应。然后向混合液中加入
关于该有机物的说法正确的是( )
CH3COOH 或 CH3COONa 固体(忽略体积和温度变化),溶液 pH 的变化如图所示。下列叙述不正确的是( )
A.该有机物的分子式为 C8H8O3,含氧官能团是羟基和羰基
B.在一定条件下能发生氧化反应、取代反应、加成反应、消去反应和缩聚反应
A b +. 点溶液中:c(Na )C.该有机物的分子中共平面的原子最多有 12 个
B.a、b、c 对应的混合液中,水的电离程度由大到小的顺序是 c>b>a
D.甲酸某酯与该有机物互为同分异构体,且能与氯化铁溶液发生显色反应,则该酯的结构有 13 种 2 10-8C.25℃时,Ka(CH3COOH)= mol L-1
13.下列反应的离子方程式正确的是( ) w-0.1
D +.由 b 点到 a 点的过程中,c(Na )有可能大于 c(CH3COO-)
A Fe O 3 . 2 3 全部溶于氢碘酸:Fe2O3 6H =2Fe 3H2O
B 18 △ 18 .乙酸乙酯在碱性条件下的水解:CH3CO OC2H5 OH CH3CO O CH3CH2OH
第 3页 共 8页 ◎ 第 4页 共 8页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
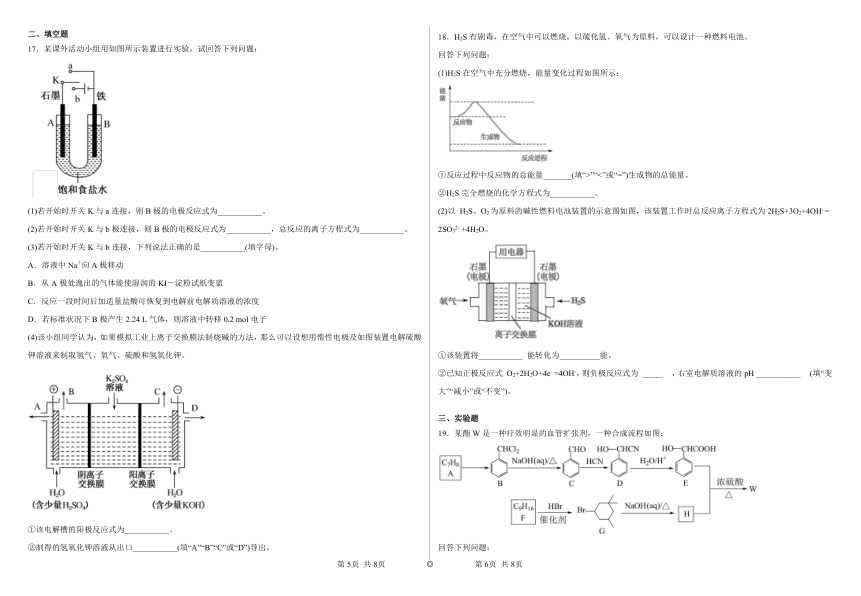
二、填空题 18.H2S 有剧毒,在空气中可以燃烧。以硫化氢、氧气为原料,可以设计一种燃料电池。
17.某课外活动小组用如图所示装置进行实验,试回答下列问题:
回答下列问题:
(1)H2S 在空气中充分燃烧,能量变化过程如图所示:
①反应过程中反应物的总能量_______(填“>”“<”或“=”)生成物的总能量。
②H2S 完全燃烧的化学方程式为___________。
(1)若开始时开关 K 与 a 连接,则 B 极的电极反应式为___________。 (2)以 H2S、O2 为原料的碱性燃料电池装置的示意图如图,该装置工作时总反应离子方程式为 2H2S+3O2+4OH- =
(2)若开始时开关 K 与 b 极连接,则 B 极的电极反应式为___________,总反应的离子方程式为___________。 2SO32- +4H2O。
(3)若开始时开关 K 与 b 连接,下列说法正确的是___________(填字母)。
A.溶液中 Na+向 A 极移动
B.从 A 极处逸出的气体能使湿润的 KI-淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质溶液的浓度
D.若标准状况下 B 极产生 2.24 L 气体,则溶液中转移 0.2 mol 电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用惰性电极及如图装置电解硫酸
钾溶液来制取氢气、氧气、硫酸和氢氧化钾。 ①该装置将___________ 能转化为__________能。
②已知正极反应式 O2+2H2O+4e- =4OH-,则负极反应式为 _____ ,右室电解质溶液的 pH ___________ (填“变
大”“减小”或“不变”)。
三、实验题
19.某酯 W 是一种疗效明显的血管扩张剂,一种合成流程如图:
①该电解槽的阳极反应式为___________。
②制得的氢氧化钾溶液从出口___________(填“A”“B”“C”或“D”)导出。 回答下列问题:
第 5页 共 8页 ◎ 第 6页 共 8页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
(1)E 中所含官能团的名称是___;C 的名称是___。 (4)向溶液 B 中加入试剂②的化学式为_______,操作 I 的名称是_______。
(2)A→B 反应条件和试剂是___;C→D 的反应类型是___。 (5)若以离子浓度降至 1×10-5mol L-1 为沉淀完全,根据表中数据推算出 ksp[Fe(OH)3]=_______。
(3)写出 W 的结构简式为___。
五、原理综合题
(4)写出 F→G 的化学方程式为___。
21.Ⅰ.反应Ⅰ: CO(g)+2H (g) 2 CH 3OH(g) ΔH1
(5)R 是 E 的同分异构体,R 同时具备下列条件的结构有___种。
①遇氯化铁溶液发生显色反应 反应Ⅱ:CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) ΔH2
②能发生水解反应和银镜反应 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
其中,在核磁共振氢谱上有 5 组峰且峰的面积比为 1∶1∶2∶2∶2 的结构简式为___。 温度 250℃ 300℃ 350℃
四、工业流程题 K 2.0 0.27 0.012
20.孔雀石主要含 Cu2 (OH)2CO3,还含少量 Fe、Si 的化合物。某工厂以孔雀石为主要原料制备 CuSO4·5H2O 及
(1)由表中数据判断ΔH1 _________(填“>”、“<”或“=”);
纳米材料 G,主要步骤如图:
(2)反应CO2 (g)+H2 (g) CO(g)+H2O(g) ΔH3 = _________(用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 _________(填字母序号)。
A.充入CO,使体系总压强增大 B.将CH3OH(g) 从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如表: (4)保持恒温恒容条件对于反应Ⅱ:将10mol CO 2 和30mol H 2 放入1L 的密闭容器中,充分反应后测得CO2的转化率
物质 开始沉淀时的 pH 完全沉淀时的 pH 为 60%,则该反应的平衡常数为_________.若维持条件不变向该容器中投入10mol CO 2 、30mol H 2 、
Fe(OH)3 2.2 3.0 10mol CH 3OH(g) 和10mol H 2O(g) ,判断平衡移动的方向是_________(填“正向移动”、“逆向移动”或“不移动”)。
Fe(OH)2 7.6 9.6 (5)反应Ⅰ的逆反应速率与时间的关系如图所示.由图可知,反应在 t1 、 t3、 t7 时都达到了平衡,而 t2 、 t8时都改变
Cu(OH) 4.7 6.4 了一种条件,试判断改变的条件:2
t
请回答下列问题: 2 时______________________;
(1)写出孔雀石主要成分 Cu2(OH)2CO3 与稀硫酸反应的化学方程式_______。 t8时______________________。
(2)溶液 A 的金属离子有 Cu2+、Fe2+、Fe3+。要检验其中的 Fe3+应选择下列试剂中的_______。
A.KMnO4 B.NaOH C.H2O2 D.KSCN (6)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:
(3)溶液 A 中的金属离子有 Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把 Fe2+氧化成 Fe3+的;该工厂选用试剂①最
M+Ni(OH)2
充电
MH+NiOOH(式中 M 为储氢合金),写出电池充电过程中阳极的电极反应式_________。
放电
好为下列中的_______(填代号)。写出试剂①氧化 Fe2+的离子方程式_______。
a.H2O2 b.空气 c.Cl2 d.KSCN
第 7页 共 8页 ◎ 第 8页 共 8页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
参考答案:
1.D
【详解】根据加聚反应的特点,可知由高聚物分解为单体的方法是:由高聚物从左往右依次
断裂一根碳碳化学键,形成一根碳碳化学键,由此可推知 的单体
分别是 ,故答案为:D。
2.B
【详解】常见强电解质:强酸、强碱、金属氧化物、绝大多数盐,常见弱电解质:弱酸、弱
碱、极少数盐,常见非电解质:非金属氧化物、某些非金属氢化物、绝大多数有机物,
A.HCl 是强酸,属于强电解质,分类错误,故 A 项不选;
B.各物质分类正确,故 B 项选;
C.Ba(OH)2是强碱,属于强电解质,Cu 既不是电解质也不是非电解质,分类错误,故 C 项
不选;
D.NaOH 是强碱,属于强电解质,分类错误,故 D 项不选;
综上所述,分类组合全部正确的是 B 项,故答案为 B。
3.D
【详解】A.加热可促进铁离子水解,则颜色加深与水解有关,故 A 错误;
B.饱和溶液中碳酸根离子水解显碱性,pH 约为 9.3 与水解有关,故 B 错误;
C. 0.1mol/LAlCl3溶液中 c(Al3+)<0.1mol/L 是因为 Al3+的水解消耗了部分 Al3+,与水解有
关,故 C 错误;
D.柠檬酸与 NaHCO3反应生成二氧化碳气体,与水解无关,故 D 正确;
故答案选 D。
4.D
【详解】已知 25℃、101kPa 下,1mol水蒸发为水蒸气需要吸热 44.01kJ,设 H2O(l)=H2O(g)
H=+44.01kJ/mol 为式 I,2H2O(l)=2H2(g)+O2(g) H=+571.66kJ/mol 为式 II,
C(s)+H2O(g)=CO(g)+H2(g) H=+131.29kJ/mol 为式 III,根据盖斯定律 2III-II+2I 得
2C(s)+O2(g)=2CO(g)的 H=2×131.29kJ/mol-571.66kJ/mol+2×44.01kJ/mol =-221.06kJ/mol,故选
D。
5.D
答案第 1页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
【详解】温度升高反应速率加快,T2 先达到平衡,可知 T1< T2,由图可知升高温度,C 的质
量分数减小,平衡逆向移动,故正反应为放热反应,故选 D。
6.D
【详解】A.温度升高,水的电离平衡向正反应方向移动,氯化钠不水解,则溶液中的氢离
子和氢氧根相等,溶液显示中性,故 A 错误;
B.硫酸电离出氢离子,抑制了水的电离,平衡向逆反应方向移动,故 B 错误;
C.小苏打为碳酸氢钠,碳酸氢钠中的碳酸氢根属于弱酸根离子,结合了水电离的氢离子,
溶液显示碱性,故 C 错误;
D.氯化铝中的铝离子水解,促进了水的电离,平衡向正反应方向移动,溶液显示酸性,故
D 正确;
答案选 D。
7.C
【详解】A. Ag+和 CO 2-3 会生成碳酸银沉淀不共存,故 A 不符合题意;
B. 2- 向溶液中加入足量的盐酸,SO 3 与盐酸会生成二氧化硫气体,AlO 2 与少量盐酸会生成氢
氧化铝沉淀,若酸足量沉淀溶解生成 Al3+。故 B 不符合题意;
C. 2- 2-向溶液中加入足量的盐酸, SiO 3 与盐酸生成 H2SiO3沉淀,CO 3 与盐酸生成二氧化碳气
体,故 C 符合题意;
D. 向溶液中加入足量的盐酸,HCO 3 与盐酸生成二氧化碳气体,但无沉淀生成,故 D 不符合
题意。
故答案选 C。
8.C
【详解】A.由结构简式可知,β—紫罗兰酮分子中含有羰基,属于烃的衍生物,不可能有
属于芳香烃类的同分异构体,故 A 错误;
B.由结构简式可知,维生素 A 分子中含有的碳碳双键一定条件下能与氢气发生加成反应,
1 mol 维生素 A 最多能与 5 mol 氢气发生加成反应,故 B 错误;
C.由结构简式可知,维生素 A 的分子式为 C20H30O,故 C 正确;
D.由结构简式可知,β—紫罗兰酮与中间体 X 的分子式不同,不可能互为同分异构体,故
D 错误;
答案第 2页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
故选 C。
9.B
【详解】A.分子中还含有羧基,含有 O 元素,而烃只含 C、H 两种元素,则不属于二烯烃,
A 错误;
B.可发生 1,2 或 1,4 加成,且结构不对称,若 1:1 加成可生成 3 种有机物,若 1:2 加
成可生成 1 种有机物,可能生成 4 种物质,B 正确;
C.只有碳碳双键与氢气发生加成反应,则 1mol 可以和 2molH2反应,C 错误;
D.酯化反应中醇提供羟基上的氢原子,和 CH3H218OH 反应生成的水是普通水分子,生成水
的摩尔质量为 18g/mol,D 错误;
答案选 B。
10.B
【分析】金属阳极 DSA 发生失去电子的氧化反应:2H2O-4e-=O2↑+4H+,阴极发生得到电子
的还原反应,主要反应为 +6e-+6H+= +2H2O,据此答题。
【详解】A.阴极发生得到电子的还原反应,因此会有少量氢离子放电产生氢气,即 X 为
H2,故 A 正确;
B.阳极发生反应 2H2O-4e-=O2↑+4H+,阳极反应消耗阳极区的水,则反应结束后阳极区硫酸
的浓度增大,pH 减小,故 B 错误;
C.阴极上对硝基苯甲酸得电子发生还原反应,生成对氨基苯甲酸,则阴极的主要电极反应
式为 +6e-+6H+= +2H2O,故 C 正确;
D.电流的流向和电子的流向相反,则电流由电源正极经金属阳极 DSA、电解质溶液、铝合
金,回到电源负极,故 D 正确;
故选 B。
11.A
【详解】A.酸或碱抑制水电离,C 点溶质为 NaHA,C 点溶液呈碱性,说明 HA-水解程度
大于电离程度,HA-水解而促进水电离,B 点不影响水电离、C 点促进水电离,则水电离程
度:BB.C 点酸碱恰好完全反应生成 NaHA,pH>7,溶液呈碱性,则 c(H+)电荷守恒 c(Na+ )+c(H+ )=c(OH- )+c(HA- )+2c(A2- ),故 c Na+ >c HA - +2c A2+ ,B 错误;
C.D 点酸碱恰好完全反应生成 Na2A,溶液中存在物料守恒 n(Na)=2n(A),则存在
答案第 3页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
c(Na+ )=2 [c(HA )+c(H2A)+c(A
2- )],C 错误;,
D.若 A 点的纵坐标为 3,则 c(H+)=10-3,且此时氢离子主要是 H2A 的一级电离生成的,则
其二级电离生成的 c(A2-)<10-3,故
c(H ) c(HA ) c(H ) c(A 2 ) 2 2 Ka Ka = =
c (H ) c(A )
10 9,D 错误;
1 2 c(H2A) c(HA ) c(H2A)
故选 A。
12.D
【详解】A.该有机物的分子式为 C8H8O3,含氧官能团是羟基和羧基,A 错误;
B.该有机物中与羟基直接相连的碳原子的邻位碳原子上没有 H 原子,不能发生消去反应,
B 错误;
C.该有机物分子中苯环为平面结构,“ ”为平面结构,旋转碳碳单键可以使两个平面
共面,旋转羧基中的 O—H 键可以使 H 原子在该平面内,故该有机物分子中最多有 16 个原
子在同一平面,C 错误;
D.甲酸某酯能与氯化铁溶液发生显色反应,说明分子中不仅含有酯基,还含有苯环与酚羟
基,当苯环上有 2 个取代基(—OH、—CH2OOCH)时,2 个取代基在苯环上有邻、间、对 3
种位置关系;当苯环上有 3 个取代基(—OH、—CH3、—OOCH)时,3 个取代基在苯环上有
10 种位置关系,故该酯的结构有 13 种,D 正确;
故答案为:D。
13.C
【详解】A. Fe2O3 全部溶于氢碘酸,为氧化还原反应,得到碘化亚铁、碘和水:
Fe2O3 6H
+2I- =2Fe2 3H2O+I2,A 错误;
B.按反应机理可知, 乙酸乙酯在碱性条件下的水解的离子方程式为:
CH 18 △ 3CO OC2H5 OH CH3COO CH3CH
18
2 OH,B 错误;
C.锅炉水垢中的硫酸钙微溶于水,不溶于酸,根据沉淀溶解平衡原理,可用碳酸钠溶液处
2 2
理、使硫酸钙转化为难溶物碳酸钙,则离子方程式为:CaSO4 CO 3 CaCO3 SO4 ,
C 正确;
D. 氨水与过量H2C2O4 溶液反应生成草酸氢铵:H2C2O4 NH3 H O=HC O
2 2 4 NH
4 H2O,
答案第 4页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
D 错误;
答案选 C。
14.D
【详解】A.由于 HA 的 Ka= 1.0×10-9,醋酸的 Ka= 1.8×10-5,则 A-的水解能力更加,故相
同温度下,等 pH 的 NaA 溶液和 CH3COONa 中,c(A-)B.加热后,A-离子水解程度增大 ,HA 的 pH 变大;加热后,水的电离程度增大 ,NaOH
溶液的 pH 减小 B 错误
C.向 HA 溶液中加少量的 NaA 固体,收于同离子效应,HA 的电离被抑制,水是电离程度
变大,C 错误;
c(H+ -D )c(A). 由 HA 的电离平衡常数Ka 1 10 9 ,由于 pH=9,即 c(H+)=1.0×10-9,
c(HA)
可得 c(A-)= c(HA),D 正确。
故选 D。
15.C
【详解】A.4~6min 内过氧化铬分解的平均速率
v CrO = (4.230 2.510) 10
5mol/L
5 8.6 10
6mol L 1 min 1 ,
2min
v H O = 6 8.6 10 6 1.29 10 6 mol L 12 min 1 ,故 A 错误;4
B.8~10min 内过氧化铬分解的物质的量为(1.790-1.350)×10-5mol/L×5×10-3L=2.2×10-8mol,
根据反应 4CrO5 12HNO3 4Cr NO3 7O g 6H O3 2 2 可得分解得到的氧气的体积为
3.85×10-8mol×22.4L/mol=8.6×10-4mL,故 B 错误;
C.若 t=15,则 10~15min 和 15~20min 这两个时间段内的速率相等,但是根据浓度越小速
率越小,10~15min 内速率大于后一阶段,故 10D.20min 时反应还未达到平衡,升高温素加快了反应速率,不能判断平衡的移动方向,不
能判断反应吸放热,故 D 错误;
故选 C。
16.D
【分析】1.0L w mol L-1 CH3COOH 溶液与 0.1mol NaOH 固体混合,混合后溶液的 pH<5,
显酸性,说明醋酸过量,溶液中溶质为 CH3COOH 和 CH3COONa;加醋酸时,酸的量增多,
使溶液酸性增强;加 CH3COONa 时,CH3COONa 本身水解显碱性,相当于加碱,使溶液酸
答案第 5页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
性减弱,最终达到中性;
【详解】A.b 点溶液 pH<5,溶液显酸性,溶液中 c(H+)>c(OH-),溶液中存在电荷守恒,
c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于 c(H+)>c(OH-),所以 c(Na+)c(CH3COO-),故 A 正确;
B.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c 三
点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是
c>b>a,故 B 正确,
C.根据图象可知,c 点溶液的 pH=7,c(H+)=c(OH-)=10-7mol/L,根据电荷守恒可知:
c(CH3COO-)=c(Na+)=0.2mol/L,c(CH3COOH)=w+0.1-0.2=w-0.1,则 CH3COOH 的电离平衡常
-8
数 Ka(CH3COOH)=
2 10 mol L-1,故 C 正确;
w-0.1
D.b 到 a 过程中 c(Na+)不变、c(CH3COOH)逐渐增大,c(Na+)不可能大于 c(CH3COO-),故 D
错误;
故选:D。
17.(1)Fe-2e-=Fe2+
(2) 2H++2e-=H ↑ 2Cl- 2H O 通电2 + 2 2OH
-+H2↑+Cl2↑
(3)B
(4) 2H +2O-4e-=4H +O2↑ D
【详解】(1)由题中图示可知,开始时开关 K 与 a 连接,装置为原电池,铁为负极,发生
氧化反应,失去电子生成亚铁离子,电极反应式为 Fe-2e-═Fe2+;答案为 Fe-2e-=Fe2+。
(2)由题中图示可知,开关 K 与 b 连接,装置为电解池,铁为阴极,阴极上氢离子得到电
子生成氢气,电极反应式为 2H++2e-=H2↑,电解饱和食盐水生成氢气、氯气和氢氧化钠,总
通电
反应的离子方程式为 2Cl-+2H2O 2OH
-+H2↑+Cl2↑;答案为 2H++2e-=H2↑;
2Cl-+2H 通电2O 2OH
-+H2↑+Cl2↑。
(3)A.若开始时开关 K 与 b 连接,形成电解池装置,石墨(A)为阳极,铁(B 为)阴极,电
解过程中阳离子向阴极移动,即溶液中 Na+向 B 极移动,故 A 错误;
B.A 极生成的氯气具有强氧化性,能氧化 KI 生成 I2,湿润 KI 淀粉试纸变蓝,故 B 正确;
C.电解时,阳极生成氯气、阴极生成氢气,则反应一段时间后加适量 HCl 气体,可恢复到
答案第 6页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
电解前电解质的浓度,故 C 错误;
D.电子不能进入溶液中,故 D 错误;
答案为 B。
(4)①溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,电解时,阳极上 OH-
发生失电子的氧化反应生成氧气,阳极反应式为 2H2O-4e-=4H++O2↑;答案为
2H2O-4e-=4H++O2↑。
②阴极上氢离子放电生成氢气,促进水的电离,氢氧根离子浓度增大,钾离子向阴极移动,
所以氢氧化钾在阴极生成,制得的氢氧化钾溶液从出口 D 导出;答案为 D。
点燃
18. > 2H2S+3O2 2SO2+2H2O 化学 电 H2S+8OH- —6e-
=SO 2-3 +5H2O 减小
【详解】(1) ①根据图示,反应物总能量>生成物总能量;
点燃
②H2S 完全燃烧生成二氧化硫和水,反应方程式是 2H2S+3O2 2SO2+2H2O;
(2) ①该装置为燃料电池,将化学能转化为电能;
②总反应为 2H2S+3O2+4OH- = 2SO32-+4H2O;正极反应为 O2+2H2O+4e-=4OH-;负极反应=总
2-
反应-正极反应,负极反应式是 H2S+8OH--6e- =SO 3 +5H2O;右室通入燃料,右室是负极,根
2-
据负极反应式 H2S+8OH--6e- =SO 3 +5H2O,负极消耗 OH-,电解质溶液的 pH 减小;
【点睛】本题考查化学反应中的能量变化,明确原电池原理是解题关键,注意原电池负极失
电子发生氧化反应,正极得电子发生还原反应,总反应-正极反应可得负极反应。
19.(1) 羧基、羟基 苯甲醛
(2) Cl2/光照 加成反应
(3)
(4) +HBr 催 化 剂 (或 +HBr 催 化 剂 )
答案第 7页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
(5) 13
【分析】A 为甲苯,侧链上发生取代反应得到 B,B 发生水解反应生成二醇,二醇脱水生成
醛,化合物 C 与 HCN 发生加成生成化合物 D,D 水解生成化合物 E。由化合物 G 逆推出化
合物 F,F 与溴化氢发生加成反应生成 G,F 为环烯烃,G 发生水解反应生成 H,F 为
或 ,E 和 H 发生酯化生成物为 。
(1)
E 中所含官能团是羧基、羟基;C 的名称是苯甲醛。
(2)
A 为甲苯,甲苯在光照下与氯气发生取代反应生成化合物 B,A→B 反应条件和试剂是 Cl2/
光照;化合物 C 与 HCN 发生加成生成化合物 D,C→D 的反应类型是加成反应。
(3)
E 和 H 发生酯化反应生成 W,则 W 的结构简式为 。
(4)
由化合物 G 逆推出化合物 F,F 与溴化氢发生加成反应生成 G,F 为环烯烃,G 发生水解反
应生成 H,F 为 或 ,F→G 的化学方程式为 +HBr 催 化 剂
或 +HBr 催 化 剂 。
(5)
依题意,R 分子中羟基直接连在苯环,含有甲酸酯基。分两种情况:第一种情况,苯环上只
含 2 个取代基,-OH,-CH2OOCH 共有邻、间、对 3 种结构;第二种情况,苯环上含有 3 个
答案第 8页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
取代基:-OH、-CH3、-OOCH,而-OH、-CH3有邻、间、对 3 种位置结构,对应的-OOCH
分别有 4 种、4 种、2 种位置结构,共有 10 种结构,综上所述,R 有符合条件的结构 13 种。
在核磁共振氢谱上有 5 组峰且峰的面积比为 1:1:2:2:2 的结构简式为
。
20.(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
(2)D
(3) a 2Fe2++H2O2+2H+=2Fe3++2H2O
(4) CuO 过滤
(5)1.0×10-38
【分析】孔雀石主要含 Cu2(OH)2CO3,还含少量 Fe、Si 的化合物,向孔雀石中加入足量稀
硫酸,发生的反应有 Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,SiO2和稀硫酸不反应,
溶液 A 的金属离子有 Cu2+、Fe2+、Fe3+,气体 E 为 CO2,由得到铵态化肥 H 可知通入气体 F
为氨气,反应方程式为 2NH3+CO2+CaCl2+H2O═CaCO3↓+2NH4Cl,H 为氯化铵,纳米材料 G
为 CaCO3;向溶液 A 中加入试剂①得到溶液 B,试剂①是一种氧化剂,将 Fe2+转化为 Fe3+
且不能引进杂质,可选取双氧水,向溶液 B 中加入试剂②经过操作Ⅰ得到溶液 C 和红褐色沉
淀 D,则操作Ⅰ为过滤,D 为 Fe(OH)3,以及过量的试剂,溶液 C 为硫酸铜溶液,所以为试
剂②为 CuO 或 Cu(OH)2 或 CaCO3或 Cu2(OH)2CO3;
(1)
碱式碳酸铜为碱式盐能与稀硫酸反应生成硫酸铜、水和二氧化碳,反应方程式为:
Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;
(2)
Fe3+与 KSCN 反应溶液变红,可用来检验铁离子,故选:D;
(3)
“试剂 1”的目的是将溶液中的 Fe2+转化为 Fe3+,且不能引进杂质,加入双氧水,双氧水是一
种绿色试剂,将 Fe2+氧化为 Fe3+,不会引入杂质,故选 a,反应的离子方程式
2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)
答案第 9页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
向溶液B中加入试剂②经过操作Ⅰ得到溶液C和红褐色沉淀D,则操作Ⅰ为过滤,D为 Fe(OH)3,
以及过量的试剂,溶液 C 为硫酸铜溶液,所以为试剂②为 CuO,操作 I 的名称是过滤;
(5)
若以 Fe3+离子浓度降至 1×10-5mol L-1 为沉淀完全,此时 pH=3.0,c(OH-)=1.0×10-11mol/L,则
ksp[Fe(OH)3]=c(Fe3+) c3(OH-)=1×10-5×(1.0×10-11)3=1.0×10-38。
21.(1)<
(2)ΔH2 -ΔH1
(3)B
1
(4) (0.0052) 正向移动
192
(5) t2 时:升温或增大生成物浓度 t8时:使用催化剂
(6) Ni(OH) -e- +OH-2 =NiOOH+H2O
【解析】(1)
由表中数据可知,温度越高,反应 I 的平衡常数越小,说明升高温度,反应 I 平衡逆向移动,
正反应为放热反应,则可判断ΔH1<0,故答案为:<;
(2)
已知反应Ⅰ: CO(g)+2H 2(g) CH 3OH(g) ΔH1 反应Ⅱ:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2 ,则反应CO2 (g)+H2 (g) CO(g)+H2O(g)可由反
应 II-反应 I,根据盖斯定律可知,ΔH3 =ΔH2 -ΔH1 ,故答案为:ΔH2 -ΔH1;
(3)
已知反应 I CO(g)+2H 2(g) CH 3OH(g) ΔH1 <0 正反应是一个气体体积减小的放热反应,
据此分析解题:
A. 充入CO,使体系总压强增大,则增大反应物 CO 的浓度,平衡正向移动,H2的转化率
增大,CO 的转化率减小,A 不合题意;
B. 将CH3OH(g) 从体系中分离,则减小生成物浓度,平衡正向移动,CO 的转化率增大,B
符合题意;
答案第 10页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
C. 充入He,使体系总压强增大,反应物和生成物的浓度均不改变,即正逆反应速率不变仍
然相等,平衡不移动,CO 的转化率不变,C 不合题意;
D. 催化剂只能改变反应速率,不能是平衡发生移动,则使用高效催化剂,CO 的转化率不
变,D 不合题意;
故答案为:B;
(4)
保持恒温恒容条件对于反应Ⅱ:将10mol CO 2 和30mol H2 放入1L 的密闭容器中,充分反应后
测得CO2的转化率为 60%,根据三段式分析可知:
CO2 (g) +3H 2 (g) CH3OH(g) +H 2 O(g)
起始量(mol) 10 30 0 0
,则该反应的平衡常数为
转化量(mol) 6 18 6 6
平衡量(mol) 4 12 6 6
c(CH3OH)c(H2O) 6×6 1K= 3 = = ,若维持条件不变向该容器中投入10mol CO 2 、30mol Hc(CO )c (H ) 、2 2 4×123 192
2
c(CH3OH)c(H O)10mol CH 2 10×10 1 13OH(g) 和10mol H2O(g),Qc = c(CO2)c
3(H ) = = < ,则判断平2 10×303 2700 192
1
衡移动的方向是正向移动,故答案为: ;正向移动;
192
(5)
已知反应 I CO(g)+2H (g) 2 CH 3OH(g) ΔH1 <0 正反应是一个气体体积减小的放热反应,
据此分析解题:
由题干图示信息可知, t2 时逆反应速率突然增大,然后减小直至平衡,说明平衡逆向移动,
结合反应 I 的特点可知,t2时改变的条件为:升温或增大生成物浓度, t8时逆反应速率突然
增大,然后一直保持不变,说明反应仍然保持平衡不移动,则 t8时改变的条件为使用(正)催
化剂,故答案为:升温或增大生成物浓度;使用(正)催化剂;
(6)
镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:
M+Ni(OH) 充电2 MH+NiOOH (式中 M 为储氢合金),电池充电过程即为电解池,放电
- -
电解池中阳极上发生氧化反应,则阳极的电极反应式为:Ni(OH)2 -e +OH =NiOOH+H2O,
故答案为:Ni(OH)2 -e
- +OH- =NiOOH+H2O。
答案第 11页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
答案第 12页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
一、单选题
1.某高分子化合物 的单体是 ( )
A. B.
A.T1 T2 放热反应 B.T1 T2 吸热反应 C.T1 T2 吸热反应 D.T1 T2 放热反应
6.下列操作中,能使水的电离平衡向右移动,而且所得溶液显酸性的是( )
C. D.
A.在水中加入少量氯化钠,并加热到 100 ℃ B.在水中滴入稀硫酸
2.下列物质的分类组合全部正确的是( ) C.在水中加入小苏打 D.在水中加入氯化铝固体
选项 强电解质 弱电解质 非电解质 7.下列各组离子在溶液中能大量共存,加入足量盐酸既有沉淀析出又有气体放出的是( )
A 2- 2- .Na+、Ag+、CO + -3 、NO 3 B.K 、OH 、SO 3 、AlO 2
A NaCl HCl CO2
C Na+ SO 2 SiO 2-. 、 4 、 3 、CO
2-
3 D.NH 4 、Ca2+、Cl-、HCO 3
B NaHCO3 NH3·H2O CCl4
8.β -紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素 A。下列说法正确的是
C BaCO3 Ba(OH)2 Cu ( )
D H2SO4 NaOH C2H5OH
A.A B.B C.C D.D
3.下列过程或现象与盐类的水解无关的是( )
A.加热氯化铁溶液的颜色变深 B.CaCO3的饱和溶液 pH 约为 9.3 A.β—紫罗兰酮可能有属于芳香烃类的同分异构体 B.1 mol 维生素 A 最多能与 4 mol H2发生加成反应
C.0.1mol/LAlCl3 溶液中 c(Al3+)<0.1mol/L D.NaHCO3 做发酵粉时加入柠檬酸后效果更好 C.维生素 A 的分子式为 C20H30O D.β—紫罗兰酮与中间体 X 互为同分异构体
4.已知 25℃、101kPa 下,1mol水蒸发为水蒸气需要吸热 44.01kJ
9.山梨酸( )是一种高效安全的防腐保鲜剂。有关山梨酸
2H2O(l) 2H2 (g) O2 (g) ΔH= 571.66kJ mol
1
C(s) H2O(g) CO(g) H2 (g) ΔH= 131.29kJ mol
1
的说法正确的是( )
则反应 2C(s)+O2(g)=2CO(g)的反应热为( ) A.属于二烯烃 B.和Br2 加成,可能生成 4 种物质
A.ΔH=-396.36kJ·mol-1 B.ΔH=-110.53kJ·mol-1 C.ΔH=-154.54kJ·mol-1 D.ΔH=-221.06kJ·mol-1
C.1mol 可以和 3mol H2 反应 D.和CH CH
18
3 2 OH H
18
反应,生成 2 O
5.可逆反应mA(s) nB(g) pC(g) qD(g)中,当其它条件不变时,C 的质量分数与温度(T)的关系如图,则下
列说法正确的是 10.对氨基苯甲酸( 是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸
( )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法不正确的是( )
第 1页 共 8页 ◎ 第 2页 共 8页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
C.用 Na2CO3溶液处理锅炉中水垢:CaSO4 CO
2 3 CaCO3 SO
2
4
D.氨水与过量H2C2O4 溶液反应:H2C2O4 2NH3 H2O=C2O
2
4 2NH
4 2H2O
14.25℃ -9 -5时,某酸 HA的Ka = 1.0×10 (醋酸的Ka = 1.8×10 ),下列说法正确的是( )
A.相同温度下,等 pH 的 NaA 溶液和 CH3COONa 溶液中,c(Na+)前者大于后者
B.加热浓度均为 0.1mol·L-1 的 NaA 溶液和 NaOH 溶液(溶液体积均保持不变),两种溶液的 pH 均变大
C.25℃时,向 0.1mol·L-1 的 HA 溶液中加少量 NaA 固体,水的电离程度变小
D.25℃时,将 HA 溶液与 NaOH 溶液混合测得 pH=9,此时溶液中 c(A-)=c(HA)
A.X 为 H2 B.反应结束后阳极区 pH 不变 15.室温下过氧化铬( CrO5 )在硝酸酸化的戊醇中会溶解并发生反应:
C.阴极的主要电极反应式为: +6e-+6H+= +2H2O 4CrO5 12HNO3 4Cr NO3 7O 3 13 2 g 6H2O。在 5m11 10 mol L 的过氧化铬戊醇溶液中滴入一定量的稀硝
D.电流由电源正极经金属阳极 DSA、电解质溶液、铝合金,回到电源负极
酸,在不同时刻测得过氧化铬浓度如下表:
11.常温下,用1mol/L 的 NaOH 溶液滴定10m11mo1/ L的H2A 溶液,溶液的 pH 与 NaOH 的体积关系如图所示。
时间/min 4 6 8 10 t 20 25 35
(H2A 的电离常数为Ka1和Ka2 )下列说法正确的是( )
c CrO5 / 10 5 mol L 1 4.230 2.510 1.790 1.350 1.240 1.130 1.110 1.100
A.水的电离程度:C>B
下列叙述正确的是( )
B.C 点, c Na c HA 2c A2
A.4~6min 6 1 1内过氧化铬分解的平均速率 v H2O =8.6 10 mol L min
C.D 点, 2c Na c H2A c HA c A2
B.8~10min 内过氧化铬分解释放的O2体积为 0.86mL(标准状况)
D.若 A 点的纵坐标为 3,则Ka1 Ka 2 10
9
C.推测表中 t 的取值范围为:10
16.在 25℃时,将 1.0Lwmol·L-1CH3COOH 溶液与 0.1molNaOH 固体混合,充分反应。然后向混合液中加入
关于该有机物的说法正确的是( )
CH3COOH 或 CH3COONa 固体(忽略体积和温度变化),溶液 pH 的变化如图所示。下列叙述不正确的是( )
A.该有机物的分子式为 C8H8O3,含氧官能团是羟基和羰基
B.在一定条件下能发生氧化反应、取代反应、加成反应、消去反应和缩聚反应
A b +. 点溶液中:c(Na )
B.a、b、c 对应的混合液中,水的电离程度由大到小的顺序是 c>b>a
D.甲酸某酯与该有机物互为同分异构体,且能与氯化铁溶液发生显色反应,则该酯的结构有 13 种 2 10-8C.25℃时,Ka(CH3COOH)= mol L-1
13.下列反应的离子方程式正确的是( ) w-0.1
D +.由 b 点到 a 点的过程中,c(Na )有可能大于 c(CH3COO-)
A Fe O 3 . 2 3 全部溶于氢碘酸:Fe2O3 6H =2Fe 3H2O
B 18 △ 18 .乙酸乙酯在碱性条件下的水解:CH3CO OC2H5 OH CH3CO O CH3CH2OH
第 3页 共 8页 ◎ 第 4页 共 8页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
二、填空题 18.H2S 有剧毒,在空气中可以燃烧。以硫化氢、氧气为原料,可以设计一种燃料电池。
17.某课外活动小组用如图所示装置进行实验,试回答下列问题:
回答下列问题:
(1)H2S 在空气中充分燃烧,能量变化过程如图所示:
①反应过程中反应物的总能量_______(填“>”“<”或“=”)生成物的总能量。
②H2S 完全燃烧的化学方程式为___________。
(1)若开始时开关 K 与 a 连接,则 B 极的电极反应式为___________。 (2)以 H2S、O2 为原料的碱性燃料电池装置的示意图如图,该装置工作时总反应离子方程式为 2H2S+3O2+4OH- =
(2)若开始时开关 K 与 b 极连接,则 B 极的电极反应式为___________,总反应的离子方程式为___________。 2SO32- +4H2O。
(3)若开始时开关 K 与 b 连接,下列说法正确的是___________(填字母)。
A.溶液中 Na+向 A 极移动
B.从 A 极处逸出的气体能使湿润的 KI-淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质溶液的浓度
D.若标准状况下 B 极产生 2.24 L 气体,则溶液中转移 0.2 mol 电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用惰性电极及如图装置电解硫酸
钾溶液来制取氢气、氧气、硫酸和氢氧化钾。 ①该装置将___________ 能转化为__________能。
②已知正极反应式 O2+2H2O+4e- =4OH-,则负极反应式为 _____ ,右室电解质溶液的 pH ___________ (填“变
大”“减小”或“不变”)。
三、实验题
19.某酯 W 是一种疗效明显的血管扩张剂,一种合成流程如图:
①该电解槽的阳极反应式为___________。
②制得的氢氧化钾溶液从出口___________(填“A”“B”“C”或“D”)导出。 回答下列问题:
第 5页 共 8页 ◎ 第 6页 共 8页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
(1)E 中所含官能团的名称是___;C 的名称是___。 (4)向溶液 B 中加入试剂②的化学式为_______,操作 I 的名称是_______。
(2)A→B 反应条件和试剂是___;C→D 的反应类型是___。 (5)若以离子浓度降至 1×10-5mol L-1 为沉淀完全,根据表中数据推算出 ksp[Fe(OH)3]=_______。
(3)写出 W 的结构简式为___。
五、原理综合题
(4)写出 F→G 的化学方程式为___。
21.Ⅰ.反应Ⅰ: CO(g)+2H (g) 2 CH 3OH(g) ΔH1
(5)R 是 E 的同分异构体,R 同时具备下列条件的结构有___种。
①遇氯化铁溶液发生显色反应 反应Ⅱ:CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) ΔH2
②能发生水解反应和银镜反应 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
其中,在核磁共振氢谱上有 5 组峰且峰的面积比为 1∶1∶2∶2∶2 的结构简式为___。 温度 250℃ 300℃ 350℃
四、工业流程题 K 2.0 0.27 0.012
20.孔雀石主要含 Cu2 (OH)2CO3,还含少量 Fe、Si 的化合物。某工厂以孔雀石为主要原料制备 CuSO4·5H2O 及
(1)由表中数据判断ΔH1 _________(填“>”、“<”或“=”);
纳米材料 G,主要步骤如图:
(2)反应CO2 (g)+H2 (g) CO(g)+H2O(g) ΔH3 = _________(用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 _________(填字母序号)。
A.充入CO,使体系总压强增大 B.将CH3OH(g) 从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如表: (4)保持恒温恒容条件对于反应Ⅱ:将10mol CO 2 和30mol H 2 放入1L 的密闭容器中,充分反应后测得CO2的转化率
物质 开始沉淀时的 pH 完全沉淀时的 pH 为 60%,则该反应的平衡常数为_________.若维持条件不变向该容器中投入10mol CO 2 、30mol H 2 、
Fe(OH)3 2.2 3.0 10mol CH 3OH(g) 和10mol H 2O(g) ,判断平衡移动的方向是_________(填“正向移动”、“逆向移动”或“不移动”)。
Fe(OH)2 7.6 9.6 (5)反应Ⅰ的逆反应速率与时间的关系如图所示.由图可知,反应在 t1 、 t3、 t7 时都达到了平衡,而 t2 、 t8时都改变
Cu(OH) 4.7 6.4 了一种条件,试判断改变的条件:2
t
请回答下列问题: 2 时______________________;
(1)写出孔雀石主要成分 Cu2(OH)2CO3 与稀硫酸反应的化学方程式_______。 t8时______________________。
(2)溶液 A 的金属离子有 Cu2+、Fe2+、Fe3+。要检验其中的 Fe3+应选择下列试剂中的_______。
A.KMnO4 B.NaOH C.H2O2 D.KSCN (6)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:
(3)溶液 A 中的金属离子有 Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把 Fe2+氧化成 Fe3+的;该工厂选用试剂①最
M+Ni(OH)2
充电
MH+NiOOH(式中 M 为储氢合金),写出电池充电过程中阳极的电极反应式_________。
放电
好为下列中的_______(填代号)。写出试剂①氧化 Fe2+的离子方程式_______。
a.H2O2 b.空气 c.Cl2 d.KSCN
第 7页 共 8页 ◎ 第 8页 共 8页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
参考答案:
1.D
【详解】根据加聚反应的特点,可知由高聚物分解为单体的方法是:由高聚物从左往右依次
断裂一根碳碳化学键,形成一根碳碳化学键,由此可推知 的单体
分别是 ,故答案为:D。
2.B
【详解】常见强电解质:强酸、强碱、金属氧化物、绝大多数盐,常见弱电解质:弱酸、弱
碱、极少数盐,常见非电解质:非金属氧化物、某些非金属氢化物、绝大多数有机物,
A.HCl 是强酸,属于强电解质,分类错误,故 A 项不选;
B.各物质分类正确,故 B 项选;
C.Ba(OH)2是强碱,属于强电解质,Cu 既不是电解质也不是非电解质,分类错误,故 C 项
不选;
D.NaOH 是强碱,属于强电解质,分类错误,故 D 项不选;
综上所述,分类组合全部正确的是 B 项,故答案为 B。
3.D
【详解】A.加热可促进铁离子水解,则颜色加深与水解有关,故 A 错误;
B.饱和溶液中碳酸根离子水解显碱性,pH 约为 9.3 与水解有关,故 B 错误;
C. 0.1mol/LAlCl3溶液中 c(Al3+)<0.1mol/L 是因为 Al3+的水解消耗了部分 Al3+,与水解有
关,故 C 错误;
D.柠檬酸与 NaHCO3反应生成二氧化碳气体,与水解无关,故 D 正确;
故答案选 D。
4.D
【详解】已知 25℃、101kPa 下,1mol水蒸发为水蒸气需要吸热 44.01kJ,设 H2O(l)=H2O(g)
H=+44.01kJ/mol 为式 I,2H2O(l)=2H2(g)+O2(g) H=+571.66kJ/mol 为式 II,
C(s)+H2O(g)=CO(g)+H2(g) H=+131.29kJ/mol 为式 III,根据盖斯定律 2III-II+2I 得
2C(s)+O2(g)=2CO(g)的 H=2×131.29kJ/mol-571.66kJ/mol+2×44.01kJ/mol =-221.06kJ/mol,故选
D。
5.D
答案第 1页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
【详解】温度升高反应速率加快,T2 先达到平衡,可知 T1< T2,由图可知升高温度,C 的质
量分数减小,平衡逆向移动,故正反应为放热反应,故选 D。
6.D
【详解】A.温度升高,水的电离平衡向正反应方向移动,氯化钠不水解,则溶液中的氢离
子和氢氧根相等,溶液显示中性,故 A 错误;
B.硫酸电离出氢离子,抑制了水的电离,平衡向逆反应方向移动,故 B 错误;
C.小苏打为碳酸氢钠,碳酸氢钠中的碳酸氢根属于弱酸根离子,结合了水电离的氢离子,
溶液显示碱性,故 C 错误;
D.氯化铝中的铝离子水解,促进了水的电离,平衡向正反应方向移动,溶液显示酸性,故
D 正确;
答案选 D。
7.C
【详解】A. Ag+和 CO 2-3 会生成碳酸银沉淀不共存,故 A 不符合题意;
B. 2- 向溶液中加入足量的盐酸,SO 3 与盐酸会生成二氧化硫气体,AlO 2 与少量盐酸会生成氢
氧化铝沉淀,若酸足量沉淀溶解生成 Al3+。故 B 不符合题意;
C. 2- 2-向溶液中加入足量的盐酸, SiO 3 与盐酸生成 H2SiO3沉淀,CO 3 与盐酸生成二氧化碳气
体,故 C 符合题意;
D. 向溶液中加入足量的盐酸,HCO 3 与盐酸生成二氧化碳气体,但无沉淀生成,故 D 不符合
题意。
故答案选 C。
8.C
【详解】A.由结构简式可知,β—紫罗兰酮分子中含有羰基,属于烃的衍生物,不可能有
属于芳香烃类的同分异构体,故 A 错误;
B.由结构简式可知,维生素 A 分子中含有的碳碳双键一定条件下能与氢气发生加成反应,
1 mol 维生素 A 最多能与 5 mol 氢气发生加成反应,故 B 错误;
C.由结构简式可知,维生素 A 的分子式为 C20H30O,故 C 正确;
D.由结构简式可知,β—紫罗兰酮与中间体 X 的分子式不同,不可能互为同分异构体,故
D 错误;
答案第 2页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
故选 C。
9.B
【详解】A.分子中还含有羧基,含有 O 元素,而烃只含 C、H 两种元素,则不属于二烯烃,
A 错误;
B.可发生 1,2 或 1,4 加成,且结构不对称,若 1:1 加成可生成 3 种有机物,若 1:2 加
成可生成 1 种有机物,可能生成 4 种物质,B 正确;
C.只有碳碳双键与氢气发生加成反应,则 1mol 可以和 2molH2反应,C 错误;
D.酯化反应中醇提供羟基上的氢原子,和 CH3H218OH 反应生成的水是普通水分子,生成水
的摩尔质量为 18g/mol,D 错误;
答案选 B。
10.B
【分析】金属阳极 DSA 发生失去电子的氧化反应:2H2O-4e-=O2↑+4H+,阴极发生得到电子
的还原反应,主要反应为 +6e-+6H+= +2H2O,据此答题。
【详解】A.阴极发生得到电子的还原反应,因此会有少量氢离子放电产生氢气,即 X 为
H2,故 A 正确;
B.阳极发生反应 2H2O-4e-=O2↑+4H+,阳极反应消耗阳极区的水,则反应结束后阳极区硫酸
的浓度增大,pH 减小,故 B 错误;
C.阴极上对硝基苯甲酸得电子发生还原反应,生成对氨基苯甲酸,则阴极的主要电极反应
式为 +6e-+6H+= +2H2O,故 C 正确;
D.电流的流向和电子的流向相反,则电流由电源正极经金属阳极 DSA、电解质溶液、铝合
金,回到电源负极,故 D 正确;
故选 B。
11.A
【详解】A.酸或碱抑制水电离,C 点溶质为 NaHA,C 点溶液呈碱性,说明 HA-水解程度
大于电离程度,HA-水解而促进水电离,B 点不影响水电离、C 点促进水电离,则水电离程
度:B
C.D 点酸碱恰好完全反应生成 Na2A,溶液中存在物料守恒 n(Na)=2n(A),则存在
答案第 3页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
c(Na+ )=2 [c(HA )+c(H2A)+c(A
2- )],C 错误;,
D.若 A 点的纵坐标为 3,则 c(H+)=10-3,且此时氢离子主要是 H2A 的一级电离生成的,则
其二级电离生成的 c(A2-)<10-3,故
c(H ) c(HA ) c(H ) c(A 2 ) 2 2 Ka Ka = =
c (H ) c(A )
10 9,D 错误;
1 2 c(H2A) c(HA ) c(H2A)
故选 A。
12.D
【详解】A.该有机物的分子式为 C8H8O3,含氧官能团是羟基和羧基,A 错误;
B.该有机物中与羟基直接相连的碳原子的邻位碳原子上没有 H 原子,不能发生消去反应,
B 错误;
C.该有机物分子中苯环为平面结构,“ ”为平面结构,旋转碳碳单键可以使两个平面
共面,旋转羧基中的 O—H 键可以使 H 原子在该平面内,故该有机物分子中最多有 16 个原
子在同一平面,C 错误;
D.甲酸某酯能与氯化铁溶液发生显色反应,说明分子中不仅含有酯基,还含有苯环与酚羟
基,当苯环上有 2 个取代基(—OH、—CH2OOCH)时,2 个取代基在苯环上有邻、间、对 3
种位置关系;当苯环上有 3 个取代基(—OH、—CH3、—OOCH)时,3 个取代基在苯环上有
10 种位置关系,故该酯的结构有 13 种,D 正确;
故答案为:D。
13.C
【详解】A. Fe2O3 全部溶于氢碘酸,为氧化还原反应,得到碘化亚铁、碘和水:
Fe2O3 6H
+2I- =2Fe2 3H2O+I2,A 错误;
B.按反应机理可知, 乙酸乙酯在碱性条件下的水解的离子方程式为:
CH 18 △ 3CO OC2H5 OH CH3COO CH3CH
18
2 OH,B 错误;
C.锅炉水垢中的硫酸钙微溶于水,不溶于酸,根据沉淀溶解平衡原理,可用碳酸钠溶液处
2 2
理、使硫酸钙转化为难溶物碳酸钙,则离子方程式为:CaSO4 CO 3 CaCO3 SO4 ,
C 正确;
D. 氨水与过量H2C2O4 溶液反应生成草酸氢铵:H2C2O4 NH3 H O=HC O
2 2 4 NH
4 H2O,
答案第 4页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
D 错误;
答案选 C。
14.D
【详解】A.由于 HA 的 Ka= 1.0×10-9,醋酸的 Ka= 1.8×10-5,则 A-的水解能力更加,故相
同温度下,等 pH 的 NaA 溶液和 CH3COONa 中,c(A-)
溶液的 pH 减小 B 错误
C.向 HA 溶液中加少量的 NaA 固体,收于同离子效应,HA 的电离被抑制,水是电离程度
变大,C 错误;
c(H+ -D )c(A). 由 HA 的电离平衡常数Ka 1 10 9 ,由于 pH=9,即 c(H+)=1.0×10-9,
c(HA)
可得 c(A-)= c(HA),D 正确。
故选 D。
15.C
【详解】A.4~6min 内过氧化铬分解的平均速率
v CrO = (4.230 2.510) 10
5mol/L
5 8.6 10
6mol L 1 min 1 ,
2min
v H O = 6 8.6 10 6 1.29 10 6 mol L 12 min 1 ,故 A 错误;4
B.8~10min 内过氧化铬分解的物质的量为(1.790-1.350)×10-5mol/L×5×10-3L=2.2×10-8mol,
根据反应 4CrO5 12HNO3 4Cr NO3 7O g 6H O3 2 2 可得分解得到的氧气的体积为
3.85×10-8mol×22.4L/mol=8.6×10-4mL,故 B 错误;
C.若 t=15,则 10~15min 和 15~20min 这两个时间段内的速率相等,但是根据浓度越小速
率越小,10~15min 内速率大于后一阶段,故 10
能判断反应吸放热,故 D 错误;
故选 C。
16.D
【分析】1.0L w mol L-1 CH3COOH 溶液与 0.1mol NaOH 固体混合,混合后溶液的 pH<5,
显酸性,说明醋酸过量,溶液中溶质为 CH3COOH 和 CH3COONa;加醋酸时,酸的量增多,
使溶液酸性增强;加 CH3COONa 时,CH3COONa 本身水解显碱性,相当于加碱,使溶液酸
答案第 5页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
性减弱,最终达到中性;
【详解】A.b 点溶液 pH<5,溶液显酸性,溶液中 c(H+)>c(OH-),溶液中存在电荷守恒,
c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于 c(H+)>c(OH-),所以 c(Na+)
B.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c 三
点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是
c>b>a,故 B 正确,
C.根据图象可知,c 点溶液的 pH=7,c(H+)=c(OH-)=10-7mol/L,根据电荷守恒可知:
c(CH3COO-)=c(Na+)=0.2mol/L,c(CH3COOH)=w+0.1-0.2=w-0.1,则 CH3COOH 的电离平衡常
-8
数 Ka(CH3COOH)=
2 10 mol L-1,故 C 正确;
w-0.1
D.b 到 a 过程中 c(Na+)不变、c(CH3COOH)逐渐增大,c(Na+)不可能大于 c(CH3COO-),故 D
错误;
故选:D。
17.(1)Fe-2e-=Fe2+
(2) 2H++2e-=H ↑ 2Cl- 2H O 通电2 + 2 2OH
-+H2↑+Cl2↑
(3)B
(4) 2H +2O-4e-=4H +O2↑ D
【详解】(1)由题中图示可知,开始时开关 K 与 a 连接,装置为原电池,铁为负极,发生
氧化反应,失去电子生成亚铁离子,电极反应式为 Fe-2e-═Fe2+;答案为 Fe-2e-=Fe2+。
(2)由题中图示可知,开关 K 与 b 连接,装置为电解池,铁为阴极,阴极上氢离子得到电
子生成氢气,电极反应式为 2H++2e-=H2↑,电解饱和食盐水生成氢气、氯气和氢氧化钠,总
通电
反应的离子方程式为 2Cl-+2H2O 2OH
-+H2↑+Cl2↑;答案为 2H++2e-=H2↑;
2Cl-+2H 通电2O 2OH
-+H2↑+Cl2↑。
(3)A.若开始时开关 K 与 b 连接,形成电解池装置,石墨(A)为阳极,铁(B 为)阴极,电
解过程中阳离子向阴极移动,即溶液中 Na+向 B 极移动,故 A 错误;
B.A 极生成的氯气具有强氧化性,能氧化 KI 生成 I2,湿润 KI 淀粉试纸变蓝,故 B 正确;
C.电解时,阳极生成氯气、阴极生成氢气,则反应一段时间后加适量 HCl 气体,可恢复到
答案第 6页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
电解前电解质的浓度,故 C 错误;
D.电子不能进入溶液中,故 D 错误;
答案为 B。
(4)①溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,电解时,阳极上 OH-
发生失电子的氧化反应生成氧气,阳极反应式为 2H2O-4e-=4H++O2↑;答案为
2H2O-4e-=4H++O2↑。
②阴极上氢离子放电生成氢气,促进水的电离,氢氧根离子浓度增大,钾离子向阴极移动,
所以氢氧化钾在阴极生成,制得的氢氧化钾溶液从出口 D 导出;答案为 D。
点燃
18. > 2H2S+3O2 2SO2+2H2O 化学 电 H2S+8OH- —6e-
=SO 2-3 +5H2O 减小
【详解】(1) ①根据图示,反应物总能量>生成物总能量;
点燃
②H2S 完全燃烧生成二氧化硫和水,反应方程式是 2H2S+3O2 2SO2+2H2O;
(2) ①该装置为燃料电池,将化学能转化为电能;
②总反应为 2H2S+3O2+4OH- = 2SO32-+4H2O;正极反应为 O2+2H2O+4e-=4OH-;负极反应=总
2-
反应-正极反应,负极反应式是 H2S+8OH--6e- =SO 3 +5H2O;右室通入燃料,右室是负极,根
2-
据负极反应式 H2S+8OH--6e- =SO 3 +5H2O,负极消耗 OH-,电解质溶液的 pH 减小;
【点睛】本题考查化学反应中的能量变化,明确原电池原理是解题关键,注意原电池负极失
电子发生氧化反应,正极得电子发生还原反应,总反应-正极反应可得负极反应。
19.(1) 羧基、羟基 苯甲醛
(2) Cl2/光照 加成反应
(3)
(4) +HBr 催 化 剂 (或 +HBr 催 化 剂 )
答案第 7页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
(5) 13
【分析】A 为甲苯,侧链上发生取代反应得到 B,B 发生水解反应生成二醇,二醇脱水生成
醛,化合物 C 与 HCN 发生加成生成化合物 D,D 水解生成化合物 E。由化合物 G 逆推出化
合物 F,F 与溴化氢发生加成反应生成 G,F 为环烯烃,G 发生水解反应生成 H,F 为
或 ,E 和 H 发生酯化生成物为 。
(1)
E 中所含官能团是羧基、羟基;C 的名称是苯甲醛。
(2)
A 为甲苯,甲苯在光照下与氯气发生取代反应生成化合物 B,A→B 反应条件和试剂是 Cl2/
光照;化合物 C 与 HCN 发生加成生成化合物 D,C→D 的反应类型是加成反应。
(3)
E 和 H 发生酯化反应生成 W,则 W 的结构简式为 。
(4)
由化合物 G 逆推出化合物 F,F 与溴化氢发生加成反应生成 G,F 为环烯烃,G 发生水解反
应生成 H,F 为 或 ,F→G 的化学方程式为 +HBr 催 化 剂
或 +HBr 催 化 剂 。
(5)
依题意,R 分子中羟基直接连在苯环,含有甲酸酯基。分两种情况:第一种情况,苯环上只
含 2 个取代基,-OH,-CH2OOCH 共有邻、间、对 3 种结构;第二种情况,苯环上含有 3 个
答案第 8页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
取代基:-OH、-CH3、-OOCH,而-OH、-CH3有邻、间、对 3 种位置结构,对应的-OOCH
分别有 4 种、4 种、2 种位置结构,共有 10 种结构,综上所述,R 有符合条件的结构 13 种。
在核磁共振氢谱上有 5 组峰且峰的面积比为 1:1:2:2:2 的结构简式为
。
20.(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
(2)D
(3) a 2Fe2++H2O2+2H+=2Fe3++2H2O
(4) CuO 过滤
(5)1.0×10-38
【分析】孔雀石主要含 Cu2(OH)2CO3,还含少量 Fe、Si 的化合物,向孔雀石中加入足量稀
硫酸,发生的反应有 Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,SiO2和稀硫酸不反应,
溶液 A 的金属离子有 Cu2+、Fe2+、Fe3+,气体 E 为 CO2,由得到铵态化肥 H 可知通入气体 F
为氨气,反应方程式为 2NH3+CO2+CaCl2+H2O═CaCO3↓+2NH4Cl,H 为氯化铵,纳米材料 G
为 CaCO3;向溶液 A 中加入试剂①得到溶液 B,试剂①是一种氧化剂,将 Fe2+转化为 Fe3+
且不能引进杂质,可选取双氧水,向溶液 B 中加入试剂②经过操作Ⅰ得到溶液 C 和红褐色沉
淀 D,则操作Ⅰ为过滤,D 为 Fe(OH)3,以及过量的试剂,溶液 C 为硫酸铜溶液,所以为试
剂②为 CuO 或 Cu(OH)2 或 CaCO3或 Cu2(OH)2CO3;
(1)
碱式碳酸铜为碱式盐能与稀硫酸反应生成硫酸铜、水和二氧化碳,反应方程式为:
Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;
(2)
Fe3+与 KSCN 反应溶液变红,可用来检验铁离子,故选:D;
(3)
“试剂 1”的目的是将溶液中的 Fe2+转化为 Fe3+,且不能引进杂质,加入双氧水,双氧水是一
种绿色试剂,将 Fe2+氧化为 Fe3+,不会引入杂质,故选 a,反应的离子方程式
2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)
答案第 9页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
向溶液B中加入试剂②经过操作Ⅰ得到溶液C和红褐色沉淀D,则操作Ⅰ为过滤,D为 Fe(OH)3,
以及过量的试剂,溶液 C 为硫酸铜溶液,所以为试剂②为 CuO,操作 I 的名称是过滤;
(5)
若以 Fe3+离子浓度降至 1×10-5mol L-1 为沉淀完全,此时 pH=3.0,c(OH-)=1.0×10-11mol/L,则
ksp[Fe(OH)3]=c(Fe3+) c3(OH-)=1×10-5×(1.0×10-11)3=1.0×10-38。
21.(1)<
(2)ΔH2 -ΔH1
(3)B
1
(4) (0.0052) 正向移动
192
(5) t2 时:升温或增大生成物浓度 t8时:使用催化剂
(6) Ni(OH) -e- +OH-2 =NiOOH+H2O
【解析】(1)
由表中数据可知,温度越高,反应 I 的平衡常数越小,说明升高温度,反应 I 平衡逆向移动,
正反应为放热反应,则可判断ΔH1<0,故答案为:<;
(2)
已知反应Ⅰ: CO(g)+2H 2(g) CH 3OH(g) ΔH1 反应Ⅱ:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2 ,则反应CO2 (g)+H2 (g) CO(g)+H2O(g)可由反
应 II-反应 I,根据盖斯定律可知,ΔH3 =ΔH2 -ΔH1 ,故答案为:ΔH2 -ΔH1;
(3)
已知反应 I CO(g)+2H 2(g) CH 3OH(g) ΔH1 <0 正反应是一个气体体积减小的放热反应,
据此分析解题:
A. 充入CO,使体系总压强增大,则增大反应物 CO 的浓度,平衡正向移动,H2的转化率
增大,CO 的转化率减小,A 不合题意;
B. 将CH3OH(g) 从体系中分离,则减小生成物浓度,平衡正向移动,CO 的转化率增大,B
符合题意;
答案第 10页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
C. 充入He,使体系总压强增大,反应物和生成物的浓度均不改变,即正逆反应速率不变仍
然相等,平衡不移动,CO 的转化率不变,C 不合题意;
D. 催化剂只能改变反应速率,不能是平衡发生移动,则使用高效催化剂,CO 的转化率不
变,D 不合题意;
故答案为:B;
(4)
保持恒温恒容条件对于反应Ⅱ:将10mol CO 2 和30mol H2 放入1L 的密闭容器中,充分反应后
测得CO2的转化率为 60%,根据三段式分析可知:
CO2 (g) +3H 2 (g) CH3OH(g) +H 2 O(g)
起始量(mol) 10 30 0 0
,则该反应的平衡常数为
转化量(mol) 6 18 6 6
平衡量(mol) 4 12 6 6
c(CH3OH)c(H2O) 6×6 1K= 3 = = ,若维持条件不变向该容器中投入10mol CO 2 、30mol Hc(CO )c (H ) 、2 2 4×123 192
2
c(CH3OH)c(H O)10mol CH 2 10×10 1 13OH(g) 和10mol H2O(g),Qc = c(CO2)c
3(H ) = = < ,则判断平2 10×303 2700 192
1
衡移动的方向是正向移动,故答案为: ;正向移动;
192
(5)
已知反应 I CO(g)+2H (g) 2 CH 3OH(g) ΔH1 <0 正反应是一个气体体积减小的放热反应,
据此分析解题:
由题干图示信息可知, t2 时逆反应速率突然增大,然后减小直至平衡,说明平衡逆向移动,
结合反应 I 的特点可知,t2时改变的条件为:升温或增大生成物浓度, t8时逆反应速率突然
增大,然后一直保持不变,说明反应仍然保持平衡不移动,则 t8时改变的条件为使用(正)催
化剂,故答案为:升温或增大生成物浓度;使用(正)催化剂;
(6)
镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:
M+Ni(OH) 充电2 MH+NiOOH (式中 M 为储氢合金),电池充电过程即为电解池,放电
- -
电解池中阳极上发生氧化反应,则阳极的电极反应式为:Ni(OH)2 -e +OH =NiOOH+H2O,
故答案为:Ni(OH)2 -e
- +OH- =NiOOH+H2O。
答案第 11页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
答案第 12页,共 12页
{#{QQABCYyEogCgAAIAAABCQwmgCgGQkgGCAAgOQAAcoEIAiRFABCA=}#}
同课章节目录
