河南省驻马店市西平县2022-2023学年高二下学期期中考试化学试题(含答案)
文档属性
| 名称 | 河南省驻马店市西平县2022-2023学年高二下学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 590.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-11 19:10:35 | ||
图片预览



文档简介
西平县2022-2023学年高二下学期期中考试
化学
本试卷分选择题和非选择题两部分,共4页。全卷满分100分,考试时间90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.本试卷可能用到元素的相对原子质量:H1 C12
一、选择题:本题共15小题,每小题3分,共45分。每小题给出的四个选项中,只有一个选项是符合题目要求的。
1.反应过程Ⅰ、Ⅱ都能将反应物(M)转化为产物(N)。其能量与反应进程的关系如下,下列有关说法正确的是( )
A.进程Ⅰ是吸热反应 B.X是催化剂
C.M·X比N·X稳定 D.反应热:Ⅰ>Ⅱ
在体积为1 L的恒容密闭容器中充入1 mol 和3 mol ,一定条件下发生反应:。测得和的浓度随时间变化如图所示。下列说法正确的是( )
A.平衡时的转化率为75%
B.平衡后充入惰性气体,平衡向正向移动
C.该条件下,第9 min时大于第3 min时
D.混合气体的密度不随时间的变化而变化,则说明上述反应达到平衡状态
3.下列有关物质关系的说法正确的是( )
A.和互为同素异形体 B.金刚石和石墨互为同位素
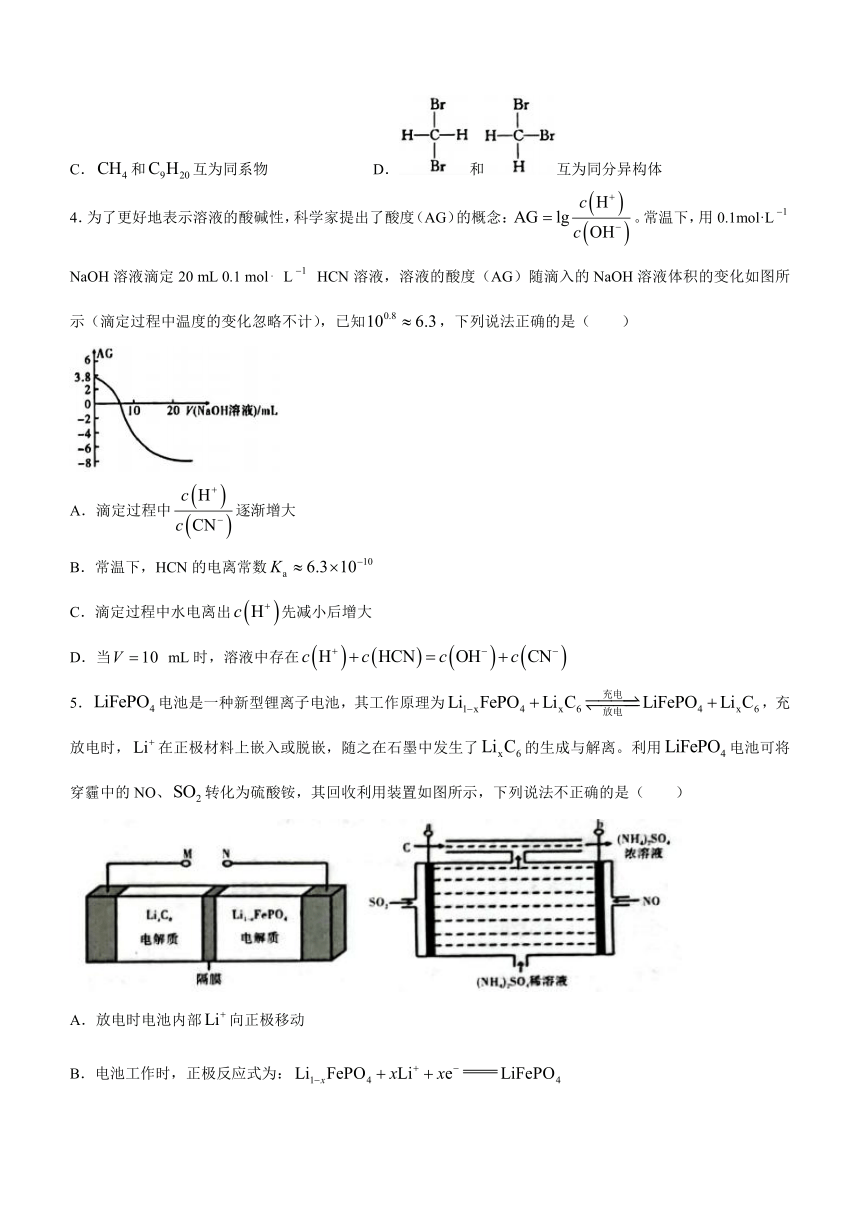
C.和互为同系物 D.和互为同分异构体
4.为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念:。常温下,用0.1mol·L NaOH溶液滴定20 mL 0.1 mol L HCN溶液,溶液的酸度(AG)随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知,下列说法正确的是( )
A.滴定过程中逐渐增大
B.常温下,HCN的电离常数
C.滴定过程中水电离出先减小后增大
D.当 mL时,溶液中存在
5.电池是一种新型锂离子电池,其工作原理为,充放电时,在正极材料上嵌入或脱嵌,随之在石墨中发生了的生成与解离。利用电池可将穿霾中的NO、转化为硫酸铵,其回收利用装置如图所示,下列说法不正确的是( )
A.放电时电池内部向正极移动
B.电池工作时,正极反应式为:
C.转化为硫酸铵时,M与b相接,N与a相接
D.该装置实际工作过程中需要在C处补充适量
6.下列描述中正确的是( )
A.基态碳原子的轨道表示式
B.磷元素的第一电离能大于硫元素的第一电离能
C.基态核外电子的排布为的原子,3p能级有一个空轨道
D.第四周期中未成对电子数最多的原子为
7.下列说法中正确的是( )
A.的名称为3,4一二甲基一2一乙基戊烷
B.、的空间结构均为平面三角形
C.HF比HCl沸点高的原因是HF分子内存在氢键
D.键角:
8.布洛芬具有抗炎、镇痛、解热的作用,但口服该药对肠道、胃有刺激性,解决方法之一是对该分子进行成酯修饰(如图所示)。下列说法正确的是( )
A.电负性:N>C>O B.R和T中均无手性碳原子
C.沸点: D.R和T均不能与氧气发生氧化反应
9.下列粒子的VSEPR模型为四面体形且其空间结构为三角锥形的是( )
A. B. C. D.
10.我国力争于2060年前实现碳中和。与重整是利用的研究热点之一,下列关于和说法正确的是( )
A.固态属于共价晶体
B.键角小于键角
C.分子中含有极性共价键,是极性分子
D.干冰中每个分子周围紧邻6个分子
11.“年年重午近佳辰,符艾一番新”,端午节常采艾草悬于门户上,艾叶中含有薄荷醇()、下列有关该物质的说法不正确的是( )
A.环上的一氯代物为3种 B.与互为同系物
C.该物质能使酸性高锰酸钾溶液褪色 D.该分子中杂化的原子数为11个
12.下列说法正确的是( )
A.的同分异构体有4种
B.光照条件下,1 mol甲烷和氯气完全取代需要2 mol氯气
C.的二氯代物只有一种,此事实可说明为正四面体结构
D.正戊烷和异戊烷属于同系物
13.欲检验卤代烃的卤元素,下列操作步骤正确的组合是()
①滴入2滴溶液观察现象 ②取少量上层水溶液
③取少量待测液于试管中 ④加入1 mL 5% NaOH溶液
⑤移入盛有1 mL稀硝酸的试管中 ⑥振荡后加热
A.②④⑤⑥③① B.③④⑥②⑤① C.③④⑤⑥②① D.③④②⑥⑤①
14.研究表明,连有4个不同的原子或原子团的碳原子,叫做不对称碳原子,也叫手性碳原子,含有手性碳原子的物质可能具有光学活性,也可能不具有光学活性。则有机物分子中()手性碳原子的个数为()
A.1 B.2 C.3 D.4
15.2,5一呋喃二甲酸(FDCA)是一种重要的化工原料,可用如图所示的电化学装置合成。图中的双极膜中间层中的解离为和,并在直流电场作用下分别向两极迁移。下列说法正确的是( )
A.a为电源正极
B.双极膜中间层中的在外电场的作用下移向铅电极
C.制得1 mol FDCA,理论上消耗2 mol
D.阴极区的电极反应为:
二、非选择题:共55分。
16.(15分)Ⅰ.CP是一种起爆药,化学式为,CP可由5-氰基四唑(结构简式为)和反应制备。
(1)Co原子基态电子排布式为___________,C、N、O元素的第一电离能由大到小的顺序为_____。
(2)5一氰基四唑分子中C原子的杂化类型为___________;1 mol 5一氰基四唑分子中含有σ键的数目为_____.
(3)在配合物中。
①的配体为_______________(填分子式)。
②空间构型_______________。
Ⅱ.偏钛酸钡在小型变压器,话筒和扩音器中均有应用,其晶胞结构如图所示。
(4)偏钛酸钡的化学式为____________。
(5)与最近且等距离的为______个。
17.(14分)某化工厂从废钼(Mo)催化剂(主要成分为、CoO、、)(中回收钴、铁、钼等,工艺流程如图:
已知:①“焙烧”过程中,转化为,转化为(易水解)。CoO转化为;
②常温下,,。
回答下列问题:
(1)“焙烧”过程中产生的气体Ⅰ的主要成分为__________________。
(2)“焙烧”过程中,转化为,该反应中氧化剂和还原剂的物质的量之比为______。
(3)“焙烧”过程中和反应的化学方程式为__________________。
(4)“熔砂”加水溶解时,加热的作用一方面是让可溶物充分溶解,另一方面是____________。
(5)“滤渣Ⅰ”中的和、稀反应的化学方程式为__________________。
(6)“滤渣Ⅱ”的成分为____________(写化学式)。
(7)常温下,“溶液”中加入溶液调节溶液的pH,当恰好完全沉淀时,溶液的pH为______[已知: mol L时,可以认为已完全沉淀]
18.(12分)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、和)在催化剂的作用下合成甲醇,发生的主反应如下:
①
②
③
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C=O)
化学键 H-H C-O C=O H-O C-H
E/(kJ·mol) 436 343 1076 465 413
由此计算______kJ mol,已知 kJ mol,由此计算,______kJ mol。
(2)图1中能正确反映反应①平衡常数K随温度变化关系的曲线为_______(填曲线标记字母),其判断理由是____________.
(3)图2中的压强由大到小为____________,其判断理由是____________。
19.(14分)按要求书写:
(1)羟基的电子式____________。
(2)的系统命名为____________。
(3)相对分子质量为72且沸点最低的烷烃的结构简式____________。
(4)某芳香烃的相对分子质量为102,若该分子内所有原子均在同一平面内,则其结构简式为____________。
(5)已知有多种同分异构体,其中主链含有五个碳原子,有两个甲基作支链。符合条件的烷烃有______种,其中有一种同分异构体的一氯代物有4种同分异构体,请写出其结构简式____________,该烷烃分子的名称____________。
高二化学参考答案
选择题共45分
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
选项 B A C B D B D C A B A C B A C
非选择题部分共55分
16.(除标注外每空2分,共15分)(1)或写为 N>O>C(1分)
(2)sp、杂化 (3)、正四面体
(4) (5)12
17.(每空2分,共14分)(1)
(2)
(3)
(4)可促进水解,使完全转化为沉淀
(5)
(6) (7)3.3
18.(每空2分,共12分)(1)-99 +41
(2)a反应①为放热反应,平衡常数应随温度升高变小
(3) 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率,而反应
③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高
19.(每空2分,共14分)(1)
(2)3-甲基戊烷
(3)
(4)
(5)4 2,2-二甲基戊烷
化学
本试卷分选择题和非选择题两部分,共4页。全卷满分100分,考试时间90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.本试卷可能用到元素的相对原子质量:H1 C12
一、选择题:本题共15小题,每小题3分,共45分。每小题给出的四个选项中,只有一个选项是符合题目要求的。
1.反应过程Ⅰ、Ⅱ都能将反应物(M)转化为产物(N)。其能量与反应进程的关系如下,下列有关说法正确的是( )
A.进程Ⅰ是吸热反应 B.X是催化剂
C.M·X比N·X稳定 D.反应热:Ⅰ>Ⅱ
在体积为1 L的恒容密闭容器中充入1 mol 和3 mol ,一定条件下发生反应:。测得和的浓度随时间变化如图所示。下列说法正确的是( )
A.平衡时的转化率为75%
B.平衡后充入惰性气体,平衡向正向移动
C.该条件下,第9 min时大于第3 min时
D.混合气体的密度不随时间的变化而变化,则说明上述反应达到平衡状态
3.下列有关物质关系的说法正确的是( )
A.和互为同素异形体 B.金刚石和石墨互为同位素
C.和互为同系物 D.和互为同分异构体
4.为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念:。常温下,用0.1mol·L NaOH溶液滴定20 mL 0.1 mol L HCN溶液,溶液的酸度(AG)随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知,下列说法正确的是( )
A.滴定过程中逐渐增大
B.常温下,HCN的电离常数
C.滴定过程中水电离出先减小后增大
D.当 mL时,溶液中存在
5.电池是一种新型锂离子电池,其工作原理为,充放电时,在正极材料上嵌入或脱嵌,随之在石墨中发生了的生成与解离。利用电池可将穿霾中的NO、转化为硫酸铵,其回收利用装置如图所示,下列说法不正确的是( )
A.放电时电池内部向正极移动
B.电池工作时,正极反应式为:
C.转化为硫酸铵时,M与b相接,N与a相接
D.该装置实际工作过程中需要在C处补充适量
6.下列描述中正确的是( )
A.基态碳原子的轨道表示式
B.磷元素的第一电离能大于硫元素的第一电离能
C.基态核外电子的排布为的原子,3p能级有一个空轨道
D.第四周期中未成对电子数最多的原子为
7.下列说法中正确的是( )
A.的名称为3,4一二甲基一2一乙基戊烷
B.、的空间结构均为平面三角形
C.HF比HCl沸点高的原因是HF分子内存在氢键
D.键角:
8.布洛芬具有抗炎、镇痛、解热的作用,但口服该药对肠道、胃有刺激性,解决方法之一是对该分子进行成酯修饰(如图所示)。下列说法正确的是( )
A.电负性:N>C>O B.R和T中均无手性碳原子
C.沸点: D.R和T均不能与氧气发生氧化反应
9.下列粒子的VSEPR模型为四面体形且其空间结构为三角锥形的是( )
A. B. C. D.
10.我国力争于2060年前实现碳中和。与重整是利用的研究热点之一,下列关于和说法正确的是( )
A.固态属于共价晶体
B.键角小于键角
C.分子中含有极性共价键,是极性分子
D.干冰中每个分子周围紧邻6个分子
11.“年年重午近佳辰,符艾一番新”,端午节常采艾草悬于门户上,艾叶中含有薄荷醇()、下列有关该物质的说法不正确的是( )
A.环上的一氯代物为3种 B.与互为同系物
C.该物质能使酸性高锰酸钾溶液褪色 D.该分子中杂化的原子数为11个
12.下列说法正确的是( )
A.的同分异构体有4种
B.光照条件下,1 mol甲烷和氯气完全取代需要2 mol氯气
C.的二氯代物只有一种,此事实可说明为正四面体结构
D.正戊烷和异戊烷属于同系物
13.欲检验卤代烃的卤元素,下列操作步骤正确的组合是()
①滴入2滴溶液观察现象 ②取少量上层水溶液
③取少量待测液于试管中 ④加入1 mL 5% NaOH溶液
⑤移入盛有1 mL稀硝酸的试管中 ⑥振荡后加热
A.②④⑤⑥③① B.③④⑥②⑤① C.③④⑤⑥②① D.③④②⑥⑤①
14.研究表明,连有4个不同的原子或原子团的碳原子,叫做不对称碳原子,也叫手性碳原子,含有手性碳原子的物质可能具有光学活性,也可能不具有光学活性。则有机物分子中()手性碳原子的个数为()
A.1 B.2 C.3 D.4
15.2,5一呋喃二甲酸(FDCA)是一种重要的化工原料,可用如图所示的电化学装置合成。图中的双极膜中间层中的解离为和,并在直流电场作用下分别向两极迁移。下列说法正确的是( )
A.a为电源正极
B.双极膜中间层中的在外电场的作用下移向铅电极
C.制得1 mol FDCA,理论上消耗2 mol
D.阴极区的电极反应为:
二、非选择题:共55分。
16.(15分)Ⅰ.CP是一种起爆药,化学式为,CP可由5-氰基四唑(结构简式为)和反应制备。
(1)Co原子基态电子排布式为___________,C、N、O元素的第一电离能由大到小的顺序为_____。
(2)5一氰基四唑分子中C原子的杂化类型为___________;1 mol 5一氰基四唑分子中含有σ键的数目为_____.
(3)在配合物中。
①的配体为_______________(填分子式)。
②空间构型_______________。
Ⅱ.偏钛酸钡在小型变压器,话筒和扩音器中均有应用,其晶胞结构如图所示。
(4)偏钛酸钡的化学式为____________。
(5)与最近且等距离的为______个。
17.(14分)某化工厂从废钼(Mo)催化剂(主要成分为、CoO、、)(中回收钴、铁、钼等,工艺流程如图:
已知:①“焙烧”过程中,转化为,转化为(易水解)。CoO转化为;
②常温下,,。
回答下列问题:
(1)“焙烧”过程中产生的气体Ⅰ的主要成分为__________________。
(2)“焙烧”过程中,转化为,该反应中氧化剂和还原剂的物质的量之比为______。
(3)“焙烧”过程中和反应的化学方程式为__________________。
(4)“熔砂”加水溶解时,加热的作用一方面是让可溶物充分溶解,另一方面是____________。
(5)“滤渣Ⅰ”中的和、稀反应的化学方程式为__________________。
(6)“滤渣Ⅱ”的成分为____________(写化学式)。
(7)常温下,“溶液”中加入溶液调节溶液的pH,当恰好完全沉淀时,溶液的pH为______[已知: mol L时,可以认为已完全沉淀]
18.(12分)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、和)在催化剂的作用下合成甲醇,发生的主反应如下:
①
②
③
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C=O)
化学键 H-H C-O C=O H-O C-H
E/(kJ·mol) 436 343 1076 465 413
由此计算______kJ mol,已知 kJ mol,由此计算,______kJ mol。
(2)图1中能正确反映反应①平衡常数K随温度变化关系的曲线为_______(填曲线标记字母),其判断理由是____________.
(3)图2中的压强由大到小为____________,其判断理由是____________。
19.(14分)按要求书写:
(1)羟基的电子式____________。
(2)的系统命名为____________。
(3)相对分子质量为72且沸点最低的烷烃的结构简式____________。
(4)某芳香烃的相对分子质量为102,若该分子内所有原子均在同一平面内,则其结构简式为____________。
(5)已知有多种同分异构体,其中主链含有五个碳原子,有两个甲基作支链。符合条件的烷烃有______种,其中有一种同分异构体的一氯代物有4种同分异构体,请写出其结构简式____________,该烷烃分子的名称____________。
高二化学参考答案
选择题共45分
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
选项 B A C B D B D C A B A C B A C
非选择题部分共55分
16.(除标注外每空2分,共15分)(1)或写为 N>O>C(1分)
(2)sp、杂化 (3)、正四面体
(4) (5)12
17.(每空2分,共14分)(1)
(2)
(3)
(4)可促进水解,使完全转化为沉淀
(5)
(6) (7)3.3
18.(每空2分,共12分)(1)-99 +41
(2)a反应①为放热反应,平衡常数应随温度升高变小
(3) 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率,而反应
③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高
19.(每空2分,共14分)(1)
(2)3-甲基戊烷
(3)
(4)
(5)4 2,2-二甲基戊烷
同课章节目录
