1.1.2物质的转化 课件(共29张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.2物质的转化 课件(共29张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 941.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-11 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
人教版2019必修第一册
第一章 物质及其变化
第1节 物质的分类及转化
01
02
03
04
教学分析
学情分析
教学目标
教学重难点
目录
CONTENTS
05
教学过程
0 1
教学分析
分析教材与课标,本节课要求学生根据物质的组成和性质对纯净物进行分类,在物质分类的基础上,能够运用化学反应建立物质转化的思路。同时强调,物质转化的价值在于制备人类生活和生产所需要的新物质,并指出工业生产中制取某种物质时需要考虑的因素,目的是培养学生综合考虑问题的意识。
学情分析
学生在初中阶段已经学习根据物质的组成和性质对物质进行分类,具备一定的知识基础,能够将物质分为混合物和纯净物,且能进一步对纯净物进行分类,具备一定的分类观。
0 2
1.通过对生活实例的反思,提炼分类的意义 并能够根据物质的组成和性质对物质进行分类,初步形成基于物质类别研究物质性质的认知模型;
2.能从微观粒子角度和宏观性质相结合的角度对胶体的性质进行讨论。在解决实际问题的过程中,从宏观和微观相结合的视角完善基于物质类别研究物质性质的认知模型。
0 3
教学目标
教学重难点
应用分类法建立各类物质的转化关系模型
各类物质之间的转化关系
应用分类法建立各类物质的转化关系模型
教学重点
教学难点
0 4
教学过程
物质的分类及转化分为两个课时,第一课时侧重讲解物质的分类,以及基于物质类别预测物质性质的一般思路。
第二课时侧重讲解基于物质性质设计物质之间的转化的思路。
0 5
第2课时 物质的转化
第1节 物质的分类及转化
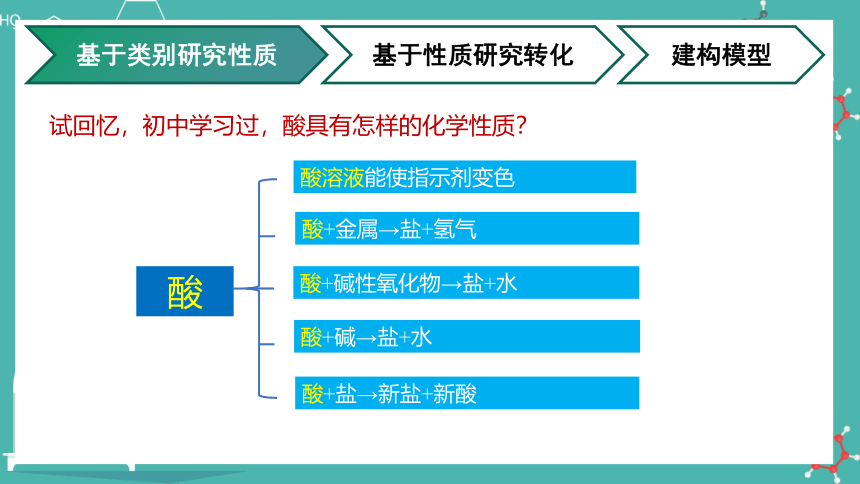
盐酸
酸
2HCl + Fe FeCl2 + H2↑
HCl + NaOH NaCl + H2O
酸+碱→盐+水
酸+碱性氧化物→盐+水
酸+盐→新盐+新酸
酸+金属→盐+氢气
酸溶液能使指示剂变色
基于类别研究性质
建构模型
基于性质研究转化
试回忆,初中学习过,酸具有怎样的化学性质?
NaOH
Ca(OH)2
碱
使紫色石蕊变蓝;使无色酚酞变红
2NaOH + CO2 Na2CO3 + H2O
NaOH + HCl NaCl + H2O
Ca(OH)2+Na2CO3 CaCO3↓+2NaOH
碱溶液能使指示剂变色
碱+盐→新盐+新碱
碱+酸→盐+水
碱+酸性氧化物→盐+水
试回忆,初中学习过,碱具有怎样的化学性质?
基于类别研究性质
建构模型
基于性质研究转化
Na2CO3
CuSO4
盐
CuSO4 + Fe FeSO4 + Cu
Na2CO3+2HCl 2NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
Na2CO3+CaCl2 CaCO3↓+2NaCl
盐 + 金属→ 新盐 + 新金属
盐 + 酸→ 新盐 + 新酸
盐 + 碱→ 新盐 + 新碱
盐 + 盐→ 新盐 + 新盐
试回忆,初中学习过,盐具有怎样的化学性质?
基于类别研究性质
建构模型
基于性质研究转化
Q1:如何以钠单质制备碳酸钠?
Na
Na2CO3
Na2O
NaOH
基于类别研究性质
建构模型
基于性质研究转化
O2
H2O
CO2
钠元素物质系列建构
Q1:如何以钠单质制备碳酸钠?
Na
钠元素物质系列建构
Na2CO3
Na2O
NaOH
基于类别研究性质
建构模型
基于性质研究转化
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
S
Q2:如何以硫单质制备硫酸铜?
SO3
SO2
H2SO4
CuSO4
基于类别研究性质
建构模型
基于性质研究转化
硫元素物质系列建构
O2
O2
H2O
Cu(OH)2
S
Q2:如何以硫单质制备硫酸铜?
SO3
SO2
H2SO4
CuSO4
基于类别研究性质
建构模型
基于性质研究转化
硫元素物质系列建构
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
Q1:如何以钠单质制备碳酸钠?
Na
S
钠元素与硫元素物质系列建构
Q2:如何以硫单质制备硫酸铜?
Na2CO3
Na2O
NaOH
SO3
SO2
H2SO4
CuSO4
Q3:两个物质系列之间可能发生的反应?
基于类别研究性质
建构模型
基于性质研究转化
Na
S
钠元素与硫元素物质系列建构
Na2CO3
Na2O
NaOH
SO3
SO2
H2SO4
CuSO4
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
基于类别研究性质
建构模型
基于性质研究转化
基于类别研究性质
建构模型
基于性质研究转化
能与水反应生成可溶性碱的常见金属氧化物只有4种:CaO、Na2O、K2O、BaO
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
原料
产物
元素组成
元素组成
物质类别
元素种类不变
物质类别的转化
物质类别
基于类别研究性质
建构模型
基于性质研究转化
核心思想
探究活动
运用物质转化的一般思路设计以Na为原料
制备Na2SO3的转化路径。
Na
4Na + O2 2Na2O
①
②
NaOH
Na2O
③
2NaOH + H2SO3 Na2SO3 + 2H2O
Na2O + H2O 2NaOH
Na2SO3
方案一
探究活动
运用物质转化的一般思路设计以Na为原料
制备Na2SO3的转化路径。
Na
4Na + O2 2Na2O
①
②
NaOH
Na2O
③
Na2O + H2O 2NaOH
Na2SO3
2NaOH + SO2 Na2SO3 + H2O
方案二
课堂小练
1. 在一定条件下,与酸、碱、盐都能反应的物质是( )
A.CaO B.Na2CO3 C.CaCO3 D.CO2
B
2.下列物质间的转化,不能通过一步反应完成的是( )
A.Zn→H2 B.CO2→CaCO3
C.Fe→Fe(OH)3 D.Ca(OH)2→CaCO3
C
课堂小练
3. 写出下列物质之间转化的化学方程式。
(1)Cu→CuO→CuSO4→Cu(OH)2→CuSO4→Cu。
2Cu + O2 2CuO
CuO + H2SO4 == CuSO4 + H2O
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2
CuSO4 + Zn == ZnSO4 + Cu
课堂小练
3. 写出下列物质之间转化的化学方程式。
(2)C→CO2→CaCO3→CaO→Ca(OH)2→CaCl2。
C+ O2 == CO2
CO2 + CaO == CaCO3
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
点燃
CaCO3 == CO2 + CaO
高温
课堂小练
4.用化学方程式表示下图中钙及其化合物之间的转化关系
课堂小练
4.用化学方程式表示下图中钙及其化合物之间的转化关系
2Ca+O2===2CaO
CaO+H2O===Ca(OH)2
CaO+ CO2===CaCO3
Ca(OH)2+CO2===CaCO3↓+H2O或Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
Ca(OH)2+2HCl===CaCl2+2H2O
CaCO3+2HCl=== CaCl2+H2O+CO2↑
6.写出三种制取NaOH的方法,并用化学方程式表示。
课堂小练
Na2O+H2O===2NaOH
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
Ba(OH)2+Na2SO4===BaSO4↓+2NaOH
课堂小结
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
物质之间转化的一般思路
下节课见!
人教版2019必修第一册
第一章 物质及其变化
第1节 物质的分类及转化
01
02
03
04
教学分析
学情分析
教学目标
教学重难点
目录
CONTENTS
05
教学过程
0 1
教学分析
分析教材与课标,本节课要求学生根据物质的组成和性质对纯净物进行分类,在物质分类的基础上,能够运用化学反应建立物质转化的思路。同时强调,物质转化的价值在于制备人类生活和生产所需要的新物质,并指出工业生产中制取某种物质时需要考虑的因素,目的是培养学生综合考虑问题的意识。
学情分析
学生在初中阶段已经学习根据物质的组成和性质对物质进行分类,具备一定的知识基础,能够将物质分为混合物和纯净物,且能进一步对纯净物进行分类,具备一定的分类观。
0 2
1.通过对生活实例的反思,提炼分类的意义 并能够根据物质的组成和性质对物质进行分类,初步形成基于物质类别研究物质性质的认知模型;
2.能从微观粒子角度和宏观性质相结合的角度对胶体的性质进行讨论。在解决实际问题的过程中,从宏观和微观相结合的视角完善基于物质类别研究物质性质的认知模型。
0 3
教学目标
教学重难点
应用分类法建立各类物质的转化关系模型
各类物质之间的转化关系
应用分类法建立各类物质的转化关系模型
教学重点
教学难点
0 4
教学过程
物质的分类及转化分为两个课时,第一课时侧重讲解物质的分类,以及基于物质类别预测物质性质的一般思路。
第二课时侧重讲解基于物质性质设计物质之间的转化的思路。
0 5
第2课时 物质的转化
第1节 物质的分类及转化
盐酸
酸
2HCl + Fe FeCl2 + H2↑
HCl + NaOH NaCl + H2O
酸+碱→盐+水
酸+碱性氧化物→盐+水
酸+盐→新盐+新酸
酸+金属→盐+氢气
酸溶液能使指示剂变色
基于类别研究性质
建构模型
基于性质研究转化
试回忆,初中学习过,酸具有怎样的化学性质?
NaOH
Ca(OH)2
碱
使紫色石蕊变蓝;使无色酚酞变红
2NaOH + CO2 Na2CO3 + H2O
NaOH + HCl NaCl + H2O
Ca(OH)2+Na2CO3 CaCO3↓+2NaOH
碱溶液能使指示剂变色
碱+盐→新盐+新碱
碱+酸→盐+水
碱+酸性氧化物→盐+水
试回忆,初中学习过,碱具有怎样的化学性质?
基于类别研究性质
建构模型
基于性质研究转化
Na2CO3
CuSO4
盐
CuSO4 + Fe FeSO4 + Cu
Na2CO3+2HCl 2NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
Na2CO3+CaCl2 CaCO3↓+2NaCl
盐 + 金属→ 新盐 + 新金属
盐 + 酸→ 新盐 + 新酸
盐 + 碱→ 新盐 + 新碱
盐 + 盐→ 新盐 + 新盐
试回忆,初中学习过,盐具有怎样的化学性质?
基于类别研究性质
建构模型
基于性质研究转化
Q1:如何以钠单质制备碳酸钠?
Na
Na2CO3
Na2O
NaOH
基于类别研究性质
建构模型
基于性质研究转化
O2
H2O
CO2
钠元素物质系列建构
Q1:如何以钠单质制备碳酸钠?
Na
钠元素物质系列建构
Na2CO3
Na2O
NaOH
基于类别研究性质
建构模型
基于性质研究转化
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
S
Q2:如何以硫单质制备硫酸铜?
SO3
SO2
H2SO4
CuSO4
基于类别研究性质
建构模型
基于性质研究转化
硫元素物质系列建构
O2
O2
H2O
Cu(OH)2
S
Q2:如何以硫单质制备硫酸铜?
SO3
SO2
H2SO4
CuSO4
基于类别研究性质
建构模型
基于性质研究转化
硫元素物质系列建构
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
Q1:如何以钠单质制备碳酸钠?
Na
S
钠元素与硫元素物质系列建构
Q2:如何以硫单质制备硫酸铜?
Na2CO3
Na2O
NaOH
SO3
SO2
H2SO4
CuSO4
Q3:两个物质系列之间可能发生的反应?
基于类别研究性质
建构模型
基于性质研究转化
Na
S
钠元素与硫元素物质系列建构
Na2CO3
Na2O
NaOH
SO3
SO2
H2SO4
CuSO4
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
基于类别研究性质
建构模型
基于性质研究转化
基于类别研究性质
建构模型
基于性质研究转化
能与水反应生成可溶性碱的常见金属氧化物只有4种:CaO、Na2O、K2O、BaO
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
原料
产物
元素组成
元素组成
物质类别
元素种类不变
物质类别的转化
物质类别
基于类别研究性质
建构模型
基于性质研究转化
核心思想
探究活动
运用物质转化的一般思路设计以Na为原料
制备Na2SO3的转化路径。
Na
4Na + O2 2Na2O
①
②
NaOH
Na2O
③
2NaOH + H2SO3 Na2SO3 + 2H2O
Na2O + H2O 2NaOH
Na2SO3
方案一
探究活动
运用物质转化的一般思路设计以Na为原料
制备Na2SO3的转化路径。
Na
4Na + O2 2Na2O
①
②
NaOH
Na2O
③
Na2O + H2O 2NaOH
Na2SO3
2NaOH + SO2 Na2SO3 + H2O
方案二
课堂小练
1. 在一定条件下,与酸、碱、盐都能反应的物质是( )
A.CaO B.Na2CO3 C.CaCO3 D.CO2
B
2.下列物质间的转化,不能通过一步反应完成的是( )
A.Zn→H2 B.CO2→CaCO3
C.Fe→Fe(OH)3 D.Ca(OH)2→CaCO3
C
课堂小练
3. 写出下列物质之间转化的化学方程式。
(1)Cu→CuO→CuSO4→Cu(OH)2→CuSO4→Cu。
2Cu + O2 2CuO
CuO + H2SO4 == CuSO4 + H2O
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2
CuSO4 + Zn == ZnSO4 + Cu
课堂小练
3. 写出下列物质之间转化的化学方程式。
(2)C→CO2→CaCO3→CaO→Ca(OH)2→CaCl2。
C+ O2 == CO2
CO2 + CaO == CaCO3
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
点燃
CaCO3 == CO2 + CaO
高温
课堂小练
4.用化学方程式表示下图中钙及其化合物之间的转化关系
课堂小练
4.用化学方程式表示下图中钙及其化合物之间的转化关系
2Ca+O2===2CaO
CaO+H2O===Ca(OH)2
CaO+ CO2===CaCO3
Ca(OH)2+CO2===CaCO3↓+H2O或Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
Ca(OH)2+2HCl===CaCl2+2H2O
CaCO3+2HCl=== CaCl2+H2O+CO2↑
6.写出三种制取NaOH的方法,并用化学方程式表示。
课堂小练
Na2O+H2O===2NaOH
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
Ba(OH)2+Na2SO4===BaSO4↓+2NaOH
课堂小结
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
物质之间转化的一般思路
下节课见!
