7.1.3烷烃的性质 课件(共24张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 7.1.3烷烃的性质 课件(共24张ppt)化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 44.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-11 22:15:57 | ||
图片预览







文档简介
(共24张PPT)
第一节 认识有机化合物
课时3 烷烃的性质
第七章 有机化合物
生活中使用的天然气,沼气,以及煤矿坑道气(煤层气)、油田气、瓦斯等主要成分都是甲烷(CH4)。
护肤品、医用软膏中的“凡士林”和蜡烛、蜡笔中的石蜡,其主要成分是含碳原子数较多的烷烃。
在生活中我们有没有接触过烷烃 想一想烷烃可能具有哪些性质
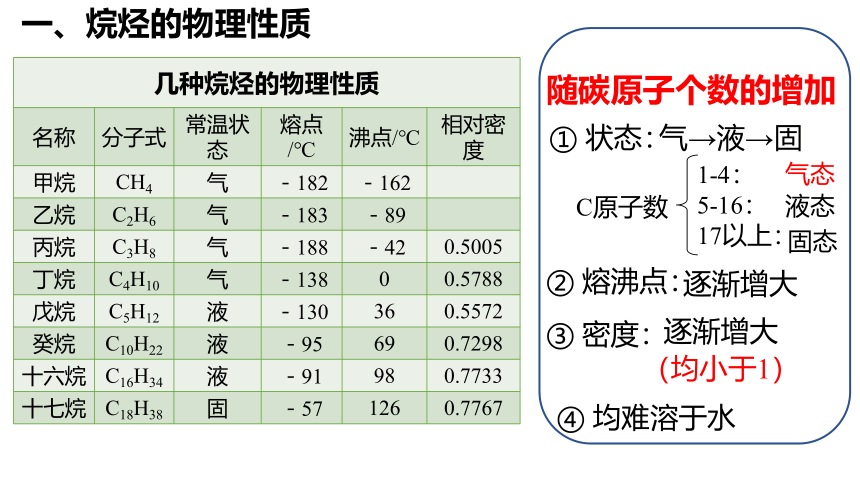
一、烷烃的物理性质
几种烷烃的物理性质 名称 分子式 常温状态 熔点/℃ 沸点/℃ 相对密度
甲烷 CH4 气 -182 -162
乙烷 C2H6 气 -183 -89
丙烷 C3H8 气 -188 -42 0.5005
丁烷 C4H10 气 -138 0 0.5788
戊烷 C5H12 液 -130 36 0.5572
癸烷 C10H22 液 -95 69 0.7298
十六烷 C16H34 液 -91 98 0.7733
十七烷 C18H38 固 -57 126 0.7767
① 状态:
C原子数
1-4:
5-16:
17以上:
随碳原子个数的增加
③ 密度:
② 熔沸点:
④ 均难溶于水
气→液→固
气态
液态
固态
逐渐增大
逐渐增大
(均小于1)
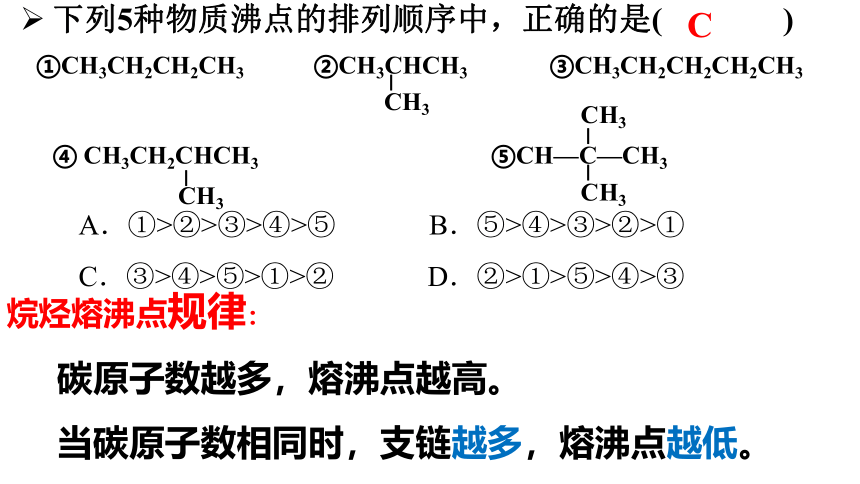
C
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.③>④>⑤>①>② D.②>①>⑤>④>③
①CH3CH2CH2CH3 ②CH3CHCH3 ③CH3CH2CH2CH2CH3
④ CH3CH2CHCH3 ⑤CH—C—CH3
CH3
I
CH3
I
下列5种物质沸点的排列顺序中,正确的是( )
CH3
I
I
CH3
烷烃熔沸点规律:
碳原子数越多,熔沸点越高。
当碳原子数相同时,支链越多,熔沸点越低。
二、烷烃的化学性质
1. 稳定性
通常情况下,烷烃比较稳定,与强酸、强碱或酸性高锰酸钾等强氧化剂都不发生反应。
1. 下列有关烷烃性质的叙述不正确的是( )
A. 常温下烷烃与酸、碱、强氧化剂不反应
B. 烷烃都具有还原性,能被氧气氧化
C. 烷烃都能燃烧生成二氧化碳和水
D. 烷烃能使酸性高锰酸钾溶液褪色
D
二、烷烃的化学性质
2.氧化反应(烷烃都具有可燃性,可用作燃料)
烷烃燃烧通式为:
CH4 + 2O2 CO2 + 2H2O
点燃
C3H8 + 5O2 3CO2 + 4H2O
点燃
CnH2n+2 + O2 n CO2 + (n + 1) H2O
点燃
注意:有机反应方程式中用“ ”,而不用“==”。
注意: 点燃甲烷(可燃性气体)前必须验纯,否则会爆炸。
(现象:放出大量的热,产生淡蓝色火焰)
煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。
点燃之前必须验纯!
燃料
甲烷
丙烷
石蜡
煤油
丁烷
烷烃都是很好的燃料
随碳数增加:含碳量增大,燃烧不充分,火焰明亮伴有黑烟
3.高温分解
烷烃在较高温度下会发生分解。这个性质常被应用于石油化工和天然气化工生产中,从烷烃可得到一系列重要的化工基本原料和燃料。
C4H10 C2H4+C2H6
△
C16H34 C8H16+C8H18
裂化
裂解
二、烷烃的化学性质
实验探究 —— 甲烷与氯气反应
取两支试管,均通过排饱和NaCl溶液的方法收集半试管CH4,和半试管Cl2,分别用铁架台固定好。将其中一支试管用铝箔套上,另一支试管放在光亮处(不要放在日光直射的地方)。静置,比较两支试管内的现象。
注意:暗处不反应 强光会爆炸
甲烷与氯气反应
实验探究
实验现象 原因分析
无光照
光照
无明显变化
无光照该反应不能发生
试管内气体颜色变浅
氯气逐渐消耗
试管壁上有油状液滴
生成不溶于水的液体
试管中液面上升
生成的气体溶于水中使试管内压强减小
水槽中有固体析出
Cl-饱和
可能观察到白雾
生成了易溶于水的HCl气体
请你根据甲烷与氯气反应历程动画,写出甲烷与氯气反应化学方程式。
如:一氯甲烷的形成
Cl—Cl
+
光
C
H
H
H
Cl
Cl
H
+
CH4 + Cl2 CH3Cl + HCl
光
常温下是无色气体,沸点:-24.2 ℃,难溶于水,主要用作有机硅的原料,也用作溶剂、冷冻剂、香料等。
(一氯甲烷)
如:二氯甲烷的形成
常温下是油状液体,沸点:39.8 ℃,难溶于水,用作牙科局部麻醉剂、冷冻剂、灭火剂、金属表面漆层清洗脱脂及脱膜剂。
CH3Cl + Cl2 CH2Cl2 + HCl
光
Cl—Cl
+
光
C
H
H
H
Cl
Cl
H
+
C
Cl
H
H
Cl
二氯甲烷只有一种结构,说明甲烷分子是正四面体形
(二氯甲烷)
如:三氯甲烷的形成
三氯甲烷(又称“氯仿”):常温下是油状液体,沸点:61.7 ℃,难溶于水,密度比水大的液体,常用作有机溶剂,主要用来生产氟利昂、染料和药物,在医学上,常用作麻醉剂
CH2Cl2 + Cl2 CHCl3 + HCl
光
(三氯甲烷)
Cl—Cl
+
光
Cl
H
+
C
Cl
H
H
Cl
C
H
Cl
Cl
Cl
如:四氯甲烷的形成
四氯甲烷(又称“四氯化碳”):常温下是油状液体,沸点:76.5 ℃,难溶于水,主要用作优良的溶剂、干洗剂、灭火剂、制冷剂及农药等
CHCl3 + Cl2 CCl4 + HCl
光
Cl—Cl
+
光
Cl
H
+
C
H
Cl
Cl
Cl
C
Cl
Cl
Cl
Cl
(四氯甲烷)
CH4 + Cl2 CH3Cl + HCl
光
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫做取代反应
CH3Cl + Cl2 CH2Cl2+ HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4+ HCl
光
特点:是“上一下一,取而代之”,类似无机反应中的复分解反应,注意在书写化学方程式时,防止漏写产物中的小分子。
每取代n mol H原子需要n mol Cl2
连锁反应
4.取代反应
反应物
反应条件
生成物
断键特点
连锁反应
数量关系
甲烷中的氢原子被氯原子逐步取代,各步反应同时进行,即第一步反应一旦开始,后续反应立即进行
每取代1 mol氢原子,消耗1 mol Cl2,生成1 mol HCl
反应特点
甲烷与氯气(不能用氯水,需纯卤素单质)
CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,产物复杂,其中HCl的产量最多
一般都需要加热、光照或催化剂等
反应中旧化学键不一定全断开,可能部分断开
取代反应的特点
烷烃(以甲烷为例)发生取代反应的一般规律
课堂小结
二、烷烃的化学性质(以甲烷为例进行分析)
三、用途
一、烷烃的物理性质
1、稳定性:
2、氧化反应—
3、取代反应(特征反应)
不与强酸、强碱、酸性KMnO4溶液反应
燃烧
现象:
反应条件:
特点:
光照,与气态纯卤素反应 (与氯水、溴水不反应)
逐步取代(随机并行),产物为混合物
除作燃料外,大量用于合成氨、尿素和炭黑,还可用于生产甲醇、氢气、乙炔、乙烯、甲醛、氢氰酸等。
4、高温分解:应用于石油化工和天然气化工生产中
碳原子数越多,熔沸点越高。当碳原子数相同时,支链越多,熔沸点越低。
当堂检测
C
1、下列化学反应中不属于取代反应的是 ( )
A.CH2Cl2+Br2 CHBrCl2+HBr
B.CH3OH+HCl CH3Cl+H2O
C.2Na+2H2O==2NaOH+H2↑
D.CH3—CH2—Br+H2O CH3—CH2—OH+HBr
光照
光照
当堂检测
B
当堂检测
C
当堂检测
4. 下图是CH4、CCl4、CH3Cl的分子球棍模型图。下列说法正确的是( )
A. CH4、CCl4和CH3Cl都是正四面体结构
B. CH4、CCl4都是正四面体结构
C. CH4、CCl4中的化学键完全相同
D. CH4、CCl4的结构相同,性质也相同
B
第一节 认识有机化合物
课时3 烷烃的性质
第七章 有机化合物
生活中使用的天然气,沼气,以及煤矿坑道气(煤层气)、油田气、瓦斯等主要成分都是甲烷(CH4)。
护肤品、医用软膏中的“凡士林”和蜡烛、蜡笔中的石蜡,其主要成分是含碳原子数较多的烷烃。
在生活中我们有没有接触过烷烃 想一想烷烃可能具有哪些性质
一、烷烃的物理性质
几种烷烃的物理性质 名称 分子式 常温状态 熔点/℃ 沸点/℃ 相对密度
甲烷 CH4 气 -182 -162
乙烷 C2H6 气 -183 -89
丙烷 C3H8 气 -188 -42 0.5005
丁烷 C4H10 气 -138 0 0.5788
戊烷 C5H12 液 -130 36 0.5572
癸烷 C10H22 液 -95 69 0.7298
十六烷 C16H34 液 -91 98 0.7733
十七烷 C18H38 固 -57 126 0.7767
① 状态:
C原子数
1-4:
5-16:
17以上:
随碳原子个数的增加
③ 密度:
② 熔沸点:
④ 均难溶于水
气→液→固
气态
液态
固态
逐渐增大
逐渐增大
(均小于1)
C
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.③>④>⑤>①>② D.②>①>⑤>④>③
①CH3CH2CH2CH3 ②CH3CHCH3 ③CH3CH2CH2CH2CH3
④ CH3CH2CHCH3 ⑤CH—C—CH3
CH3
I
CH3
I
下列5种物质沸点的排列顺序中,正确的是( )
CH3
I
I
CH3
烷烃熔沸点规律:
碳原子数越多,熔沸点越高。
当碳原子数相同时,支链越多,熔沸点越低。
二、烷烃的化学性质
1. 稳定性
通常情况下,烷烃比较稳定,与强酸、强碱或酸性高锰酸钾等强氧化剂都不发生反应。
1. 下列有关烷烃性质的叙述不正确的是( )
A. 常温下烷烃与酸、碱、强氧化剂不反应
B. 烷烃都具有还原性,能被氧气氧化
C. 烷烃都能燃烧生成二氧化碳和水
D. 烷烃能使酸性高锰酸钾溶液褪色
D
二、烷烃的化学性质
2.氧化反应(烷烃都具有可燃性,可用作燃料)
烷烃燃烧通式为:
CH4 + 2O2 CO2 + 2H2O
点燃
C3H8 + 5O2 3CO2 + 4H2O
点燃
CnH2n+2 + O2 n CO2 + (n + 1) H2O
点燃
注意:有机反应方程式中用“ ”,而不用“==”。
注意: 点燃甲烷(可燃性气体)前必须验纯,否则会爆炸。
(现象:放出大量的热,产生淡蓝色火焰)
煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。
点燃之前必须验纯!
燃料
甲烷
丙烷
石蜡
煤油
丁烷
烷烃都是很好的燃料
随碳数增加:含碳量增大,燃烧不充分,火焰明亮伴有黑烟
3.高温分解
烷烃在较高温度下会发生分解。这个性质常被应用于石油化工和天然气化工生产中,从烷烃可得到一系列重要的化工基本原料和燃料。
C4H10 C2H4+C2H6
△
C16H34 C8H16+C8H18
裂化
裂解
二、烷烃的化学性质
实验探究 —— 甲烷与氯气反应
取两支试管,均通过排饱和NaCl溶液的方法收集半试管CH4,和半试管Cl2,分别用铁架台固定好。将其中一支试管用铝箔套上,另一支试管放在光亮处(不要放在日光直射的地方)。静置,比较两支试管内的现象。
注意:暗处不反应 强光会爆炸
甲烷与氯气反应
实验探究
实验现象 原因分析
无光照
光照
无明显变化
无光照该反应不能发生
试管内气体颜色变浅
氯气逐渐消耗
试管壁上有油状液滴
生成不溶于水的液体
试管中液面上升
生成的气体溶于水中使试管内压强减小
水槽中有固体析出
Cl-饱和
可能观察到白雾
生成了易溶于水的HCl气体
请你根据甲烷与氯气反应历程动画,写出甲烷与氯气反应化学方程式。
如:一氯甲烷的形成
Cl—Cl
+
光
C
H
H
H
Cl
Cl
H
+
CH4 + Cl2 CH3Cl + HCl
光
常温下是无色气体,沸点:-24.2 ℃,难溶于水,主要用作有机硅的原料,也用作溶剂、冷冻剂、香料等。
(一氯甲烷)
如:二氯甲烷的形成
常温下是油状液体,沸点:39.8 ℃,难溶于水,用作牙科局部麻醉剂、冷冻剂、灭火剂、金属表面漆层清洗脱脂及脱膜剂。
CH3Cl + Cl2 CH2Cl2 + HCl
光
Cl—Cl
+
光
C
H
H
H
Cl
Cl
H
+
C
Cl
H
H
Cl
二氯甲烷只有一种结构,说明甲烷分子是正四面体形
(二氯甲烷)
如:三氯甲烷的形成
三氯甲烷(又称“氯仿”):常温下是油状液体,沸点:61.7 ℃,难溶于水,密度比水大的液体,常用作有机溶剂,主要用来生产氟利昂、染料和药物,在医学上,常用作麻醉剂
CH2Cl2 + Cl2 CHCl3 + HCl
光
(三氯甲烷)
Cl—Cl
+
光
Cl
H
+
C
Cl
H
H
Cl
C
H
Cl
Cl
Cl
如:四氯甲烷的形成
四氯甲烷(又称“四氯化碳”):常温下是油状液体,沸点:76.5 ℃,难溶于水,主要用作优良的溶剂、干洗剂、灭火剂、制冷剂及农药等
CHCl3 + Cl2 CCl4 + HCl
光
Cl—Cl
+
光
Cl
H
+
C
H
Cl
Cl
Cl
C
Cl
Cl
Cl
Cl
(四氯甲烷)
CH4 + Cl2 CH3Cl + HCl
光
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫做取代反应
CH3Cl + Cl2 CH2Cl2+ HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4+ HCl
光
特点:是“上一下一,取而代之”,类似无机反应中的复分解反应,注意在书写化学方程式时,防止漏写产物中的小分子。
每取代n mol H原子需要n mol Cl2
连锁反应
4.取代反应
反应物
反应条件
生成物
断键特点
连锁反应
数量关系
甲烷中的氢原子被氯原子逐步取代,各步反应同时进行,即第一步反应一旦开始,后续反应立即进行
每取代1 mol氢原子,消耗1 mol Cl2,生成1 mol HCl
反应特点
甲烷与氯气(不能用氯水,需纯卤素单质)
CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,产物复杂,其中HCl的产量最多
一般都需要加热、光照或催化剂等
反应中旧化学键不一定全断开,可能部分断开
取代反应的特点
烷烃(以甲烷为例)发生取代反应的一般规律
课堂小结
二、烷烃的化学性质(以甲烷为例进行分析)
三、用途
一、烷烃的物理性质
1、稳定性:
2、氧化反应—
3、取代反应(特征反应)
不与强酸、强碱、酸性KMnO4溶液反应
燃烧
现象:
反应条件:
特点:
光照,与气态纯卤素反应 (与氯水、溴水不反应)
逐步取代(随机并行),产物为混合物
除作燃料外,大量用于合成氨、尿素和炭黑,还可用于生产甲醇、氢气、乙炔、乙烯、甲醛、氢氰酸等。
4、高温分解:应用于石油化工和天然气化工生产中
碳原子数越多,熔沸点越高。当碳原子数相同时,支链越多,熔沸点越低。
当堂检测
C
1、下列化学反应中不属于取代反应的是 ( )
A.CH2Cl2+Br2 CHBrCl2+HBr
B.CH3OH+HCl CH3Cl+H2O
C.2Na+2H2O==2NaOH+H2↑
D.CH3—CH2—Br+H2O CH3—CH2—OH+HBr
光照
光照
当堂检测
B
当堂检测
C
当堂检测
4. 下图是CH4、CCl4、CH3Cl的分子球棍模型图。下列说法正确的是( )
A. CH4、CCl4和CH3Cl都是正四面体结构
B. CH4、CCl4都是正四面体结构
C. CH4、CCl4中的化学键完全相同
D. CH4、CCl4的结构相同,性质也相同
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
