第九单元溶液综合测试卷(含部分答案)---2022-2023学年九年级化学人教版下册
文档属性
| 名称 | 第九单元溶液综合测试卷(含部分答案)---2022-2023学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 191.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-12 13:40:29 | ||
图片预览




文档简介
人教版化学九年级下册 第九单元 溶液 综合测试卷
一、单选题
1.化学实验考查时,小芳抽到的考题是:“配制 40g 质量分数为 18%的氯化钠溶液”,她的实验操作正确的是( )
A.取氯化钠固体
B.称量 7.2g 氧化钠
C.量取 32.8mL 水
D.玻璃棒搅拌溶解
2.下列物质放入水中能形成溶液的是( )
A.蔗糖 B.汽油 C.面粉 D.泥沙
3.把盛有5g 16%的NaOH溶液的短试管放入盛有10g 16%的CuSO4溶液的锥形瓶里,如图所示,倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是( )
A.产生蓝色沉淀0.98g
B.锥形瓶内物质总质量不变
C.所得溶液的Na2SO4质量分数大于9.5%
D.所得的Na2SO4溶液质量与原CuSO4溶液质量相等
4.20℃时,取下表中的四种物质各10克,分别加入到100克水中充分溶解后,有固体剩余的是( )
常见物质的溶解度(20℃)
物质名称 氯酸钾 硝酸钾 氯化钠 蔗糖
溶解度/克 7.4 31.6 36.0 203.9
A.氯酸钾 B.硝酸钾
C.氯化钠 D.蔗糖
5.下列说法正确的是( )
A.过滤可以除去水中的所有杂质
B.汽油能除去油污的原因是其有乳化作用
C.化石燃料是可再生能源
D.可以用肥皂水区别硬水和软水
6.如图是甲乙两物质溶解度曲线,下列说法中正确的是( )
A.甲的溶解度大于乙溶解度
B.t℃,甲、乙的饱和溶液的溶质质量分数相等
C.升高温度一定能使甲的不饱和溶液变为饱和溶液
D.10℃,分别用100g 水配制甲、乙的饱和溶液,需要甲的质量大于乙的质量
7.如图,往烧杯中加入一定量的某固体,会引起试管内白磷燃烧,该固体可能是( )
A.氢氧化钠 B.硝酸铵 C.氯化钠 D.碳酸钙
8.图3是甲、乙两种物质的溶解度曲线,下列说法正确的是
A.甲的溶解度受温度影响比乙小
B.15℃时,甲、乙的溶解度相等
C.30℃时,100 g甲的饱和溶液中含溶质30g
D.将30℃乙的饱和溶液降温到15℃时变为不饱和溶液
9.a,b两种物质的溶解度曲线如图所示.下列说法不正确的是( )
A.将t1℃时b的饱和溶液加水可变为不饱和溶液
B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变
C.t2℃时,两种物质的饱和溶液中溶质质量分数a>b
D.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等
10.下图是a、b、c三种物质的溶解度曲线。由图示判断下列说法中正确的是( )
A.a的溶解度随温度的升高而减少
B.a的溶解度大于b的溶解度
C.c的饱和溶液从t2℃降温至t1℃时变为不饱和溶液
D.t1℃时,60g a的饱和溶液中含有溶剂70g
11.烧杯中有一定质量的MgO和MgCO3的混合物,向其中加入150g稀盐酸,恰好完全反应,一定温度下,得到156g不饱和溶液.下列数据中,与该溶液的溶质质量分数最接近的是( )
A.16.6% B.6.1% C.12.2% D.9.1%
12.几种物质的溶解度曲线如图。则下列说法正确的是( )
A.氯化铵的溶解度最大
B.随着温度升高,硫酸钠的溶解度不断增大
C.40℃时硫酸钠饱和溶液溶质的质量分数为50%
D.把40℃时饱和溶液降温到20℃,硫酸钠析出晶体最多
二、填空题
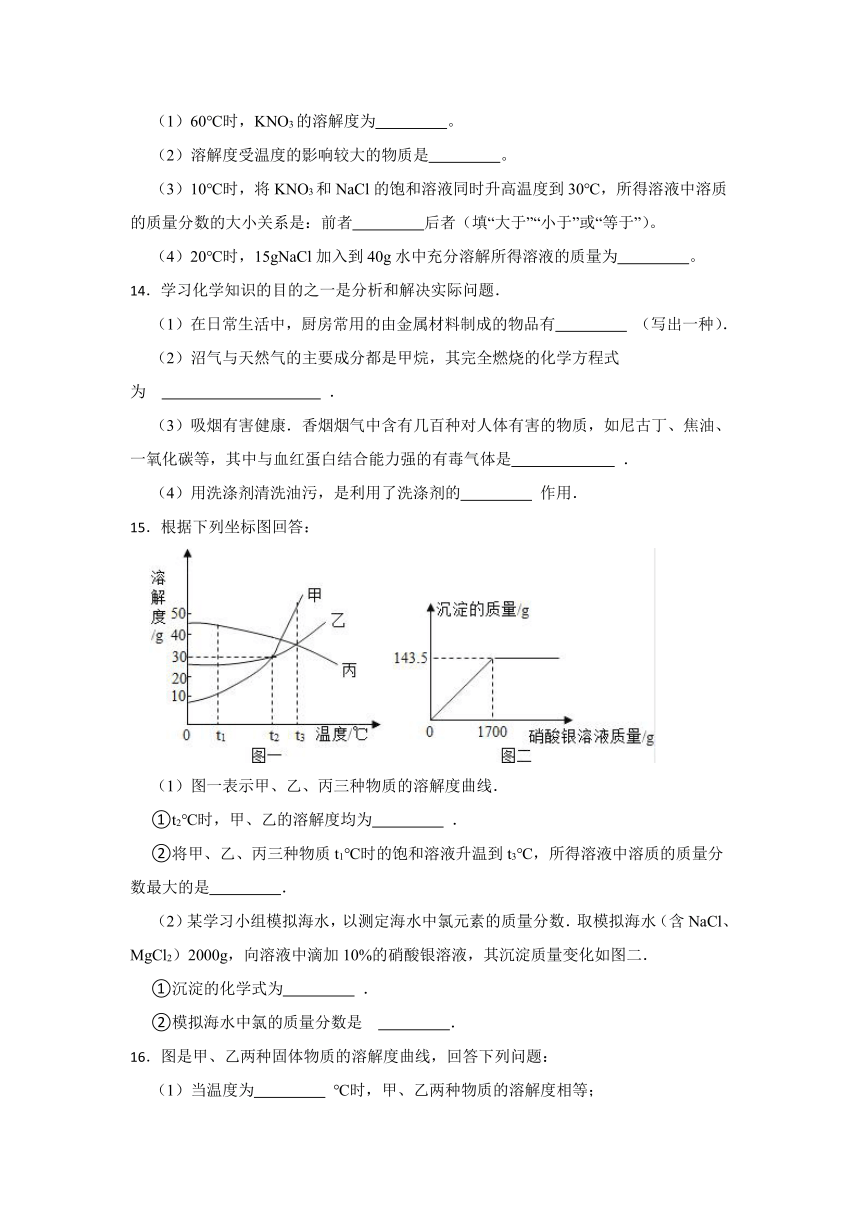
13.下表是KNO3、NaCl在不同温度下的溶解度:
温度/℃ 10 20 30 40 50 60 70 80 90
溶解度/g KNO3 20.9 32 45.8 64 85.5 110 138 169 202
NaCl 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39
根据上表信息,完成下列各题
(1)60℃时,KNO3的溶解度为 。
(2)溶解度受温度的影响较大的物质是 。
(3)10℃时,将KNO3和NaCl的饱和溶液同时升高温度到30℃,所得溶液中溶质的质量分数的大小关系是:前者 后者(填“大于”“小于”或“等于”)。
(4)20℃时,15gNaCl加入到40g水中充分溶解所得溶液的质量为 。
14.学习化学知识的目的之一是分析和解决实际问题.
(1)在日常生活中,厨房常用的由金属材料制成的物品有 (写出一种).
(2)沼气与天然气的主要成分都是甲烷,其完全燃烧的化学方程式为 .
(3)吸烟有害健康.香烟烟气中含有几百种对人体有害的物质,如尼古丁、焦油、一氧化碳等,其中与血红蛋白结合能力强的有毒气体是 .
(4)用洗涤剂清洗油污,是利用了洗涤剂的 作用.
15.根据下列坐标图回答:
(1)图一表示甲、乙、丙三种物质的溶解度曲线.
①t2℃时,甲、乙的溶解度均为 .
②将甲、乙、丙三种物质t1℃时的饱和溶液升温到t3℃,所得溶液中溶质的质量分数最大的是 .
(2)某学习小组模拟海水,以测定海水中氯元素的质量分数.取模拟海水(含NaCl、MgCl2)2000g,向溶液中滴加10%的硝酸银溶液,其沉淀质量变化如图二.
①沉淀的化学式为 .
②模拟海水中氯的质量分数是 .
16.图是甲、乙两种固体物质的溶解度曲线,回答下列问题:
(1)当温度为 ℃时,甲、乙两种物质的溶解度相等;
(2)T3℃时,在100g水中加入60g甲,形成 溶液(填“饱和”或“不饱和”).此时溶液中溶质的质量分数为 (保留一位小数).
17.实验室一瓶新购进的浓硫酸,其标签的部分内容如图所示.
(1)若该瓶硫酸还没有开封使用,瓶内溶液的质量为 g.
(2)若要配制9.8%的稀硫酸400g,则需用该浓硫酸 mL(计算结果保留至0.1).
(3)配制稀硫酸的过程中,除了用到量筒、胶头滴管、烧杯外,还需要用到的仪器可能有 .
(4)若量取浓硫酸时采用仰视的方法,则配制的溶液溶质质量分数 9.8%(填“>”、“=”或“<”).
(5)若取该9.8%的稀硫酸100g与足量的镁充分反应后,所得溶液的质量为 g.
三、计算题
18.为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取10g混合物,放入一干净的烧杯中,然后取100g某溶质质量分数的稀硫酸,平均分五次加入其中,充分反应,实验所得数据如下表:
(1)上表中m= 、n= .
(2)请计算所用稀硫酸的溶质质量分数 (结果保留一位小数).
(3)固体混合物中,镁元素的质量分数为 .
(4)现有60g溶质质量分数为98%的浓硫酸,配制上述实验中所需溶质质量分数的稀硫酸,需加水 g.
四、实验探究题
19.如图是对20℃一定质量的甲的溶液进行恒温蒸发的结晶实验过程,请回答:
(1)蒸发前原溶液是 (填“饱和”或“不饱和”)溶液,n的数值是 .
(2)依据上述实验,你认为甲的溶解度随温度变化的趋势是 (填字母)的.
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.
20.实验室要配置50g 10%的氯化钠溶液,其操作示意图如下图所示。
(1)①中玻璃棒的作用是 。
(2)把操作顺序补全:③ ①(填数字序号)。
(3)若在步骤⑤时,量筒中有部分液体洒出,则所配溶液的溶质质量分数将 (填“不变”“偏低”或“偏高”)。
21.欲配制50g质量分数为5%的NaCl溶液,下图是某同学配制溶液的操作过程。
(1)A中盛放溶液的仪器名称: 。配制的操作示意图如上图,该实验的正确操作顺序为 。(填字母序号)
(2)经检测,所配制溶液的溶质质量分数偏小,其原因可能是 (填序号)。
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出。
(3)水的密度为1.0g/mL。实验室配制50g溶质质量分数为5%的氯化钠溶液,需要量取水 mL。
22.请根据如图回答下列问题。
(1)写出图中仪器①的名称: 。
(2)实验室用B装置制取O2,组装好仪器后应先进行的操作是 ,相应的化学方程式为 。
(3)氨气是极易溶于水、密度小于空气的气体,实验室可通过加热氯化铵和氢氧化钙固体制取,则实验室制取氨气时应选择的发生装置是 (填序号); (填“能”或“不能”)用装置D收集氨气。
(4)图中E装置有多种功能。若要检验CO2气体,则瓶内装入的无色试剂的名称是 ,若用装置E、F组合来收集并测定O2的体积,应先在集气瓶中装满水,然后将导管 (填“a”或“b”)端和导管c端连接。
(5)生理盐水是溶质质量分数为0.9%的NaCl溶液。现需配制500g生理盐水,请回答下列问题:
①计算:需要称取NaCl的质量是 g。
②配制溶液的操作步骤如图,正确的操作顺序是 (填字母序号)。
答案解析部分
1.【答案】D
2.【答案】A
3.【答案】D
4.【答案】A
5.【答案】D
6.【答案】B
7.【答案】A
8.【答案】B
9.【答案】B
10.【答案】C
11.【答案】D
12.【答案】D
13.【答案】(1)110g
(2)KNO3
(3)小于
(4)54.4g
14.【答案】铁锅;CH4+2O2CO2+2H2O;一氧化碳;乳化
15.【答案】30g;丙;AgCl;1.775%
16.【答案】t2;饱和;37.5%
17.【答案】920;21.7;玻璃棒;>;102.2
18.【答案】(1)0.24;0.4
(2)29.4%
(3)58.4%
(4)140g
19.【答案】(1)不饱和;11
(2)C
20.【答案】(1)搅挤,加速溶解
(2)②④⑤
(3)偏高
一、单选题
1.化学实验考查时,小芳抽到的考题是:“配制 40g 质量分数为 18%的氯化钠溶液”,她的实验操作正确的是( )
A.取氯化钠固体
B.称量 7.2g 氧化钠
C.量取 32.8mL 水
D.玻璃棒搅拌溶解
2.下列物质放入水中能形成溶液的是( )
A.蔗糖 B.汽油 C.面粉 D.泥沙
3.把盛有5g 16%的NaOH溶液的短试管放入盛有10g 16%的CuSO4溶液的锥形瓶里,如图所示,倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是( )
A.产生蓝色沉淀0.98g
B.锥形瓶内物质总质量不变
C.所得溶液的Na2SO4质量分数大于9.5%
D.所得的Na2SO4溶液质量与原CuSO4溶液质量相等
4.20℃时,取下表中的四种物质各10克,分别加入到100克水中充分溶解后,有固体剩余的是( )
常见物质的溶解度(20℃)
物质名称 氯酸钾 硝酸钾 氯化钠 蔗糖
溶解度/克 7.4 31.6 36.0 203.9
A.氯酸钾 B.硝酸钾
C.氯化钠 D.蔗糖
5.下列说法正确的是( )
A.过滤可以除去水中的所有杂质
B.汽油能除去油污的原因是其有乳化作用
C.化石燃料是可再生能源
D.可以用肥皂水区别硬水和软水
6.如图是甲乙两物质溶解度曲线,下列说法中正确的是( )
A.甲的溶解度大于乙溶解度
B.t℃,甲、乙的饱和溶液的溶质质量分数相等
C.升高温度一定能使甲的不饱和溶液变为饱和溶液
D.10℃,分别用100g 水配制甲、乙的饱和溶液,需要甲的质量大于乙的质量
7.如图,往烧杯中加入一定量的某固体,会引起试管内白磷燃烧,该固体可能是( )
A.氢氧化钠 B.硝酸铵 C.氯化钠 D.碳酸钙
8.图3是甲、乙两种物质的溶解度曲线,下列说法正确的是
A.甲的溶解度受温度影响比乙小
B.15℃时,甲、乙的溶解度相等
C.30℃时,100 g甲的饱和溶液中含溶质30g
D.将30℃乙的饱和溶液降温到15℃时变为不饱和溶液
9.a,b两种物质的溶解度曲线如图所示.下列说法不正确的是( )
A.将t1℃时b的饱和溶液加水可变为不饱和溶液
B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变
C.t2℃时,两种物质的饱和溶液中溶质质量分数a>b
D.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等
10.下图是a、b、c三种物质的溶解度曲线。由图示判断下列说法中正确的是( )
A.a的溶解度随温度的升高而减少
B.a的溶解度大于b的溶解度
C.c的饱和溶液从t2℃降温至t1℃时变为不饱和溶液
D.t1℃时,60g a的饱和溶液中含有溶剂70g
11.烧杯中有一定质量的MgO和MgCO3的混合物,向其中加入150g稀盐酸,恰好完全反应,一定温度下,得到156g不饱和溶液.下列数据中,与该溶液的溶质质量分数最接近的是( )
A.16.6% B.6.1% C.12.2% D.9.1%
12.几种物质的溶解度曲线如图。则下列说法正确的是( )
A.氯化铵的溶解度最大
B.随着温度升高,硫酸钠的溶解度不断增大
C.40℃时硫酸钠饱和溶液溶质的质量分数为50%
D.把40℃时饱和溶液降温到20℃,硫酸钠析出晶体最多
二、填空题
13.下表是KNO3、NaCl在不同温度下的溶解度:
温度/℃ 10 20 30 40 50 60 70 80 90
溶解度/g KNO3 20.9 32 45.8 64 85.5 110 138 169 202
NaCl 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39
根据上表信息,完成下列各题
(1)60℃时,KNO3的溶解度为 。
(2)溶解度受温度的影响较大的物质是 。
(3)10℃时,将KNO3和NaCl的饱和溶液同时升高温度到30℃,所得溶液中溶质的质量分数的大小关系是:前者 后者(填“大于”“小于”或“等于”)。
(4)20℃时,15gNaCl加入到40g水中充分溶解所得溶液的质量为 。
14.学习化学知识的目的之一是分析和解决实际问题.
(1)在日常生活中,厨房常用的由金属材料制成的物品有 (写出一种).
(2)沼气与天然气的主要成分都是甲烷,其完全燃烧的化学方程式为 .
(3)吸烟有害健康.香烟烟气中含有几百种对人体有害的物质,如尼古丁、焦油、一氧化碳等,其中与血红蛋白结合能力强的有毒气体是 .
(4)用洗涤剂清洗油污,是利用了洗涤剂的 作用.
15.根据下列坐标图回答:
(1)图一表示甲、乙、丙三种物质的溶解度曲线.
①t2℃时,甲、乙的溶解度均为 .
②将甲、乙、丙三种物质t1℃时的饱和溶液升温到t3℃,所得溶液中溶质的质量分数最大的是 .
(2)某学习小组模拟海水,以测定海水中氯元素的质量分数.取模拟海水(含NaCl、MgCl2)2000g,向溶液中滴加10%的硝酸银溶液,其沉淀质量变化如图二.
①沉淀的化学式为 .
②模拟海水中氯的质量分数是 .
16.图是甲、乙两种固体物质的溶解度曲线,回答下列问题:
(1)当温度为 ℃时,甲、乙两种物质的溶解度相等;
(2)T3℃时,在100g水中加入60g甲,形成 溶液(填“饱和”或“不饱和”).此时溶液中溶质的质量分数为 (保留一位小数).
17.实验室一瓶新购进的浓硫酸,其标签的部分内容如图所示.
(1)若该瓶硫酸还没有开封使用,瓶内溶液的质量为 g.
(2)若要配制9.8%的稀硫酸400g,则需用该浓硫酸 mL(计算结果保留至0.1).
(3)配制稀硫酸的过程中,除了用到量筒、胶头滴管、烧杯外,还需要用到的仪器可能有 .
(4)若量取浓硫酸时采用仰视的方法,则配制的溶液溶质质量分数 9.8%(填“>”、“=”或“<”).
(5)若取该9.8%的稀硫酸100g与足量的镁充分反应后,所得溶液的质量为 g.
三、计算题
18.为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取10g混合物,放入一干净的烧杯中,然后取100g某溶质质量分数的稀硫酸,平均分五次加入其中,充分反应,实验所得数据如下表:
(1)上表中m= 、n= .
(2)请计算所用稀硫酸的溶质质量分数 (结果保留一位小数).
(3)固体混合物中,镁元素的质量分数为 .
(4)现有60g溶质质量分数为98%的浓硫酸,配制上述实验中所需溶质质量分数的稀硫酸,需加水 g.
四、实验探究题
19.如图是对20℃一定质量的甲的溶液进行恒温蒸发的结晶实验过程,请回答:
(1)蒸发前原溶液是 (填“饱和”或“不饱和”)溶液,n的数值是 .
(2)依据上述实验,你认为甲的溶解度随温度变化的趋势是 (填字母)的.
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.
20.实验室要配置50g 10%的氯化钠溶液,其操作示意图如下图所示。
(1)①中玻璃棒的作用是 。
(2)把操作顺序补全:③ ①(填数字序号)。
(3)若在步骤⑤时,量筒中有部分液体洒出,则所配溶液的溶质质量分数将 (填“不变”“偏低”或“偏高”)。
21.欲配制50g质量分数为5%的NaCl溶液,下图是某同学配制溶液的操作过程。
(1)A中盛放溶液的仪器名称: 。配制的操作示意图如上图,该实验的正确操作顺序为 。(填字母序号)
(2)经检测,所配制溶液的溶质质量分数偏小,其原因可能是 (填序号)。
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出。
(3)水的密度为1.0g/mL。实验室配制50g溶质质量分数为5%的氯化钠溶液,需要量取水 mL。
22.请根据如图回答下列问题。
(1)写出图中仪器①的名称: 。
(2)实验室用B装置制取O2,组装好仪器后应先进行的操作是 ,相应的化学方程式为 。
(3)氨气是极易溶于水、密度小于空气的气体,实验室可通过加热氯化铵和氢氧化钙固体制取,则实验室制取氨气时应选择的发生装置是 (填序号); (填“能”或“不能”)用装置D收集氨气。
(4)图中E装置有多种功能。若要检验CO2气体,则瓶内装入的无色试剂的名称是 ,若用装置E、F组合来收集并测定O2的体积,应先在集气瓶中装满水,然后将导管 (填“a”或“b”)端和导管c端连接。
(5)生理盐水是溶质质量分数为0.9%的NaCl溶液。现需配制500g生理盐水,请回答下列问题:
①计算:需要称取NaCl的质量是 g。
②配制溶液的操作步骤如图,正确的操作顺序是 (填字母序号)。
答案解析部分
1.【答案】D
2.【答案】A
3.【答案】D
4.【答案】A
5.【答案】D
6.【答案】B
7.【答案】A
8.【答案】B
9.【答案】B
10.【答案】C
11.【答案】D
12.【答案】D
13.【答案】(1)110g
(2)KNO3
(3)小于
(4)54.4g
14.【答案】铁锅;CH4+2O2CO2+2H2O;一氧化碳;乳化
15.【答案】30g;丙;AgCl;1.775%
16.【答案】t2;饱和;37.5%
17.【答案】920;21.7;玻璃棒;>;102.2
18.【答案】(1)0.24;0.4
(2)29.4%
(3)58.4%
(4)140g
19.【答案】(1)不饱和;11
(2)C
20.【答案】(1)搅挤,加速溶解
(2)②④⑤
(3)偏高
同课章节目录
