第三章《晶体结构与性质》单元检测(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章《晶体结构与性质》单元检测(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 333.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-12 20:34:28 | ||
图片预览




文档简介
第三章《晶体结构与性质》单元检测
一、单选题
1.CrSi、Ge—GaAs、ZnGeAs2和碳化硅都是重要的半导体化合物,下列说法错误的是
A.基态铬原子的价电子排布式为3d54s1
B.Ge—GaAs中元素Ge、Ga、As的第一电离能由大到小的顺序为As>Ga>Ge
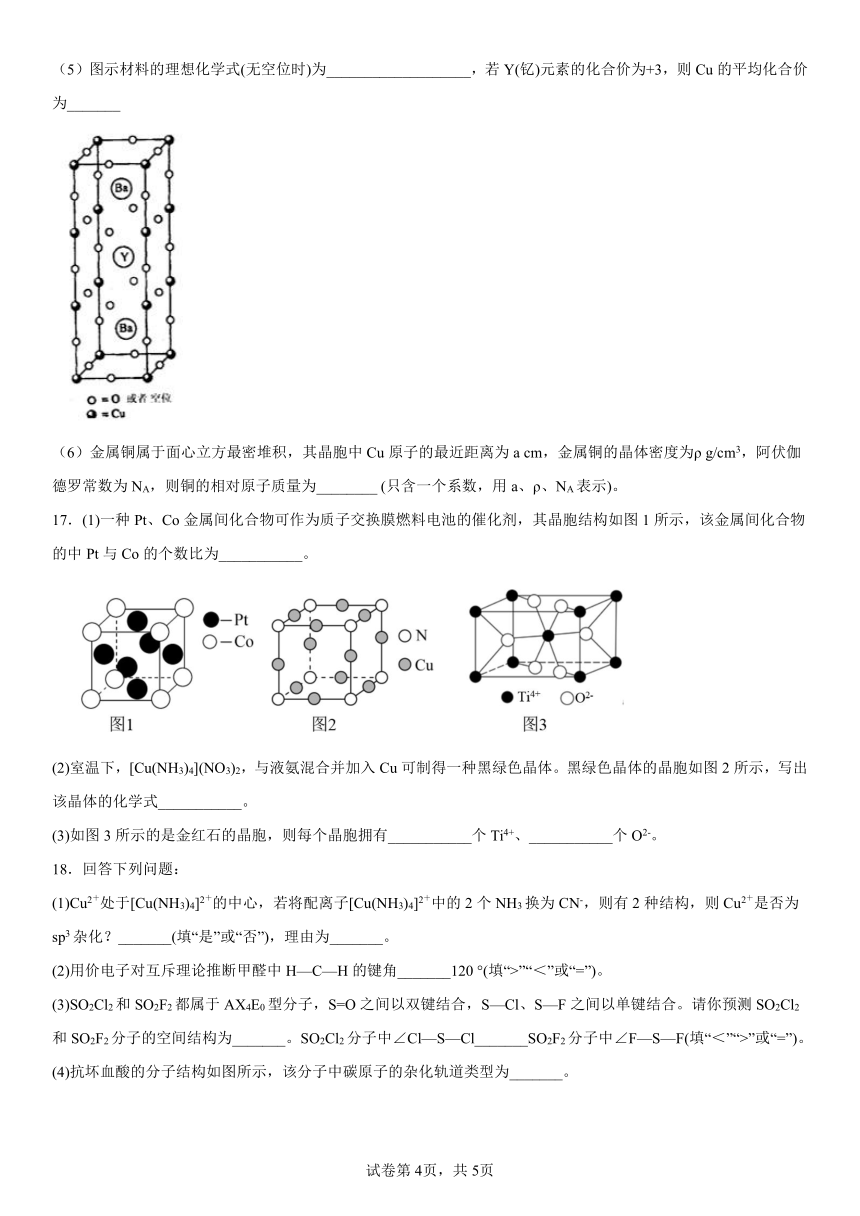
C.ZnGeAs2中元素Zn、Ge、As的电负性由大到小的顺序为As>Ge>Zn
D.碳化硅属于原子晶体,其熔沸点均大于晶体硅
2.以下命题,违背化学变化规律的是
A.石墨制成金刚石 B.煤加氢变成人造石油
C.水变成汽油 D.干冰转化成原子晶体
3.下列关于金属的叙述中正确的是( )
A.常温下所有的金属都是固态
B.金属具有导电、导热和延展性
C.金属都具有较高的硬度和密度
D.金属都具有较高的熔点和沸点
4.下列有关性质的比较,正确的是
A.第一电离能:O>N B.水溶性:CH3CH2OH>CH3CH2OCH2CH3
C.沸点:HCl>HF D.晶格能:NaCl>MgO
5.下列有关晶胞的叙述错误的是( )
A.晶胞是晶体结构中最小的重复单元 B.不同晶体中晶胞的大小和形状不一定相同
C.晶胞中的任何一个粒子都完全属于该晶胞 D.已知晶胞的结构可推知晶体的组成
6.下列关于物质熔点的排列顺序不正确的是
A.生铁>纯铁>钠 B.
C. D.
7.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出。下列关于此化合物的说法正确的是
A.该配合物的配位原子是N B.中心离子是Pt6+
C.配合物的中心离子配位数为6 D.该配合物可能是正方形结构
8.能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
A.、、的熔点 B.、、的氧化性
C.、、的颜色 D.、、的酸性
9.下列变化过程只需要破坏共价键的是
A.碘升华 B.金刚石熔化 C.金属钠熔融 D.氯化钠溶于水
10.有关离子晶体的下列说法不正确的是
A.离子晶体在熔融状态时都能导电
B.离子晶体具有较高的熔、沸点,较大的硬度
C.离子晶体中阴、阳离子个数比为1∶1
D.氯化钠溶于水时离子键被破坏
11.下列陈述Ⅰ和陈述Ⅱ均正确并且存在因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
某晶体熔点低,硬度小,不导电 该晶体是离子晶体
、的第一电离能依次增大 、的最外层电子数依次增多
金刚石、硅、锗的熔点、硬度依次降低 C、、的非金属性依次减弱,金属性依次增强
在晶体中,每个分子周围紧邻的分子有个;在冰晶体中,每个分子周围紧邻的分子有个 晶体中,分子间只存在范德华力;冰晶体中,分子间存在氢键,氢键具有方向性
A. B. C. D.
12.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,下图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为
A.1∶2∶1 B.11∶8∶4 C.9∶8∶4 D.9∶14∶9
二、填空题
13.(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在___(填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(2)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答:
①H2Se的酸性比H2S________(填“强”或“弱”),SO32-离子的立体构型为________。
②H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:H2SeO4比H2SeO3酸性强的原因:__________。
(3)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为___________________。
②与H2O分子互为等电子体的阴离子为________。
③)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为____________。
14.写出下列物质的电子式:
CO2___________、Ca(OH)2___________、Na2O2___________、PCl3 ___________、CCl4___________。
15.已知该晶体的晶胞参数apm,阿伏加德罗常数的值为N A,则该晶体的密度为d =_______g·cm-3(用含a和N A的代数式表示)。
16.1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______族
(2)下列关于Ge元素叙述正确的是______(从下列选项中选择)
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________
(4)NH3也常作制冷剂,其键角_______(填“大于”或“小于”)109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是___________________________
(5)图示材料的理想化学式(无空位时)为___________________,若Y(钇)元素的化合价为+3,则Cu的平均化合价为_______
(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为________ (只含一个系数,用a、ρ、NA表示)。
17.(1)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图1所示,该金属间化合物的中Pt与Co的个数比为___________。
(2)室温下,[Cu(NH3)4](NO3)2,与液氨混合并加入Cu可制得一种黑绿色晶体。黑绿色晶体的晶胞如图2所示,写出该晶体的化学式___________。
(3)如图3所示的是金红石的晶胞,则每个晶胞拥有___________个Ti4+、___________个O2-。
18.回答下列问题:
(1)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化?_______(填“是”或“否”),理由为_______。
(2)用价电子对互斥理论推断甲醛中H—C—H的键角_______120 °(填“>”“<”或“=”)。
(3)SO2Cl2和SO2F2都属于AX4E0型分子,S=O之间以双键结合,S—Cl、S—F之间以单键结合。请你预测SO2Cl2和SO2F2分子的空间结构为_______。SO2Cl2分子中∠Cl—S—Cl_______SO2F2分子中∠F—S—F(填“<”“>”或“=”)。
(4)抗坏血酸的分子结构如图所示,该分子中碳原子的杂化轨道类型为_______。
(5)下列变化:①碘的升华;②氯化钠溶于水;③氧气溶于水;④烧碱熔化。化学键没有被破坏的是_______(填序号,下同);仅发生离子键破坏的是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.铬元素的原子序数24,基态铬原子的价电子排布式为3d54s1,故A正确;
B.同周期元素,从左到右第一电离能呈增大趋势,则第一电离能As>Ge>Ga,故B错误;
C.非金属元素的电负性强于金属元素,金属元素的金属性越强,电负性越小,砷为非金属元素,锌的金属性强于锗元素,则电负性由大到小的顺序为As>Ge>Zn,故C正确;
D.原子晶体的熔沸点取决于共价键的强弱,碳化硅、晶体硅均属于原子晶体,碳硅键的键能大于硅硅键、键长小于硅硅键,则熔沸点碳化硅均大于晶体硅,故D正确;
故选B。
2.C
【详解】化学反应的实质是旧化学键的断裂与新化学键的形成,化学反应中,元素的种类不会发生改变;水中没有碳元素,不可能转化为碳原子为C5~C11的烃的汽油,故选C。
3.B
【详解】A.金属Hg常温下为液体,A错误;
B.金属是热和电的良导体,金属具有延展性,B正确;
C.多数的金属具有较高的硬度和密度,金属钠质软且密度比水小,C错误;
D.多数的金属具有较高的熔点和沸点,少数金属如Hg不具有较高的熔沸点,D错误;
答案选B。
4.B
【详解】A.N原子2P能级为半充满状态,结构稳定,第一电离能:OB.CH3CH2OH含有羟基,与水能形成氢键,所以水溶性CH3CH2OH>CH3CH2OCH2CH3,故B正确;
C.HF分子间能形成氢键,沸点:HClD.Mg2+、O2-所带电荷数大于Na+、Cl-,晶格能:NaCl选B。
5.C
【详解】A.晶胞是晶体中的最小的结构重复单元,A项正确;
B.不同的晶体中晶胞的大小和形状不一定都相同,B项正确;
C.晶胞中的任何一个粒子不一定都完全属于该晶胞,如体心立方晶胞,立方体顶点的原子属于该晶胞的只有,C项错误;
D.已知晶胞的结构可推知晶体的组成,D项正确;
答案选C。
【点睛】该题是基础性试题的考查,主要是考查学生对晶胞结构的了解掌握情况,意在巩固学生的基础,提高学生的能力,有利于培养学生的抽象思维能力和发散思维能力。
6.A
【详解】A.生铁为铁合金,熔点要低于纯铁,A错误;
B.物质均为分子晶体,且组成与结构相似,相对分子质量越大,熔沸点越高,B正确;
C.物质均为离子晶体,离子半径越小,离子键键能越大,熔点越高,离子半径,故熔点:,而阳离子半径:,故熔点:,C正确;
D.MgO属于离子晶体,H2O和O2属于分子晶体,一般熔点:离子晶体>分子晶体, 故MgO的熔点高于H2O和O2,H2O分子间存在氢键常温下呈液态,熔点比O2高,D正确;
故选A。
7.C
【分析】该物质加入AgNO3溶液不产生沉淀,用强碱处理没有NH3放出,说明该物质不存在游离的氯离子和铵根离子,所以该物质的配位化学式为[PtCl4(NH3)2]。
【详解】A.由分析可知,Cl-和NH3分子均与Pt4+配位,该配合物的配位原子是N和Cl-,故A错误;
B.由分析可知,中心离子是Pt4+,故B错误;
C.由该物质的配位化学式为[PtCl4(NH3)2]可知,该配合物中中心离子的配位数为6,故C正确;
D.该物质的配位化学式为[PtCl4(NH3)2],配位数为6,则该配合物是八面体结构,不可能是平面正方形结构,故D错误;
故答案选C。
8.B
【分析】同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强。
【详解】A.Cl2、Br2、I2都是由分子构成的物质,分子之间作用力越强,克服分子间作用力使物质熔化或气化消耗的能量就越大,物质的熔点、沸点就越高,与元素的非金属性强弱无关,故A不符合题意;
B.元素的非金属性越强,该元素形成的单质的氧化性就越强,所以可根据Cl2、Br2、I2的氧化性强弱判断Cl、Br、I的元素的非金属性强弱,故B符合题意;
C.元素形成的单质的颜色是物质的物理性质,与元素的非金属性强弱无关,故C不符合题意;
D.元素的非金属性越强,其形成的最高价氧化物对应的水化物的酸性越强,不能通过比较氢化物水溶液的酸性比较元素非金属性强弱,故D不符合题意;
答案选B。
9.B
【详解】A.碘升华破坏的是分子间作用力,A错误;
B.金刚石中碳碳之间是共价键,融化的时候,需要破坏共价键,B正确;
C.金属钠属于金属晶体,融化的时候破坏的是金属键,C错误;
D.氯化钠中存在着钠离子和氯离子之间的离子键,溶于水时破坏的是离子键,D错误;
故选B。
10.C
【详解】A.离子晶体在熔融状态时含有自由离子,能导电,故A正确;
B.由正、负离子或正、负离子基团按一定比例通过离子键结合形成的晶体称作离子晶体,离子晶体一般硬而脆,具有较高的熔沸点,故B正确;
C.离子晶体如Na2O2晶体中阳离子为Na+、阴离子为过氧根离子,所以Na2O2晶体中阴阳离子个数之比为1:2,故C错误;
D.NaCl溶于水时,NaCl在水分子作用下发生电离生成钠离子、氯离子,所以离子键被破坏,故D正确;
故选:C。
11.D
【详解】A.根据某晶体熔点低,硬度小,不导电,推出该晶体是分子晶体,陈述Ⅱ不成立,A错误;
B.P的3p3处于半满较稳定结构,P第一电离能大于S,陈述Ⅰ错误,且与陈述Ⅱ没有因果关系,B错误;
C.陈述Ⅰ与陈述Ⅱ正确,熔点、硬度与晶体类型和作用力相关,与金属性非金属性无关,二者没有因果关系,C错误;
D.晶体中,分子间只存在范德华力,采用面心立方密堆积,晶体中每个分子周围紧邻的分子是个,水分子中氧原子采用sp3杂化,冰晶体中,分子间存在的氢键具有方向性,每个分子周围紧邻的分子有个,陈述Ⅰ与陈述Ⅱ正确且有因果关系,D正确;
答案选D。
12.A
【详解】根据均摊法可推知,第一个为六方最密堆积的晶胞,此晶胞中有两个金属原子;第二个为面心立方最密堆积的晶胞,此晶胞中有4个金属原子;第三个为体心立方堆积的晶胞,此晶胞中有2个金属原子;所以原子个数比为2∶4∶2,化简为1∶2∶1,所以选A。
13. 3 d 强 三角锥形 H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+ 1s22s22p63s23p63d10(或[Ar]3d10) NH2-
【分析】(1)①反应中有4 mol N—H键断裂即消耗1mol N2H4,再根据方程式计算。
②硫酸铵含有离子键,共价键和配位键,不存在范德华力。
(2)①Se的原子半径大于S的原子半径,H2Se中Se原子对H原子的作用力较弱,先计算SO32 离子价层电子对数,再得立体构型;②H2SeO4的非羟基氧比H2SeO3的非羟基氧多。
(3)①Zn为30号元素;②根据价电子N-=O,得与H2O分子互为等电子体;③[Zn(CN)4]2 中Zn2+与CN-的C原子形成配位键,C提供孤对电子。
【详解】(1)①N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(g),根据反应方程式,反应中有4 mol N—H键断裂即消耗1mol N2H4,则生成1.5mol N2,每个氮气含有2个π键,因此形成的π键有3 mol;故答案为:3。
②硫酸铵含有离子键,共价键和配位键,不存在范德华力,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内含有离子键,共价键和配位键,不存在范德华力,故答案为:d。
(2)①Se的原子半径大于S的原子半径,H2Se中Se原子对H原子的作用力较弱,H2Se在水中更容易电离出氢离子,因此H2Se的酸性比H2S强,SO32 离子价层电子对数,其立体构型为三角锥形;故答案为:强;三角锥形。
②H2SeO4比H2SeO3酸性强的原因是H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+;故答案为:H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+。
(3)①Zn为30号元素,Zn2+基态核外电子排布式为1s22s22p63s23p63d10;故答案为:1s22s22p63s23p63d10(或[Ar]3d10)。
②根据价电子N-=O,因此与H2O分子互为等电子体的阴离子为NH2-;故答案为:NH2-。
③)[Zn(CN)4]2 中Zn2+与CN-的C原子形成配位键,C提供孤对电子,因此[Zn(CN)4]2 的结构可用示意图表示为;故答案为:。
14.
【详解】CO2是共价化合物,C原子和每个O原子形成两个共用电子对,电子式为,Ca(OH)2是由Ca2+和OH-构成的离子化合物,其电子式为,Na2O2是由Na+和构成的离子化合物,其电子式为,PCl3 是共价化合物,P原子和Cl原子形成一个共用电子对,其电子式为,CCl4是共价化合物,C原子和Cl原子形成一个共用电子对,其电子式为。
15.
【详解】晶体密度计算公式为,根据晶胞模型推出晶胞中n=8(每个晶胞中Fe3O4组合的份数),Fe3O4相对分子量为3×56+4×16=232,所以M=232g mol-1,V=(a×10-10)3cm3,Fe3O4晶体密度为。
16. VB A C sp3 小于 NH3分子间有氢键,N2分子间无氢键,致使NH3的沸点更高 Ba2YCu3O9 +11/3 a3ρNA或0.707a3ρNA
【详解】(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,在周期表的ds区,第5轨道上有电子所以位于第五周期,4d 上有4个电子和5s上有一个电子所以是在VB族;
(2)A.Ge位于元素周期表金属元素与非金属元素的分界线附近,晶体属于准金属,且为共价晶体,选项A正确;B.Ge属于p区,但不属于过渡金属,选项B错误;C.同周期元素从左到右第一电离能逐渐增大,As的4p能级含有3个电子,为半满稳定状态,第一电离能较高,则第一电离能As>Se>Ge,选项C正确;D.同主族从上到下非金属性减弱电负性减弱,则Ge的电负性比C小,选项D错误。答案选AC;
(3)Ge(CH3)2Cl2分子的中心原子Ge的价层电子对是4,其杂化方式是sp3;
(4)NH3也常作制冷剂,其分子构型是三角锥形,其键角小于109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是NH3分子间有氢键,N2分子间无氢键,致使NH3的沸点更高;
(5)晶胞内部含有2个钡原子、1个Y原子,棱上含有8个铜原子、20个O原子,顶点含有8个铜原子,面心含有8个O原子,共3个铜原子、9个O原子,图示材料的理想化学式(无空位时)为Ba2YCu3O9,若Y(钇)元素的化合价为+3,则Cu的平均化合价为;
(6)金属铜属于面心立方最密堆积,其晶胞中含有4个铜原子,Cu原子的最近距离为a cm,则晶胞边长为,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则有,故铜的相对原子质量为a3ρNA。
【点睛】本题考查较为综合,涉及元素周期律的递变规律、杂化类型的判断、晶胞的计算等知识,题目难度中等,注意有关基础知识的积累。
17. 3:1 Cu3N 2 4
【详解】(1)根据均摊原则,1个晶胞中Pt原子数是、Co原子数是,Pt与Co的个数比为3:1;
(2) 根据均摊原则,1个晶胞中Cu原子数是、N原子数是,该晶体的化学式Cu3N;
(3)根据均摊原则,则每个晶胞拥有个Ti4+、个O2-。
18.(1) 否 若是sp3杂化,[Cu(NH3)4]2+的空间结构为正四面体形,将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则只有1种结构
(2)<
(3) 四面体形 >
(4)sp2、sp3
(5) ①③ ②④
【详解】(1)将配离子[Cu(NH3)4]2+中的2个氨分子换为氰酸根离子有2种结构,说明配离子的空间构型为平面正方形,若铜离子的杂化方式为sp3杂化,配离子的空间构型为正四面体形,将配离子[Cu(NH3)4]2+中的2个氨分子换为氰酸根离子只有1种结构,所以铜离子的杂化方式不可能是sp3杂化;
(2)甲醛分子中形成碳氧双键的碳原子的杂化方式为sp2杂化,分子的空间构型为平面三角形,由价层电子对互斥理论可知,分子中双键与单键之间的斥力大于单键与单键之间的斥力,所以分子中的H—C—H的键角小于120°;
(3)SO2Cl2和SO2F2分子中硫原子的价层电子对数都为4、孤对电子对数都为0,所以两种分子的空间构型都为四面体形;氟元素的电负性大于氯元素,氟原子的得电子能力大于氯原子,与硫原子形成的共用电子对之间的斥力大于氯原子,所以SO2Cl2分子中∠Cl—S—Cl大于SO2F2分子中∠F—S—F;
(4)由结构简式可知,有机物分子中饱和碳原子的杂化方式为sp3杂化,形成双键的碳原子的杂化方式为sp2杂化;
(5)①碘的升华破坏范德华力,没有破坏化学键;
②氯化钠溶于电离出能自由移动的Na+和Cl-,破坏离子键;
③氧气溶于水没有发生化学变化,也没有化学键破坏;
④烧碱熔化变为Na+和OH-,破坏离子键;
综上所述,化学键没有被破坏的是①③;仅发生离子键破坏的是②④。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.CrSi、Ge—GaAs、ZnGeAs2和碳化硅都是重要的半导体化合物,下列说法错误的是
A.基态铬原子的价电子排布式为3d54s1
B.Ge—GaAs中元素Ge、Ga、As的第一电离能由大到小的顺序为As>Ga>Ge
C.ZnGeAs2中元素Zn、Ge、As的电负性由大到小的顺序为As>Ge>Zn
D.碳化硅属于原子晶体,其熔沸点均大于晶体硅
2.以下命题,违背化学变化规律的是
A.石墨制成金刚石 B.煤加氢变成人造石油
C.水变成汽油 D.干冰转化成原子晶体
3.下列关于金属的叙述中正确的是( )
A.常温下所有的金属都是固态
B.金属具有导电、导热和延展性
C.金属都具有较高的硬度和密度
D.金属都具有较高的熔点和沸点
4.下列有关性质的比较,正确的是
A.第一电离能:O>N B.水溶性:CH3CH2OH>CH3CH2OCH2CH3
C.沸点:HCl>HF D.晶格能:NaCl>MgO
5.下列有关晶胞的叙述错误的是( )
A.晶胞是晶体结构中最小的重复单元 B.不同晶体中晶胞的大小和形状不一定相同
C.晶胞中的任何一个粒子都完全属于该晶胞 D.已知晶胞的结构可推知晶体的组成
6.下列关于物质熔点的排列顺序不正确的是
A.生铁>纯铁>钠 B.
C. D.
7.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出。下列关于此化合物的说法正确的是
A.该配合物的配位原子是N B.中心离子是Pt6+
C.配合物的中心离子配位数为6 D.该配合物可能是正方形结构
8.能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
A.、、的熔点 B.、、的氧化性
C.、、的颜色 D.、、的酸性
9.下列变化过程只需要破坏共价键的是
A.碘升华 B.金刚石熔化 C.金属钠熔融 D.氯化钠溶于水
10.有关离子晶体的下列说法不正确的是
A.离子晶体在熔融状态时都能导电
B.离子晶体具有较高的熔、沸点,较大的硬度
C.离子晶体中阴、阳离子个数比为1∶1
D.氯化钠溶于水时离子键被破坏
11.下列陈述Ⅰ和陈述Ⅱ均正确并且存在因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
某晶体熔点低,硬度小,不导电 该晶体是离子晶体
、的第一电离能依次增大 、的最外层电子数依次增多
金刚石、硅、锗的熔点、硬度依次降低 C、、的非金属性依次减弱,金属性依次增强
在晶体中,每个分子周围紧邻的分子有个;在冰晶体中,每个分子周围紧邻的分子有个 晶体中,分子间只存在范德华力;冰晶体中,分子间存在氢键,氢键具有方向性
A. B. C. D.
12.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,下图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为
A.1∶2∶1 B.11∶8∶4 C.9∶8∶4 D.9∶14∶9
二、填空题
13.(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在___(填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(2)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答:
①H2Se的酸性比H2S________(填“强”或“弱”),SO32-离子的立体构型为________。
②H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:H2SeO4比H2SeO3酸性强的原因:__________。
(3)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为___________________。
②与H2O分子互为等电子体的阴离子为________。
③)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为____________。
14.写出下列物质的电子式:
CO2___________、Ca(OH)2___________、Na2O2___________、PCl3 ___________、CCl4___________。
15.已知该晶体的晶胞参数apm,阿伏加德罗常数的值为N A,则该晶体的密度为d =_______g·cm-3(用含a和N A的代数式表示)。
16.1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______族
(2)下列关于Ge元素叙述正确的是______(从下列选项中选择)
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________
(4)NH3也常作制冷剂,其键角_______(填“大于”或“小于”)109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是___________________________
(5)图示材料的理想化学式(无空位时)为___________________,若Y(钇)元素的化合价为+3,则Cu的平均化合价为_______
(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为________ (只含一个系数,用a、ρ、NA表示)。
17.(1)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图1所示,该金属间化合物的中Pt与Co的个数比为___________。
(2)室温下,[Cu(NH3)4](NO3)2,与液氨混合并加入Cu可制得一种黑绿色晶体。黑绿色晶体的晶胞如图2所示,写出该晶体的化学式___________。
(3)如图3所示的是金红石的晶胞,则每个晶胞拥有___________个Ti4+、___________个O2-。
18.回答下列问题:
(1)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化?_______(填“是”或“否”),理由为_______。
(2)用价电子对互斥理论推断甲醛中H—C—H的键角_______120 °(填“>”“<”或“=”)。
(3)SO2Cl2和SO2F2都属于AX4E0型分子,S=O之间以双键结合,S—Cl、S—F之间以单键结合。请你预测SO2Cl2和SO2F2分子的空间结构为_______。SO2Cl2分子中∠Cl—S—Cl_______SO2F2分子中∠F—S—F(填“<”“>”或“=”)。
(4)抗坏血酸的分子结构如图所示,该分子中碳原子的杂化轨道类型为_______。
(5)下列变化:①碘的升华;②氯化钠溶于水;③氧气溶于水;④烧碱熔化。化学键没有被破坏的是_______(填序号,下同);仅发生离子键破坏的是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.铬元素的原子序数24,基态铬原子的价电子排布式为3d54s1,故A正确;
B.同周期元素,从左到右第一电离能呈增大趋势,则第一电离能As>Ge>Ga,故B错误;
C.非金属元素的电负性强于金属元素,金属元素的金属性越强,电负性越小,砷为非金属元素,锌的金属性强于锗元素,则电负性由大到小的顺序为As>Ge>Zn,故C正确;
D.原子晶体的熔沸点取决于共价键的强弱,碳化硅、晶体硅均属于原子晶体,碳硅键的键能大于硅硅键、键长小于硅硅键,则熔沸点碳化硅均大于晶体硅,故D正确;
故选B。
2.C
【详解】化学反应的实质是旧化学键的断裂与新化学键的形成,化学反应中,元素的种类不会发生改变;水中没有碳元素,不可能转化为碳原子为C5~C11的烃的汽油,故选C。
3.B
【详解】A.金属Hg常温下为液体,A错误;
B.金属是热和电的良导体,金属具有延展性,B正确;
C.多数的金属具有较高的硬度和密度,金属钠质软且密度比水小,C错误;
D.多数的金属具有较高的熔点和沸点,少数金属如Hg不具有较高的熔沸点,D错误;
答案选B。
4.B
【详解】A.N原子2P能级为半充满状态,结构稳定,第一电离能:O
C.HF分子间能形成氢键,沸点:HCl
5.C
【详解】A.晶胞是晶体中的最小的结构重复单元,A项正确;
B.不同的晶体中晶胞的大小和形状不一定都相同,B项正确;
C.晶胞中的任何一个粒子不一定都完全属于该晶胞,如体心立方晶胞,立方体顶点的原子属于该晶胞的只有,C项错误;
D.已知晶胞的结构可推知晶体的组成,D项正确;
答案选C。
【点睛】该题是基础性试题的考查,主要是考查学生对晶胞结构的了解掌握情况,意在巩固学生的基础,提高学生的能力,有利于培养学生的抽象思维能力和发散思维能力。
6.A
【详解】A.生铁为铁合金,熔点要低于纯铁,A错误;
B.物质均为分子晶体,且组成与结构相似,相对分子质量越大,熔沸点越高,B正确;
C.物质均为离子晶体,离子半径越小,离子键键能越大,熔点越高,离子半径,故熔点:,而阳离子半径:,故熔点:,C正确;
D.MgO属于离子晶体,H2O和O2属于分子晶体,一般熔点:离子晶体>分子晶体, 故MgO的熔点高于H2O和O2,H2O分子间存在氢键常温下呈液态,熔点比O2高,D正确;
故选A。
7.C
【分析】该物质加入AgNO3溶液不产生沉淀,用强碱处理没有NH3放出,说明该物质不存在游离的氯离子和铵根离子,所以该物质的配位化学式为[PtCl4(NH3)2]。
【详解】A.由分析可知,Cl-和NH3分子均与Pt4+配位,该配合物的配位原子是N和Cl-,故A错误;
B.由分析可知,中心离子是Pt4+,故B错误;
C.由该物质的配位化学式为[PtCl4(NH3)2]可知,该配合物中中心离子的配位数为6,故C正确;
D.该物质的配位化学式为[PtCl4(NH3)2],配位数为6,则该配合物是八面体结构,不可能是平面正方形结构,故D错误;
故答案选C。
8.B
【分析】同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强。
【详解】A.Cl2、Br2、I2都是由分子构成的物质,分子之间作用力越强,克服分子间作用力使物质熔化或气化消耗的能量就越大,物质的熔点、沸点就越高,与元素的非金属性强弱无关,故A不符合题意;
B.元素的非金属性越强,该元素形成的单质的氧化性就越强,所以可根据Cl2、Br2、I2的氧化性强弱判断Cl、Br、I的元素的非金属性强弱,故B符合题意;
C.元素形成的单质的颜色是物质的物理性质,与元素的非金属性强弱无关,故C不符合题意;
D.元素的非金属性越强,其形成的最高价氧化物对应的水化物的酸性越强,不能通过比较氢化物水溶液的酸性比较元素非金属性强弱,故D不符合题意;
答案选B。
9.B
【详解】A.碘升华破坏的是分子间作用力,A错误;
B.金刚石中碳碳之间是共价键,融化的时候,需要破坏共价键,B正确;
C.金属钠属于金属晶体,融化的时候破坏的是金属键,C错误;
D.氯化钠中存在着钠离子和氯离子之间的离子键,溶于水时破坏的是离子键,D错误;
故选B。
10.C
【详解】A.离子晶体在熔融状态时含有自由离子,能导电,故A正确;
B.由正、负离子或正、负离子基团按一定比例通过离子键结合形成的晶体称作离子晶体,离子晶体一般硬而脆,具有较高的熔沸点,故B正确;
C.离子晶体如Na2O2晶体中阳离子为Na+、阴离子为过氧根离子,所以Na2O2晶体中阴阳离子个数之比为1:2,故C错误;
D.NaCl溶于水时,NaCl在水分子作用下发生电离生成钠离子、氯离子,所以离子键被破坏,故D正确;
故选:C。
11.D
【详解】A.根据某晶体熔点低,硬度小,不导电,推出该晶体是分子晶体,陈述Ⅱ不成立,A错误;
B.P的3p3处于半满较稳定结构,P第一电离能大于S,陈述Ⅰ错误,且与陈述Ⅱ没有因果关系,B错误;
C.陈述Ⅰ与陈述Ⅱ正确,熔点、硬度与晶体类型和作用力相关,与金属性非金属性无关,二者没有因果关系,C错误;
D.晶体中,分子间只存在范德华力,采用面心立方密堆积,晶体中每个分子周围紧邻的分子是个,水分子中氧原子采用sp3杂化,冰晶体中,分子间存在的氢键具有方向性,每个分子周围紧邻的分子有个,陈述Ⅰ与陈述Ⅱ正确且有因果关系,D正确;
答案选D。
12.A
【详解】根据均摊法可推知,第一个为六方最密堆积的晶胞,此晶胞中有两个金属原子;第二个为面心立方最密堆积的晶胞,此晶胞中有4个金属原子;第三个为体心立方堆积的晶胞,此晶胞中有2个金属原子;所以原子个数比为2∶4∶2,化简为1∶2∶1,所以选A。
13. 3 d 强 三角锥形 H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+ 1s22s22p63s23p63d10(或[Ar]3d10) NH2-
【分析】(1)①反应中有4 mol N—H键断裂即消耗1mol N2H4,再根据方程式计算。
②硫酸铵含有离子键,共价键和配位键,不存在范德华力。
(2)①Se的原子半径大于S的原子半径,H2Se中Se原子对H原子的作用力较弱,先计算SO32 离子价层电子对数,再得立体构型;②H2SeO4的非羟基氧比H2SeO3的非羟基氧多。
(3)①Zn为30号元素;②根据价电子N-=O,得与H2O分子互为等电子体;③[Zn(CN)4]2 中Zn2+与CN-的C原子形成配位键,C提供孤对电子。
【详解】(1)①N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(g),根据反应方程式,反应中有4 mol N—H键断裂即消耗1mol N2H4,则生成1.5mol N2,每个氮气含有2个π键,因此形成的π键有3 mol;故答案为:3。
②硫酸铵含有离子键,共价键和配位键,不存在范德华力,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内含有离子键,共价键和配位键,不存在范德华力,故答案为:d。
(2)①Se的原子半径大于S的原子半径,H2Se中Se原子对H原子的作用力较弱,H2Se在水中更容易电离出氢离子,因此H2Se的酸性比H2S强,SO32 离子价层电子对数,其立体构型为三角锥形;故答案为:强;三角锥形。
②H2SeO4比H2SeO3酸性强的原因是H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+;故答案为:H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+。
(3)①Zn为30号元素,Zn2+基态核外电子排布式为1s22s22p63s23p63d10;故答案为:1s22s22p63s23p63d10(或[Ar]3d10)。
②根据价电子N-=O,因此与H2O分子互为等电子体的阴离子为NH2-;故答案为:NH2-。
③)[Zn(CN)4]2 中Zn2+与CN-的C原子形成配位键,C提供孤对电子,因此[Zn(CN)4]2 的结构可用示意图表示为;故答案为:。
14.
【详解】CO2是共价化合物,C原子和每个O原子形成两个共用电子对,电子式为,Ca(OH)2是由Ca2+和OH-构成的离子化合物,其电子式为,Na2O2是由Na+和构成的离子化合物,其电子式为,PCl3 是共价化合物,P原子和Cl原子形成一个共用电子对,其电子式为,CCl4是共价化合物,C原子和Cl原子形成一个共用电子对,其电子式为。
15.
【详解】晶体密度计算公式为,根据晶胞模型推出晶胞中n=8(每个晶胞中Fe3O4组合的份数),Fe3O4相对分子量为3×56+4×16=232,所以M=232g mol-1,V=(a×10-10)3cm3,Fe3O4晶体密度为。
16. VB A C sp3 小于 NH3分子间有氢键,N2分子间无氢键,致使NH3的沸点更高 Ba2YCu3O9 +11/3 a3ρNA或0.707a3ρNA
【详解】(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,在周期表的ds区,第5轨道上有电子所以位于第五周期,4d 上有4个电子和5s上有一个电子所以是在VB族;
(2)A.Ge位于元素周期表金属元素与非金属元素的分界线附近,晶体属于准金属,且为共价晶体,选项A正确;B.Ge属于p区,但不属于过渡金属,选项B错误;C.同周期元素从左到右第一电离能逐渐增大,As的4p能级含有3个电子,为半满稳定状态,第一电离能较高,则第一电离能As>Se>Ge,选项C正确;D.同主族从上到下非金属性减弱电负性减弱,则Ge的电负性比C小,选项D错误。答案选AC;
(3)Ge(CH3)2Cl2分子的中心原子Ge的价层电子对是4,其杂化方式是sp3;
(4)NH3也常作制冷剂,其分子构型是三角锥形,其键角小于109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是NH3分子间有氢键,N2分子间无氢键,致使NH3的沸点更高;
(5)晶胞内部含有2个钡原子、1个Y原子,棱上含有8个铜原子、20个O原子,顶点含有8个铜原子,面心含有8个O原子,共3个铜原子、9个O原子,图示材料的理想化学式(无空位时)为Ba2YCu3O9,若Y(钇)元素的化合价为+3,则Cu的平均化合价为;
(6)金属铜属于面心立方最密堆积,其晶胞中含有4个铜原子,Cu原子的最近距离为a cm,则晶胞边长为,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则有,故铜的相对原子质量为a3ρNA。
【点睛】本题考查较为综合,涉及元素周期律的递变规律、杂化类型的判断、晶胞的计算等知识,题目难度中等,注意有关基础知识的积累。
17. 3:1 Cu3N 2 4
【详解】(1)根据均摊原则,1个晶胞中Pt原子数是、Co原子数是,Pt与Co的个数比为3:1;
(2) 根据均摊原则,1个晶胞中Cu原子数是、N原子数是,该晶体的化学式Cu3N;
(3)根据均摊原则,则每个晶胞拥有个Ti4+、个O2-。
18.(1) 否 若是sp3杂化,[Cu(NH3)4]2+的空间结构为正四面体形,将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则只有1种结构
(2)<
(3) 四面体形 >
(4)sp2、sp3
(5) ①③ ②④
【详解】(1)将配离子[Cu(NH3)4]2+中的2个氨分子换为氰酸根离子有2种结构,说明配离子的空间构型为平面正方形,若铜离子的杂化方式为sp3杂化,配离子的空间构型为正四面体形,将配离子[Cu(NH3)4]2+中的2个氨分子换为氰酸根离子只有1种结构,所以铜离子的杂化方式不可能是sp3杂化;
(2)甲醛分子中形成碳氧双键的碳原子的杂化方式为sp2杂化,分子的空间构型为平面三角形,由价层电子对互斥理论可知,分子中双键与单键之间的斥力大于单键与单键之间的斥力,所以分子中的H—C—H的键角小于120°;
(3)SO2Cl2和SO2F2分子中硫原子的价层电子对数都为4、孤对电子对数都为0,所以两种分子的空间构型都为四面体形;氟元素的电负性大于氯元素,氟原子的得电子能力大于氯原子,与硫原子形成的共用电子对之间的斥力大于氯原子,所以SO2Cl2分子中∠Cl—S—Cl大于SO2F2分子中∠F—S—F;
(4)由结构简式可知,有机物分子中饱和碳原子的杂化方式为sp3杂化,形成双键的碳原子的杂化方式为sp2杂化;
(5)①碘的升华破坏范德华力,没有破坏化学键;
②氯化钠溶于电离出能自由移动的Na+和Cl-,破坏离子键;
③氧气溶于水没有发生化学变化,也没有化学键破坏;
④烧碱熔化变为Na+和OH-,破坏离子键;
综上所述,化学键没有被破坏的是①③;仅发生离子键破坏的是②④。
答案第1页,共2页
答案第1页,共2页
