第三章《晶体结构与性质》检测题(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章《晶体结构与性质》检测题(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 379.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-12 20:35:01 | ||
图片预览




文档简介
第三章《晶体结构与性质》检测题
一、单选题
1.下列说法正确的是
A.固体中含有
B.碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力
C.金刚石和C60熔点相差很大是因为两者所含化学键类型不同
D.常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构
2.下列各组物质中,按沸点由低到高的顺序排列正确的是
A.H2O、H2S、H2Se、H2Te
B.CH4、CCl4、CBr4、CI4
C.金刚石、P4、O2
D.碳化硅、二氧化硅、晶体硅
3.向盛有天蓝色水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后浓度不变
B.溶液呈天蓝色是因为存在,该离子的空间结构为正四面体
C.深蓝色的配离子为,说明比稳定
D.若向反应后的溶液加入乙醇,将会有晶体析出
4.钛有“二十一世纪的金属”、“全能金属”、“现代金属”的美称。镁与熔融的四氯化钛反应可制取钛:2Mg+TiCl42MgCl2+Ti。下列说法正确的是
A.中子数为14的镁原子:
B.Cl 结构示意图:
C.MgCl2的电子式:
D.TiCl4熔点是 25℃,沸点是136.4℃,可溶于苯和CCl4,该晶体属于离子晶体
5.下列晶体中,金属阳离子与“自由电子”间的作用最强的是
A. B. C. D.
6.设NA为阿伏加德罗常数的值,下列说法正确的是
A.60gSiO2中的Si-O共价键的数目为2NA
B.1molI中心原子上的价层电子对数目为2NA
C.1mol苯乙醛分子中含π键的数目为4NA
D.25℃时,1L pH =12的氨水中含有OH-数目为0.01NA
7.以下比较中正确的是
A.微粒半径:O2-Na>K>Rb
C.分子中的键角:CH4>H2O>CO2 D.共价键的键能:C—C>C—Si>Si—Si
8.缺电子化合物是指电子数不符合路易斯结构(一个原子通过共用电子使其价层电子数达到8,H原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法错误的是( )
A.NH3、BF3、CCl4中只有BF3是缺电子化合物
B.BF3、CCl4中心原子的杂化方式分别为sp2、sp3
C.BF3与NH3反应时有配位键生成
D.CCl4的键角小于NH3
9.下列说法中,正确的是
A.同类型原子晶体中,共价键的键长越短,键能越大,熔点就越高
B.金属晶体的熔、沸点一定比分子晶体的高
C.分子内共价键越强,分子热稳定性越强,其晶体熔沸点越高
D.离子晶体离子键越强,熔沸点越高,导电能力越强
10.某超分子的结构如图所示,下列有关超分子的描述不正确的是
A.超分子就是高分子
B.超分子的特征是分子识别和分子自组装
C.图示中的超分子是两个不同的分子通过氢键形成的分子聚集体
D.图示中的超分子中的N原子采取sp2、sp3两种杂化方式
11.已知钼(Mo)的晶胞如图所示,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏伽德罗常数的值。
(1)钼晶体的堆积方式为_______________,晶体中粒子的配位数为________________。
(2)构成钼晶体的粒子是__________________,晶胞中所含的粒子数为___________。
(3)金属钼的密度为______________g·cm-3。
二、填空题
12.铜单质及其化合物在很多领域都有着重要用途,如金属铜可用来制造各项体育赛事的奖牌、电线、电缆,胆矾可用作杀菌剂等。试回答下列问题。
(1)已知Cu位于元素周期表第四周期第ⅠB族,则Cu原子的价电子排布式为___________。
(2)下列关于[Cu(NH3)4]SO4的说法中,正确的有___________
A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.[Cu(NH3)4]SO4中含有NH3分子,其水溶液中也含有NH3分子
C.[Cu(NH3)4]SO4的配体空间构型为正四面体形
D.[Cu(NH3)4]SO4的外界离子的空间构型为三角锥形
(3)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液。下列对此现象叙述正确的是___________
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后生成深蓝色的[Cu(NH3)4]2+
C.若硫酸铜溶液中混有少量硫酸,则可用氨水除去硫酸铜溶液中的硫酸
D.在[Cu(NH3)4]2+中,Cu2+提供孤电子对,NH3提供空轨道
13.根据要求填空(选填序号):
(1)以下有机物,分子结构呈平面正六边形的是____________;一定条件下,均能与、、反应的是_________;可用作果实催熟剂的是___________。
①甲烷 ②乙烯 ③苯 ④乙醇 ⑤乙酸
(2)以下有机物,含ⅤA族元素的是__________;不属于有机高分子化合物的是_____________。
①蔗糖 ②纤维素 ③淀粉 ④油脂 ⑤蛋白质
(3)以下晶体,存在分子间作用力的共价化合物是_________;存在共价键的离子晶体是_________。
①晶体 ②晶体 ③晶体 ④干冰 ⑤水晶
14.下列物质:①干冰 ②铜 ③碳酸氢钠 ④C60 ⑤石英 ⑥氯化钠 ⑦晶体硅 ⑧钠
属于离子晶体的是___________(填序号,下同);属于分子晶体的是___________;属于共价晶体的是___________;属于金属晶体的是___________。
15.铁元素是最重要的金属元素之一,很多含铁化合物具有重要作用。
(1)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。
①与N同周期的主族元素中,第一电离能比N大的元素是_______。
②[Fe(SCN)(H2O)5]2+中该配离子中配位体是_______,Fe3+的配位数为_______。
(2)血红素结构如图所示,在图中画出Fe2+与N原子间的化学键_______(若是配位键,需要用箭头加以表示),血红素中C原子的杂化方式是_______。
(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:①r(Fe2+)为61pm,r(Co2+)为65pm。②隔绝空气加热:FeCO3FeO+CO2↑,CoCO3CoO+CO2↑分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是_______。
16.回答下列问题:
(1)硅和卤素单质反应可以得到,的熔沸点如下表:
熔点/K 183 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
、、、沸点依次升高的原因是___________。
(2)肥皂的主要成分是硬脂酸钠,在水溶液中电离成和。将沾了油污的衣物擦上肥皂搓洗时,将衣物洗净的去污原理是___________。
17.(1)分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2 200℃,熔融态不导电________;
B.溴化铝,无色晶体,熔点98℃,熔融态不导电________;
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中________;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电________。
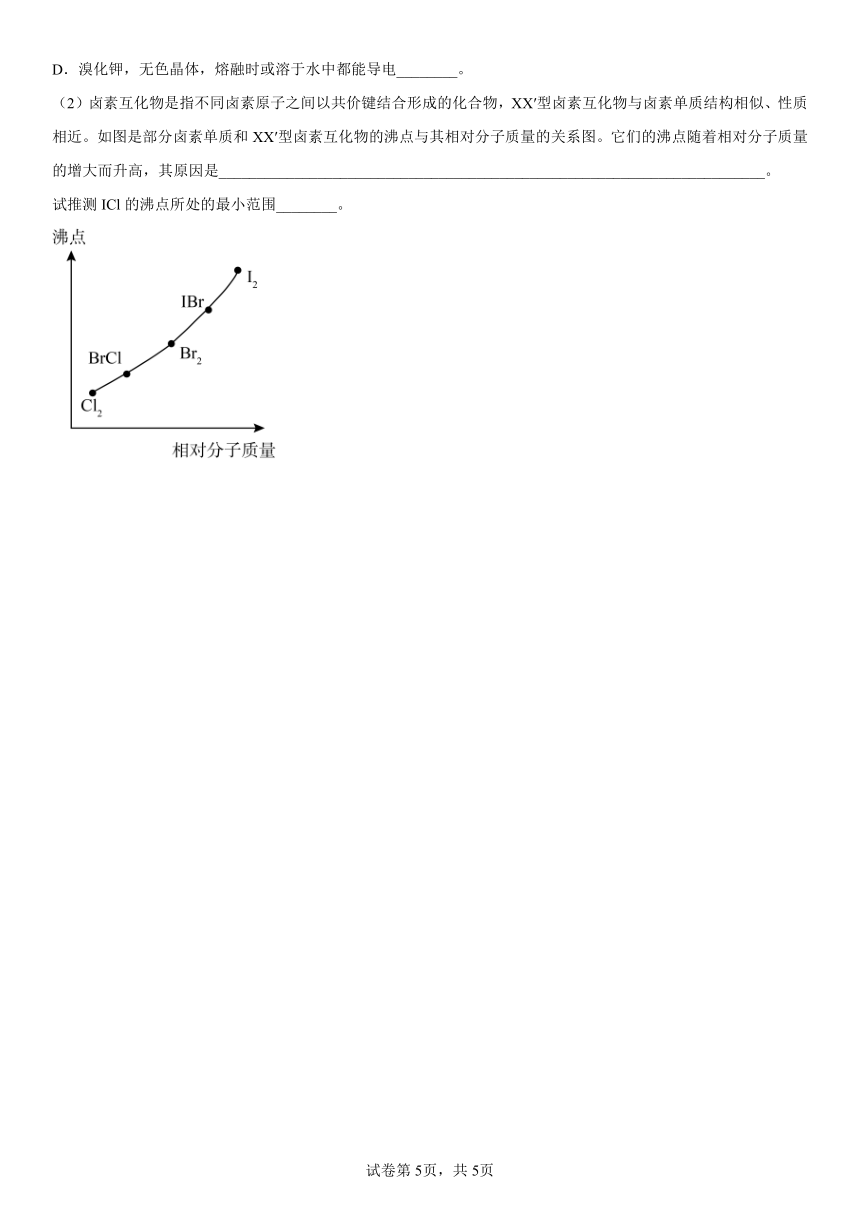
(2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX′型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是________________________________________________________________________。
试推测ICl的沸点所处的最小范围________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.固体由铵根离子和氯离子构成,固体中含有,A正确;
B.碘晶体受热转变为碘蒸气,破坏的是分子间作用力,故吸收的热量用于克服碘分子间的作用力,B错误;
C.金刚石和C60中的化学键均为共价键,熔点相差很大是因为两者晶体类型不同,金刚石为原子晶体,C60为分子晶体,C错误;
D.气态单质分子氢气,每个原子的最外层不满足8电子稳定结构,D错误;
故选A。
2.B
【详解】A.H2O、H2S、H2Se、H2Te均是分子晶体,但分子间存在氢键,其沸点反常,A错误;
B.CH4、CCl4、CBr4、CI4均是分子晶体,且分子组成和结构相似,分子间不存在氢键,故相对分子质量越大,分子间作用力越强,沸点越高,可知沸点,B正确;
C.一般地,共价晶体的沸点高于分子晶体的沸点,在常温常压下,为固体,为气体,所以沸点金刚石,C错误;
D.三者均为原子晶体,键长,键能,故碳化硅的沸点应比晶体硅的高,D错误;
故选B。
3.C
【详解】A.[硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物而使溶液澄清,所以溶液中铜离子浓度减小,A错误;
B.溶液呈天蓝色是因为存在,形成4个配位键,具有对称的空间结构,为平面正方形,B错误;
C.通过题意分析可知,深蓝色的配离子为,说明比稳定,C正确;
D.乙醇极性小于水,络合物在乙醇中溶解度较小,若向反应后的溶液加入乙醇,将会有晶体析出而不是,D错误;
故选C。
4.C
【详解】A.原子符号左下角为质子数,左上角为质量数,质量数等于质子数与中子数的和,则中子数为14的镁原子的质量数是26,用原子符号表示为:,A错误;
B.Cl 核外电子排布是2、8、8,所以Cl-的结构示意图为,B错误;
C.MgCl2是离子化合物,2个Cl-与Mg2+之间以离子键结合,故MgCl2的电子式:,C正确;
D.TiCl4熔点是 25℃,沸点是136.4℃,物质的熔沸点比较低,说明构成物质的微粒之间的作用力比较小,可溶于苯和CCl4,根据相似相溶原理可知该晶体是由分子通过分子间作用力构成的分子晶体,因此物质的晶体类型为分子晶体,D错误;
故合理选项是C。
5.C
【分析】同周期从左向右金属性减弱,结合金属活动性顺序表、元素周期律解答。
【详解】Na、Mg、Al位于同周期,结合金属活动性顺序可知,金属性为K>Na>Mg>Al,则金属性最强的为Na,钠最容易失去电子,金属阳离子与“自由电子”间的作用最强的是Al,电子越难失去。
也可从离子半径铝离子最小,铝离子带的电荷最大,对电子的引力越大来理解。
故选C。
6.D
【详解】A. 60g SiO2物质的量为1mol,1mol SiO2的Si-O共价键的数目为4NA,故A错误;
B. 以其中一个I原子为中心原子,I中心原子上的价层电子对数目为,故1molI中心原子上的价层电子对数目为4NA,故B错误;
C.苯乙醛分子中的苯环含有一个大π键,醛基含有一个π键,故1mol苯乙醛分子中含π键的数目为2NA,故C错误;
D. 25℃时,pH =12的氨水中OH-浓度为0.01mol/L,则1L pH =12的氨水中含有OH-数目为0.01NA,故D正确;
故选D。
7.D
【详解】A.离子核外电子层数越多,半径越大,O2-、F-、Na+核外电子排布相同,核电荷数越大,离子半径越小,则应为O2->F->Na+,A错误;
B.同一主族,从上到下,金属性逐渐增强,故金属性:LiC.CH4为正四面体结构,其中的键角为109°28′,H2O为V形结构,其中的键角为104.5゜,CO2为直线形结构,其中的键角为180゜,则分子中的键角:H2O<CH4<CO2,C错误;
D.原子半径C-C<C-Si<Si-Si,原子晶体中原子半径越小,键长越短,则键能越大,D正确;
故选D。
8.D
【详解】A.NH3电子式为,符合路易斯结构,BF3电子式为,B原子价层电子数为6,不符合路易斯结构,CCl4电子式为、,符合路易斯结构,只有BF3是缺电子化合物,故A正确;
B.BF3中心原子B价层电子对数为3+× (3-3×1)=3,则杂化方式为sp2杂化;CCl4中心原子C价层电子对数为4+×(4-4×1)=4,则杂化方式为sp3杂化,故B正确;
C.BF3与NH3反应时,NH3中N原子有孤电子对,BF3中B有空轨道,可生成配位键,故C正确;
D.CCl4和NH3均为sp3杂化,CCl4中心原子无孤电子对,NH3有一对孤电子对,根据价层电子对互斥理论,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,键角减小,则CCl4的键角大于NH3,故D错误;
故答案选:D。
9.A
【详解】A.同类型共价(原子)晶体中,共价键的键长越短,共价键越强,键能越大,熔点就越高,A正确;
B.金属晶体的熔、沸点一搬比分子晶体的高,但也有特例,如Hg的熔沸点就比硫晶体的低,B错误;
C.分子内共价键越强,分子热稳定性越强,但熔沸点与共价键无关,与分子间作用力、是否含有氢键有关,C错误;
D.离子晶体在固态时不能导电,在溶液中或熔融状态下才可以导电,D错误;
故选A。
10.A
【详解】A.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,超分子不同于高分子,A错误;
B.超分子的特征是分子识别和分子自组装,例如细胞和细胞器的双分子膜具有自组装性质,生物体的细胞即是由各种生物分子自组装而成,B正确;
C.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,图示中的超分子是两个不同的分子通过氢键形成的分子聚集体,C正确;
D.图示中的超分子中的N原子有双键、单键,则采取sp2、sp3杂化,D正确;
故选A。
11. 面心立方最密堆积 12 金属离子、自由电子 4
【分析】根据晶胞中原子的排列判断堆积方式;以顶点Mo原子判断距离最近的Mo原子数,确定配位数;均摊法确定晶胞中含有的粒子数;根据晶胞的质量和体积计算密度。
【详解】(1)如图金属钼晶体中的原子堆积方式中,Mo原子处于立方体的面心与顶点,属于面心立方最密堆积;顶点Mo原子到面心Mo原子的距离最短,则钼原子的配位数为12;
(2)金属晶体的成键粒子为金属离子和自由电子,故构成钼晶体的粒子是金属离子和自由电子;晶胞中所含的该种粒子数为6×+8×=4;
(3)晶胞的质量为g,钼原子半径为a pm=a×10-10cm,晶胞的边长为×10-10cm,则晶胞的体积为=(×10-10)3cm3,金属钼的密度为g·cm-3=g·cm-3。
12. A B
【详解】(1)已知Cu位于元素周期表第四周期第ⅠB族,则Cu原子的价电子排布式为。
(2)A.[Cu(NH3)4]SO4中,硫酸根离子和铜氨离子之间存在离子键,铜离子和氨分子之间存在配位键,氮原子和氢原子之间存在极性键,硫酸根离子中存在极性键,故A正确;
B.[Cu(NH3)4]SO4中,氨分子和铜离子之间通过配位键形成了配合离子,不存在单独的NH3分子,其水溶液中也不含有大量NH3分子,故B错误;
C.[Cu(NH3)4]SO4的配体是氨分子、其空间构型为三角锥形,故C错误;
D.[Cu(NH3)4]SO4的外界离子为硫酸根离子,其中心原子的孤电子对=、价层电子对数为4+0=4,则其空间构型为正四面体形,故D错误;
正确的有A。
(3)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物即氢氧化铜沉淀,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液,因为发生了反应:。则:
A.反应后,铜离子转化到配合离子中,所以溶液中铜离子浓度减小,故A错误;
B.由反应方程式知:沉淀溶解后生成深蓝色的[Cu(NH3)4]2+,B正确;
C.氨水能与硫酸铜反应,所以不能用氨水除去硫酸铜溶液中的硫酸,故C错误;
D.氨分子的氮原子有1对孤电子对,在[Cu(NH3)4]2+中,Cu2+提供空轨道,NH3提供孤电子对,通过配位键形成配合离子,故D错误;
则叙述正确的是B。
13. ③ ⑤ ② ⑤ ①④ ④ ②
【详解】(1)苯分子结构呈平面正六边形;一定条件下,乙酸分子中羧基上的氢原子能电离出来,使其水溶液显酸性,乙酸具有酸的通性,均能与、、反应,乙醇分子中羟基上的氢原子不能电离出来,不能与、反应,但是可被活泼金属,如钠,置换出氢气;乙烯可用作果实催熟剂;
(2)蔗糖、纤维素、淀粉、油脂均只含C、H、O三种元素,蛋白质一定含有C、H、O、N四种元素,还可能含有S、P等元素,故含第ⅤA族元素的是蛋白质;高分子化合物的相对分子质量在一万以上,蔗糖、油脂不属于有机高分子化合物;
(3)①晶体为单质,②晶体为离子晶体,由铵根离子和氯离子构成,铵根离子中氮原子与氢原子间形成共价键;③晶体为离子晶体,由钙离子和氯离子构成,不含有共价键;④干冰为分子晶体,分子间存在分子间作用力,且其为共价化合物;⑤水晶为原子晶体;故存在分子间作用力的共价化合物是干冰;存在共价键的离子晶体是。
【点睛】淀粉、纤维素、蛋白质、核酸为高分子化合物,而油脂不属于高分子化合物,这是学生们的易错点,学生们总是误认为油脂也是高分子化合物。
14. ③⑥ ①④ ⑤⑦ ②⑧
【详解】①干冰是由CO2分子通过分子间作用力结合形成的分子晶体;
②铜是由金属阳离子与自由电子之间以金属键结合形成的金属晶体;
③碳酸氢钠是由Na+与通过离子键结合形成的离子晶体;
④C60是由C60分子通过分子间作用力结合形成的分子晶体;
⑤石英是由Si原子与O原子通过共价键结合形成的共价晶体;
⑥氯化钠是由Na+与Cl-通过离子键结合形成的离子晶体;
⑦晶体硅是由Si原子通过通过共价键结合形成的共价晶体;
⑧金属钠是由Na+与自由移动之间以金属键结合而成的金属晶体。
根据上述分析可知:属于离子晶体的是③⑥;属于分子晶体的是①④;属于共价晶体的是⑤⑦;属于金属晶体的是②⑧。
15.(1) F SCN-、H2O 6
(2) sp2、sp3
(3)FeO和CoO都是离子晶体,r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeO比CoO更稳定,FeCO3比CoCO3易分解,即FeCO3的分解温度低于CoCO3
【详解】(1)①同周期随原子序数增大,元素第一电离能呈增大趋势,但IIA族、VA族元素原子具有全充满或半充满稳定结构,第一电离能高于同周期相邻元素的,与N同周期的主族元素中,第一电离能比N大的元素是F元素,故答案为:F;
②[Fe(SCN)(H2O)5]2+中配体是SCN-、H2O,Fe3+的配位数为1+5=6,故答案为:SCN-、H2O;6;
(2)Fe2+具有空轨道,N原子有孤电子对,形成双键的N原子与Fe2+之间形成配位键,另外N原子形成普通键,Fe2+与N原子间的化学键为:,双键中碳原子形成3个σ,其它碳原子形成4个σ,均没有孤电子对,杂化轨道数目分别为3、4,分别采取sp2、sp3杂化,故答案为:;sp2、sp3;
(3)FeO和CoO都是离子晶体,r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeO比CoO更稳定,FeCO3比CoCO3易分解,即FeCO3的分解温度低于CoCO3,故答案为:FeO和CoO都是离子晶体,r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeO比CoO更稳定,FeCO3比CoCO3易分解,即FeCO3的分解温度低于CoCO3。
16.(1)都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大
(2)是亲油基团,一头拉着油,是亲水基团,另一头拉着水,将油污拖入水
【分析】(1)
由图标中的熔沸点可知,都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大。
(2)
硬脂酸钠,在水溶液中电离成和,是亲油基团,一头拉着油,是亲水基团,另一头拉着水,将油污拖入水。
17. 原子晶体 分子晶体 分子晶体 离子晶体 相对分子质量越大,分子间的作用力越强 介于Br2的沸点和IBr的沸点之间
【详解】(1)A.原子晶体的熔点很高,熔融时不导电,已知碳化铝,黄色晶体,熔点2200℃,熔融态不导电,则碳化铝为原子晶体;
B.分子晶体的熔点较低,易溶于有机溶剂,熔融时不导电,已知溴化铝,无色晶体,熔点98℃,熔融态不导电,则溴化铝是分子晶体;
C.分子晶体的熔点较低,易溶于有机溶剂,已知五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、四氯化碳溶液等有机溶剂,说明五氟化钒是分子晶体;
D.离子晶体熔融时或水溶液都能导电,已知溴化钾,无色晶体,熔融时或溶于水中都能导电,则溴化钾是离子晶体;
(2)卤素单质和卤素互化物结构相似,均为分子晶体,相对分子质量越大,分子间的作用力越强,沸点越高;根据相对分子质量可知,ICl的沸点所处的最小范围介于Br2的沸点和IBr的沸点之间。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列说法正确的是
A.固体中含有
B.碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力
C.金刚石和C60熔点相差很大是因为两者所含化学键类型不同
D.常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构
2.下列各组物质中,按沸点由低到高的顺序排列正确的是
A.H2O、H2S、H2Se、H2Te
B.CH4、CCl4、CBr4、CI4
C.金刚石、P4、O2
D.碳化硅、二氧化硅、晶体硅
3.向盛有天蓝色水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后浓度不变
B.溶液呈天蓝色是因为存在,该离子的空间结构为正四面体
C.深蓝色的配离子为,说明比稳定
D.若向反应后的溶液加入乙醇,将会有晶体析出
4.钛有“二十一世纪的金属”、“全能金属”、“现代金属”的美称。镁与熔融的四氯化钛反应可制取钛:2Mg+TiCl42MgCl2+Ti。下列说法正确的是
A.中子数为14的镁原子:
B.Cl 结构示意图:
C.MgCl2的电子式:
D.TiCl4熔点是 25℃,沸点是136.4℃,可溶于苯和CCl4,该晶体属于离子晶体
5.下列晶体中,金属阳离子与“自由电子”间的作用最强的是
A. B. C. D.
6.设NA为阿伏加德罗常数的值,下列说法正确的是
A.60gSiO2中的Si-O共价键的数目为2NA
B.1molI中心原子上的价层电子对数目为2NA
C.1mol苯乙醛分子中含π键的数目为4NA
D.25℃时,1L pH =12的氨水中含有OH-数目为0.01NA
7.以下比较中正确的是
A.微粒半径:O2-
C.分子中的键角:CH4>H2O>CO2 D.共价键的键能:C—C>C—Si>Si—Si
8.缺电子化合物是指电子数不符合路易斯结构(一个原子通过共用电子使其价层电子数达到8,H原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法错误的是( )
A.NH3、BF3、CCl4中只有BF3是缺电子化合物
B.BF3、CCl4中心原子的杂化方式分别为sp2、sp3
C.BF3与NH3反应时有配位键生成
D.CCl4的键角小于NH3
9.下列说法中,正确的是
A.同类型原子晶体中,共价键的键长越短,键能越大,熔点就越高
B.金属晶体的熔、沸点一定比分子晶体的高
C.分子内共价键越强,分子热稳定性越强,其晶体熔沸点越高
D.离子晶体离子键越强,熔沸点越高,导电能力越强
10.某超分子的结构如图所示,下列有关超分子的描述不正确的是
A.超分子就是高分子
B.超分子的特征是分子识别和分子自组装
C.图示中的超分子是两个不同的分子通过氢键形成的分子聚集体
D.图示中的超分子中的N原子采取sp2、sp3两种杂化方式
11.已知钼(Mo)的晶胞如图所示,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏伽德罗常数的值。
(1)钼晶体的堆积方式为_______________,晶体中粒子的配位数为________________。
(2)构成钼晶体的粒子是__________________,晶胞中所含的粒子数为___________。
(3)金属钼的密度为______________g·cm-3。
二、填空题
12.铜单质及其化合物在很多领域都有着重要用途,如金属铜可用来制造各项体育赛事的奖牌、电线、电缆,胆矾可用作杀菌剂等。试回答下列问题。
(1)已知Cu位于元素周期表第四周期第ⅠB族,则Cu原子的价电子排布式为___________。
(2)下列关于[Cu(NH3)4]SO4的说法中,正确的有___________
A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.[Cu(NH3)4]SO4中含有NH3分子,其水溶液中也含有NH3分子
C.[Cu(NH3)4]SO4的配体空间构型为正四面体形
D.[Cu(NH3)4]SO4的外界离子的空间构型为三角锥形
(3)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液。下列对此现象叙述正确的是___________
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后生成深蓝色的[Cu(NH3)4]2+
C.若硫酸铜溶液中混有少量硫酸,则可用氨水除去硫酸铜溶液中的硫酸
D.在[Cu(NH3)4]2+中,Cu2+提供孤电子对,NH3提供空轨道
13.根据要求填空(选填序号):
(1)以下有机物,分子结构呈平面正六边形的是____________;一定条件下,均能与、、反应的是_________;可用作果实催熟剂的是___________。
①甲烷 ②乙烯 ③苯 ④乙醇 ⑤乙酸
(2)以下有机物,含ⅤA族元素的是__________;不属于有机高分子化合物的是_____________。
①蔗糖 ②纤维素 ③淀粉 ④油脂 ⑤蛋白质
(3)以下晶体,存在分子间作用力的共价化合物是_________;存在共价键的离子晶体是_________。
①晶体 ②晶体 ③晶体 ④干冰 ⑤水晶
14.下列物质:①干冰 ②铜 ③碳酸氢钠 ④C60 ⑤石英 ⑥氯化钠 ⑦晶体硅 ⑧钠
属于离子晶体的是___________(填序号,下同);属于分子晶体的是___________;属于共价晶体的是___________;属于金属晶体的是___________。
15.铁元素是最重要的金属元素之一,很多含铁化合物具有重要作用。
(1)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。
①与N同周期的主族元素中,第一电离能比N大的元素是_______。
②[Fe(SCN)(H2O)5]2+中该配离子中配位体是_______,Fe3+的配位数为_______。
(2)血红素结构如图所示,在图中画出Fe2+与N原子间的化学键_______(若是配位键,需要用箭头加以表示),血红素中C原子的杂化方式是_______。
(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:①r(Fe2+)为61pm,r(Co2+)为65pm。②隔绝空气加热:FeCO3FeO+CO2↑,CoCO3CoO+CO2↑分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是_______。
16.回答下列问题:
(1)硅和卤素单质反应可以得到,的熔沸点如下表:
熔点/K 183 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
、、、沸点依次升高的原因是___________。
(2)肥皂的主要成分是硬脂酸钠,在水溶液中电离成和。将沾了油污的衣物擦上肥皂搓洗时,将衣物洗净的去污原理是___________。
17.(1)分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2 200℃,熔融态不导电________;
B.溴化铝,无色晶体,熔点98℃,熔融态不导电________;
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中________;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电________。
(2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX′型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是________________________________________________________________________。
试推测ICl的沸点所处的最小范围________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.固体由铵根离子和氯离子构成,固体中含有,A正确;
B.碘晶体受热转变为碘蒸气,破坏的是分子间作用力,故吸收的热量用于克服碘分子间的作用力,B错误;
C.金刚石和C60中的化学键均为共价键,熔点相差很大是因为两者晶体类型不同,金刚石为原子晶体,C60为分子晶体,C错误;
D.气态单质分子氢气,每个原子的最外层不满足8电子稳定结构,D错误;
故选A。
2.B
【详解】A.H2O、H2S、H2Se、H2Te均是分子晶体,但分子间存在氢键,其沸点反常,A错误;
B.CH4、CCl4、CBr4、CI4均是分子晶体,且分子组成和结构相似,分子间不存在氢键,故相对分子质量越大,分子间作用力越强,沸点越高,可知沸点,B正确;
C.一般地,共价晶体的沸点高于分子晶体的沸点,在常温常压下,为固体,为气体,所以沸点金刚石,C错误;
D.三者均为原子晶体,键长,键能,故碳化硅的沸点应比晶体硅的高,D错误;
故选B。
3.C
【详解】A.[硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物而使溶液澄清,所以溶液中铜离子浓度减小,A错误;
B.溶液呈天蓝色是因为存在,形成4个配位键,具有对称的空间结构,为平面正方形,B错误;
C.通过题意分析可知,深蓝色的配离子为,说明比稳定,C正确;
D.乙醇极性小于水,络合物在乙醇中溶解度较小,若向反应后的溶液加入乙醇,将会有晶体析出而不是,D错误;
故选C。
4.C
【详解】A.原子符号左下角为质子数,左上角为质量数,质量数等于质子数与中子数的和,则中子数为14的镁原子的质量数是26,用原子符号表示为:,A错误;
B.Cl 核外电子排布是2、8、8,所以Cl-的结构示意图为,B错误;
C.MgCl2是离子化合物,2个Cl-与Mg2+之间以离子键结合,故MgCl2的电子式:,C正确;
D.TiCl4熔点是 25℃,沸点是136.4℃,物质的熔沸点比较低,说明构成物质的微粒之间的作用力比较小,可溶于苯和CCl4,根据相似相溶原理可知该晶体是由分子通过分子间作用力构成的分子晶体,因此物质的晶体类型为分子晶体,D错误;
故合理选项是C。
5.C
【分析】同周期从左向右金属性减弱,结合金属活动性顺序表、元素周期律解答。
【详解】Na、Mg、Al位于同周期,结合金属活动性顺序可知,金属性为K>Na>Mg>Al,则金属性最强的为Na,钠最容易失去电子,金属阳离子与“自由电子”间的作用最强的是Al,电子越难失去。
也可从离子半径铝离子最小,铝离子带的电荷最大,对电子的引力越大来理解。
故选C。
6.D
【详解】A. 60g SiO2物质的量为1mol,1mol SiO2的Si-O共价键的数目为4NA,故A错误;
B. 以其中一个I原子为中心原子,I中心原子上的价层电子对数目为,故1molI中心原子上的价层电子对数目为4NA,故B错误;
C.苯乙醛分子中的苯环含有一个大π键,醛基含有一个π键,故1mol苯乙醛分子中含π键的数目为2NA,故C错误;
D. 25℃时,pH =12的氨水中OH-浓度为0.01mol/L,则1L pH =12的氨水中含有OH-数目为0.01NA,故D正确;
故选D。
7.D
【详解】A.离子核外电子层数越多,半径越大,O2-、F-、Na+核外电子排布相同,核电荷数越大,离子半径越小,则应为O2->F->Na+,A错误;
B.同一主族,从上到下,金属性逐渐增强,故金属性:Li
D.原子半径C-C<C-Si<Si-Si,原子晶体中原子半径越小,键长越短,则键能越大,D正确;
故选D。
8.D
【详解】A.NH3电子式为,符合路易斯结构,BF3电子式为,B原子价层电子数为6,不符合路易斯结构,CCl4电子式为、,符合路易斯结构,只有BF3是缺电子化合物,故A正确;
B.BF3中心原子B价层电子对数为3+× (3-3×1)=3,则杂化方式为sp2杂化;CCl4中心原子C价层电子对数为4+×(4-4×1)=4,则杂化方式为sp3杂化,故B正确;
C.BF3与NH3反应时,NH3中N原子有孤电子对,BF3中B有空轨道,可生成配位键,故C正确;
D.CCl4和NH3均为sp3杂化,CCl4中心原子无孤电子对,NH3有一对孤电子对,根据价层电子对互斥理论,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,键角减小,则CCl4的键角大于NH3,故D错误;
故答案选:D。
9.A
【详解】A.同类型共价(原子)晶体中,共价键的键长越短,共价键越强,键能越大,熔点就越高,A正确;
B.金属晶体的熔、沸点一搬比分子晶体的高,但也有特例,如Hg的熔沸点就比硫晶体的低,B错误;
C.分子内共价键越强,分子热稳定性越强,但熔沸点与共价键无关,与分子间作用力、是否含有氢键有关,C错误;
D.离子晶体在固态时不能导电,在溶液中或熔融状态下才可以导电,D错误;
故选A。
10.A
【详解】A.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,超分子不同于高分子,A错误;
B.超分子的特征是分子识别和分子自组装,例如细胞和细胞器的双分子膜具有自组装性质,生物体的细胞即是由各种生物分子自组装而成,B正确;
C.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,图示中的超分子是两个不同的分子通过氢键形成的分子聚集体,C正确;
D.图示中的超分子中的N原子有双键、单键,则采取sp2、sp3杂化,D正确;
故选A。
11. 面心立方最密堆积 12 金属离子、自由电子 4
【分析】根据晶胞中原子的排列判断堆积方式;以顶点Mo原子判断距离最近的Mo原子数,确定配位数;均摊法确定晶胞中含有的粒子数;根据晶胞的质量和体积计算密度。
【详解】(1)如图金属钼晶体中的原子堆积方式中,Mo原子处于立方体的面心与顶点,属于面心立方最密堆积;顶点Mo原子到面心Mo原子的距离最短,则钼原子的配位数为12;
(2)金属晶体的成键粒子为金属离子和自由电子,故构成钼晶体的粒子是金属离子和自由电子;晶胞中所含的该种粒子数为6×+8×=4;
(3)晶胞的质量为g,钼原子半径为a pm=a×10-10cm,晶胞的边长为×10-10cm,则晶胞的体积为=(×10-10)3cm3,金属钼的密度为g·cm-3=g·cm-3。
12. A B
【详解】(1)已知Cu位于元素周期表第四周期第ⅠB族,则Cu原子的价电子排布式为。
(2)A.[Cu(NH3)4]SO4中,硫酸根离子和铜氨离子之间存在离子键,铜离子和氨分子之间存在配位键,氮原子和氢原子之间存在极性键,硫酸根离子中存在极性键,故A正确;
B.[Cu(NH3)4]SO4中,氨分子和铜离子之间通过配位键形成了配合离子,不存在单独的NH3分子,其水溶液中也不含有大量NH3分子,故B错误;
C.[Cu(NH3)4]SO4的配体是氨分子、其空间构型为三角锥形,故C错误;
D.[Cu(NH3)4]SO4的外界离子为硫酸根离子,其中心原子的孤电子对=、价层电子对数为4+0=4,则其空间构型为正四面体形,故D错误;
正确的有A。
(3)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物即氢氧化铜沉淀,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液,因为发生了反应:。则:
A.反应后,铜离子转化到配合离子中,所以溶液中铜离子浓度减小,故A错误;
B.由反应方程式知:沉淀溶解后生成深蓝色的[Cu(NH3)4]2+,B正确;
C.氨水能与硫酸铜反应,所以不能用氨水除去硫酸铜溶液中的硫酸,故C错误;
D.氨分子的氮原子有1对孤电子对,在[Cu(NH3)4]2+中,Cu2+提供空轨道,NH3提供孤电子对,通过配位键形成配合离子,故D错误;
则叙述正确的是B。
13. ③ ⑤ ② ⑤ ①④ ④ ②
【详解】(1)苯分子结构呈平面正六边形;一定条件下,乙酸分子中羧基上的氢原子能电离出来,使其水溶液显酸性,乙酸具有酸的通性,均能与、、反应,乙醇分子中羟基上的氢原子不能电离出来,不能与、反应,但是可被活泼金属,如钠,置换出氢气;乙烯可用作果实催熟剂;
(2)蔗糖、纤维素、淀粉、油脂均只含C、H、O三种元素,蛋白质一定含有C、H、O、N四种元素,还可能含有S、P等元素,故含第ⅤA族元素的是蛋白质;高分子化合物的相对分子质量在一万以上,蔗糖、油脂不属于有机高分子化合物;
(3)①晶体为单质,②晶体为离子晶体,由铵根离子和氯离子构成,铵根离子中氮原子与氢原子间形成共价键;③晶体为离子晶体,由钙离子和氯离子构成,不含有共价键;④干冰为分子晶体,分子间存在分子间作用力,且其为共价化合物;⑤水晶为原子晶体;故存在分子间作用力的共价化合物是干冰;存在共价键的离子晶体是。
【点睛】淀粉、纤维素、蛋白质、核酸为高分子化合物,而油脂不属于高分子化合物,这是学生们的易错点,学生们总是误认为油脂也是高分子化合物。
14. ③⑥ ①④ ⑤⑦ ②⑧
【详解】①干冰是由CO2分子通过分子间作用力结合形成的分子晶体;
②铜是由金属阳离子与自由电子之间以金属键结合形成的金属晶体;
③碳酸氢钠是由Na+与通过离子键结合形成的离子晶体;
④C60是由C60分子通过分子间作用力结合形成的分子晶体;
⑤石英是由Si原子与O原子通过共价键结合形成的共价晶体;
⑥氯化钠是由Na+与Cl-通过离子键结合形成的离子晶体;
⑦晶体硅是由Si原子通过通过共价键结合形成的共价晶体;
⑧金属钠是由Na+与自由移动之间以金属键结合而成的金属晶体。
根据上述分析可知:属于离子晶体的是③⑥;属于分子晶体的是①④;属于共价晶体的是⑤⑦;属于金属晶体的是②⑧。
15.(1) F SCN-、H2O 6
(2) sp2、sp3
(3)FeO和CoO都是离子晶体,r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeO比CoO更稳定,FeCO3比CoCO3易分解,即FeCO3的分解温度低于CoCO3
【详解】(1)①同周期随原子序数增大,元素第一电离能呈增大趋势,但IIA族、VA族元素原子具有全充满或半充满稳定结构,第一电离能高于同周期相邻元素的,与N同周期的主族元素中,第一电离能比N大的元素是F元素,故答案为:F;
②[Fe(SCN)(H2O)5]2+中配体是SCN-、H2O,Fe3+的配位数为1+5=6,故答案为:SCN-、H2O;6;
(2)Fe2+具有空轨道,N原子有孤电子对,形成双键的N原子与Fe2+之间形成配位键,另外N原子形成普通键,Fe2+与N原子间的化学键为:,双键中碳原子形成3个σ,其它碳原子形成4个σ,均没有孤电子对,杂化轨道数目分别为3、4,分别采取sp2、sp3杂化,故答案为:;sp2、sp3;
(3)FeO和CoO都是离子晶体,r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeO比CoO更稳定,FeCO3比CoCO3易分解,即FeCO3的分解温度低于CoCO3,故答案为:FeO和CoO都是离子晶体,r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeO比CoO更稳定,FeCO3比CoCO3易分解,即FeCO3的分解温度低于CoCO3。
16.(1)都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大
(2)是亲油基团,一头拉着油,是亲水基团,另一头拉着水,将油污拖入水
【分析】(1)
由图标中的熔沸点可知,都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大。
(2)
硬脂酸钠,在水溶液中电离成和,是亲油基团,一头拉着油,是亲水基团,另一头拉着水,将油污拖入水。
17. 原子晶体 分子晶体 分子晶体 离子晶体 相对分子质量越大,分子间的作用力越强 介于Br2的沸点和IBr的沸点之间
【详解】(1)A.原子晶体的熔点很高,熔融时不导电,已知碳化铝,黄色晶体,熔点2200℃,熔融态不导电,则碳化铝为原子晶体;
B.分子晶体的熔点较低,易溶于有机溶剂,熔融时不导电,已知溴化铝,无色晶体,熔点98℃,熔融态不导电,则溴化铝是分子晶体;
C.分子晶体的熔点较低,易溶于有机溶剂,已知五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、四氯化碳溶液等有机溶剂,说明五氟化钒是分子晶体;
D.离子晶体熔融时或水溶液都能导电,已知溴化钾,无色晶体,熔融时或溶于水中都能导电,则溴化钾是离子晶体;
(2)卤素单质和卤素互化物结构相似,均为分子晶体,相对分子质量越大,分子间的作用力越强,沸点越高;根据相对分子质量可知,ICl的沸点所处的最小范围介于Br2的沸点和IBr的沸点之间。
答案第1页,共2页
答案第1页,共2页
