第四章物质结构元素周期律单元测试(含解析)2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章物质结构元素周期律单元测试(含解析)2022-2023学年高一上学期化学人教版(2019)必修第一册 | 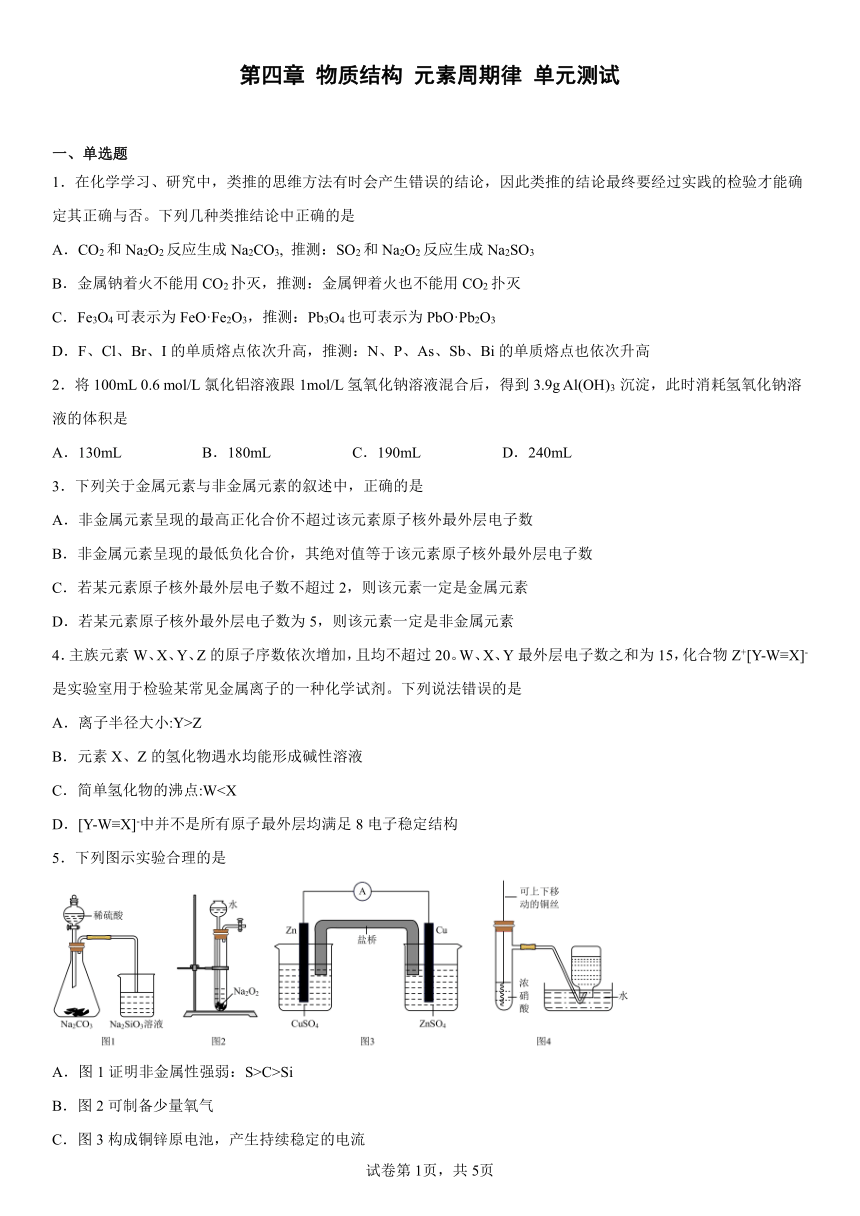 | |
| 格式 | docx | ||
| 文件大小 | 266.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-12 20:37:04 | ||
图片预览




文档简介
第四章 物质结构 元素周期律 单元测试
一、单选题
1.在化学学习、研究中,类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A.CO2和Na2O2反应生成Na2CO3, 推测:SO2和Na2O2反应生成Na2SO3
B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
C.Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3
D.F、Cl、Br、I的单质熔点依次升高,推测:N、P、As、Sb、Bi的单质熔点也依次升高
2.将100mL 0.6 mol/L氯化铝溶液跟1mol/L氢氧化钠溶液混合后,得到3.9g Al(OH)3 沉淀,此时消耗氢氧化钠溶液的体积是
A.130mL B.180mL C.190mL D.240mL
3.下列关于金属元素与非金属元素的叙述中,正确的是
A.非金属元素呈现的最高正化合价不超过该元素原子核外最外层电子数
B.非金属元素呈现的最低负化合价,其绝对值等于该元素原子核外最外层电子数
C.若某元素原子核外最外层电子数不超过2,则该元素一定是金属元素
D.若某元素原子核外最外层电子数为5,则该元素一定是非金属元素
4.主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,化合物Z+[Y-W≡X]-是实验室用于检验某常见金属离子的一种化学试剂。下列说法错误的是
A.离子半径大小:Y>Z
B.元素X、Z的氢化物遇水均能形成碱性溶液
C.简单氢化物的沸点:WD.[Y-W≡X]-中并不是所有原子最外层均满足8电子稳定结构
5.下列图示实验合理的是
A.图1证明非金属性强弱:S>C>Si
B.图2可制备少量氧气
C.图3构成铜锌原电池,产生持续稳定的电流
D.图4可制备并收集NO2气体
6.下列叙述正确的是
A.碱金属单质与水反应时都能生成强碱和氢气
B.Cl2可以从NaBr水溶液中置换出溴单质,可类推F2可以从NaCl水溶液中置换出氯单质
C.碱金属单质在空气中燃烧的生成物都是过氧化物
D.HX的还原性顺序为:HF>HCl>HBr>HI
7.下列关于氯元素相应微粒的叙述正确的是
A.35Cl和37Cl是两种不同的元素
B.氯离子(Cl-)的结构示意图:
C.液氯能储存在钢瓶中,说明氯气与铁不反应
D.NaCl溶液是非电解质
8.锝()是核医学临床诊断中应用最广的医用核素,这里的“99”是指该原子的
A.质子数 B.中子数 C.质量数 D.相对原子质量
9.短周期主族元素X、Y、Z、W的原子序数依次增大。Z原子2p轨道上有3个未成对电子。甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下已溶液显中性,它们转化关系如图所示,则下列说法中错误的是
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.W的氢化物中的某一种具有漂白性
C.丙的电子式为
D.W的氢化物沸点一定比Y的氢化物沸点高
10.下列说法不正确的是
A.H、D、T互为同位素 B.H2O、H2O2互为同素异形体
C.正丁烷和异丁烷互为同分异构体 D.CH4和C3H8互为同系物
11.下列说法正确的是
A.MgCl2晶体中的化学键是共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.干冰构成微粒为分子,其溶于水生成碳酸的过程只需克服分子间作用力
12.49号铟元素的相关计算式为:113×4.3%+115×95.7%=114.9。说法正确的是
A.113是铟元素的质量数 B.某种同位素原子符号为In
C.95.7%是铟元素的丰度 D.114.9表示铟元素的近似相对原子质量
二、填空题
13.自然界的矿物,岩石的成因和变化受到许多条件的影响。地壳内每增加1 km,压强增大约25000~30000kPa,在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g) SiF4(g)+2H2O(g)。
(1)SiF4的结构式为___________,用电子式表示H2O的形成过程___________
(2)以上反应在地壳的那个区域先达到化学平衡状态___________(选填编号,下同)。
A.地壳表层 B.地壳深层
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到化学平衡状态时,___________
A.2v正(HF)=v逆(H2O) B.c(HF)与c(H2O)之比保持不变
C.SiO2的质量保持不变 D.反应物不再转化为生成物
(4)若反应的容器容积为2.0 L,反应时间8.0min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为___________
14.据报道,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将给量子计算机的研究带来重大突破。已知铷是37号元素。根据相关知识回答下列问题:
(1)铷(Rb)位于元素周期表的第________周期________族。
(2)关于铷的结构和性质判断正确的是________(填序号)。
①与水反应比钠剧烈
②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁相同
⑤它是还原剂
(3)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是________(填序号)。
a.Li b.Na
c.K d.Cs
15.某化学兴趣小组为了研究部分ⅥA族元素及其化合物的部分性质,查阅资料如下:
①酸性:;
②O、S、与的化合越来越难,与不能直接化合;
③由不同元素的单质生成等物质的量的氢化物的焓变情况如图所示。
请回答下列问题:
(1)S与的化合反应_________(填“吸收”或“放出”)热量。
(2)已知的分解反应的,请解释与不能直接化合的原因______________。
(3)题述信息中能说明S的非金属性强于的是_________(填序号)。
16.用符号A:质子数,B:中子数,C:核外电子数,D:最外层电子数,E:电子层数,填写下列各空。
(1)原子种类由_____决定。
(2)元素的种类由_____决定
(3)元素的化合价主要由____决定
(4)核电荷数由_____决定。
17.在中学实验中学过的可用于分离或提纯物质的方法很多,如①过滤、②蒸发结晶,③降温结晶,④蒸馏,⑤萃取,⑥分液等。请将分离或提纯下列各混合物最适宜的方法名称的序号填入横线上。
(1)除去粗盐中的泥沙___________。
(2)从饱和食盐水中提取食盐___________。
(3)分离植物油和水___________。
(4)用CCl4溶液提取碘水中的碘___________。
18.已知元素X、Y、Z、W的原子序数分别为6、8、11、13,请回答:
(1)写出下列元素符号Z___________;
(2)写出下列元素在周期表中的位置W_______________;
(3)写出下列反应方程式:X单质在足量Y单质中反应_________________________。
19.1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,表中所列的字母分别代表某一化学元素。回答下列问题:
(1)元素B在元素周期表中的位置是第____周期第_____族,A、B、C三种元素原子半径从大到小的顺序是_________________;(填元素符号)
(2)D简单离子的结构示意图为_____________,用电子式表示D2C的形成过程_______。
(3)下列说法正确的是( )(填序号)
①B的简单气态氢化物比C的稳定
②D元素的最高价氧化物对应的水化物的碱性比E的强
③D元素的单质与水反应比E元素的单质与水反应更剧烈
④B的简单阴离子比C的简单阴离子还原性强
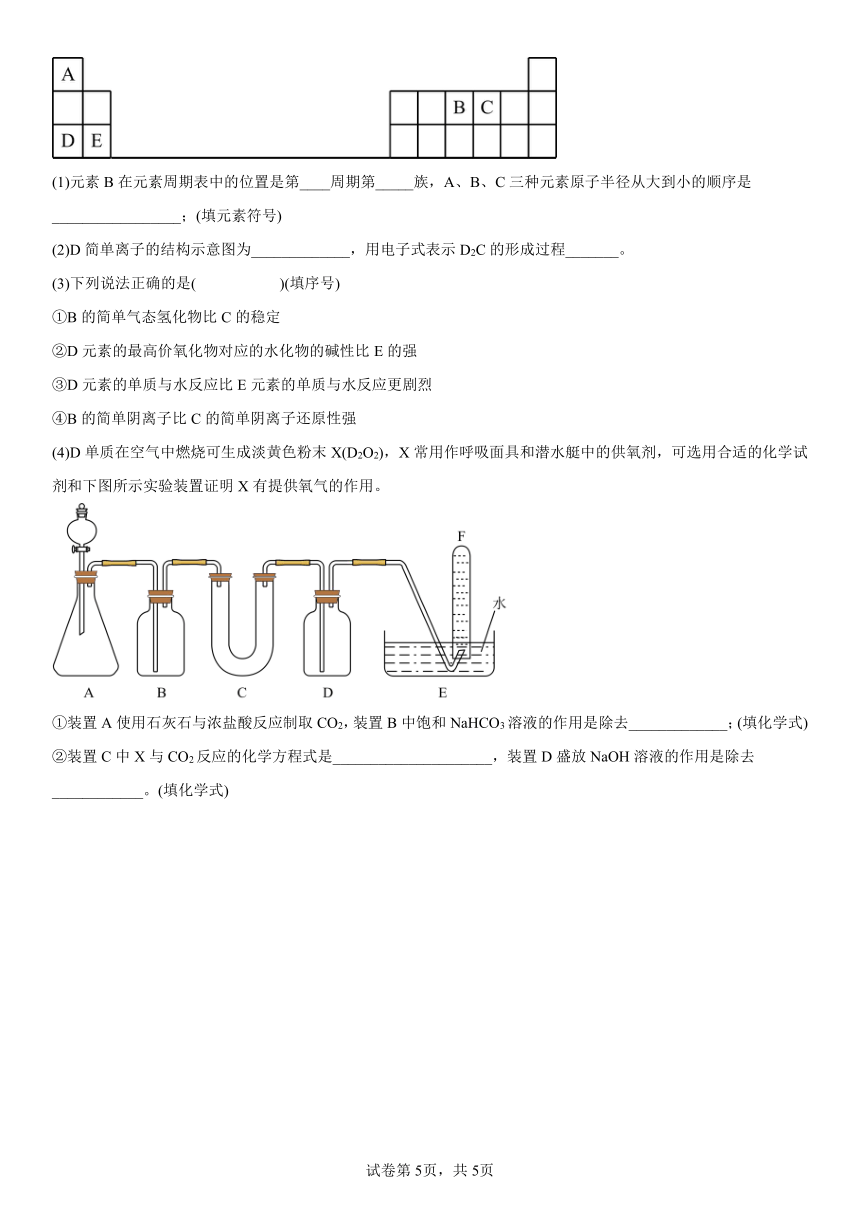
(4)D单质在空气中燃烧可生成淡黄色粉末X(D2O2),X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。
①装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去_____________;(填化学式)
②装置C中X与CO2反应的化学方程式是_____________________,装置D盛放NaOH溶液的作用是除去____________。(填化学式)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.SO2有还原性,Na2O2有强氧化性,二者发生氧化还原反应生成Na2SO4,A错误;
B.钠燃烧生成的过氧化钠能和二氧化碳反应生成氧气助燃,钾燃烧生成的过氧化钾、超氧化钾也能和二氧化碳反应产生氧气助燃,所以金属钠着火不能用CO2扑灭,金属钾着火也不能用CO2扑灭,B正确;
C.Fe3O4中铁的化合价+2价、+3价,可看作“混合氧化物”,可改写成FeO Fe2O3,Pb在化合物里显+2价和+4价,根据化合价代数和为零的原则,Pb的+2价和+4价两种氧化物形式为PbO和PbO2,则Pb3O4的氧化物的表示形式可以写成2PbO PbO2,C错误;
D.N、P、As为非金属单质,熔点升高,但是,Sb的熔点630.74℃、Bi的熔点271℃,D错误。
答案选B。
2.C
【详解】氯化铝的物质的量=0.1L×0.6mol/L=0.06mol,最终生成的氢氧化铝的质量是3.9g,物质的量==0.05mol<0.06mol,这说明反应中铝元素没有完全转化为氢氧化铝沉淀,如果氯化铝过量,则根据方程式可知:
Al3+ + 3OH-=Al(OH)3↓
1mol 3mol 1mol
0.05mol 0.15mol 0.05mol
所以消耗氢氧化钠溶液的体积==0.15L=150mL;
如果反应中氯元素部分转化为AlO2-,则根据方程式可知
Al3+ + 3OH-=Al(OH)3↓
1mol 3mol 1mol
0.06mol 0.18mol 0.06mol
其中又被氢氧化钠溶液溶解的氢氧化铝是0.06mol-0.05mol=0.01mol
Al(OH)3 + OH-=AlO2-+2H2O
1mol 1mol
0.01mol 0.01mol
则最终消耗氢氧化钠的物质的量是0.18mol+0.01mol=0.19mol
因此消耗氢氧化钠溶液的体积==0.19L=190mL,所以答案选C。
3.A
【详解】A.主族元素的最高正化合价等于该元素原子的最外层电子数,非金属元素呈现的最高正化合价不超过该元素原子核外最外层电子数,故A正确;
B.非金属元素呈现的最低负化合价,其绝对值=8-该元素原子核外最外层电子数,故B错误;
C.He原子最外层有2个电子,若某元素原子核外最外层电子数不超过2,则该元素不一定是金属元素,故C错误;
D.若某元素原子核外最外层电子数为5,则该元素不一定是非金属元素,如51号元素锑(Sb)是金属元素,故D错误;
选A。
4.D
【分析】根据题干信息,W、X、Y、Z为原子序数依次增加且均不超过20的主族元素,W、X、Y最外层电子数之和为15,化合物Z+[Y-W≡X]-是实验室用于检验某常见金属离子的一种化学试剂,根据结构式可知,Z为第ⅠA族原子,W为第ⅣA族元素,X为第ⅤA族元素,则该化合物可能为KSCN,因此W为C元素,X为N元素,Y为S元素,Z为K元素,据此分析解答。
【详解】A.S2-和K+的核外电子层数相同,核电荷数K>S,则离子半径:S2->K+,A选项正确;
B.X为N元素,Z为K元素,两者的氢化物分别为NH3和KH,NH3与遇水形成NH3·H2O,显碱性,KH遇水形成KOH,显碱性,B选项正确;
C.NH3分子间可形成氢键,因此沸点高于CH4,C选项正确;
D.[S-C≡N]-中所有原子最外层均满足8电子稳定结构,D选项错误;
答案选D。
5.A
【详解】A.发生强酸制取弱酸的反应,可知酸性为硫酸>碳酸>硅酸,则非金属性为S>C>Si,A正确;
B.过氧化钠为粉末固体,不能使反应随时停止,则图中装置不能制备少量氧气,B错误;
C.左烧杯中发生化学反应,不能形成原电池,则不能产生持续稳定的电流,硫酸铜与硫酸锌溶液应该相互对换,C错误;
D.二氧化氮与水反应,不能用排水法收集,D错误;
故选A。
6.A
【详解】A. 碱金属是活泼的金属,其单质与水反应时都能生成强碱和氢气,A正确;
B. Cl2可以从NaBr水溶液中置换出溴单质,由于F是最活泼的非金属,其单质极易与水反应,则F2不能从NaCl水溶液中置换出氯单质,B错误;
C. 碱金属单质在空气中燃烧的生成物不一定都是过氧化物,例如Li只有Li2O一种氧化物,C错误;
D. 同主族从上到下非金属性逐渐减弱,氢化物的还原性逐渐增强,则HX的还原性顺序为:HF<HCl<HBr<HI,D错误。
答案选A。
7.B
【详解】A.两种原子质子数相同中子数不同,均为氯元素,是同种元素,A错误;
B.氯离子的结构示意图正确,B正确;
C.氯气与铁在点燃或加热条件下可以反应,C错误;
D.氯化钠溶液既不是电解质也不是非电解质,D错误;
故选B。
8.C
【详解】的质量数为99,质子数为43,该原子核内中子数=质量数-质子数=99-43=56,质量数是原子的相对原子质量近似整数值,因此“99”是指该原子的质量数或相对原子质量近似整数值,故选C。
【点睛】本题的易错点为D,要正确区分相对原子质量与质量数的关系。
9.D
【分析】短周期主族元素X、Y、Z、W的原子序数依次增大,Z原子2p轨道上有3个未成对电子,是N,甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,甲为乙醇,乙醇含有C、H、O元素,X为H,Y为C,W为O,乙醇可以和氧气反应生成乙醛和水,丙为乙醛,已为水,丙和氧气生成乙酸,丁为乙酸,戊是Z和X组成的10电子分子,为氨气,常温下已溶液显中性,为醋酸铵,X、Y、Z、W四种元素分别为H、C、N、O,然后分析。
【详解】A.X、Y、Z、W四种元素分别为H、C、N、O,同周期从左到右原子半径逐渐减小,原子半径由大到小的顺序为:Y>Z>W>X,故A正确;
B.W是O,它的氢化物中的某一种是过氧化氢,具有强氧化性,具有漂白性,故B正确;
C.丙是乙醛,分子中含有醛基,含有碳氧双键,电子式为 ,故C正确;
D.W的氢化物可能为过氧化氢或过氧化氢,Y的氢化物可能为苯,过氧化氢或过氧化氢的沸点低于苯,故D错误;
答案选D。
10.B
【详解】A.H、D、T原子分别是氢元素的不同原子,故其互为同位素,故A正确;
B.H2O、H2O2是氢元素构成的不同氧化物,不是同素异形体,故B错误;
C.正丁烷和异丁烷分子式相同,均为C4H10,结构不同,因此它们互为同分异构体,故C正确;
D.CH4和C3H8结构相似,都属于烷烃,且分子组成相差2个CH2,因此互为同系物,故D正确。
答案选B。
11.C
【详解】A.MgCl2晶体中只含镁离子和氯离子形成的离子键,A错误;
B.金属单质在熔融状态下也可以导电,但不含离子键,B错误;
C.N2的电子式为,Cl2的电子式为,两种分子中,每个原子的最外层都具有8电子稳定结构,C正确;
D.干冰是分子晶体,其溶于水生成碳酸的过程除了需克服分子间作用力外,还需要克服共价键,D错误;
综上所述答案为C。
12.D
【分析】49号铟元素近似相对原子质量为:113×4.3%+115×95.7%=114.9,是同位素所占丰度和原子的质量数计算得到的平均值,说明铟元素存在两种同位素,质量数分别为113、115,质子数=核电荷数=核外电子数=49,质量数=质子数+中子数,主族元素最外层电子数=主族族序数,原子符号左上角为质量数,左下角为质子数,以此解答该题。
【详解】A.铟元素存在两种同位素,113是铟元素一种同位素的质量数,故A错误;
B.质子数应位于左下角,符号为In,故B错误;
C.95.7%是的丰度,故C错误;
D.49号铟元素近似相对原子质量为:113×43%+115×95.7%=114.9,故D正确;
故选D。
13. B BC 0.001mol/(L min)
【详解】(1)SiF4的属于共价化合物,硅原子与氟原子形成4个共价键,所以SiF4的结构式为:;水属于共价化合物,氢氧原子间形成1对共用电子对,用电子式表示H2O的形成过程如下:;
(2) SiO2(s)+4HF(g) SiF4(g)+2H2O(g)是个气体体积减小的反应,增大压强,平衡正向移动;地壳内每增加1 km,压强增大约25000~30000kPa,地壳深层区域先达到平衡,故选B。
(3)A.反应的速率之比等于系数之比;v正(HF)=2v正(H2O),当反应达到平衡时,v正(H2O)= v逆(H2O),因此v正(HF)=2v逆(H2O),故A错误;
B.氟化氢为反应物,水蒸气为生成物,当反应达到平衡时,各物质的浓度保持不变,所以c(HF)与c(H2O)之比保持不变,故B正确;
C.反应向右进行时,SiO2不断消耗,质量减小,当SiO2质量保持不变时,反应达到平衡状态,故C正确;
D.反应达到平衡时正逆反应仍在进行,反应并没有停止,反应物和生成物在相互转化,只是正逆反应速率相等,故D错误;
故选BC。
(4)若反应的容器容积为2.0 L,反应时间8.0min,容器内气体的密度增大了0.12 g/L,则气体的质量增大了0.24g,为二氧化硅的质量,n(SiO2)= =0.004mol,由方程式可知消耗0.016molHF,则在这段时间内HF的平均反应速率为=0.001mol/(L min)。
14. 五 ⅠA ①③⑤ ab
【分析】(1)由Rb的原子序数是37可推知。
(2)根据Rb的原子结构示意图,Na和Rb同主族,根据同主族元素性质的递变规律的结论。
(3)设该合金的平均相对原子质量为M,则根据得失电子守恒定律等式,得出平均摩尔质量,再根据平均值的关系得到结论。
【详解】(1)由Rb的原子序数是37可推知Rb位于第五周期ⅠA族;故答案为:五;ⅠA。
(2)由Rb的原子结构示意图可知②④不正确;又因Na和Rb同主族,根据同主族元素性质的递变规律知,Rb的金属性比Na强,故①③⑤正确;故答案为:①③⑤。
(3)设该合金的平均相对原子质量为M,则根据得失电子守恒定律得,解得M=25,因Mr(Rb)>25,则另一种碱金属的相对原子质量应小于25,可能为Li或Na;故答案为:ab。
15. 放出 反应的,反应不能自发进行 ①②③
【详解】(1)由题图可知,S与的化合反应的,为放热反应。
(2)由题图可知,与的化合反应的,的分解反应的,则与化合生成的,即与的化合反应的,反应不能自发进行。
(3)①最高价氧化为的水化物的酸性越强,相应元素的非金属性越强,故①可以说明S的非金属性强于Se;
②非金属单质和氢气化合越困难,相应元素的非金属性越弱,故②可以说明S的非金属性强于Se;
③从图中可以看出,硫和氢气化合是放热反应,而Se和氢气化合是吸热反应,说明硫比硒易与氢气化合,故③可以说明 S的非金属性强于Se;
故选①②③。
16. AB A D A
【详解】(1)原子种类由原子核内的质子数、中子数共同决定,故选AB。
(2)元素是具有相同的核电荷数(即核内质子数)的一类原子的总称,元素的种类由质子数决定,故选A;
(3)元素的最高正价=最外层电子数(O、F除外),所以元素的化合价主要由最外层电子数决定 ,故选D;
(4)1个质子带1个正电荷、中子不带电,核电荷数由质子数决定,故选A。
17.(1)①
(2)②
(3)⑥
(4)⑤
【分析】(1)
除去粗盐中的泥沙,分离不溶性杂质和溶液的方法为过滤,故答案为:①;
(2)
从饱和食盐水中提取食盐,由于氯化钠的溶解度随温度变化不明显,故从溶液中析出氯化钠晶体的方法为蒸发结晶,故答案为:②;
(3)
由于植物油和水互不相容的两种液体,故分离植物油和水采用分液的方法,故答案为:⑥;
(4)
由于I2在水中的溶解度不大,在CCl4中的溶解度很大,故用CCl4溶液提取碘水中的碘的分离方法为萃取,故答案为:⑤。
18. Na 第三周期第IIIA族 C+O2CO2
【详解】元素X、Y、Z、W的原子序数分别为6、8、11、13,其元素分别是C、O、Na、Al元素,
(1)通过以上分析知,Z是Na元素;
(2)Al原子核外有3个电子层,最外层电子数是3,所以Al位于第三周期第IIIA族;
(3)碳在氧气中完全燃烧生成二氧化碳,反应方程式为:C+O2CO2。
19. 二 VA N> O> H ②③④ HCl 2Na2O2 + 2CO2 =2Na2CO3 + O2 CO2
【分析】根据各元素在元素周期表中的位置可知A为H、B为N、C为O、D为Na、E为Mg。
(4)D为Na元素,Na单质在空气中燃烧生成淡黄色粉末Na2O2;实验的目的是证明X有提供氧气的作用,人呼出的气体中主要含有二氧化碳,则该实验中需要验证二氧化碳与Na2O2反应可以生成氧气,则装置A中可以利用石灰水与浓盐酸反应制取CO2,之后利用装置B中利用饱和碳酸氢钠除去HCl气体,装置C中盛放Na2O2,进行CO2与Na2O2的反应,装置D中盛放NaOH吸收未反应的CO2,装置E中利用排水法收集产生的氧气。
【详解】(1)元素B为N元素,位于第二周期第VA族;电子层数越多原子半径越大,电子层数相同核电荷数越小半径越大,所以A、B、C三种元素原子半径从大到小的顺序为N> O> H;
(2)D为Na元素,Na+的结构示意图为;D2C为Na2O,其形成过程为;
(3)①同周期主族元素自左至右非金属性增强,所以非金属性O>N,则B的简单气态氢化物不如C的稳定,故①错误;
②同周期主族元素自左至右金属性减弱,所以金属性Na>Mg,则D元素的最高价氧化物对应的水化物的碱性比E的强,故②正确;
③金属性Na>Mg,则D元素的单质与水反应比E元素的单质与水反应更剧烈,故③正确;
④非金属性O>N,氧化性O2>N2,则还原性N3->O2-,即B的简单阴离子比C的简单阴离子还原性强,故④正确;
综上所述答案为②③④;
(4)①浓盐酸具有挥发性,所以生成的CO2气体中含有HCl,装置B中饱和NaHCO3溶液的作用是除去HCl气体;
②装置C中过氧化钠与CO2反应生成碳酸钠和氧气,化学方程式为2Na2O2 + 2CO2 =2Na2CO3 + O2;装置D中盛放NaOH吸收未反应的CO2。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.在化学学习、研究中,类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A.CO2和Na2O2反应生成Na2CO3, 推测:SO2和Na2O2反应生成Na2SO3
B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
C.Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3
D.F、Cl、Br、I的单质熔点依次升高,推测:N、P、As、Sb、Bi的单质熔点也依次升高
2.将100mL 0.6 mol/L氯化铝溶液跟1mol/L氢氧化钠溶液混合后,得到3.9g Al(OH)3 沉淀,此时消耗氢氧化钠溶液的体积是
A.130mL B.180mL C.190mL D.240mL
3.下列关于金属元素与非金属元素的叙述中,正确的是
A.非金属元素呈现的最高正化合价不超过该元素原子核外最外层电子数
B.非金属元素呈现的最低负化合价,其绝对值等于该元素原子核外最外层电子数
C.若某元素原子核外最外层电子数不超过2,则该元素一定是金属元素
D.若某元素原子核外最外层电子数为5,则该元素一定是非金属元素
4.主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,化合物Z+[Y-W≡X]-是实验室用于检验某常见金属离子的一种化学试剂。下列说法错误的是
A.离子半径大小:Y>Z
B.元素X、Z的氢化物遇水均能形成碱性溶液
C.简单氢化物的沸点:W
5.下列图示实验合理的是
A.图1证明非金属性强弱:S>C>Si
B.图2可制备少量氧气
C.图3构成铜锌原电池,产生持续稳定的电流
D.图4可制备并收集NO2气体
6.下列叙述正确的是
A.碱金属单质与水反应时都能生成强碱和氢气
B.Cl2可以从NaBr水溶液中置换出溴单质,可类推F2可以从NaCl水溶液中置换出氯单质
C.碱金属单质在空气中燃烧的生成物都是过氧化物
D.HX的还原性顺序为:HF>HCl>HBr>HI
7.下列关于氯元素相应微粒的叙述正确的是
A.35Cl和37Cl是两种不同的元素
B.氯离子(Cl-)的结构示意图:
C.液氯能储存在钢瓶中,说明氯气与铁不反应
D.NaCl溶液是非电解质
8.锝()是核医学临床诊断中应用最广的医用核素,这里的“99”是指该原子的
A.质子数 B.中子数 C.质量数 D.相对原子质量
9.短周期主族元素X、Y、Z、W的原子序数依次增大。Z原子2p轨道上有3个未成对电子。甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下已溶液显中性,它们转化关系如图所示,则下列说法中错误的是
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.W的氢化物中的某一种具有漂白性
C.丙的电子式为
D.W的氢化物沸点一定比Y的氢化物沸点高
10.下列说法不正确的是
A.H、D、T互为同位素 B.H2O、H2O2互为同素异形体
C.正丁烷和异丁烷互为同分异构体 D.CH4和C3H8互为同系物
11.下列说法正确的是
A.MgCl2晶体中的化学键是共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.干冰构成微粒为分子,其溶于水生成碳酸的过程只需克服分子间作用力
12.49号铟元素的相关计算式为:113×4.3%+115×95.7%=114.9。说法正确的是
A.113是铟元素的质量数 B.某种同位素原子符号为In
C.95.7%是铟元素的丰度 D.114.9表示铟元素的近似相对原子质量
二、填空题
13.自然界的矿物,岩石的成因和变化受到许多条件的影响。地壳内每增加1 km,压强增大约25000~30000kPa,在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g) SiF4(g)+2H2O(g)。
(1)SiF4的结构式为___________,用电子式表示H2O的形成过程___________
(2)以上反应在地壳的那个区域先达到化学平衡状态___________(选填编号,下同)。
A.地壳表层 B.地壳深层
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到化学平衡状态时,___________
A.2v正(HF)=v逆(H2O) B.c(HF)与c(H2O)之比保持不变
C.SiO2的质量保持不变 D.反应物不再转化为生成物
(4)若反应的容器容积为2.0 L,反应时间8.0min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为___________
14.据报道,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将给量子计算机的研究带来重大突破。已知铷是37号元素。根据相关知识回答下列问题:
(1)铷(Rb)位于元素周期表的第________周期________族。
(2)关于铷的结构和性质判断正确的是________(填序号)。
①与水反应比钠剧烈
②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁相同
⑤它是还原剂
(3)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是________(填序号)。
a.Li b.Na
c.K d.Cs
15.某化学兴趣小组为了研究部分ⅥA族元素及其化合物的部分性质,查阅资料如下:
①酸性:;
②O、S、与的化合越来越难,与不能直接化合;
③由不同元素的单质生成等物质的量的氢化物的焓变情况如图所示。
请回答下列问题:
(1)S与的化合反应_________(填“吸收”或“放出”)热量。
(2)已知的分解反应的,请解释与不能直接化合的原因______________。
(3)题述信息中能说明S的非金属性强于的是_________(填序号)。
16.用符号A:质子数,B:中子数,C:核外电子数,D:最外层电子数,E:电子层数,填写下列各空。
(1)原子种类由_____决定。
(2)元素的种类由_____决定
(3)元素的化合价主要由____决定
(4)核电荷数由_____决定。
17.在中学实验中学过的可用于分离或提纯物质的方法很多,如①过滤、②蒸发结晶,③降温结晶,④蒸馏,⑤萃取,⑥分液等。请将分离或提纯下列各混合物最适宜的方法名称的序号填入横线上。
(1)除去粗盐中的泥沙___________。
(2)从饱和食盐水中提取食盐___________。
(3)分离植物油和水___________。
(4)用CCl4溶液提取碘水中的碘___________。
18.已知元素X、Y、Z、W的原子序数分别为6、8、11、13,请回答:
(1)写出下列元素符号Z___________;
(2)写出下列元素在周期表中的位置W_______________;
(3)写出下列反应方程式:X单质在足量Y单质中反应_________________________。
19.1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,表中所列的字母分别代表某一化学元素。回答下列问题:
(1)元素B在元素周期表中的位置是第____周期第_____族,A、B、C三种元素原子半径从大到小的顺序是_________________;(填元素符号)
(2)D简单离子的结构示意图为_____________,用电子式表示D2C的形成过程_______。
(3)下列说法正确的是( )(填序号)
①B的简单气态氢化物比C的稳定
②D元素的最高价氧化物对应的水化物的碱性比E的强
③D元素的单质与水反应比E元素的单质与水反应更剧烈
④B的简单阴离子比C的简单阴离子还原性强
(4)D单质在空气中燃烧可生成淡黄色粉末X(D2O2),X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。
①装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去_____________;(填化学式)
②装置C中X与CO2反应的化学方程式是_____________________,装置D盛放NaOH溶液的作用是除去____________。(填化学式)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.SO2有还原性,Na2O2有强氧化性,二者发生氧化还原反应生成Na2SO4,A错误;
B.钠燃烧生成的过氧化钠能和二氧化碳反应生成氧气助燃,钾燃烧生成的过氧化钾、超氧化钾也能和二氧化碳反应产生氧气助燃,所以金属钠着火不能用CO2扑灭,金属钾着火也不能用CO2扑灭,B正确;
C.Fe3O4中铁的化合价+2价、+3价,可看作“混合氧化物”,可改写成FeO Fe2O3,Pb在化合物里显+2价和+4价,根据化合价代数和为零的原则,Pb的+2价和+4价两种氧化物形式为PbO和PbO2,则Pb3O4的氧化物的表示形式可以写成2PbO PbO2,C错误;
D.N、P、As为非金属单质,熔点升高,但是,Sb的熔点630.74℃、Bi的熔点271℃,D错误。
答案选B。
2.C
【详解】氯化铝的物质的量=0.1L×0.6mol/L=0.06mol,最终生成的氢氧化铝的质量是3.9g,物质的量==0.05mol<0.06mol,这说明反应中铝元素没有完全转化为氢氧化铝沉淀,如果氯化铝过量,则根据方程式可知:
Al3+ + 3OH-=Al(OH)3↓
1mol 3mol 1mol
0.05mol 0.15mol 0.05mol
所以消耗氢氧化钠溶液的体积==0.15L=150mL;
如果反应中氯元素部分转化为AlO2-,则根据方程式可知
Al3+ + 3OH-=Al(OH)3↓
1mol 3mol 1mol
0.06mol 0.18mol 0.06mol
其中又被氢氧化钠溶液溶解的氢氧化铝是0.06mol-0.05mol=0.01mol
Al(OH)3 + OH-=AlO2-+2H2O
1mol 1mol
0.01mol 0.01mol
则最终消耗氢氧化钠的物质的量是0.18mol+0.01mol=0.19mol
因此消耗氢氧化钠溶液的体积==0.19L=190mL,所以答案选C。
3.A
【详解】A.主族元素的最高正化合价等于该元素原子的最外层电子数,非金属元素呈现的最高正化合价不超过该元素原子核外最外层电子数,故A正确;
B.非金属元素呈现的最低负化合价,其绝对值=8-该元素原子核外最外层电子数,故B错误;
C.He原子最外层有2个电子,若某元素原子核外最外层电子数不超过2,则该元素不一定是金属元素,故C错误;
D.若某元素原子核外最外层电子数为5,则该元素不一定是非金属元素,如51号元素锑(Sb)是金属元素,故D错误;
选A。
4.D
【分析】根据题干信息,W、X、Y、Z为原子序数依次增加且均不超过20的主族元素,W、X、Y最外层电子数之和为15,化合物Z+[Y-W≡X]-是实验室用于检验某常见金属离子的一种化学试剂,根据结构式可知,Z为第ⅠA族原子,W为第ⅣA族元素,X为第ⅤA族元素,则该化合物可能为KSCN,因此W为C元素,X为N元素,Y为S元素,Z为K元素,据此分析解答。
【详解】A.S2-和K+的核外电子层数相同,核电荷数K>S,则离子半径:S2->K+,A选项正确;
B.X为N元素,Z为K元素,两者的氢化物分别为NH3和KH,NH3与遇水形成NH3·H2O,显碱性,KH遇水形成KOH,显碱性,B选项正确;
C.NH3分子间可形成氢键,因此沸点高于CH4,C选项正确;
D.[S-C≡N]-中所有原子最外层均满足8电子稳定结构,D选项错误;
答案选D。
5.A
【详解】A.发生强酸制取弱酸的反应,可知酸性为硫酸>碳酸>硅酸,则非金属性为S>C>Si,A正确;
B.过氧化钠为粉末固体,不能使反应随时停止,则图中装置不能制备少量氧气,B错误;
C.左烧杯中发生化学反应,不能形成原电池,则不能产生持续稳定的电流,硫酸铜与硫酸锌溶液应该相互对换,C错误;
D.二氧化氮与水反应,不能用排水法收集,D错误;
故选A。
6.A
【详解】A. 碱金属是活泼的金属,其单质与水反应时都能生成强碱和氢气,A正确;
B. Cl2可以从NaBr水溶液中置换出溴单质,由于F是最活泼的非金属,其单质极易与水反应,则F2不能从NaCl水溶液中置换出氯单质,B错误;
C. 碱金属单质在空气中燃烧的生成物不一定都是过氧化物,例如Li只有Li2O一种氧化物,C错误;
D. 同主族从上到下非金属性逐渐减弱,氢化物的还原性逐渐增强,则HX的还原性顺序为:HF<HCl<HBr<HI,D错误。
答案选A。
7.B
【详解】A.两种原子质子数相同中子数不同,均为氯元素,是同种元素,A错误;
B.氯离子的结构示意图正确,B正确;
C.氯气与铁在点燃或加热条件下可以反应,C错误;
D.氯化钠溶液既不是电解质也不是非电解质,D错误;
故选B。
8.C
【详解】的质量数为99,质子数为43,该原子核内中子数=质量数-质子数=99-43=56,质量数是原子的相对原子质量近似整数值,因此“99”是指该原子的质量数或相对原子质量近似整数值,故选C。
【点睛】本题的易错点为D,要正确区分相对原子质量与质量数的关系。
9.D
【分析】短周期主族元素X、Y、Z、W的原子序数依次增大,Z原子2p轨道上有3个未成对电子,是N,甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,甲为乙醇,乙醇含有C、H、O元素,X为H,Y为C,W为O,乙醇可以和氧气反应生成乙醛和水,丙为乙醛,已为水,丙和氧气生成乙酸,丁为乙酸,戊是Z和X组成的10电子分子,为氨气,常温下已溶液显中性,为醋酸铵,X、Y、Z、W四种元素分别为H、C、N、O,然后分析。
【详解】A.X、Y、Z、W四种元素分别为H、C、N、O,同周期从左到右原子半径逐渐减小,原子半径由大到小的顺序为:Y>Z>W>X,故A正确;
B.W是O,它的氢化物中的某一种是过氧化氢,具有强氧化性,具有漂白性,故B正确;
C.丙是乙醛,分子中含有醛基,含有碳氧双键,电子式为 ,故C正确;
D.W的氢化物可能为过氧化氢或过氧化氢,Y的氢化物可能为苯,过氧化氢或过氧化氢的沸点低于苯,故D错误;
答案选D。
10.B
【详解】A.H、D、T原子分别是氢元素的不同原子,故其互为同位素,故A正确;
B.H2O、H2O2是氢元素构成的不同氧化物,不是同素异形体,故B错误;
C.正丁烷和异丁烷分子式相同,均为C4H10,结构不同,因此它们互为同分异构体,故C正确;
D.CH4和C3H8结构相似,都属于烷烃,且分子组成相差2个CH2,因此互为同系物,故D正确。
答案选B。
11.C
【详解】A.MgCl2晶体中只含镁离子和氯离子形成的离子键,A错误;
B.金属单质在熔融状态下也可以导电,但不含离子键,B错误;
C.N2的电子式为,Cl2的电子式为,两种分子中,每个原子的最外层都具有8电子稳定结构,C正确;
D.干冰是分子晶体,其溶于水生成碳酸的过程除了需克服分子间作用力外,还需要克服共价键,D错误;
综上所述答案为C。
12.D
【分析】49号铟元素近似相对原子质量为:113×4.3%+115×95.7%=114.9,是同位素所占丰度和原子的质量数计算得到的平均值,说明铟元素存在两种同位素,质量数分别为113、115,质子数=核电荷数=核外电子数=49,质量数=质子数+中子数,主族元素最外层电子数=主族族序数,原子符号左上角为质量数,左下角为质子数,以此解答该题。
【详解】A.铟元素存在两种同位素,113是铟元素一种同位素的质量数,故A错误;
B.质子数应位于左下角,符号为In,故B错误;
C.95.7%是的丰度,故C错误;
D.49号铟元素近似相对原子质量为:113×43%+115×95.7%=114.9,故D正确;
故选D。
13. B BC 0.001mol/(L min)
【详解】(1)SiF4的属于共价化合物,硅原子与氟原子形成4个共价键,所以SiF4的结构式为:;水属于共价化合物,氢氧原子间形成1对共用电子对,用电子式表示H2O的形成过程如下:;
(2) SiO2(s)+4HF(g) SiF4(g)+2H2O(g)是个气体体积减小的反应,增大压强,平衡正向移动;地壳内每增加1 km,压强增大约25000~30000kPa,地壳深层区域先达到平衡,故选B。
(3)A.反应的速率之比等于系数之比;v正(HF)=2v正(H2O),当反应达到平衡时,v正(H2O)= v逆(H2O),因此v正(HF)=2v逆(H2O),故A错误;
B.氟化氢为反应物,水蒸气为生成物,当反应达到平衡时,各物质的浓度保持不变,所以c(HF)与c(H2O)之比保持不变,故B正确;
C.反应向右进行时,SiO2不断消耗,质量减小,当SiO2质量保持不变时,反应达到平衡状态,故C正确;
D.反应达到平衡时正逆反应仍在进行,反应并没有停止,反应物和生成物在相互转化,只是正逆反应速率相等,故D错误;
故选BC。
(4)若反应的容器容积为2.0 L,反应时间8.0min,容器内气体的密度增大了0.12 g/L,则气体的质量增大了0.24g,为二氧化硅的质量,n(SiO2)= =0.004mol,由方程式可知消耗0.016molHF,则在这段时间内HF的平均反应速率为=0.001mol/(L min)。
14. 五 ⅠA ①③⑤ ab
【分析】(1)由Rb的原子序数是37可推知。
(2)根据Rb的原子结构示意图,Na和Rb同主族,根据同主族元素性质的递变规律的结论。
(3)设该合金的平均相对原子质量为M,则根据得失电子守恒定律等式,得出平均摩尔质量,再根据平均值的关系得到结论。
【详解】(1)由Rb的原子序数是37可推知Rb位于第五周期ⅠA族;故答案为:五;ⅠA。
(2)由Rb的原子结构示意图可知②④不正确;又因Na和Rb同主族,根据同主族元素性质的递变规律知,Rb的金属性比Na强,故①③⑤正确;故答案为:①③⑤。
(3)设该合金的平均相对原子质量为M,则根据得失电子守恒定律得,解得M=25,因Mr(Rb)>25,则另一种碱金属的相对原子质量应小于25,可能为Li或Na;故答案为:ab。
15. 放出 反应的,反应不能自发进行 ①②③
【详解】(1)由题图可知,S与的化合反应的,为放热反应。
(2)由题图可知,与的化合反应的,的分解反应的,则与化合生成的,即与的化合反应的,反应不能自发进行。
(3)①最高价氧化为的水化物的酸性越强,相应元素的非金属性越强,故①可以说明S的非金属性强于Se;
②非金属单质和氢气化合越困难,相应元素的非金属性越弱,故②可以说明S的非金属性强于Se;
③从图中可以看出,硫和氢气化合是放热反应,而Se和氢气化合是吸热反应,说明硫比硒易与氢气化合,故③可以说明 S的非金属性强于Se;
故选①②③。
16. AB A D A
【详解】(1)原子种类由原子核内的质子数、中子数共同决定,故选AB。
(2)元素是具有相同的核电荷数(即核内质子数)的一类原子的总称,元素的种类由质子数决定,故选A;
(3)元素的最高正价=最外层电子数(O、F除外),所以元素的化合价主要由最外层电子数决定 ,故选D;
(4)1个质子带1个正电荷、中子不带电,核电荷数由质子数决定,故选A。
17.(1)①
(2)②
(3)⑥
(4)⑤
【分析】(1)
除去粗盐中的泥沙,分离不溶性杂质和溶液的方法为过滤,故答案为:①;
(2)
从饱和食盐水中提取食盐,由于氯化钠的溶解度随温度变化不明显,故从溶液中析出氯化钠晶体的方法为蒸发结晶,故答案为:②;
(3)
由于植物油和水互不相容的两种液体,故分离植物油和水采用分液的方法,故答案为:⑥;
(4)
由于I2在水中的溶解度不大,在CCl4中的溶解度很大,故用CCl4溶液提取碘水中的碘的分离方法为萃取,故答案为:⑤。
18. Na 第三周期第IIIA族 C+O2CO2
【详解】元素X、Y、Z、W的原子序数分别为6、8、11、13,其元素分别是C、O、Na、Al元素,
(1)通过以上分析知,Z是Na元素;
(2)Al原子核外有3个电子层,最外层电子数是3,所以Al位于第三周期第IIIA族;
(3)碳在氧气中完全燃烧生成二氧化碳,反应方程式为:C+O2CO2。
19. 二 VA N> O> H ②③④ HCl 2Na2O2 + 2CO2 =2Na2CO3 + O2 CO2
【分析】根据各元素在元素周期表中的位置可知A为H、B为N、C为O、D为Na、E为Mg。
(4)D为Na元素,Na单质在空气中燃烧生成淡黄色粉末Na2O2;实验的目的是证明X有提供氧气的作用,人呼出的气体中主要含有二氧化碳,则该实验中需要验证二氧化碳与Na2O2反应可以生成氧气,则装置A中可以利用石灰水与浓盐酸反应制取CO2,之后利用装置B中利用饱和碳酸氢钠除去HCl气体,装置C中盛放Na2O2,进行CO2与Na2O2的反应,装置D中盛放NaOH吸收未反应的CO2,装置E中利用排水法收集产生的氧气。
【详解】(1)元素B为N元素,位于第二周期第VA族;电子层数越多原子半径越大,电子层数相同核电荷数越小半径越大,所以A、B、C三种元素原子半径从大到小的顺序为N> O> H;
(2)D为Na元素,Na+的结构示意图为;D2C为Na2O,其形成过程为;
(3)①同周期主族元素自左至右非金属性增强,所以非金属性O>N,则B的简单气态氢化物不如C的稳定,故①错误;
②同周期主族元素自左至右金属性减弱,所以金属性Na>Mg,则D元素的最高价氧化物对应的水化物的碱性比E的强,故②正确;
③金属性Na>Mg,则D元素的单质与水反应比E元素的单质与水反应更剧烈,故③正确;
④非金属性O>N,氧化性O2>N2,则还原性N3->O2-,即B的简单阴离子比C的简单阴离子还原性强,故④正确;
综上所述答案为②③④;
(4)①浓盐酸具有挥发性,所以生成的CO2气体中含有HCl,装置B中饱和NaHCO3溶液的作用是除去HCl气体;
②装置C中过氧化钠与CO2反应生成碳酸钠和氧气,化学方程式为2Na2O2 + 2CO2 =2Na2CO3 + O2;装置D中盛放NaOH吸收未反应的CO2。
答案第1页,共2页
答案第1页,共2页
