第一章 有机化合物的结构特点与研究方法 测试题(含解析) 高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第一章 有机化合物的结构特点与研究方法 测试题(含解析) 高二化学人教版(2019)选择性必修3 | 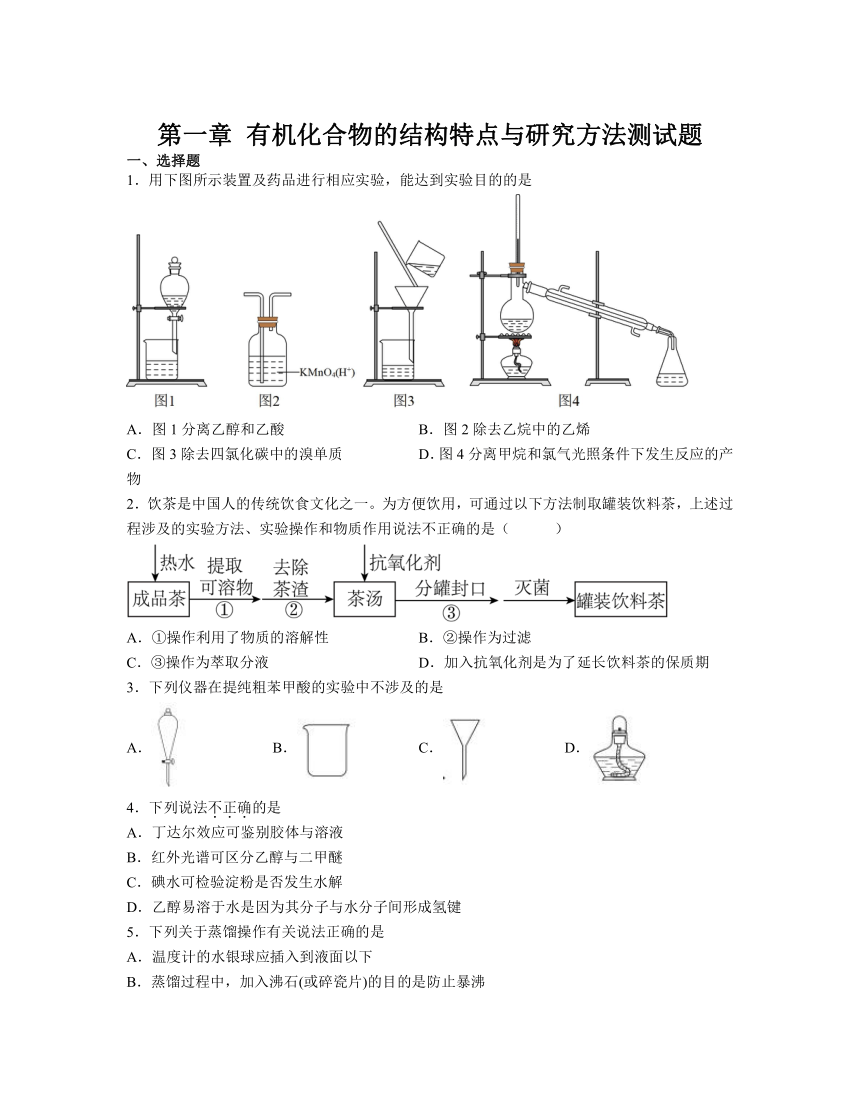 | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-12 20:40:44 | ||
图片预览



文档简介
第一章 有机化合物的结构特点与研究方法测试题
一、选择题
1.用下图所示装置及药品进行相应实验,能达到实验目的的是
A.图1分离乙醇和乙酸 B.图2除去乙烷中的乙烯
C.图3除去四氯化碳中的溴单质 D.图4分离甲烷和氯气光照条件下发生反应的产物
2.饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶,上述过程涉及的实验方法、实验操作和物质作用说法不正确的是( )
A.①操作利用了物质的溶解性 B.②操作为过滤
C.③操作为萃取分液 D.加入抗氧化剂是为了延长饮料茶的保质期
3.下列仪器在提纯粗苯甲酸的实验中不涉及的是
A. B. C. D.
4.下列说法不正确的是
A.丁达尔效应可鉴别胶体与溶液
B.红外光谱可区分乙醇与二甲醚
C.碘水可检验淀粉是否发生水解
D.乙醇易溶于水是因为其分子与水分子间形成氢键
5.下列关于蒸馏操作有关说法正确的是
A.温度计的水银球应插入到液面以下
B.蒸馏过程中,加入沸石(或碎瓷片)的目的是防止暴沸
C.冷凝管进出水的方向是上进下出
D.用烧杯接收蒸馏出来的液体
6.下列各有机物核磁共振氢谱图显示有两个吸收峰,且峰的面积比不是3:1的是
A.甲酸甲酯 B.2-甲基丙烯
C. D.1,3,5-三甲基苯
7.化合物M可用于油漆、颜料、涂料工业,其结构如图。下列关于该物质的说法正确的是
A.分子式为C14H10O3
B.分子中碳的杂化方式有2种
C.分子中含有4种官能团
D.苯环上的一氯代物有5种
8.2022年7月25日,由河南科学家研发的阿兹夫定片获批上市,这是我国首款抗新冠口服药物,其有效成分的结构简式如图所示:
下列说法错误的是
A.的电子式为 B.非金属性:F>O>N>H
C.该有机物能发生氧化反应 D.该物质最多与反应
9.乙酸乙酯与H218O在硫酸作用下,发生下列水解反应:+H218O+CH3CH2-OH,可利用实验方法测定有机物组成、结构和研究化学反应机理。下列有关说法正确的是
A.利用李比希燃烧法可以测定乙醇的分子式为C2H6O
B.乙酸乙酯和乙醇的核磁共振氢谱均有3个峰,无法鉴别二者
C.利用金属钠与无水乙醇反应的定量关系可确定乙醇的结构
D.运用同位素示踪法可判断乙酸乙酯水解时断裂的C-O的位置
10.下列说法正确的是
A.相对分子质量相同,但结构不同的两种烃一定互为同分异构体
B.各组成元素质量分数相同的烃是同一种烃
C.最简式相同的有机物不一定互为同系物
D.分子组成相差一个或几个原子团的有机物是同系物
11.我国化学家在基于苯炔的不对称催化研究方面取得了突破,反应示意图如下。下列说法错误的是
A.该反应为加成反应 B.化合物乙的不饱和度为7
C.化合物甲核磁共振氢谱有7组峰 D.化合物甲中没有手性碳原子
12.下列烷烃进行一氯取代反应后,生成的取代产物的数目与其他物质不相同的是
A. B.
C. D.
13.下列化学用语表达正确的是
A.苯乙胺的结构简式: B.乙酸的空间填充模型:
C.羧基的电子式: D.丁烷的实验式:
14.关于甲基丙烯酸甲酯()的叙述正确的是
A.所有原子共平面 B.能发生还原反应
C.不能使Br2的CCl4溶液褪色 D.易溶于水或乙醇
15.氨、氮、硫的化合物应用广泛。ClO2(分子空间填充模型为)。NaClO等含氯消毒剂可用于杀菌消毒。人工固氮可将N2转化为NH3,再进一步制备肼(N2H4)、硝酸、铵盐等化合物,肼和偏二甲肼(C2H8N2)常用作火箭燃料,肼的燃烧热为622.08 kJ·mol-1,H2S可除去废水中Hg2+等重金属禹子,H2S 水溶液在空气中会缓慢氧化生成S而变诨浊。下列说法正确的是
A.基态氮原子的核外电子有5种运动状态
B.NH和H2S中心原子均采用sp3杂化方式
C.ClO2是由极性键构成的非极性分子
D.偏二甲肼(C2H8N2)的结构简式为:
二、填空题
16.根据题意,完成下列有机试题的填空:
(1)提纯互溶液体有机物常用的方法是___。
(2)有机物具有三种官能团:___、___和___(填官能团的名称)。
(3)化合物M分子式是C2H4Br2,M的核磁共振氢谱图如图所示,则M的结构简式为___。
(4)键线式表示的有机物的分子式为___。
(5)根据表中烃的分子式排列规律,判断空格中烃的同分异构体的数目是___。
1 2 3 4 5 6 7 8
CH4 C2H4 C3H8 C4H8 C6H12 C7H16 C8H16
(6)将甲醛(HCHO)水溶液与氨水混合蒸发可制得乌洛托品(如图所示)。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比应为___。
17.回答下列问题:
(1)某有机化合物的结构简式为,写出其分子式:_______。
(2)下面列出了几组物质:①金刚石与“足球烯”C60;②D2O与H2O;③16O、18O;④氧气与臭氧;⑤与;⑥CH3CH2CH2CH3和;⑦CH4和CH3CH2CH3;⑧CH3CH3和。其中互为同位素的是_______;互为同素异形体的是_______;属于同系物的是_______;互为同分异构体_______。
(3)写出下列有机物的系统命名或结构简式:
①(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3 _______。
② _______。
③2-甲基-2-丁烯 _______。
18.I.下列物质中:
①液氯和氯气②白磷和红磷③和④Cl和Cl⑤(CH3)2CHCH3和CH3(CH2)2CH3⑥CH4和CH3CH2CH3
(1)互为同分异构体的有_______
(2)互为同素异形体的有_______
(3)属于同位素的有_______
(4)属于同一种物质的有_______。(填序号)
Ⅱ.“立方烷”是新合成的一种烃,其分子呈正方体结构。该分子的碳架结构如下图所示,其中每个顶点表示一个碳原子,棱表示碳碳单键,氢原子未画出。
(1)“立方烷”的分子式为_______;
(2)其一氯代物共有_______种;
(3)其二氯代物共有_______种。
19.请分析丙烯酸的结构,将分析结果填入表格中。
丙烯酸的结构式 分析角度
官能团 化学键
键的饱和性 键的极性
饱和键 不饱和键 极性键 非极性键
____ ____ ____ ____ ____
20.下列两幅谱图是结构简式为CH3CH2CH2OH和的两种有机化合物的1H核磁共振谱图。请判断哪一幅是的1H-NMR谱图,并说明理由____________。
A. B.
三、计算题
21.为了测定一种气态烃A的化学式,取一定量的A置于一密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。学生甲、乙设计了两个方案,均认为根据自己的方案能求出A的最简式,他们测得的在一定条件下的有关数据如下(图中的箭头表示气流的方向,实验前系统内的空气已排尽):
甲方案:燃烧产物浓硫酸增重2.52 g碱石灰增重1.32g生成CO21.76 g
乙方案:燃烧产物碱石灰增重5.60 g固体减小0.64 g石灰水增重4g。试回答:
(1)甲、乙两方案中,你认为哪种方案能求出A的最简式_______?
(2)请根据你选择的方案,通过计算求出A的最简式_______。(要求写出计算过程)
(3)若要确定A的分子式,是否需要测定其它数据?并说明原因_______。
四、元素或物质推断题
22.某研究性学习小组对有机物A的结构和性质进行如下实验。
实验一:通过质谱分析仪测定得有机物A的相对分子质量为166。
实验二:1.66g有机物A完全燃烧后,生成3.96gCO2和0.90gH2O。
实验三:用红外光谱分析得知有机物A中含有、-COOH和-OH。
实验四:A的1H核磁共振谱图显示六组峰,且峰面积比为3:2:2:1:1:1。
(1)有机物A的结构简式为___________。
(2)有机物A在一定条件下可以发生的反应有___________。
a.消去反应 b.氧化反应 c.加聚反应 d.加成反应
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B能和Br2的CCl4溶液发生加成反应,则B的结构简式为___________。另一种产物C是一种六元环状酯,则C的结构简式为___________。
(4)写出A与足量的金属钠反应的化学方程式:___________。
五、实验题
23.化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
回答下列问题:
(1)装置A中装有MnO2,写出A装置中发生反应的化学方程式是______;
(2)C装置(燃烧管)中CuO的作用是______;
(3)写出E装置中所盛放物质的名称______,它的作用是______。
(4)若将B装置去掉会对实验结果造成什么影响?______。
(5)若准确称取1.20 g样品(烃或烃的含氧衍生物)。经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的实验式为______。
(6)从定量测定准确角度去考虑,该装置应怎样进一步改进______。
【参考答案】
一、选择题
1.D
解析:A.乙酸和乙醇互溶,乙酸和乙醇混合后不分层,不能用分液法分离乙醇和乙酸,故不选A;
B.乙烯被酸性高锰酸钾溶液氧化为二氧化碳,引入新的杂质,不能用高锰酸钾溶液除去乙烷中的乙烯,一般用溴水除乙烷中的乙烯,故不选B;
C.溴易溶于四氯化碳,不能用过滤法除去四氯化碳中的溴单质,故不选C;
D.甲烷和氯气在光照条件下发生取代反应,生成沸点不同的氯代甲烷,用蒸馏法分离甲烷和氯气光照条件下发生反应的产物,故选D;
答案选D。
2.C
解析:A.①操作为提取可溶物,利用了物质的溶解性,溶解到水中,A正确;
B.②操作为除去不溶物茶渣,方法为过滤,B正确;
C.③操作时,混合物不分层,分罐密封,无分液操作,C不正确;
D.抗氧化剂具有还原性,加入抗氧化剂是为了延长饮料茶的保质期,D正确;
答案为C。
3.A
解析:粗苯甲酸提纯过程为重结晶,经过升温溶解,降温结晶,过滤,没有分液操作,故不需要用到的仪器是分液漏斗,故答案为:A。
4.C
解析:A.胶体能发生丁达尔效应,溶液不能发生丁达尔效应,则丁达尔效应可鉴别胶体与溶液,故A正确;
B.乙醇分子中含有氢氧键,二甲醚分子中不含有氢氧键,则红外光谱可区分乙醇与二甲醚,故B正确;
C.检验淀粉是否发生水解应选用银氨溶液或新制氢氧化铜悬浊液,故C错误;
D.乙醇分子中含有羟基,羟基能与水分子间形成氢键,使得乙醇分子易溶于水,故D正确;
故选C。
5.B
解析:A.蒸馏操作中温度计的水银球应放在支管口处,故A错误;
B.蒸馏过程中,加入沸石(或碎瓷片)的目的是防止暴沸,故B正确;
C.冷凝管进出水的方向是下进上出,故C错误;
D.蒸馏时用锥形瓶接收蒸馏出来的液体,故D错误;
故选B。
6.C
【分析】若核磁共振氢谱图显示有两个吸收峰,且峰的面积为3:1,则该物质中有两种环境的氢原子,且两种环境的氢原子的个数比为3:1。
解析:A.甲酸甲酯的结构简式为CH3OOCH,有两种环境的氢原子,且个数比为3:1,故A不符合题意;
B.2-甲基丙烯为,有两种环境的氢原子,且个数比为6:2,即3:1,故B不符合题意;
C.该物质结构高度对称,有两种环境的氢原子,苯环上4个为一种,取代基上6个为一种,个数比为6:4=3:2,故C符合题意;
D.1,3,5-三甲基苯为,苯环上3个为一种氢原子,取代基上9个为一种氢原子,共两种,个数比为9:3,即3:1,故D不符合题意;
综上所述答案为C。
7.B
解析:A.由结构简式可知M的分子式为:C14H12O3,故A错误;
B.分子中含有单键碳原子和双键碳原子,杂化方式分别为:,故B正确;
C.M中含羟基、羰基、醚键三种官能团,故C错误;
D.该物质含两个苯环,一氯代物共6种,故D错误;
故选:B。
8.D
解析:A.H原子周围2个电子,N原子周围8个电子, NH2 有一个共价键,故A正确;
B.非金属性体现得电子能力:F>O>N>H,B正确;
C.该物质中含有醇羟基,可以发生氧化反应,C正确;
D.醇羟基可以与金属钠发生反应生成H2,物质结构中有2个醇羟基,故1mol物质能与2molNa发生反应,D错误;
故答案为:D。
9.D
解析:A.李比希燃烧法是将准确称量的样品置于一燃烧管中,经红热的氧化铜氧化后,再将其彻底燃烧成二氧化碳和水,用纯的氧气流把它们分别赶入烧碱石棉剂(附在石棉上粉碎的氢氧化钠)及高氯酸镁的吸收管内,这两个吸收管增加的质量分别表示生成的二氧化碳和水的质量,由此即可计算样品中的碳、氢、氧的含量,从而确定有机物中C、H、O个数的最简整数比,故利用李比希燃烧法可以测定乙醇的实验式为C2H6O,不能确定分子式,A错误;
B.乙酸乙酯()含3种等效氢,核磁共振氢谱会出现3组峰,峰面积比为3:3:2,乙醇(CH3CH2-OH)含3种等效氢,核磁共振氢谱会出现3组峰,峰面积比为3:2:1,二者的核磁共振氢谱均有3个峰,但峰面积比不同,可以鉴别二者,B错误;
C.利用金属钠与无水乙醇反应的定量关系可确定乙醇分子中-OH的个数,不能确定乙醇的结构,C错误;
D.利用18O标记水分子为CH3CO18OCH2CH3,可根据检测水解产物中乙酸有放射性或乙醇有放射性来确定C-O键的断裂位置,D正确;
答案选D。
10.C
解析:A.相对分子质量相同的两种烃的分子式不一定相同,如C10H8和C9H20,不是同分异构体,A错误;
B.各组成元素质量分数相同的烃可能是同分异构体,或者是一类烃如烯烃,B错误;
C.最简式相同的有机物不一定互为同系物,如HCHO与CH3COOH,C正确;
D.结构相似,分子组成相差一个或几个CH2原子团的有机物是同系物,D错误;
故选C。
11.D
解析:A.由反应示意图可知,苯炔中碳碳叁键的不饱和度变小,为加成反应,A正确;
B.化合物乙中含1个苯环、1个碳环、1个羰基、1个酯基,则不饱和度为4+1+1+1=7,B正确;
C.化合物甲中有7种不同环境的氢,核磁共振氢谱有7组峰,C正确;
D.化合物甲中存在1个手性碳原子(如图*所示),D错误;
答案选D。
12.C
解析:ABD都可以形成2种一氯代物,C可以形成1种一氯代物,故选C。
13.B
解析:A.苯乙胺的结构简式为,故A错误;
B.乙酸的结构简式为CH3COOH,空间填充模型为:,故B正确;
C.羧基的电子式为,故C错误;
D.丁烷的实验式为C2H5,故D错误;
故选B。
14.B
解析:A.该物质中有甲基,故不可能所有原子共面,故A项错误;
B.该物质有碳碳双键,能与氢气发生加成反应,与氢气加成也属于还原反应,故B项正确;
C.该物质中有碳碳双键,能使Br2的CCl4溶液褪色,故C项错误;
D.该物质有酯基,不易溶于水,易溶于乙醇,故D项错误。
故答案选B。
15.B
解析:A.基态氮原子的核外电子有7个电子,所以有7种运动状态,A错误;
B.NH和H2S中心原子的价层电子对数都是4,所以均采用sp3杂化方式,B正确;
C.ClO2是夹角小于120度的折线结构,是由极性键构成的极性分子,C错误;
D.偏二甲肼(C2H8N2)的结构简式为:,D错误;
故选B。
二、填空题
16. 蒸馏 羟基 羧基 醛基 CH2BrCH2Br C6H14 3 3:2
解析:(1)根据沸点不同,提纯互溶液体有机物常用的方法是蒸馏。
(2)有机物具有三种官能团:羧基、羟基和醛基。
(3)化合物M分子式是C2H4Br2,根据M的核磁共振氢谱图,M只有一种等效氢,则M的结构简式为CH2BrCH2Br;
(4)键线式中端点、折点都是C原子,根据价键规律,表示的有机物的分子式为C6H14。
(5)根据表中烃的分子式排列规律,空格中烃分子式是C5H12,同分异构体有CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、C(CH3)4,共3种;
(6)根据乌洛托品的结构简式,乌洛托品的分子式是C6N4H12,若甲醛与氨完全反应生成乌洛托品,根据C、N原子守恒,HCHO与NH3的物质的量之比应为3:2。
17.(1)C16H16O5
(2) ③ ①④ ⑦⑧ ⑥
(3) 2-甲基-5-乙基辛烷 5-甲基-3-乙基-1-己炔
【分析】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:(1)烷烃命名原则:①长--选最长碳链为主链;②多--遇等长碳链时,支链最多为主链;③近--离支链最近一端编号;④小--支链编号之和最小;⑤简--两取代基距离主链两端等距离时,从简单取代基开始编号。如取代基不同,就把简单的写在前面,复杂的写在后面;含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小。
解析:(1)根据该结构简式可得出其分子式:C16H16O5,故答案为:C16H16O5。
(2)关于“四同”的比较:
同位素:质子数相同中子数不同的核素;同素异形体:一种元素构成的不同物质,一定是单质;同分异构体:分子式相同,结构不同,必为化合物;同系物:结构相似,分子式相差若干CH2原子团。
①金刚石与“足球烯”C60都是由碳元素形成的不同单质,互为同素异形体;
②D2O与H2O都是氢的同位素与氧元素形成的化合物;
③16O与18O质子数相同,中子数不同,互为同位素;
④氧气(O2)与臭氧(O3)都是由氧元素形成的不同单质,互为同素异形体;
⑤与均为丙烷,属于同种物质;
⑥CH3CH2CH2CH3和分子式相同,但结构不同,互为同分异构体
⑦CH4和CH3CH2CH3结构相似,分子组成相差2个“CH2”原子团,互为同系物,
⑧CH3CH3和结构相似,分子组成相差3个“CH2”原子团,故互为同系物;
即互为同位素的是③;互为同素异形体的是①④;属于同系物的是⑦⑧;互为同分异构体⑥ ;故为③;①④;⑦⑧;⑥。
(3)把碳链打开按照烷烃命名规则命名:,最长的碳链含有8个C,主链为辛烷,编号从左边开始,取代基的编号最小,2号C一个甲基、5号C一个乙基,名称:2-甲基-5-乙基辛烷;故答案为:2-甲基-5-乙基辛烷。
首先选择含有碳碳三键的最长碳链作为主链,按主链中所含碳原子的数目命名为某炔;给主链编号时从距离碳碳三键最近的一端开始,侧链视为取代基,碳碳三键的位次须标明;其它同烷烃的命名规则;,名称: 5-甲基-3-乙基-1-己炔;
故答案为: 5-甲基-3-乙基-1-己炔。
2-甲基-2-丁烯,碳碳双键在2号C,甲基在2号C,主链为丁烯,结构简式为;故答案为:。
18. ③⑤ ② ④ ① C8H8 1 3
【分析】根据同分异构体、同素异形体、同位素的定义及特点进行判断;根据碳和氢原子的成键特点:碳形成4个化学键、氢原子形成1个化学键判断物质的化学式;根据等效氢法判断一氯、二氯的同分异构体个数。
解析:I. (1)根据分子式相同结构不同的特点判断互为同分异构体的是:③⑤;
(2)根据同一种元素组成的不同单质判断互为同素异形体的是:②;
(3)根据质子数相同、中子数不同的同一种元素互为同位素的是:④;
(4)液氯和氯气是同一种物质的不同状态,故选①;
Ⅱ.(1)根据顶点表示的碳原子接三个碳原子,故每个碳原子还接1个氢原子判断,立方烷的化学式为:C8H8;
(2)根据等效氢法中的对称性判断,立方烷中的氢原子都是一样的,故一氯代物只有1种;
(3)根据立方烷的特点,其二氯代物分别是相邻位置的棱上,和面对角线上的及体对角线上的二氯取代,共有3种。
19.碳碳双键、羧基 C-H、O-H、C-C、C-O C=C、C=O C-H、C=O、C-O、O-H C=C、C-C
解析:丙烯酸含有的官能团有:碳碳双键、羧基,饱和键为C-H、O-H、C-C、C-O键,不饱和键为C=C、C=O键,极性键有C-H、C=O、C-O、O-H键,非极性键有C=C、C-C键。
20.A,CH3CH(OH)CH3有3种不同环境下的氢原子,所以1H核磁共振谱图中有3组峰,
解析:从结构上分析,CH3CH(OH)CH3有三种不同化学环境的H,CH3CH2CH2OH有四种不同的H,所以1H核磁共振谱图中A有三组峰,而B四组峰,故A是CH3CH(OH)CH3的1H-NMR谱图。
三、计算题
21. 甲方案 CH4 不需要,因为最简式中H的含量已经达到最大,所以CH4即为A的分子式
【分析】要求出A的最简式,需要计算出C、H原子的物质的量比,根据浓硫酸吸收水的质量计算氢原子的物质的量,根据反应生成二氧化碳的物质的量计算碳元素的物质的量。
解析:(1)方案甲中浓硫酸增重的质量就是生成物水的质量,根据水的质量科计算A中H原子的物质的量;碱石灰增重的质量是CO2的质量,剩余气体燃烧又生成CO2,所以CO2的总的质量是1.32g+1.76g=3.08g,根据二氧化碳的质量可计算烃A中含有C原子的物质的量,甲方案可以计算A的最简式。
由于碱石灰既能吸收二氧化碳,也能吸收水蒸气,因此在方案乙中只能计算出CO的质量,而生成物水和CO2的质量之和是5.60g,但无法计算每一种物质的质量,所以乙方案不能计算化合物的最简式。
(2)方案甲中浓硫酸增重的质量就是生成物水的质量,即水是2.52g÷18g/mol=0.14mol,则A中H原子的物质的量是0.28mol;碱石灰增重的质量是CO2的质量,剩余气体燃烧又生成CO2,所以CO2的总的质量是1.32g+1.76g=3.08g,物质的量是3.08g÷44g/mol=0.07mol,则A中含有C原子的物质的量是0.07mol。烃A分子中碳、氢原子的个数之比是0.07︰0.28=1︰4,即A最简式为CH4;
(3)由于1个碳原子最多结合4个氢原子,最简式中H的含量已经达到最大,所以CH4即为A的分子式,所以不需要其他数据。
四、元素或物质推断题
22.(1)
(2)ad
(3)
(4)+2Na→+H2↑
解析:3.96gCO2的物质的量为,n(C)=0.09mol,m(C)=1.08g;0.90gH2O的物质的量为,n(H)=0.1mol,m(H)=0.1g;故含有m(O)=1.66g-1.08g-0.1g=0.48g,n(O)=0.03mol;故N(C): N(H): N(O)=0.09mol:0.1mol:0.03mol=9:10:3,最简式为(C9H10O3)n,有机物A的相对分子质量为166,则166n=166,n=1,故有机物A的分子式为C9H10O3;
(1)用红外光谱分析得知有机物A中含有、-COOH和-OH,A的1H核磁共振谱图显示六组峰,且峰面积比为3:2:2:1:1:1,故应该有一个甲基,符合条件的有机物A的结构简式为;
(2)有机物含有羟基、羧基,
a.分子中含有羟基且与羟基相连的碳的相邻居的碳上有氢原子,能发生消去反应,选项a正确;
b.分子中含有羟基,但羟基相连的碳上没有氢,不能发生氧化反应,选项b错误;
c.分子中不含碳碳双键或碳碳三键,不能发生加聚反应,选项c错误;
d.分子中含有苯环,能发生加成反应,选项d正确;
答案选ad;
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B能和Br2的CCl4溶液发生加成反应,则B含有碳碳双键,应该为A发生消去反应而得,故B的结构简式为;另一种产物C是一种六元环状酯,则为两分子A发生酯化反应生成的环酯,故C的结构简式为;
(4)与足量的金属钠反应生成和氢气,反应的化学方程式为+2Na→+H2↑。
五、实验题
23. 2H2O22H2O+O2↑ 使有机物充分氧化生成CO2和H2O 碱石灰或氢氧化钠 吸收CO2气体 造成测得有机物中含氢量偏高 CH2O 在E后再连一个干燥管,防止空气中的CO2和H2O进入E中
【分析】先明确各装置的作用:A用来制取反应所需的氧气、B用来吸收水、C是在电炉加热时用纯氧气氧化管内样品、D用来吸收产生的水、E用于测量二氧化碳的含量;
(1)双氧水可分解生成氧气,A装置中分液漏斗盛放的物质是双氧水,化学方程式:2H2O22H2O+O2↑;
(2) 根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(3) E装置的作用为测量燃烧生成的二氧化碳的质量;
(4) 装置B用于干燥氧气,避免氧气中水分进入有机物燃烧装置发生危险,且影响有机物中氢元素的测定;
(5)根据E中增加的为二氧化碳的质量、D中增加的为水的质量计算出C、H元素质量,再根据总质量确定是否含有氧元素,最后计算出该有机物的最简式;
(6)碱石灰能够吸收空气中的二氧化碳和水分,影响测定结果,需要在E装置后增加一个干燥管。
解析:(1)双氧水可分解生成氧气,A装置中分液漏斗盛放的物质是双氧水,化学方程式为2H2O22H2O+O2↑;
(2)有机物燃烧产物中会有部分CO,CuO的作用是使有机物充分氧化生成二氧化碳和水;
(3)E装置中所盛放的物质最好选用碱石灰或氢氧化钠,因为氢氧化钠可以完全吸收反应生成的二氧化碳,故填碱石灰或氢氧化钠,它的作用是吸收二氧化碳气体;
(4)若B装置去掉,A中生成的氧气中含有水蒸气进入D装置,导致造成测得有机物中含氢量增大;
(5)本实验需要测定有机物中的碳元素、氢元素的质量,原理是根据氢氧化钠吸收的二氧化碳的质量求碳元素的质量,有机物燃烧时可能也产生一氧化碳,为了测定精确,要将有机物不完全燃烧产生的少量一氧化碳氧化成二氧化碳,氧化铜通过与一氧化碳反应能保证有机物中的碳都转化为二氧化碳;根据硫酸铜吸收的水的质量求氢元素的质量,然后根据谈情元素的质量和是否等于1.2g确定是否含有氧元素,过程如下:E管质量增加1.76g说明生成了1.76g二氧化碳,可得碳元素的质量:;D管质量增加0.72g说明生成了0.72g的水,可得H元素的质量:;从而可推出含氧元素的质量为1.2-0.48-0.08=0.64g,设最简式为CxHyOz,则:12x:y:16z=0.48:0.08:0.64,则x:y:z=1:2:1,所以该有机物的结构简式为CH2O;
(6)碱石灰中的二氧化碳和水分能够被碱石灰吸收,影响测定结果,从定量测定准确角度去考虑,该装置的改进方法为:在E后再连一个干燥管,防止空气中的二氧化碳和水。
一、选择题
1.用下图所示装置及药品进行相应实验,能达到实验目的的是
A.图1分离乙醇和乙酸 B.图2除去乙烷中的乙烯
C.图3除去四氯化碳中的溴单质 D.图4分离甲烷和氯气光照条件下发生反应的产物
2.饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶,上述过程涉及的实验方法、实验操作和物质作用说法不正确的是( )
A.①操作利用了物质的溶解性 B.②操作为过滤
C.③操作为萃取分液 D.加入抗氧化剂是为了延长饮料茶的保质期
3.下列仪器在提纯粗苯甲酸的实验中不涉及的是
A. B. C. D.
4.下列说法不正确的是
A.丁达尔效应可鉴别胶体与溶液
B.红外光谱可区分乙醇与二甲醚
C.碘水可检验淀粉是否发生水解
D.乙醇易溶于水是因为其分子与水分子间形成氢键
5.下列关于蒸馏操作有关说法正确的是
A.温度计的水银球应插入到液面以下
B.蒸馏过程中,加入沸石(或碎瓷片)的目的是防止暴沸
C.冷凝管进出水的方向是上进下出
D.用烧杯接收蒸馏出来的液体
6.下列各有机物核磁共振氢谱图显示有两个吸收峰,且峰的面积比不是3:1的是
A.甲酸甲酯 B.2-甲基丙烯
C. D.1,3,5-三甲基苯
7.化合物M可用于油漆、颜料、涂料工业,其结构如图。下列关于该物质的说法正确的是
A.分子式为C14H10O3
B.分子中碳的杂化方式有2种
C.分子中含有4种官能团
D.苯环上的一氯代物有5种
8.2022年7月25日,由河南科学家研发的阿兹夫定片获批上市,这是我国首款抗新冠口服药物,其有效成分的结构简式如图所示:
下列说法错误的是
A.的电子式为 B.非金属性:F>O>N>H
C.该有机物能发生氧化反应 D.该物质最多与反应
9.乙酸乙酯与H218O在硫酸作用下,发生下列水解反应:+H218O+CH3CH2-OH,可利用实验方法测定有机物组成、结构和研究化学反应机理。下列有关说法正确的是
A.利用李比希燃烧法可以测定乙醇的分子式为C2H6O
B.乙酸乙酯和乙醇的核磁共振氢谱均有3个峰,无法鉴别二者
C.利用金属钠与无水乙醇反应的定量关系可确定乙醇的结构
D.运用同位素示踪法可判断乙酸乙酯水解时断裂的C-O的位置
10.下列说法正确的是
A.相对分子质量相同,但结构不同的两种烃一定互为同分异构体
B.各组成元素质量分数相同的烃是同一种烃
C.最简式相同的有机物不一定互为同系物
D.分子组成相差一个或几个原子团的有机物是同系物
11.我国化学家在基于苯炔的不对称催化研究方面取得了突破,反应示意图如下。下列说法错误的是
A.该反应为加成反应 B.化合物乙的不饱和度为7
C.化合物甲核磁共振氢谱有7组峰 D.化合物甲中没有手性碳原子
12.下列烷烃进行一氯取代反应后,生成的取代产物的数目与其他物质不相同的是
A. B.
C. D.
13.下列化学用语表达正确的是
A.苯乙胺的结构简式: B.乙酸的空间填充模型:
C.羧基的电子式: D.丁烷的实验式:
14.关于甲基丙烯酸甲酯()的叙述正确的是
A.所有原子共平面 B.能发生还原反应
C.不能使Br2的CCl4溶液褪色 D.易溶于水或乙醇
15.氨、氮、硫的化合物应用广泛。ClO2(分子空间填充模型为)。NaClO等含氯消毒剂可用于杀菌消毒。人工固氮可将N2转化为NH3,再进一步制备肼(N2H4)、硝酸、铵盐等化合物,肼和偏二甲肼(C2H8N2)常用作火箭燃料,肼的燃烧热为622.08 kJ·mol-1,H2S可除去废水中Hg2+等重金属禹子,H2S 水溶液在空气中会缓慢氧化生成S而变诨浊。下列说法正确的是
A.基态氮原子的核外电子有5种运动状态
B.NH和H2S中心原子均采用sp3杂化方式
C.ClO2是由极性键构成的非极性分子
D.偏二甲肼(C2H8N2)的结构简式为:
二、填空题
16.根据题意,完成下列有机试题的填空:
(1)提纯互溶液体有机物常用的方法是___。
(2)有机物具有三种官能团:___、___和___(填官能团的名称)。
(3)化合物M分子式是C2H4Br2,M的核磁共振氢谱图如图所示,则M的结构简式为___。
(4)键线式表示的有机物的分子式为___。
(5)根据表中烃的分子式排列规律,判断空格中烃的同分异构体的数目是___。
1 2 3 4 5 6 7 8
CH4 C2H4 C3H8 C4H8 C6H12 C7H16 C8H16
(6)将甲醛(HCHO)水溶液与氨水混合蒸发可制得乌洛托品(如图所示)。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比应为___。
17.回答下列问题:
(1)某有机化合物的结构简式为,写出其分子式:_______。
(2)下面列出了几组物质:①金刚石与“足球烯”C60;②D2O与H2O;③16O、18O;④氧气与臭氧;⑤与;⑥CH3CH2CH2CH3和;⑦CH4和CH3CH2CH3;⑧CH3CH3和。其中互为同位素的是_______;互为同素异形体的是_______;属于同系物的是_______;互为同分异构体_______。
(3)写出下列有机物的系统命名或结构简式:
①(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3 _______。
② _______。
③2-甲基-2-丁烯 _______。
18.I.下列物质中:
①液氯和氯气②白磷和红磷③和④Cl和Cl⑤(CH3)2CHCH3和CH3(CH2)2CH3⑥CH4和CH3CH2CH3
(1)互为同分异构体的有_______
(2)互为同素异形体的有_______
(3)属于同位素的有_______
(4)属于同一种物质的有_______。(填序号)
Ⅱ.“立方烷”是新合成的一种烃,其分子呈正方体结构。该分子的碳架结构如下图所示,其中每个顶点表示一个碳原子,棱表示碳碳单键,氢原子未画出。
(1)“立方烷”的分子式为_______;
(2)其一氯代物共有_______种;
(3)其二氯代物共有_______种。
19.请分析丙烯酸的结构,将分析结果填入表格中。
丙烯酸的结构式 分析角度
官能团 化学键
键的饱和性 键的极性
饱和键 不饱和键 极性键 非极性键
____ ____ ____ ____ ____
20.下列两幅谱图是结构简式为CH3CH2CH2OH和的两种有机化合物的1H核磁共振谱图。请判断哪一幅是的1H-NMR谱图,并说明理由____________。
A. B.
三、计算题
21.为了测定一种气态烃A的化学式,取一定量的A置于一密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。学生甲、乙设计了两个方案,均认为根据自己的方案能求出A的最简式,他们测得的在一定条件下的有关数据如下(图中的箭头表示气流的方向,实验前系统内的空气已排尽):
甲方案:燃烧产物浓硫酸增重2.52 g碱石灰增重1.32g生成CO21.76 g
乙方案:燃烧产物碱石灰增重5.60 g固体减小0.64 g石灰水增重4g。试回答:
(1)甲、乙两方案中,你认为哪种方案能求出A的最简式_______?
(2)请根据你选择的方案,通过计算求出A的最简式_______。(要求写出计算过程)
(3)若要确定A的分子式,是否需要测定其它数据?并说明原因_______。
四、元素或物质推断题
22.某研究性学习小组对有机物A的结构和性质进行如下实验。
实验一:通过质谱分析仪测定得有机物A的相对分子质量为166。
实验二:1.66g有机物A完全燃烧后,生成3.96gCO2和0.90gH2O。
实验三:用红外光谱分析得知有机物A中含有、-COOH和-OH。
实验四:A的1H核磁共振谱图显示六组峰,且峰面积比为3:2:2:1:1:1。
(1)有机物A的结构简式为___________。
(2)有机物A在一定条件下可以发生的反应有___________。
a.消去反应 b.氧化反应 c.加聚反应 d.加成反应
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B能和Br2的CCl4溶液发生加成反应,则B的结构简式为___________。另一种产物C是一种六元环状酯,则C的结构简式为___________。
(4)写出A与足量的金属钠反应的化学方程式:___________。
五、实验题
23.化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
回答下列问题:
(1)装置A中装有MnO2,写出A装置中发生反应的化学方程式是______;
(2)C装置(燃烧管)中CuO的作用是______;
(3)写出E装置中所盛放物质的名称______,它的作用是______。
(4)若将B装置去掉会对实验结果造成什么影响?______。
(5)若准确称取1.20 g样品(烃或烃的含氧衍生物)。经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的实验式为______。
(6)从定量测定准确角度去考虑,该装置应怎样进一步改进______。
【参考答案】
一、选择题
1.D
解析:A.乙酸和乙醇互溶,乙酸和乙醇混合后不分层,不能用分液法分离乙醇和乙酸,故不选A;
B.乙烯被酸性高锰酸钾溶液氧化为二氧化碳,引入新的杂质,不能用高锰酸钾溶液除去乙烷中的乙烯,一般用溴水除乙烷中的乙烯,故不选B;
C.溴易溶于四氯化碳,不能用过滤法除去四氯化碳中的溴单质,故不选C;
D.甲烷和氯气在光照条件下发生取代反应,生成沸点不同的氯代甲烷,用蒸馏法分离甲烷和氯气光照条件下发生反应的产物,故选D;
答案选D。
2.C
解析:A.①操作为提取可溶物,利用了物质的溶解性,溶解到水中,A正确;
B.②操作为除去不溶物茶渣,方法为过滤,B正确;
C.③操作时,混合物不分层,分罐密封,无分液操作,C不正确;
D.抗氧化剂具有还原性,加入抗氧化剂是为了延长饮料茶的保质期,D正确;
答案为C。
3.A
解析:粗苯甲酸提纯过程为重结晶,经过升温溶解,降温结晶,过滤,没有分液操作,故不需要用到的仪器是分液漏斗,故答案为:A。
4.C
解析:A.胶体能发生丁达尔效应,溶液不能发生丁达尔效应,则丁达尔效应可鉴别胶体与溶液,故A正确;
B.乙醇分子中含有氢氧键,二甲醚分子中不含有氢氧键,则红外光谱可区分乙醇与二甲醚,故B正确;
C.检验淀粉是否发生水解应选用银氨溶液或新制氢氧化铜悬浊液,故C错误;
D.乙醇分子中含有羟基,羟基能与水分子间形成氢键,使得乙醇分子易溶于水,故D正确;
故选C。
5.B
解析:A.蒸馏操作中温度计的水银球应放在支管口处,故A错误;
B.蒸馏过程中,加入沸石(或碎瓷片)的目的是防止暴沸,故B正确;
C.冷凝管进出水的方向是下进上出,故C错误;
D.蒸馏时用锥形瓶接收蒸馏出来的液体,故D错误;
故选B。
6.C
【分析】若核磁共振氢谱图显示有两个吸收峰,且峰的面积为3:1,则该物质中有两种环境的氢原子,且两种环境的氢原子的个数比为3:1。
解析:A.甲酸甲酯的结构简式为CH3OOCH,有两种环境的氢原子,且个数比为3:1,故A不符合题意;
B.2-甲基丙烯为,有两种环境的氢原子,且个数比为6:2,即3:1,故B不符合题意;
C.该物质结构高度对称,有两种环境的氢原子,苯环上4个为一种,取代基上6个为一种,个数比为6:4=3:2,故C符合题意;
D.1,3,5-三甲基苯为,苯环上3个为一种氢原子,取代基上9个为一种氢原子,共两种,个数比为9:3,即3:1,故D不符合题意;
综上所述答案为C。
7.B
解析:A.由结构简式可知M的分子式为:C14H12O3,故A错误;
B.分子中含有单键碳原子和双键碳原子,杂化方式分别为:,故B正确;
C.M中含羟基、羰基、醚键三种官能团,故C错误;
D.该物质含两个苯环,一氯代物共6种,故D错误;
故选:B。
8.D
解析:A.H原子周围2个电子,N原子周围8个电子, NH2 有一个共价键,故A正确;
B.非金属性体现得电子能力:F>O>N>H,B正确;
C.该物质中含有醇羟基,可以发生氧化反应,C正确;
D.醇羟基可以与金属钠发生反应生成H2,物质结构中有2个醇羟基,故1mol物质能与2molNa发生反应,D错误;
故答案为:D。
9.D
解析:A.李比希燃烧法是将准确称量的样品置于一燃烧管中,经红热的氧化铜氧化后,再将其彻底燃烧成二氧化碳和水,用纯的氧气流把它们分别赶入烧碱石棉剂(附在石棉上粉碎的氢氧化钠)及高氯酸镁的吸收管内,这两个吸收管增加的质量分别表示生成的二氧化碳和水的质量,由此即可计算样品中的碳、氢、氧的含量,从而确定有机物中C、H、O个数的最简整数比,故利用李比希燃烧法可以测定乙醇的实验式为C2H6O,不能确定分子式,A错误;
B.乙酸乙酯()含3种等效氢,核磁共振氢谱会出现3组峰,峰面积比为3:3:2,乙醇(CH3CH2-OH)含3种等效氢,核磁共振氢谱会出现3组峰,峰面积比为3:2:1,二者的核磁共振氢谱均有3个峰,但峰面积比不同,可以鉴别二者,B错误;
C.利用金属钠与无水乙醇反应的定量关系可确定乙醇分子中-OH的个数,不能确定乙醇的结构,C错误;
D.利用18O标记水分子为CH3CO18OCH2CH3,可根据检测水解产物中乙酸有放射性或乙醇有放射性来确定C-O键的断裂位置,D正确;
答案选D。
10.C
解析:A.相对分子质量相同的两种烃的分子式不一定相同,如C10H8和C9H20,不是同分异构体,A错误;
B.各组成元素质量分数相同的烃可能是同分异构体,或者是一类烃如烯烃,B错误;
C.最简式相同的有机物不一定互为同系物,如HCHO与CH3COOH,C正确;
D.结构相似,分子组成相差一个或几个CH2原子团的有机物是同系物,D错误;
故选C。
11.D
解析:A.由反应示意图可知,苯炔中碳碳叁键的不饱和度变小,为加成反应,A正确;
B.化合物乙中含1个苯环、1个碳环、1个羰基、1个酯基,则不饱和度为4+1+1+1=7,B正确;
C.化合物甲中有7种不同环境的氢,核磁共振氢谱有7组峰,C正确;
D.化合物甲中存在1个手性碳原子(如图*所示),D错误;
答案选D。
12.C
解析:ABD都可以形成2种一氯代物,C可以形成1种一氯代物,故选C。
13.B
解析:A.苯乙胺的结构简式为,故A错误;
B.乙酸的结构简式为CH3COOH,空间填充模型为:,故B正确;
C.羧基的电子式为,故C错误;
D.丁烷的实验式为C2H5,故D错误;
故选B。
14.B
解析:A.该物质中有甲基,故不可能所有原子共面,故A项错误;
B.该物质有碳碳双键,能与氢气发生加成反应,与氢气加成也属于还原反应,故B项正确;
C.该物质中有碳碳双键,能使Br2的CCl4溶液褪色,故C项错误;
D.该物质有酯基,不易溶于水,易溶于乙醇,故D项错误。
故答案选B。
15.B
解析:A.基态氮原子的核外电子有7个电子,所以有7种运动状态,A错误;
B.NH和H2S中心原子的价层电子对数都是4,所以均采用sp3杂化方式,B正确;
C.ClO2是夹角小于120度的折线结构,是由极性键构成的极性分子,C错误;
D.偏二甲肼(C2H8N2)的结构简式为:,D错误;
故选B。
二、填空题
16. 蒸馏 羟基 羧基 醛基 CH2BrCH2Br C6H14 3 3:2
解析:(1)根据沸点不同,提纯互溶液体有机物常用的方法是蒸馏。
(2)有机物具有三种官能团:羧基、羟基和醛基。
(3)化合物M分子式是C2H4Br2,根据M的核磁共振氢谱图,M只有一种等效氢,则M的结构简式为CH2BrCH2Br;
(4)键线式中端点、折点都是C原子,根据价键规律,表示的有机物的分子式为C6H14。
(5)根据表中烃的分子式排列规律,空格中烃分子式是C5H12,同分异构体有CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、C(CH3)4,共3种;
(6)根据乌洛托品的结构简式,乌洛托品的分子式是C6N4H12,若甲醛与氨完全反应生成乌洛托品,根据C、N原子守恒,HCHO与NH3的物质的量之比应为3:2。
17.(1)C16H16O5
(2) ③ ①④ ⑦⑧ ⑥
(3) 2-甲基-5-乙基辛烷 5-甲基-3-乙基-1-己炔
【分析】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:(1)烷烃命名原则:①长--选最长碳链为主链;②多--遇等长碳链时,支链最多为主链;③近--离支链最近一端编号;④小--支链编号之和最小;⑤简--两取代基距离主链两端等距离时,从简单取代基开始编号。如取代基不同,就把简单的写在前面,复杂的写在后面;含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小。
解析:(1)根据该结构简式可得出其分子式:C16H16O5,故答案为:C16H16O5。
(2)关于“四同”的比较:
同位素:质子数相同中子数不同的核素;同素异形体:一种元素构成的不同物质,一定是单质;同分异构体:分子式相同,结构不同,必为化合物;同系物:结构相似,分子式相差若干CH2原子团。
①金刚石与“足球烯”C60都是由碳元素形成的不同单质,互为同素异形体;
②D2O与H2O都是氢的同位素与氧元素形成的化合物;
③16O与18O质子数相同,中子数不同,互为同位素;
④氧气(O2)与臭氧(O3)都是由氧元素形成的不同单质,互为同素异形体;
⑤与均为丙烷,属于同种物质;
⑥CH3CH2CH2CH3和分子式相同,但结构不同,互为同分异构体
⑦CH4和CH3CH2CH3结构相似,分子组成相差2个“CH2”原子团,互为同系物,
⑧CH3CH3和结构相似,分子组成相差3个“CH2”原子团,故互为同系物;
即互为同位素的是③;互为同素异形体的是①④;属于同系物的是⑦⑧;互为同分异构体⑥ ;故为③;①④;⑦⑧;⑥。
(3)把碳链打开按照烷烃命名规则命名:,最长的碳链含有8个C,主链为辛烷,编号从左边开始,取代基的编号最小,2号C一个甲基、5号C一个乙基,名称:2-甲基-5-乙基辛烷;故答案为:2-甲基-5-乙基辛烷。
首先选择含有碳碳三键的最长碳链作为主链,按主链中所含碳原子的数目命名为某炔;给主链编号时从距离碳碳三键最近的一端开始,侧链视为取代基,碳碳三键的位次须标明;其它同烷烃的命名规则;,名称: 5-甲基-3-乙基-1-己炔;
故答案为: 5-甲基-3-乙基-1-己炔。
2-甲基-2-丁烯,碳碳双键在2号C,甲基在2号C,主链为丁烯,结构简式为;故答案为:。
18. ③⑤ ② ④ ① C8H8 1 3
【分析】根据同分异构体、同素异形体、同位素的定义及特点进行判断;根据碳和氢原子的成键特点:碳形成4个化学键、氢原子形成1个化学键判断物质的化学式;根据等效氢法判断一氯、二氯的同分异构体个数。
解析:I. (1)根据分子式相同结构不同的特点判断互为同分异构体的是:③⑤;
(2)根据同一种元素组成的不同单质判断互为同素异形体的是:②;
(3)根据质子数相同、中子数不同的同一种元素互为同位素的是:④;
(4)液氯和氯气是同一种物质的不同状态,故选①;
Ⅱ.(1)根据顶点表示的碳原子接三个碳原子,故每个碳原子还接1个氢原子判断,立方烷的化学式为:C8H8;
(2)根据等效氢法中的对称性判断,立方烷中的氢原子都是一样的,故一氯代物只有1种;
(3)根据立方烷的特点,其二氯代物分别是相邻位置的棱上,和面对角线上的及体对角线上的二氯取代,共有3种。
19.碳碳双键、羧基 C-H、O-H、C-C、C-O C=C、C=O C-H、C=O、C-O、O-H C=C、C-C
解析:丙烯酸含有的官能团有:碳碳双键、羧基,饱和键为C-H、O-H、C-C、C-O键,不饱和键为C=C、C=O键,极性键有C-H、C=O、C-O、O-H键,非极性键有C=C、C-C键。
20.A,CH3CH(OH)CH3有3种不同环境下的氢原子,所以1H核磁共振谱图中有3组峰,
解析:从结构上分析,CH3CH(OH)CH3有三种不同化学环境的H,CH3CH2CH2OH有四种不同的H,所以1H核磁共振谱图中A有三组峰,而B四组峰,故A是CH3CH(OH)CH3的1H-NMR谱图。
三、计算题
21. 甲方案 CH4 不需要,因为最简式中H的含量已经达到最大,所以CH4即为A的分子式
【分析】要求出A的最简式,需要计算出C、H原子的物质的量比,根据浓硫酸吸收水的质量计算氢原子的物质的量,根据反应生成二氧化碳的物质的量计算碳元素的物质的量。
解析:(1)方案甲中浓硫酸增重的质量就是生成物水的质量,根据水的质量科计算A中H原子的物质的量;碱石灰增重的质量是CO2的质量,剩余气体燃烧又生成CO2,所以CO2的总的质量是1.32g+1.76g=3.08g,根据二氧化碳的质量可计算烃A中含有C原子的物质的量,甲方案可以计算A的最简式。
由于碱石灰既能吸收二氧化碳,也能吸收水蒸气,因此在方案乙中只能计算出CO的质量,而生成物水和CO2的质量之和是5.60g,但无法计算每一种物质的质量,所以乙方案不能计算化合物的最简式。
(2)方案甲中浓硫酸增重的质量就是生成物水的质量,即水是2.52g÷18g/mol=0.14mol,则A中H原子的物质的量是0.28mol;碱石灰增重的质量是CO2的质量,剩余气体燃烧又生成CO2,所以CO2的总的质量是1.32g+1.76g=3.08g,物质的量是3.08g÷44g/mol=0.07mol,则A中含有C原子的物质的量是0.07mol。烃A分子中碳、氢原子的个数之比是0.07︰0.28=1︰4,即A最简式为CH4;
(3)由于1个碳原子最多结合4个氢原子,最简式中H的含量已经达到最大,所以CH4即为A的分子式,所以不需要其他数据。
四、元素或物质推断题
22.(1)
(2)ad
(3)
(4)+2Na→+H2↑
解析:3.96gCO2的物质的量为,n(C)=0.09mol,m(C)=1.08g;0.90gH2O的物质的量为,n(H)=0.1mol,m(H)=0.1g;故含有m(O)=1.66g-1.08g-0.1g=0.48g,n(O)=0.03mol;故N(C): N(H): N(O)=0.09mol:0.1mol:0.03mol=9:10:3,最简式为(C9H10O3)n,有机物A的相对分子质量为166,则166n=166,n=1,故有机物A的分子式为C9H10O3;
(1)用红外光谱分析得知有机物A中含有、-COOH和-OH,A的1H核磁共振谱图显示六组峰,且峰面积比为3:2:2:1:1:1,故应该有一个甲基,符合条件的有机物A的结构简式为;
(2)有机物含有羟基、羧基,
a.分子中含有羟基且与羟基相连的碳的相邻居的碳上有氢原子,能发生消去反应,选项a正确;
b.分子中含有羟基,但羟基相连的碳上没有氢,不能发生氧化反应,选项b错误;
c.分子中不含碳碳双键或碳碳三键,不能发生加聚反应,选项c错误;
d.分子中含有苯环,能发生加成反应,选项d正确;
答案选ad;
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B能和Br2的CCl4溶液发生加成反应,则B含有碳碳双键,应该为A发生消去反应而得,故B的结构简式为;另一种产物C是一种六元环状酯,则为两分子A发生酯化反应生成的环酯,故C的结构简式为;
(4)与足量的金属钠反应生成和氢气,反应的化学方程式为+2Na→+H2↑。
五、实验题
23. 2H2O22H2O+O2↑ 使有机物充分氧化生成CO2和H2O 碱石灰或氢氧化钠 吸收CO2气体 造成测得有机物中含氢量偏高 CH2O 在E后再连一个干燥管,防止空气中的CO2和H2O进入E中
【分析】先明确各装置的作用:A用来制取反应所需的氧气、B用来吸收水、C是在电炉加热时用纯氧气氧化管内样品、D用来吸收产生的水、E用于测量二氧化碳的含量;
(1)双氧水可分解生成氧气,A装置中分液漏斗盛放的物质是双氧水,化学方程式:2H2O22H2O+O2↑;
(2) 根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(3) E装置的作用为测量燃烧生成的二氧化碳的质量;
(4) 装置B用于干燥氧气,避免氧气中水分进入有机物燃烧装置发生危险,且影响有机物中氢元素的测定;
(5)根据E中增加的为二氧化碳的质量、D中增加的为水的质量计算出C、H元素质量,再根据总质量确定是否含有氧元素,最后计算出该有机物的最简式;
(6)碱石灰能够吸收空气中的二氧化碳和水分,影响测定结果,需要在E装置后增加一个干燥管。
解析:(1)双氧水可分解生成氧气,A装置中分液漏斗盛放的物质是双氧水,化学方程式为2H2O22H2O+O2↑;
(2)有机物燃烧产物中会有部分CO,CuO的作用是使有机物充分氧化生成二氧化碳和水;
(3)E装置中所盛放的物质最好选用碱石灰或氢氧化钠,因为氢氧化钠可以完全吸收反应生成的二氧化碳,故填碱石灰或氢氧化钠,它的作用是吸收二氧化碳气体;
(4)若B装置去掉,A中生成的氧气中含有水蒸气进入D装置,导致造成测得有机物中含氢量增大;
(5)本实验需要测定有机物中的碳元素、氢元素的质量,原理是根据氢氧化钠吸收的二氧化碳的质量求碳元素的质量,有机物燃烧时可能也产生一氧化碳,为了测定精确,要将有机物不完全燃烧产生的少量一氧化碳氧化成二氧化碳,氧化铜通过与一氧化碳反应能保证有机物中的碳都转化为二氧化碳;根据硫酸铜吸收的水的质量求氢元素的质量,然后根据谈情元素的质量和是否等于1.2g确定是否含有氧元素,过程如下:E管质量增加1.76g说明生成了1.76g二氧化碳,可得碳元素的质量:;D管质量增加0.72g说明生成了0.72g的水,可得H元素的质量:;从而可推出含氧元素的质量为1.2-0.48-0.08=0.64g,设最简式为CxHyOz,则:12x:y:16z=0.48:0.08:0.64,则x:y:z=1:2:1,所以该有机物的结构简式为CH2O;
(6)碱石灰中的二氧化碳和水分能够被碱石灰吸收,影响测定结果,从定量测定准确角度去考虑,该装置的改进方法为:在E后再连一个干燥管,防止空气中的二氧化碳和水。
