五年2019-2023高考化学真题按知识点分类汇编-2化学用语(元素符号、化学式等含解析)
文档属性
| 名称 | 五年2019-2023高考化学真题按知识点分类汇编-2化学用语(元素符号、化学式等含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-14 09:38:17 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
五年2019-2023高考化学真题按知识点分类汇编-2化学用语(元素符号、化学式等含解析)
一、单选题
1.(2023·浙江·统考高考真题)下列化学用语表示正确的是
A.分子的球棍模型:
B.的价层电子对互斥模型:
C.的电子式:
D.的名称:3 甲基戊烷
2.(2023·湖南·统考高考真题)下列化学用语表述错误的是
A.HClO的电子式:
B.中子数为10的氧原子:O
C.NH3分子的VSEPR模型:
D.基态N原子的价层电子排布图:
3.(2023·湖北·统考高考真题)化学用语可以表达化学过程,下列化学用语的表达错误的是
A.用电子式表示的形成:
B.用离子方程式表示溶于烧碱溶液:
C.用电子云轮廓图表示H-H的s-sσ键形成的示意图:
D.用化学方程式表示尿素与甲醛制备线型脲醛树脂:
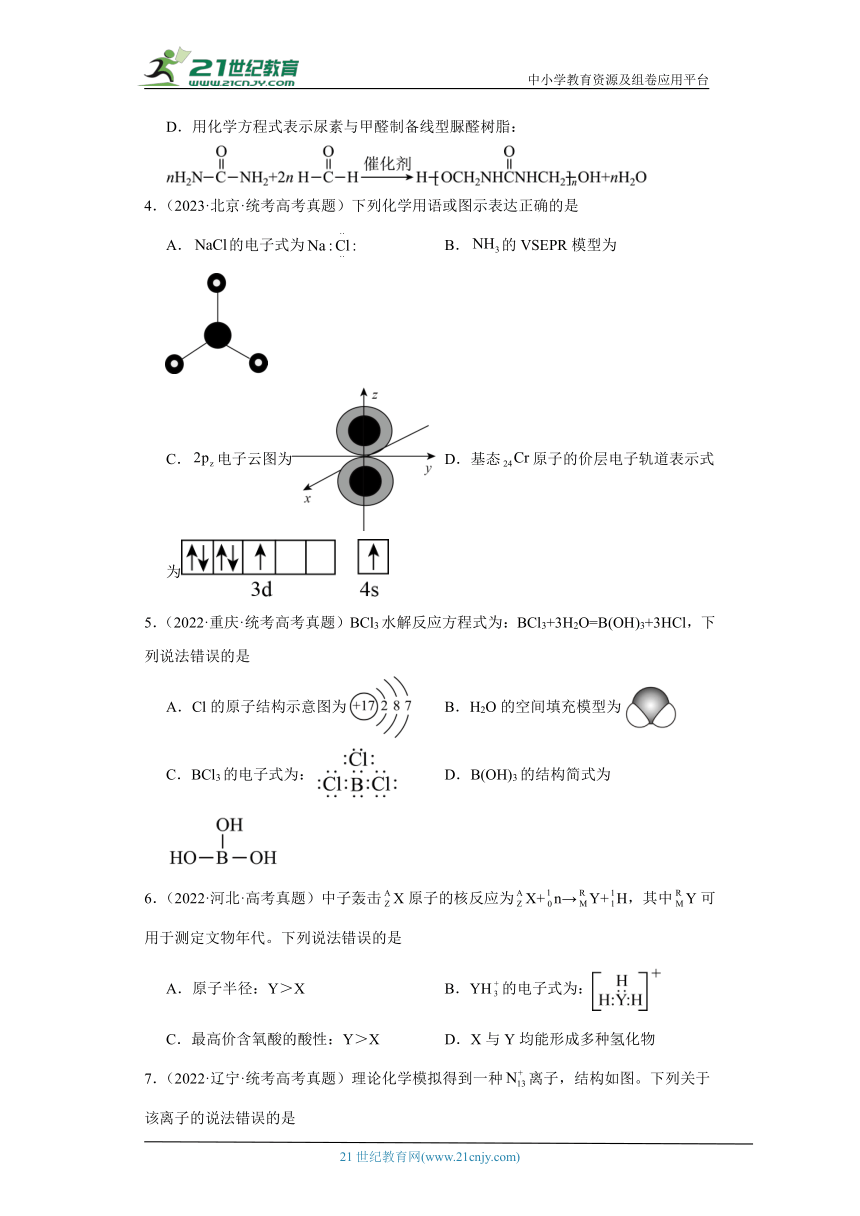
4.(2023·北京·统考高考真题)下列化学用语或图示表达正确的是
A.的电子式为 B.的VSEPR模型为
C.电子云图为 D.基态原子的价层电子轨道表示式为
5.(2022·重庆·统考高考真题)BCl3水解反应方程式为:BCl3+3H2O=B(OH)3+3HCl,下列说法错误的是
A.Cl的原子结构示意图为 B.H2O的空间填充模型为
C.BCl3的电子式为: D.B(OH)3的结构简式为
6.(2022·河北·高考真题)中子轰击X原子的核反应为X+n→Y+H,其中Y可用于测定文物年代。下列说法错误的是
A.原子半径:Y>X B.YH的电子式为:
C.最高价含氧酸的酸性:Y>X D.X与Y均能形成多种氢化物
7.(2022·辽宁·统考高考真题)理论化学模拟得到一种离子,结构如图。下列关于该离子的说法错误的是
A.所有原子均满足8电子结构 B.N原子的杂化方式有2种
C.空间结构为四面体形 D.常温下不稳定
8.(2022·辽宁·统考高考真题)下列符号表征或说法正确的是
A.电离: B.位于元素周期表p区
C.空间结构:平面三角形 D.电子式:
9.(2021·重庆·统考高考真题)次磷酸根()的球棍模型如图所示,下列说法错误的是
A.P的原子结构示意图为:
B.次磷酸根的电子式为:
C.次磷酸根的结构式为:
D.次磷酸分子式为:H3PO2
10.(2021·福建·统考高考真题)实验室配制碘水时,通常将溶于溶液:。关于该溶液,下列说法正确的是
A.的电子式为 B.滴入淀粉溶液,不变蓝
C.加水稀释,平衡逆向移动 D.加少量固体平衡正向移动
11.(2021·北京·高考真题)下列有关放射性核素氚(H)的表述不正确的是
A.H原子核外电子数为1 B.H原子核内中子数为3
C.与H2化学性质基本相同 D.具有放射性
12.(2021·江苏·高考真题)反应Cl2+2NaOH=NaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是
A.Cl2是极性分子
B.NaOH的电子式为
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
13.(2021·天津·统考高考真题)下列化学用语表达正确的是
A.F-的离子结构示意图:
B.基态碳原子的轨道表示式:
C.丙炔的键线式:
D.H2O分子的球棍模型:
14.(2020·海南·高考真题)下列叙述正确的是
A.HClO 的结构式为H-Cl-O B.核内有33个中子的Fe表示为Fe
C.NH2OH的电子式为 D.CH3CHO 的球棍模型为
15.(2020·江苏·高考真题)反应可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子:
B.N2分子的电子式:
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
16.(2020·天津·高考真题)熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为(x=5~3,难溶于熔融硫),下列说法错误的是
A.Na2S4的电子式为
B.放电时正极反应为
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以为隔膜的二次电池
17.(2020·浙江·高考真题)下列表示不正确的是
A.乙烯的结构式: B.甲酸甲酯的结构简式:
C.甲基丁烷的键线式: D.甲基的电子式:
18.(2019·浙江·统考高考真题)下列表示不正确的是
A.Na+ 结构示意图 B.乙烷的比例模型
C.乙醛的结构简式CH3CHO D.氯化钙的电子式
二、多选题
19.(2022·海南·统考高考真题)已知,的酸性比强。下列有关说法正确的是
A.HCl的电子式为 B.Cl-Cl键的键长比I-I键短
C.分子中只有σ键 D.的酸性比强
三、原理综合题
20.(2021·天津·统考高考真题)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应,回答下列问题:
(1)CH4的电子式为___________,CS2分子的立体构型为___________。
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________。
②当以下数值不变时,能说明该反应达到平衡的是___________(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___________(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________。
(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式___________。
四、填空题
21.(2020·浙江·高考真题)(1)气态氢化物热稳定性大于的主要原因是__________。
(2)是离子化合物,各原子均满足8电子稳定结构,的电子式是_______。
(3)常温下,在水中的溶解度乙醇大于氯乙烷,原因是__________。
参考答案:
1.D
【详解】A.分子是“V”形结构,因此该图不是分子的球棍模型,故A错误;
B.中心原子价层电子对数为,其价层电子对互斥模型为平面三角形,故B错误;
C.是离子化合物,其电子式:,故C错误;
D.的结构简式为,其名称为3 甲基戊烷,故D正确。
综上所述,答案为D。
2.C
【详解】A.HClO中O元素呈负化合价,在结构中得到H和Cl共用的电子,因此HClO的电子式为,A正确;
B.中子数为10,质子数为8的O原子其相对原子质量为10+8=18,其原子表示为O,B正确;
C.根据VSEPR模型计算,NH3分子中有1对孤电子对,N还连接有3和H原子,因此NH3的VSEPR模型为四面体型,C错误;
D.基态N原子的价层电子排布为2s22p3,其电子排布图为,D正确;
故答案选C。
3.D
【详解】A.钾原子失去电子,硫原子得到电子形成硫化钾,硫化钾为离子化合物,用电子式表示的形成:,A正确;
B.氢氧化铝为两性氢氧化物,可以和强碱反应生成四羟基合铝酸根离子,离子方程式为:,B正确;
C.H的s能级为球形,两个氢原子形成氢气的时候,是两个s能级的原子轨道相互靠近,形成新的轨道,则用电子云轮廓图表示H-H的s-sσ键形成的示意图:,C正确;
D.用化学方程式表示尿素与甲醛制备线型脲醛树脂为,D错误;
故选D。
4.C
【详解】A.氯化钠是离子化合物,其电子式是 ,A项错误;
B.氨分子的VSEPR模型是四面体结构,B项错误:
C.p能级电子云是哑铃(纺锤)形,C项正确;
D.基态铬原子的价层电子轨道表示式是 ,D项错误;
故选C。
5.C
【详解】A.Cl为荷电核数为17,原子结构示意图为 ,A项正确;
B.分子为V形结构,且O原子的半径比H原子的半径大,B项正确;
C.是缺电子化合物,B提供3个电子,与3个Cl分别共用1对电子,电子式应为,C项错误;
D.的结构简式为,D项正确;
答案选C。
6.C
【分析】由Y可用于测定文物年代可知,Y为C元素;由核反应方程式可知,X为N元素。
【详解】A.同周期元素,从左到右原子半径依次减小,则碳原子的原子半径大于氮原子,故A正确;
B.CH为质子数大于电子数的阳离子,电子式为,故B正确;
C.元素的非金属性越强,最高价含氧酸的酸性越强,氮元素的非金属性强于碳元素,则硝酸的酸性强于碳酸,故C错误;
D.碳元素可以与氢元素形成的氢化物为烃类化合物,氮元素可以与氢元素形成的氢化物可能为氨气、联氨,则碳元素和氮元素均能形成多种氢化物,故D正确;
故选C。
7.B
【详解】A.由的结构式可知,所有N原子均满足8电子稳定结构,A正确;
B.中心N原子为杂化,与中心N原子直接相连的N原子为杂化,与端位N原子直接相连的N原子为杂化,端位N原子为杂化,则N原子的杂化方式有3种,B错误;
C.中心N原子为杂化,则其空间结构为四面体形,C正确;
D.中含叠氮结构(),常温下不稳定,D正确;
故答案选B。
8.C
【详解】A.是二元弱酸,电离分步进行,其一级电离方程式为,A错误;
B.基态原子的价电子排布式是,最后一个电子填充在s能级,位于元素周期表s区,B错误;
C.中心碳原子的价层电子对数为,故其空间结构为平面三角形,C正确;
D.是离子化合物,电子式为,D错误;
故答案选C。
9.B
【详解】A.P是15号元素,质子数为15,核外电子数为15,原子结构示意图为: ,A正确;
B.次磷酸根中其中一个O与P原子共用2对电子对,正确的电子式为: ,B错误;
C.由次磷酸根()的球棍模型,可得次磷酸根的结构式为: ,C正确;
D.次磷酸根为,次磷酸为一元弱酸,则次磷酸分子式为:H3PO2,D正确;
故选:B。
10.C
【详解】A.是离子化合物,电子式为,A错误;
B.该溶液存在,滴入淀粉溶液,变蓝,B错误;
C.根据勒夏特列原理,加水稀释,平衡朝着离子浓度增大的方向移动,即逆向移动,C正确;
D.加少量固体,与生成沉淀,浓度下降,平衡逆向移动,D错误;
故选C。
11.B
【详解】A.放射性核素H,质量数是3,质子数是1,质子数等于核外电子数,所以核外电子数等于1,故A正确;
B.放射性核素H,质量数是3,质子数是1,所以中子数等于3-1=2,故B错误;
C.与H2的相对分子质量不同,二者的沸点不同,但二者同属于氢气,化学性质基本相同,故C正确;
D.H是放射性核素,所以3H2O也具有放射性,故D正确;
故选B。
12.C
【详解】A.氯气分子结构对称,正负电荷中心重合,为非极性分子,A错误;
B.NaOH为离子化合物,电子式为,B错误;
C.NaClO含有钠离子和次氯酸根形成的离子键,含有O原子和Cl原子形成的共价键,C正确;
D.Cl-有3层电子,Na+有2层电子,D错误;
综上所述答案为C。
13.D
【详解】A.F-最外层有8个电子,离子结构示意图:,故A错误;
B.基态碳原子的轨道表示式:,故B错误;
C.丙炔的三个碳原子在一条线上,故C错误;
D.H2O分子的空间构型为V型,所以球棍模型为:,故D正确;
故选D。
14.C
【详解】A. HClO 的结构式为H-O-Cl,故A错误;
B. 核内有33个中子的Fe原子质量数为:33+26=59,表示为Fe,故B错误;
C. NH2OH的电子式为,故C正确;
D. CH3CHO 的球棍模型为,故D错误;
正确答案是C。
15.C
【详解】A.N原子的质子数为7,中子数为9的氮原子的质量数为7+9=16,该氮原子表示为,A错误;
B.N2分子中两个N原子间形成3对共用电子对,N2分子的电子式为,B错误;
C.Cl2分子中两个Cl原子间形成1对共用电子对,Cl2分子的结构式为Cl—Cl,C正确;
D.Cl-的核电荷数为17,核外有18个电子,Cl-的结构示意图为,D错误;
答案选C。
16.C
【分析】根据电池反应:可知,放电时,钠作负极,发生氧化反应,电极反应为:Na-e-= Na+,硫作正极,发生还原反应,电极反应为,据此分析。
【详解】A.Na2S4属于离子化合物,4个硫原子间形成三对共用电子对,电子式为,故A正确;
B.放电时发生的是原电池反应,正极发生还原反应,电极反应为:,故B正确;
C.放电时,Na为电池的负极,正极为硫单质,故C错误;
D.放电时,该电池是以钠作负极,硫作正极的原电池,充电时,是电解池,为隔膜,起到电解质溶液的作用,该电池为二次电池,故D正确;
答案选C。
17.B
【详解】A.结构式是每一对共用电子对用一个短横来表示,乙烯分子中每个碳原子和每个氢原子形成一对共用电子对,碳原子和碳原子形成两对共用电子对,故A正确;
B.结构简式中需要体现出特殊结构和官能团,甲酸甲酯中要体现出酯基,其结构简式为HCOOCH3,故B错误;
C.键线式中每个端点为一个C原子,省略C—H键,故C正确;
D.甲基中碳原子和三个氢原子形成3对共用电子对,还剩一个成单电子,故D正确;
答案选B。
18.B
【详解】A. Na+ 结构示意图为,选项A正确;B. 乙烷的比例模型为,为乙烷的球棍模型,选项B不正确;C. 乙醛的结构简式为CH3CHO,选项C正确;D. 氯化钙的电子式为,选项D正确。答案选B。
【点睛】本题主要考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
19.BD
【详解】A.HCl为共价化合物,H原子和Cl原子间形成共用电子对,其电子式为,A错误;
B.原子半径Cl<I,故键长:Cl—Cl<I—I,B正确;
C.CH3COOH分子中,羧基的碳氧双键中含有π键,C错误;
D.电负性Cl>I,对O-H的共用电子对具有更强的吸引作用,导致O-H更易电离,故而酸性增加。即ClCH2COOH的酸性比ICH2COOH强,D正确;
答案选BD。
20.(1) 直线形
(2) 30% d
(3) 放热 600℃时甲烷平衡转化率高达99%,低于600℃时,S2浓度明显偏小,且反应速率慢
(4)、、写出任意一个
【详解】(1)CH4的电子式为:;CS2和二氧化碳是等电子体故其立体构型为:直线型;
(2)①在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应,
CS2的体积分数为10%,即,解得x=0.3a,则CH4的转化率为30%。
②a.恒容容器,质量不变,故密度一直不变,故密度不变不一定平衡,不选;b.反应前后气体的物质的量不变,故压强也一直不变,故压强不变一定平衡,不选;c.CH4与S2体积比一直为1:2,故不一定平衡,不选;d.CS2的体积分数说明反应已经达到了平衡,选;故选d。
(3)由图可知,随温度升高,甲烷的转化率降低,故反应为放热反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是600℃时甲烷平衡转化率高达99%,低于600℃时,S2浓度明显偏小,且反应速率慢。
(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S)发生的化学反应方程式为、、写出任意一个。
21. 原子半径,键能 乙醇与水之间形成氢键而氯乙烷没有
【分析】(1)气态氢化物的稳定性取决于共价键键能的大小;
(2)根据价键规则书写CaCN2的电子式;
(3)溶质分子与溶剂分子间形成氢键可增大溶质的溶解度。
【详解】(1)由于原子半径F<Cl,故键长:F—H<Cl—H,键能:F—H>Cl—H,所以HF比HCl稳定,故答案为:原子半径F<Cl,键能F—H>Cl—H。
(2)CaCN2是离子化合物,则阳离子为Ca2+、为阴离子;Ca原子最外层有2个电子,易失去最外层的2个电子达到8电子的稳定结构;N原子最外层有5个电子,易得到3个电子或形成3对共用电子对达到8电子的稳定结构;C原子最外层有4个电子,通常形成4对共用电子对达到8电子的稳定结构;则每个N原子分别得到Ca失去的1个电子、与C原子形成两对共用电子对,Ca、C、N都达到8电子的稳定结构,CaCN2的电子式为,故答案为:。
(3)乙醇和氯乙烷都属于极性分子,但乙醇与水分子之间形成氢键,而氯乙烷不能与水分子形成氢键,故常温下在水中的溶解度乙醇大于氯乙烷,故答案为:乙醇与水分子之间形成氢键而氯乙烷没有。
【点睛】与CO2互为等电子体,可以根据CO2的电子式,结合等电子原理书写的电子式。
试卷第1页,共3页
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
五年2019-2023高考化学真题按知识点分类汇编-2化学用语(元素符号、化学式等含解析)
一、单选题
1.(2023·浙江·统考高考真题)下列化学用语表示正确的是
A.分子的球棍模型:
B.的价层电子对互斥模型:
C.的电子式:
D.的名称:3 甲基戊烷
2.(2023·湖南·统考高考真题)下列化学用语表述错误的是
A.HClO的电子式:
B.中子数为10的氧原子:O
C.NH3分子的VSEPR模型:
D.基态N原子的价层电子排布图:
3.(2023·湖北·统考高考真题)化学用语可以表达化学过程,下列化学用语的表达错误的是
A.用电子式表示的形成:
B.用离子方程式表示溶于烧碱溶液:
C.用电子云轮廓图表示H-H的s-sσ键形成的示意图:
D.用化学方程式表示尿素与甲醛制备线型脲醛树脂:
4.(2023·北京·统考高考真题)下列化学用语或图示表达正确的是
A.的电子式为 B.的VSEPR模型为
C.电子云图为 D.基态原子的价层电子轨道表示式为
5.(2022·重庆·统考高考真题)BCl3水解反应方程式为:BCl3+3H2O=B(OH)3+3HCl,下列说法错误的是
A.Cl的原子结构示意图为 B.H2O的空间填充模型为
C.BCl3的电子式为: D.B(OH)3的结构简式为
6.(2022·河北·高考真题)中子轰击X原子的核反应为X+n→Y+H,其中Y可用于测定文物年代。下列说法错误的是
A.原子半径:Y>X B.YH的电子式为:
C.最高价含氧酸的酸性:Y>X D.X与Y均能形成多种氢化物
7.(2022·辽宁·统考高考真题)理论化学模拟得到一种离子,结构如图。下列关于该离子的说法错误的是
A.所有原子均满足8电子结构 B.N原子的杂化方式有2种
C.空间结构为四面体形 D.常温下不稳定
8.(2022·辽宁·统考高考真题)下列符号表征或说法正确的是
A.电离: B.位于元素周期表p区
C.空间结构:平面三角形 D.电子式:
9.(2021·重庆·统考高考真题)次磷酸根()的球棍模型如图所示,下列说法错误的是
A.P的原子结构示意图为:
B.次磷酸根的电子式为:
C.次磷酸根的结构式为:
D.次磷酸分子式为:H3PO2
10.(2021·福建·统考高考真题)实验室配制碘水时,通常将溶于溶液:。关于该溶液,下列说法正确的是
A.的电子式为 B.滴入淀粉溶液,不变蓝
C.加水稀释,平衡逆向移动 D.加少量固体平衡正向移动
11.(2021·北京·高考真题)下列有关放射性核素氚(H)的表述不正确的是
A.H原子核外电子数为1 B.H原子核内中子数为3
C.与H2化学性质基本相同 D.具有放射性
12.(2021·江苏·高考真题)反应Cl2+2NaOH=NaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是
A.Cl2是极性分子
B.NaOH的电子式为
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
13.(2021·天津·统考高考真题)下列化学用语表达正确的是
A.F-的离子结构示意图:
B.基态碳原子的轨道表示式:
C.丙炔的键线式:
D.H2O分子的球棍模型:
14.(2020·海南·高考真题)下列叙述正确的是
A.HClO 的结构式为H-Cl-O B.核内有33个中子的Fe表示为Fe
C.NH2OH的电子式为 D.CH3CHO 的球棍模型为
15.(2020·江苏·高考真题)反应可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子:
B.N2分子的电子式:
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
16.(2020·天津·高考真题)熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为(x=5~3,难溶于熔融硫),下列说法错误的是
A.Na2S4的电子式为
B.放电时正极反应为
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以为隔膜的二次电池
17.(2020·浙江·高考真题)下列表示不正确的是
A.乙烯的结构式: B.甲酸甲酯的结构简式:
C.甲基丁烷的键线式: D.甲基的电子式:
18.(2019·浙江·统考高考真题)下列表示不正确的是
A.Na+ 结构示意图 B.乙烷的比例模型
C.乙醛的结构简式CH3CHO D.氯化钙的电子式
二、多选题
19.(2022·海南·统考高考真题)已知,的酸性比强。下列有关说法正确的是
A.HCl的电子式为 B.Cl-Cl键的键长比I-I键短
C.分子中只有σ键 D.的酸性比强
三、原理综合题
20.(2021·天津·统考高考真题)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应,回答下列问题:
(1)CH4的电子式为___________,CS2分子的立体构型为___________。
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________。
②当以下数值不变时,能说明该反应达到平衡的是___________(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___________(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________。
(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式___________。
四、填空题
21.(2020·浙江·高考真题)(1)气态氢化物热稳定性大于的主要原因是__________。
(2)是离子化合物,各原子均满足8电子稳定结构,的电子式是_______。
(3)常温下,在水中的溶解度乙醇大于氯乙烷,原因是__________。
参考答案:
1.D
【详解】A.分子是“V”形结构,因此该图不是分子的球棍模型,故A错误;
B.中心原子价层电子对数为,其价层电子对互斥模型为平面三角形,故B错误;
C.是离子化合物,其电子式:,故C错误;
D.的结构简式为,其名称为3 甲基戊烷,故D正确。
综上所述,答案为D。
2.C
【详解】A.HClO中O元素呈负化合价,在结构中得到H和Cl共用的电子,因此HClO的电子式为,A正确;
B.中子数为10,质子数为8的O原子其相对原子质量为10+8=18,其原子表示为O,B正确;
C.根据VSEPR模型计算,NH3分子中有1对孤电子对,N还连接有3和H原子,因此NH3的VSEPR模型为四面体型,C错误;
D.基态N原子的价层电子排布为2s22p3,其电子排布图为,D正确;
故答案选C。
3.D
【详解】A.钾原子失去电子,硫原子得到电子形成硫化钾,硫化钾为离子化合物,用电子式表示的形成:,A正确;
B.氢氧化铝为两性氢氧化物,可以和强碱反应生成四羟基合铝酸根离子,离子方程式为:,B正确;
C.H的s能级为球形,两个氢原子形成氢气的时候,是两个s能级的原子轨道相互靠近,形成新的轨道,则用电子云轮廓图表示H-H的s-sσ键形成的示意图:,C正确;
D.用化学方程式表示尿素与甲醛制备线型脲醛树脂为,D错误;
故选D。
4.C
【详解】A.氯化钠是离子化合物,其电子式是 ,A项错误;
B.氨分子的VSEPR模型是四面体结构,B项错误:
C.p能级电子云是哑铃(纺锤)形,C项正确;
D.基态铬原子的价层电子轨道表示式是 ,D项错误;
故选C。
5.C
【详解】A.Cl为荷电核数为17,原子结构示意图为 ,A项正确;
B.分子为V形结构,且O原子的半径比H原子的半径大,B项正确;
C.是缺电子化合物,B提供3个电子,与3个Cl分别共用1对电子,电子式应为,C项错误;
D.的结构简式为,D项正确;
答案选C。
6.C
【分析】由Y可用于测定文物年代可知,Y为C元素;由核反应方程式可知,X为N元素。
【详解】A.同周期元素,从左到右原子半径依次减小,则碳原子的原子半径大于氮原子,故A正确;
B.CH为质子数大于电子数的阳离子,电子式为,故B正确;
C.元素的非金属性越强,最高价含氧酸的酸性越强,氮元素的非金属性强于碳元素,则硝酸的酸性强于碳酸,故C错误;
D.碳元素可以与氢元素形成的氢化物为烃类化合物,氮元素可以与氢元素形成的氢化物可能为氨气、联氨,则碳元素和氮元素均能形成多种氢化物,故D正确;
故选C。
7.B
【详解】A.由的结构式可知,所有N原子均满足8电子稳定结构,A正确;
B.中心N原子为杂化,与中心N原子直接相连的N原子为杂化,与端位N原子直接相连的N原子为杂化,端位N原子为杂化,则N原子的杂化方式有3种,B错误;
C.中心N原子为杂化,则其空间结构为四面体形,C正确;
D.中含叠氮结构(),常温下不稳定,D正确;
故答案选B。
8.C
【详解】A.是二元弱酸,电离分步进行,其一级电离方程式为,A错误;
B.基态原子的价电子排布式是,最后一个电子填充在s能级,位于元素周期表s区,B错误;
C.中心碳原子的价层电子对数为,故其空间结构为平面三角形,C正确;
D.是离子化合物,电子式为,D错误;
故答案选C。
9.B
【详解】A.P是15号元素,质子数为15,核外电子数为15,原子结构示意图为: ,A正确;
B.次磷酸根中其中一个O与P原子共用2对电子对,正确的电子式为: ,B错误;
C.由次磷酸根()的球棍模型,可得次磷酸根的结构式为: ,C正确;
D.次磷酸根为,次磷酸为一元弱酸,则次磷酸分子式为:H3PO2,D正确;
故选:B。
10.C
【详解】A.是离子化合物,电子式为,A错误;
B.该溶液存在,滴入淀粉溶液,变蓝,B错误;
C.根据勒夏特列原理,加水稀释,平衡朝着离子浓度增大的方向移动,即逆向移动,C正确;
D.加少量固体,与生成沉淀,浓度下降,平衡逆向移动,D错误;
故选C。
11.B
【详解】A.放射性核素H,质量数是3,质子数是1,质子数等于核外电子数,所以核外电子数等于1,故A正确;
B.放射性核素H,质量数是3,质子数是1,所以中子数等于3-1=2,故B错误;
C.与H2的相对分子质量不同,二者的沸点不同,但二者同属于氢气,化学性质基本相同,故C正确;
D.H是放射性核素,所以3H2O也具有放射性,故D正确;
故选B。
12.C
【详解】A.氯气分子结构对称,正负电荷中心重合,为非极性分子,A错误;
B.NaOH为离子化合物,电子式为,B错误;
C.NaClO含有钠离子和次氯酸根形成的离子键,含有O原子和Cl原子形成的共价键,C正确;
D.Cl-有3层电子,Na+有2层电子,D错误;
综上所述答案为C。
13.D
【详解】A.F-最外层有8个电子,离子结构示意图:,故A错误;
B.基态碳原子的轨道表示式:,故B错误;
C.丙炔的三个碳原子在一条线上,故C错误;
D.H2O分子的空间构型为V型,所以球棍模型为:,故D正确;
故选D。
14.C
【详解】A. HClO 的结构式为H-O-Cl,故A错误;
B. 核内有33个中子的Fe原子质量数为:33+26=59,表示为Fe,故B错误;
C. NH2OH的电子式为,故C正确;
D. CH3CHO 的球棍模型为,故D错误;
正确答案是C。
15.C
【详解】A.N原子的质子数为7,中子数为9的氮原子的质量数为7+9=16,该氮原子表示为,A错误;
B.N2分子中两个N原子间形成3对共用电子对,N2分子的电子式为,B错误;
C.Cl2分子中两个Cl原子间形成1对共用电子对,Cl2分子的结构式为Cl—Cl,C正确;
D.Cl-的核电荷数为17,核外有18个电子,Cl-的结构示意图为,D错误;
答案选C。
16.C
【分析】根据电池反应:可知,放电时,钠作负极,发生氧化反应,电极反应为:Na-e-= Na+,硫作正极,发生还原反应,电极反应为,据此分析。
【详解】A.Na2S4属于离子化合物,4个硫原子间形成三对共用电子对,电子式为,故A正确;
B.放电时发生的是原电池反应,正极发生还原反应,电极反应为:,故B正确;
C.放电时,Na为电池的负极,正极为硫单质,故C错误;
D.放电时,该电池是以钠作负极,硫作正极的原电池,充电时,是电解池,为隔膜,起到电解质溶液的作用,该电池为二次电池,故D正确;
答案选C。
17.B
【详解】A.结构式是每一对共用电子对用一个短横来表示,乙烯分子中每个碳原子和每个氢原子形成一对共用电子对,碳原子和碳原子形成两对共用电子对,故A正确;
B.结构简式中需要体现出特殊结构和官能团,甲酸甲酯中要体现出酯基,其结构简式为HCOOCH3,故B错误;
C.键线式中每个端点为一个C原子,省略C—H键,故C正确;
D.甲基中碳原子和三个氢原子形成3对共用电子对,还剩一个成单电子,故D正确;
答案选B。
18.B
【详解】A. Na+ 结构示意图为,选项A正确;B. 乙烷的比例模型为,为乙烷的球棍模型,选项B不正确;C. 乙醛的结构简式为CH3CHO,选项C正确;D. 氯化钙的电子式为,选项D正确。答案选B。
【点睛】本题主要考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
19.BD
【详解】A.HCl为共价化合物,H原子和Cl原子间形成共用电子对,其电子式为,A错误;
B.原子半径Cl<I,故键长:Cl—Cl<I—I,B正确;
C.CH3COOH分子中,羧基的碳氧双键中含有π键,C错误;
D.电负性Cl>I,对O-H的共用电子对具有更强的吸引作用,导致O-H更易电离,故而酸性增加。即ClCH2COOH的酸性比ICH2COOH强,D正确;
答案选BD。
20.(1) 直线形
(2) 30% d
(3) 放热 600℃时甲烷平衡转化率高达99%,低于600℃时,S2浓度明显偏小,且反应速率慢
(4)、、写出任意一个
【详解】(1)CH4的电子式为:;CS2和二氧化碳是等电子体故其立体构型为:直线型;
(2)①在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应,
CS2的体积分数为10%,即,解得x=0.3a,则CH4的转化率为30%。
②a.恒容容器,质量不变,故密度一直不变,故密度不变不一定平衡,不选;b.反应前后气体的物质的量不变,故压强也一直不变,故压强不变一定平衡,不选;c.CH4与S2体积比一直为1:2,故不一定平衡,不选;d.CS2的体积分数说明反应已经达到了平衡,选;故选d。
(3)由图可知,随温度升高,甲烷的转化率降低,故反应为放热反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是600℃时甲烷平衡转化率高达99%,低于600℃时,S2浓度明显偏小,且反应速率慢。
(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S)发生的化学反应方程式为、、写出任意一个。
21. 原子半径,键能 乙醇与水之间形成氢键而氯乙烷没有
【分析】(1)气态氢化物的稳定性取决于共价键键能的大小;
(2)根据价键规则书写CaCN2的电子式;
(3)溶质分子与溶剂分子间形成氢键可增大溶质的溶解度。
【详解】(1)由于原子半径F<Cl,故键长:F—H<Cl—H,键能:F—H>Cl—H,所以HF比HCl稳定,故答案为:原子半径F<Cl,键能F—H>Cl—H。
(2)CaCN2是离子化合物,则阳离子为Ca2+、为阴离子;Ca原子最外层有2个电子,易失去最外层的2个电子达到8电子的稳定结构;N原子最外层有5个电子,易得到3个电子或形成3对共用电子对达到8电子的稳定结构;C原子最外层有4个电子,通常形成4对共用电子对达到8电子的稳定结构;则每个N原子分别得到Ca失去的1个电子、与C原子形成两对共用电子对,Ca、C、N都达到8电子的稳定结构,CaCN2的电子式为,故答案为:。
(3)乙醇和氯乙烷都属于极性分子,但乙醇与水分子之间形成氢键,而氯乙烷不能与水分子形成氢键,故常温下在水中的溶解度乙醇大于氯乙烷,故答案为:乙醇与水分子之间形成氢键而氯乙烷没有。
【点睛】与CO2互为等电子体,可以根据CO2的电子式,结合等电子原理书写的电子式。
试卷第1页,共3页
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
