高中化学苏教版必修第一册1.2.2 气体摩尔体积 课件(34张)
文档属性
| 名称 | 高中化学苏教版必修第一册1.2.2 气体摩尔体积 课件(34张) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-13 17:07:02 | ||
图片预览











文档简介
(共34张PPT)
第二单元 物质的化学计量
第2课时 气体摩尔体积
课标定位素养阐释
1.能说出决定气体体积的主要因素,在微观和宏观转换中提升对气体摩尔体积概念的理解。
2.能运用公式Vm= 逐步建立气体体积与气体物质的量之间的换算关系,熟练掌握22.4 L·mol-1的应用,逐步形成证据推理与模型认知的学科核心素养。
3.能描述阿伏加德罗定律及简单推论,并能将该推论应用于有关气体的体积、压强、物质的量间的关系判断或计算,培养科学探究与创新意识的学科核心素养。
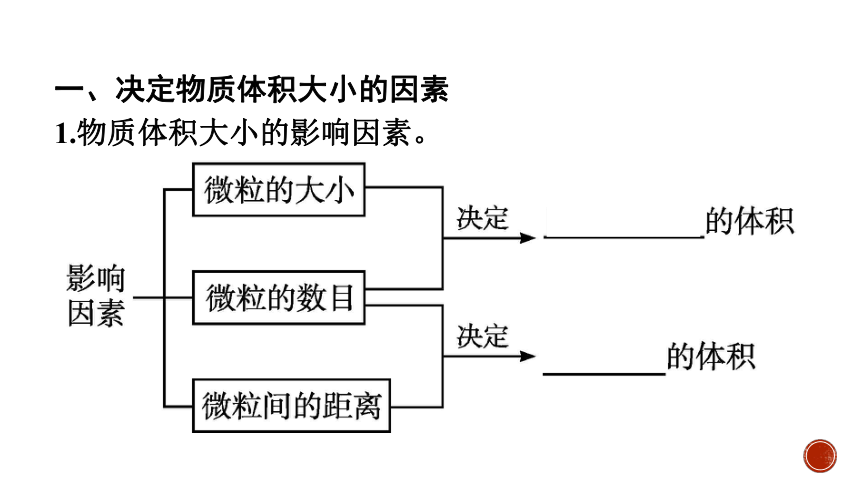
一、决定物质体积大小的因素
1.物质体积大小的影响因素。
2.微粒数目相同的物质的体积关系。
二、气体摩尔体积
【自主思考1】 两种气体体积相同,所含分子数一定相同吗
提示:不一定。气体的体积受温度和压强的影响。温度、压强相同时,体积相同的气体所含的分子数相同;如果温度、压强不相同,则体积相同的气体所含分子数不一定相同。
【自主思考2】 在标准状况下,混合气体的气体摩尔体积也是22.4 L·mol-1吗 为什么
提示:是。在标准状况下,混合气体中的不同分子间距相同,故1 mol混合气体的体积与1 mol单一气体的体积相同,均约为22.4 L。
【自主思考3】 1 mol不同固体物质的体积各不相同,其原因是什么
提示:影响固体物质体积的主要因素是微粒数目和微粒大小。1 mol不同固体物质虽然微粒数目相同,但是微粒大小不同,所以体积不同。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)在相同条件下,1 mol任何物质的体积相同。( )
(2)同温同压下,任何气体的体积都是22.4 L。( )
(3)0.5 mol H2的体积约为11.2 L。( )
(4)标准状况下,1 mol任何物质的体积都为22.4 L。( )
(5)同温同压下,相同物质的量的气体体积相同。( )
×
×
×
×
√
2.34.0 g氨气的物质的量是 ,标准状况下氨气的体积是 ,所含分子数约为 。
答案:2.0 mol 44.8 L 1.204×1024
3.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。设NA表示阿伏加德罗常数的值,则:
(1)该气体的物质的量为 。
(2)该气体所含原子总数为 。
(3)该气体在标准状况下的体积为 。
(4)该气体在标准状况下的密度为 。
(5)该气体一个分子的质量为 。
问题引领
1 mol CO2飘飘悠悠地来到了一座绿树葱葱、河水潺潺的公园,忽然发现1 mol CaCO3悠闲地躺在树下。
CO2打趣地说:“CaCO3老兄,你怎么如此的渺小 ”
CaCO3反唇相讥:“哈哈,咱们到天平上去站一站,谁渺小就一目了然了。”
CO2听后溜之大吉。
探究任务1 气体摩尔体积及相关计算
1.你知道CO2和CaCO3是从哪个角度来显摆自己的吗
提示:相同状况下,物质的量相同时,因为气体分子间距离比固体微粒间距离大得多,所以CO2气体的体积较大。1 mol CO2的质量是44 g,1 mol CaCO3的质量为100 g,CaCO3的质量较大。
2.标准状况下,1 mol CO2的体积约为22.4 L,1 mol任何物质的体积都约是22.4 L吗
提示:物质的状态有气体、固体或液体,在标准状况下,1 mol任何气体的体积约为22.4 L,而1 mol固体或液体的体积均不是22.4 L。
3.当1 mol CO2气体的体积为22.4 L时,能否说明该气体一定处于标准状况下
提示:不能。标准状况下,1 mol气体的体积均约为22.4 L,但1 mol气体的体积为22.4 L时,并不一定说明该气体处于标准状况下,比如适当的升高温度(气体膨胀)、增大压强(压缩气体),也能使1 mol气体的体积变为22.4 L。
4.如何计算标准状况下CO2气体的密度
提示:标准状况,1 mol CO2的质量为44 g,体积约为22.4 L。
归纳提升
1.气体摩尔体积的适用条件。
(1)标准状况(273 K、101 kPa)。
(2)物质在标准状况下为气体,若不是气体或非标准状况均不能用22.4 L·mol-1进行计算。
(3)气体可以是单一气体也可以是混合气体。
2.标准状况下,气体摩尔体积的相关计算。
(1)气体摩尔体积与温度和压强有关,标准状况下的气体摩尔体积为22.4 L·mol-1,非标准状况下,气体摩尔体积也可能是22.4 L·mol-1。
(2)标准状况下存在以下关系:
素养提升
典型例题
【例题1】 设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )。
A.常温常压下,11.2 L CO2所含的原子数为1.5NA
B.常温常压下,48 g O3含有的氧原子数为3NA
C.标准状况下,22.4 L H2O所含分子数为NA
D.标准状况下,22.4 L H2所含原子数为NA
答案:B
解析:常温常压(非标准状况)下11.2 L CO2的物质的量不是0.5 mol,所含原子数不是1.5NA,A错;48 g O3的物质的量为1 mol,所含氧原子数为3NA,B对;标准状况下H2O不是气体,不能用气体摩尔体积计算其物质的量,C错;标准状况下22.4 L H2的物质的量为1 mol,所含氢原子数为2NA,D错。
使用“22.4 L·mol-1”要“三看”。
(1)看所处条件:必须为标准状况。非标准状况下,1 mol气体的体积不一定是22.4 L。
(2)看物质状态:必须为气态。如标准状况下水、酒精等不是气态物质,不能用气体摩尔体积计算。
(3)看数值单位:单位是L·mol-1,而不是L;数值“22.4”为近似值。
易错提醒
【变式训练1】 (双选)设NA代表阿伏加德罗常数的值。下列说法正确的是( )。
A.在常温常压下,11.2 L CH4含有的分子数为0.5NA
B.标准状况下,4.48 L N2含有0.2NA个原子
C.在常温常压下,1 mol氦气含有的原子数为NA
D.标准状况下,1.12 L SO2和1.12 L CO2均含0.1NA个氧原子
答案:CD
解析:标准状况下,11.2 L CH4中含有的分子数为0.5NA,A错误;每个N2分子由2个氮原子构成,标准状况下,4.48 L N2含有0.4NA个原子,B错误;氦气分子为单原子分子,1 mol氦气含有的原子数为NA,C正确;每个SO2、CO2分子均含有2个氧原子,标准状况下,1.12 L SO2和1.12 L CO2均含0.1NA个氧原子,D正确。
问题引领
物质的量相同的气体,其体积受到温度和压强的影响。
1.若相同容积的两个容器,一个盛放氮气,一个盛放氢气,在同温同压下,两容器中气体分子的数目有何关系
提示:在同温同压下,相同体积的气体物质的量相同,气体分子数相同。
探究任务2 阿伏加德罗定律及其推论
2.若相同容积的两个容器,一个盛放1 mol N2,一个盛放2 mol N2,则在相同温度下,甲、乙两容器中压强之比是多少
提示:温度相同、体积相同条件下,压强与物质的量成正比。两容器中气体压强之比为1∶2。
3.同温、同压、同体积的氧气和臭氧分子数相同吗 原子数呢
提示:同温、同压、同体积的氧气和臭氧分子数相同。但是每个气体分子含有的原子数不同,则同温、同压、同体积的氧气和臭氧所含原子数之比为2∶3。
归纳提升
1.阿伏加德罗定律。
内容:在相同温度和压强下,相同体积的任何气体都含有相同数目的分子。
2.阿伏加德罗定律的推论。
(1)同温同压下,气体分子间距离相同,物质的量越多,其体积必然越大。
(2)可联系实际:气体中氢气密度最小,其相对分子质量也最小;相对分子质量大于29的气体,其密度也大于空气的密度。
(3)可联系实际生活,如轮胎充气时,若轮胎的体积不变,充入气体越多,即气体物质的量越多,压强越大。
方法技巧
典型例题
【例题2】 同温同压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是( )。
答案:D
解析:在同温同压下,气体的物质的量越大,气体所占的体积就越大。等质量的气体,其相对分子质量越小,气体的物质的量越大(n= )。相等质量的4种气体中,CH4的相对分子质量为16,相对分子质量最小,其物质的量最大,对应的气球的体积最大。
(1)阿伏加德罗定律及其推论,只适用于气体,可以是单一气体,也可以是混合气体。
(2)阿伏加德罗定律中包括“四同”,只要其中任意三个相同,则必有第四个相同;若只有两个相同,则另外两个必定成比例。
(3)若题目给出气体的质量或物质的量,则微粒数与外界条件无关。
注意:
【变式训练2】 同温同压下,1 mol H2与1 mol O2,它们的( )。
A.质量相同,体积不同 B.分子数相同,质量不同
C.体积相同,分子数不同 D.体积相同,原子数不同
答案:B
解析:同温同压下,物质的量相同的氢气和氧气,其分子数和体积都相同;它们都是双原子分子,含有的原子数也相同;它们的摩尔质量不同,其质量一定不同。
第二单元 物质的化学计量
第2课时 气体摩尔体积
课标定位素养阐释
1.能说出决定气体体积的主要因素,在微观和宏观转换中提升对气体摩尔体积概念的理解。
2.能运用公式Vm= 逐步建立气体体积与气体物质的量之间的换算关系,熟练掌握22.4 L·mol-1的应用,逐步形成证据推理与模型认知的学科核心素养。
3.能描述阿伏加德罗定律及简单推论,并能将该推论应用于有关气体的体积、压强、物质的量间的关系判断或计算,培养科学探究与创新意识的学科核心素养。
一、决定物质体积大小的因素
1.物质体积大小的影响因素。
2.微粒数目相同的物质的体积关系。
二、气体摩尔体积
【自主思考1】 两种气体体积相同,所含分子数一定相同吗
提示:不一定。气体的体积受温度和压强的影响。温度、压强相同时,体积相同的气体所含的分子数相同;如果温度、压强不相同,则体积相同的气体所含分子数不一定相同。
【自主思考2】 在标准状况下,混合气体的气体摩尔体积也是22.4 L·mol-1吗 为什么
提示:是。在标准状况下,混合气体中的不同分子间距相同,故1 mol混合气体的体积与1 mol单一气体的体积相同,均约为22.4 L。
【自主思考3】 1 mol不同固体物质的体积各不相同,其原因是什么
提示:影响固体物质体积的主要因素是微粒数目和微粒大小。1 mol不同固体物质虽然微粒数目相同,但是微粒大小不同,所以体积不同。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)在相同条件下,1 mol任何物质的体积相同。( )
(2)同温同压下,任何气体的体积都是22.4 L。( )
(3)0.5 mol H2的体积约为11.2 L。( )
(4)标准状况下,1 mol任何物质的体积都为22.4 L。( )
(5)同温同压下,相同物质的量的气体体积相同。( )
×
×
×
×
√
2.34.0 g氨气的物质的量是 ,标准状况下氨气的体积是 ,所含分子数约为 。
答案:2.0 mol 44.8 L 1.204×1024
3.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。设NA表示阿伏加德罗常数的值,则:
(1)该气体的物质的量为 。
(2)该气体所含原子总数为 。
(3)该气体在标准状况下的体积为 。
(4)该气体在标准状况下的密度为 。
(5)该气体一个分子的质量为 。
问题引领
1 mol CO2飘飘悠悠地来到了一座绿树葱葱、河水潺潺的公园,忽然发现1 mol CaCO3悠闲地躺在树下。
CO2打趣地说:“CaCO3老兄,你怎么如此的渺小 ”
CaCO3反唇相讥:“哈哈,咱们到天平上去站一站,谁渺小就一目了然了。”
CO2听后溜之大吉。
探究任务1 气体摩尔体积及相关计算
1.你知道CO2和CaCO3是从哪个角度来显摆自己的吗
提示:相同状况下,物质的量相同时,因为气体分子间距离比固体微粒间距离大得多,所以CO2气体的体积较大。1 mol CO2的质量是44 g,1 mol CaCO3的质量为100 g,CaCO3的质量较大。
2.标准状况下,1 mol CO2的体积约为22.4 L,1 mol任何物质的体积都约是22.4 L吗
提示:物质的状态有气体、固体或液体,在标准状况下,1 mol任何气体的体积约为22.4 L,而1 mol固体或液体的体积均不是22.4 L。
3.当1 mol CO2气体的体积为22.4 L时,能否说明该气体一定处于标准状况下
提示:不能。标准状况下,1 mol气体的体积均约为22.4 L,但1 mol气体的体积为22.4 L时,并不一定说明该气体处于标准状况下,比如适当的升高温度(气体膨胀)、增大压强(压缩气体),也能使1 mol气体的体积变为22.4 L。
4.如何计算标准状况下CO2气体的密度
提示:标准状况,1 mol CO2的质量为44 g,体积约为22.4 L。
归纳提升
1.气体摩尔体积的适用条件。
(1)标准状况(273 K、101 kPa)。
(2)物质在标准状况下为气体,若不是气体或非标准状况均不能用22.4 L·mol-1进行计算。
(3)气体可以是单一气体也可以是混合气体。
2.标准状况下,气体摩尔体积的相关计算。
(1)气体摩尔体积与温度和压强有关,标准状况下的气体摩尔体积为22.4 L·mol-1,非标准状况下,气体摩尔体积也可能是22.4 L·mol-1。
(2)标准状况下存在以下关系:
素养提升
典型例题
【例题1】 设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )。
A.常温常压下,11.2 L CO2所含的原子数为1.5NA
B.常温常压下,48 g O3含有的氧原子数为3NA
C.标准状况下,22.4 L H2O所含分子数为NA
D.标准状况下,22.4 L H2所含原子数为NA
答案:B
解析:常温常压(非标准状况)下11.2 L CO2的物质的量不是0.5 mol,所含原子数不是1.5NA,A错;48 g O3的物质的量为1 mol,所含氧原子数为3NA,B对;标准状况下H2O不是气体,不能用气体摩尔体积计算其物质的量,C错;标准状况下22.4 L H2的物质的量为1 mol,所含氢原子数为2NA,D错。
使用“22.4 L·mol-1”要“三看”。
(1)看所处条件:必须为标准状况。非标准状况下,1 mol气体的体积不一定是22.4 L。
(2)看物质状态:必须为气态。如标准状况下水、酒精等不是气态物质,不能用气体摩尔体积计算。
(3)看数值单位:单位是L·mol-1,而不是L;数值“22.4”为近似值。
易错提醒
【变式训练1】 (双选)设NA代表阿伏加德罗常数的值。下列说法正确的是( )。
A.在常温常压下,11.2 L CH4含有的分子数为0.5NA
B.标准状况下,4.48 L N2含有0.2NA个原子
C.在常温常压下,1 mol氦气含有的原子数为NA
D.标准状况下,1.12 L SO2和1.12 L CO2均含0.1NA个氧原子
答案:CD
解析:标准状况下,11.2 L CH4中含有的分子数为0.5NA,A错误;每个N2分子由2个氮原子构成,标准状况下,4.48 L N2含有0.4NA个原子,B错误;氦气分子为单原子分子,1 mol氦气含有的原子数为NA,C正确;每个SO2、CO2分子均含有2个氧原子,标准状况下,1.12 L SO2和1.12 L CO2均含0.1NA个氧原子,D正确。
问题引领
物质的量相同的气体,其体积受到温度和压强的影响。
1.若相同容积的两个容器,一个盛放氮气,一个盛放氢气,在同温同压下,两容器中气体分子的数目有何关系
提示:在同温同压下,相同体积的气体物质的量相同,气体分子数相同。
探究任务2 阿伏加德罗定律及其推论
2.若相同容积的两个容器,一个盛放1 mol N2,一个盛放2 mol N2,则在相同温度下,甲、乙两容器中压强之比是多少
提示:温度相同、体积相同条件下,压强与物质的量成正比。两容器中气体压强之比为1∶2。
3.同温、同压、同体积的氧气和臭氧分子数相同吗 原子数呢
提示:同温、同压、同体积的氧气和臭氧分子数相同。但是每个气体分子含有的原子数不同,则同温、同压、同体积的氧气和臭氧所含原子数之比为2∶3。
归纳提升
1.阿伏加德罗定律。
内容:在相同温度和压强下,相同体积的任何气体都含有相同数目的分子。
2.阿伏加德罗定律的推论。
(1)同温同压下,气体分子间距离相同,物质的量越多,其体积必然越大。
(2)可联系实际:气体中氢气密度最小,其相对分子质量也最小;相对分子质量大于29的气体,其密度也大于空气的密度。
(3)可联系实际生活,如轮胎充气时,若轮胎的体积不变,充入气体越多,即气体物质的量越多,压强越大。
方法技巧
典型例题
【例题2】 同温同压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是( )。
答案:D
解析:在同温同压下,气体的物质的量越大,气体所占的体积就越大。等质量的气体,其相对分子质量越小,气体的物质的量越大(n= )。相等质量的4种气体中,CH4的相对分子质量为16,相对分子质量最小,其物质的量最大,对应的气球的体积最大。
(1)阿伏加德罗定律及其推论,只适用于气体,可以是单一气体,也可以是混合气体。
(2)阿伏加德罗定律中包括“四同”,只要其中任意三个相同,则必有第四个相同;若只有两个相同,则另外两个必定成比例。
(3)若题目给出气体的质量或物质的量,则微粒数与外界条件无关。
注意:
【变式训练2】 同温同压下,1 mol H2与1 mol O2,它们的( )。
A.质量相同,体积不同 B.分子数相同,质量不同
C.体积相同,分子数不同 D.体积相同,原子数不同
答案:B
解析:同温同压下,物质的量相同的氢气和氧气,其分子数和体积都相同;它们都是双原子分子,含有的原子数也相同;它们的摩尔质量不同,其质量一定不同。
