5.1 降低化学反应活化能的酶课件(45张ppt,含1个视频)-2022-2023学年高一上学期生物人教版(2019)必修1
文档属性
| 名称 | 5.1 降低化学反应活化能的酶课件(45张ppt,含1个视频)-2022-2023学年高一上学期生物人教版(2019)必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 27.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 生物学 | ||
| 更新时间 | 2023-07-13 23:33:30 | ||
图片预览







文档简介
(共45张PPT)
降低化学反应活化能的酶
1773年,意大利科学家斯帕兰札尼做了一个巧妙的实验:将肉块放入小巧的金属笼内,然后让鹰把小笼子吞下去。过一段时间后,他把小笼子取出来,发现笼内的肉块消失了。
讨论:
1、为什么要将肉块放在金属笼内?
2、是什么物质使肉块消失了?
3、怎样才能证明你的推测
问题探讨
便于取出实验材料( 肉块), 排除物理性消化对肉块的影响, 确定其是否发生了化学性消化
化学物质将其分解
收集胃内化学物质,进行体外实验
细胞代谢: 细胞中每时每刻都进行着许多化学反应,统称为细胞代谢。
细胞代谢是细胞生命活动的基础。
资料:细胞代谢是细胞生命活动的基础,但代谢也会产生对细胞有害的物质,如过氧化氢,体内过氧化氢过多会导致皮肤发黄,毛发(包括头发)变白 ,会加速人体衰老。
2H2O2
2H2O + O2↑
1、过氧化氢在体外分解需要什么条件?
加热、强酸、强碱、 加催化剂(如Fecl3)等
2、细胞内的过氧化氢又是怎样被快速分解的呢?
细胞中含有过氧化氢酶。
实验原理
2H2O2 2H2O + O2
常态/加热 /Fe3+/过氧化氢酶
过氧化氢在高温或铁离子或过氧化氢酶的作用下都可分解成水和氧气。
实验目的
通过比较过氧化氢在不同条件下分解的快慢,了解酶的作用和意义。
质量分数为3%的FeCl3溶液
新配制的体积分数为3%的过氧化氢溶液
a.材料:
b.用具:
量筒、试管、滴管、试管架、卫生香、火柴、
酒精灯/试管夹、大烧杯、三脚架、石棉网、温度计
3
材料用具
2
1
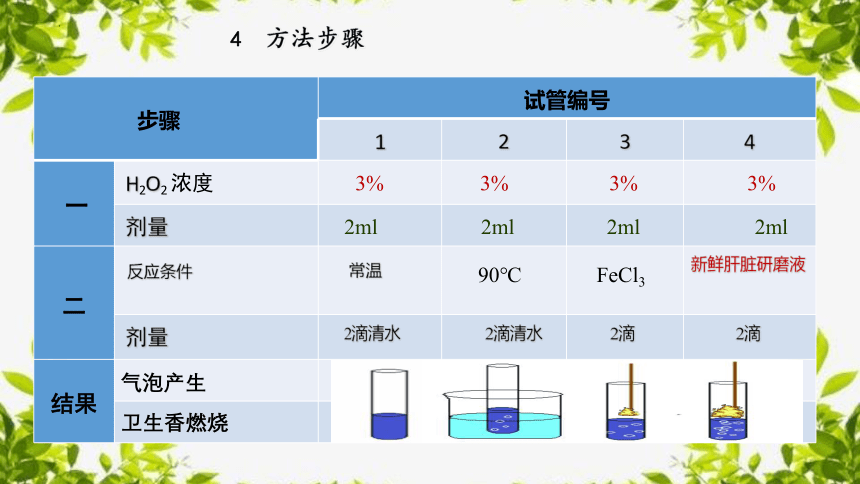
比较过氧化氢在不同条件下的分解
试管编号 1 2 3 4
一 H2O2 浓度
剂量
二
剂量
结果
2ml
2ml
2ml
2ml
3%
3%
3%
3%
常温
90℃
FeCl3
新鲜肝脏研磨液
2滴清水
2滴清水
2滴
2滴
不明显
少量
较多
大量
不复燃
不复燃
变亮
复燃
反应条件
步骤
4
方法步骤
气泡产生
卫生香燃烧
讨论
不明显
少量
较多
复燃不明显
大量
迅速复燃
1号
2号
3号
4号
如何判断过氧化氢被分解的快慢?
观察单位时间内产生气泡的多少
观察带火星的卫生香的复燃情况
5
实验现象
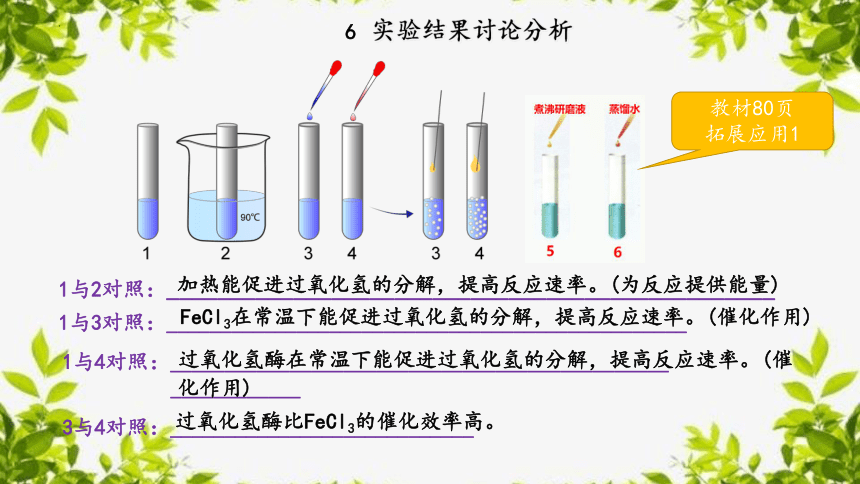
1与2对照:________________________________________________
加热能促进过氧化氢的分解,提高反应速率。(为反应提供能量)
1与3对照:________________________________________________
FeCl3在常温下能促进过氧化氢的分解,提高反应速率。(催化作用)
1与4对照:______________________________________________
____________
过氧化氢酶在常温下能促进过氧化氢的分解,提高反应速率。(催化作用)
3与4对照:____________________________
过氧化氢酶比FeCl3的催化效率高。
教材80页
拓展应用1
实验结果讨论分析
6
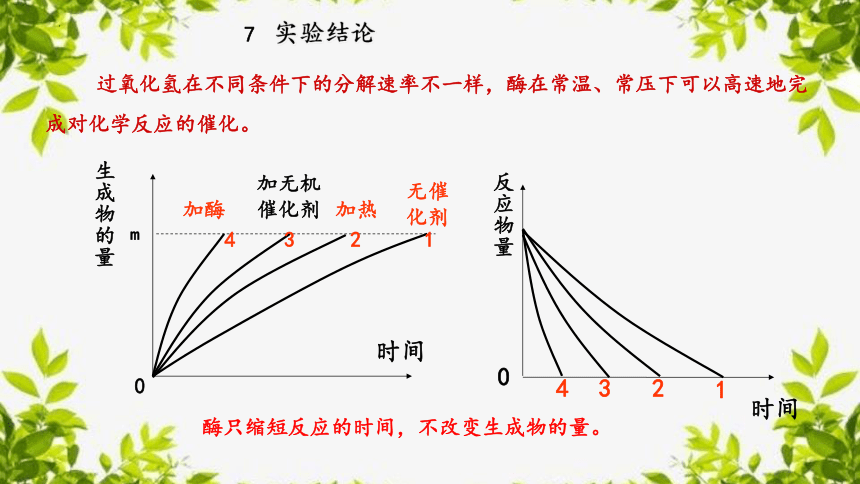
酶只缩短反应的时间,不改变生成物的量。
m
加酶
加无机
催化剂
无催
化剂
生成物的量
时间
0
1
3
4
反应物量
时间
0
1
3
4
2
加热
2
实验结论
过氧化氢在不同条件下的分解速率不一样,酶在常温、常压下可以高速地完成对化学反应的催化。
7
步骤 试管编号 说明
1 2 3 4 一 H2O2 浓度 3% 3% 3% 3%
剂量 2ml 2ml 2ml 2ml 二 反应条件 常温 90℃ FeCl3溶液 新鲜肝脏研磨液
剂 量 2滴 2滴
结果 气泡产生 不明显 少量 较多 大量
卫生香燃烧 不复燃 不复燃 变亮 复燃 对照组
实验组
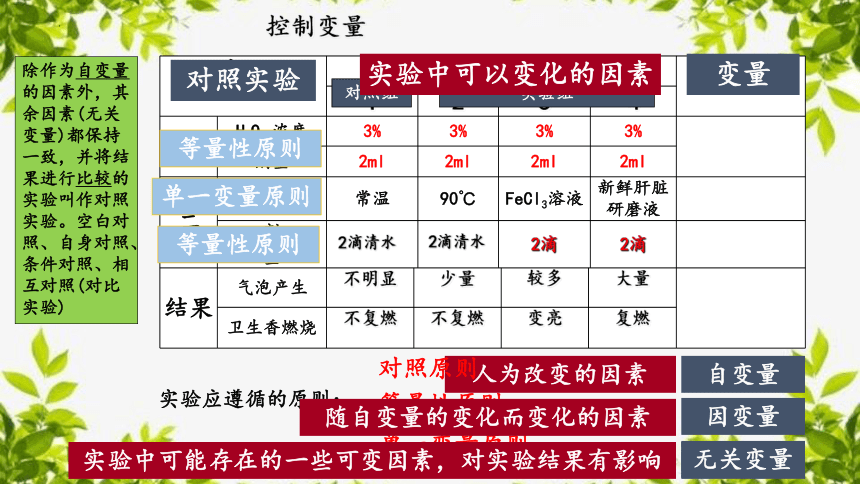
实验应遵循的原则:
等量性原则
单一变量原则
随自变量的变化而变化的因素
人为改变的因素
实验中可能存在的一些可变因素,对实验结果有影响
自变量
因变量
无关变量
无关变量
对照实验
变量
实验中可以变化的因素
对照原则
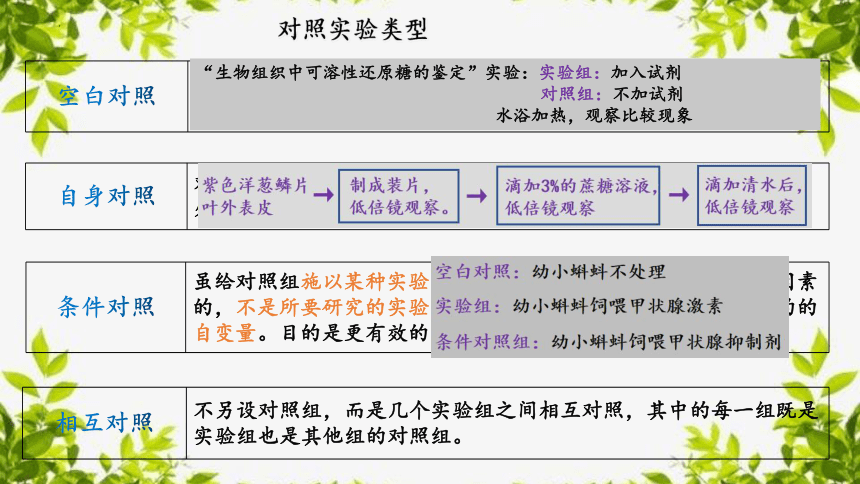
除作为自变量的因素外,其余因素(无关变量)都保持一致,并将结果进行比较的实验叫作对照实验。空白对照、自身对照、条件对照、相互对照(对比实验)
2滴清水
2滴清水
等量性原则
等量性原则
单一变量原则
控制变量
空白对照 不给对照组做任何实验处理,这里的”空白”绝不是什么影响因素都不给予,而是针对实验组所要研究的实验因素给与空白。
对照实验类型
自身对照 对照组和实验组都在同一研究对象上进行。不另设对照组。(不同处理的前后对照)
条件对照 虽给对照组施以某种实验因素的处理。但这种处理是作为对照因素的,不是所要研究的实验因素。这种处理不包括实验研究给定的的自变量。目的是更有效的比较实验组和对照组的结果。
相互对照 不另设对照组,而是几个实验组之间相互对照,其中的每一组既是实验组也是其他组的对照组。
“生物组织中可溶性还原糖的鉴定”实验:实验组:加入试剂
对照组:不加试剂
水浴加热,观察比较现象
如何进行对照实验设计
实验步骤设计
1.分组编号:选取生长状况相同且良好的植株/动物若干,随机平均分为N组,编号为ABC...(甲乙丙组)
2.施加自变量处理:实验组施加自变量处理(单一变量原则),对照组不做处理或加入与自变量等量(等量性原则)的物质(常见如等量蒸馏水、生理盐水等,视情况而定)
3.在相同且适宜的条件下培养一段时间(排除无关变量影响)
5.得出结论:说明自变量对因变量的影响
注:(1)若为探究性实验,结果未知,则表述应为:
若......,则......;若......,则......。
(2)若为验证性实验,结果已知,则表述应为肯定句式。
4.阐明实验现象:说明因变量的变化
分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能
J/mol
酶的作用原理——降低活化能
生物催化剂
常态
终态
活跃状态
活化能
b
a
c
d
反应过程
能量
常态
(反应物)
终态
(产物)
活跃状态
①
②
③
ac______________________________________。
②
①
酶降低的活化能
无催化剂条件下,反应所
需要的活化能
无催化剂
无机催化剂
③
酶
ab 。
酶催化时,反应的活化能
bc 。
分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能
J/mol
语音转文字:我觉得,发酵与活细胞有关,发酵是整个细胞而不是细胞中某些物质起作用。没有活细胞的参与,糖类是不可能变成酒精的。
巴弟弟,恕我不敢苟同,窃以为,引起发酵的是酵母细胞中的物质,这些物质在酵母细胞死亡并裂解后,才能发挥作用。
各位哥哥说的都有道理,且莫争吵,伤了和气,我做了相关实验,
发现酵母细胞中的某些物质能够在酵母细胞破碎后继续起催化作用,就像在活酵母细胞中一样。但由于纯化技术还不到位,我始终无法知道酶的化学本质是什么,恼火啊!!
切赫
奥尔特曼
莫恼,我已从刀豆中提纯脲酶,并证明其化学本质是蛋白质。
群公告:群友们获得胃蛋白酶,胰蛋白酶等许多酶的结晶,并证明这些酶的化学本质是蛋白质。
emmm,那个,好像也不是所有酶的化学本质都是蛋白质,我们也发现少数RNA具有催化作用,我们称其为核酶。
酶的本质深入研究交流群(非大佬勿入)
暗中观察的我
酶的本质
巴斯德之前
发酵是纯化学反应,与生命活动无关
巴斯德(微生物学家)
发酵与活细胞有关,发酵是整个细胞而不是细胞中某些物质起作用
引起发酵的是细胞中的某些物质,但这些物质只有在酵母细胞死亡并裂解后才能发挥作用
毕希纳
酵母细胞中的某些物质能够在酵母细胞破碎后继续起催化作用,就像在活酵母细胞中一样
萨姆纳
提取脲酶,并证明其是蛋白质
李比希(化学家)
切赫、奥尔特曼
少数RNA也具有生物催化功能
定义
绝大多数酶是蛋白质,少数是RNA。
酶的化学本质
酶的来源
酶的功能
活细胞产生的
具有催化作用的
有机物。
一类
一般说来,活细胞都能产生酶
酶可在细胞内、细胞外、体外发挥作用
酶只起催化作用,无调节功能
本质
温馨提示
酶的特性
(一)酶具有高效性:
在相同时间内,4号试管比3号试管产生的气泡数量多,说明过氧化氢酶比FeCl3的催化效率更高。
大量实验数据表明,酶的催化效率是无机催化剂的107~1013倍
加FeCl3
加H2O2酶
正是由于酶具有高效性,才能保证细胞生命活动的正常进行。
用坐标曲线图表示酶的高效性
ta
tb
t
a
b
c
时间
产物浓度
a 加酶
b 加无机催化剂
c 不加催化剂
a、b
对比说明酶具有高效性。
对比说明酶具有催化作用。
a、c
(1)酶的高效性是指酶与无机催化剂相比, 酶的催化效率更高。
平衡点
(2)酶只能缩短达到反应平衡所需时间,不改变反应的平衡点。
反应前后酶的性质和数量不变。
无机催化剂催化的化学反应范围较为广泛,例如,酸既能催化
蛋白质的水解,也能催化脂肪水解,还能催化淀粉水解。
酶能像无机催化剂一样,催化多种化学反应吗?
设计实验探究酶的专一性:
项目 方案一 方案二 对照组 实验组 对照组 实验组
材料 底物A 底物A 底物A 底物B
试剂 酶B 酶A 酶B 酶B
现象 不发生反应 发生反应 不发生反应 发生反应
结论 酶具有专一性 探究酶的专一性实验设计思路:
淀粉酶对淀粉和蔗糖的水解作用
探究 实践
在淀粉溶液和蔗糖溶液中分别加入淀粉酶,再用斐林试剂鉴定溶液中有无还原糖,就可以看出淀粉酶是否只能催化特定的化学反应。
探究淀粉酶是否只能催化特定的化学反应。
淀粉酶溶液,蔗糖酶溶液,淀粉溶液,蔗糖溶液,碘液,
斐林试剂, 热水等。
实验原理:
目的要求:
材料用具:
(底物相同、酶不同)
方法步骤:
方案一
底物不同、酶相同
实验步骤 一 二
三 四 实验现象
结论 加入新鲜淀粉酶溶液2滴,振荡,试管下半部分浸入60℃的
水浴中,反应5min。
2号试管中加入2mL蔗糖溶液
加入斐林试剂
振荡
60℃水浴2min
1号试管中加入2mL淀粉溶液
无变化
砖红色沉淀
淀粉酶只能催化淀粉水解,不能催化蔗糖水解。
取两支洁净试管,编号1、2
不选碘液鉴定的原因是什么?
无法鉴定蔗糖是否反应
注
分析本实验的变量:自变量、因变量、无关变量?
实验步骤 一 二 三
四 实验现象
结论 1号试管加入2滴淀粉酶溶液
向两支试管中各加入2mL淀粉溶液
变蓝
不变蓝
淀粉酶只能催化淀粉水解,不能催化蔗糖水解。
取两支洁净试管,编号1、2
方案二
底物相同、酶不同
2号试管加入2滴蔗糖酶溶液
反应5min后,向两支试管中加入等量的碘液
注
本实验能不能用斐林试剂鉴定?
(可以)
方法步骤:
(二)酶具有专一性:
每一种酶只能催化 化学反应。
一种或一类
酶的活性部位只能与相应底物分子的空间结构相匹配
(1)含义:
(2)原因:
(3)意义:
使细胞代谢有条不紊地进行。
H2O2酶 ——只能使过氧化氢分解。
脲 酶 ——只能催化尿素分解。
底物浓度
反应速率
底物A + 酶A
底物B + 酶A
底物浓度
反应速率
底物A + 酶A
底物A+ 酶B
酶A只能催化底物A参与的
反应,说明酶具有专一性
尝试叙述:
用坐标曲线图表示酶的专一性:
只有酶A能催化底物A参与的
反应,说明酶具有专一性
酶的专一性
锁钥学说:认为整个酶分子的天然构象具有刚性结构,酶表面具有特定
的形状。E与S的结合如同一把钥匙对一把锁一样。
诱导契合
学 说:
酶
酶-底物 复合物
酶-底物 复合物
酶表面并没有一种与底物互补的固定形状,而只是由于底物的诱导才形成了互补形状,从而有利于底物的结合。
设计实验探究影响酶活性的条件:
许多无机催化剂能在高温、高压、强酸或强碱条件下催化化学反应。
细胞代谢需要酶的参与,组成生物体的细胞生活的环境都比较温和。
因此,酶所催化的化学反应一般都是在比较温和的条件下进行的。
用一定条件下酶所催化某一化学反应的速率表示。通常以单位时间
内底物减少的量或产物生成的量来表示酶活性的大小。
酶的活性:
酶的活性的表示:
产物生成量
底物减少量
酶起催化作用需要适宜的温度和酸碱度影响。
酶催化特定化学反应的能力。
探究 实践
影响酶活性的条件
科学探究步骤:
提出问题:
作出假设:
设计实验:
进行实验:
分析结果:
表达与交流:
(温度/pH 会影响酶的活性吗?)
(温度/pH 会影响酶的活性)
(设计方案、预期结果…)
(按预定方案进行实验,仔细观察,认真记录…)
(分析实验结果,得出结论:……)
(总结,写实验报告,绘曲线图,适当交流…)
1、材料:
(一) 温度对酶活性的影响
2、原理:
淀粉酶、淀粉、沸水、冰块、 60 ℃的水、碘液
如何控制温度?
先将酶与底物分别于不同温度下保温一段时间后再混合
确保混合后的酶促反应在预设温度下进行
3、思考:
三、酶的作用条件较温和---实验设计
温度影响酶的活性,从而影响淀粉的水解,滴加碘液,
根据是否出现蓝色及蓝色的深浅来判断酶的活性。
实 验 步 骤 一
二 三 三 四 五 实验现象 结论 蓝色
各加入两滴碘液
振荡
不变蓝
温度对酶的活性有影响,温度偏低或偏高都会降低酶活性
蓝色
1、3、5各加入2mL淀粉溶液, 2、4、6各加入淀粉酶溶液1mL
1号
5号
0 ℃保温约5min
60 ℃保温约5min
100 ℃保温约5min
3、4号试管
溶液混合
5、6号试管
溶液混合
(一) 探究温度对淀粉酶活性的影响
2号
3号
4号
6号
在各自的温度条件下反应约5min
1、2号试管
溶液混合
(1)在温度对酶活性影响的实验中,为什么淀粉和淀粉酶溶液混合
之前要控制好各自的温度?
防止在控制温度之前淀粉酶已将淀粉水解,从而失去对照作用,
影响实验效果。
问题讨论:
(2) 能否在反应后加入新配制的斐林试剂观察是否有砖红色沉淀生成,
来判断试管中的淀粉是否水解了?
不能。因为这个实验要严格控制温度,而斐林试剂的反应需要
水浴加热。
(3) 能否用过氧化氢和过氧化氢酶来做这个实验?
不能,因为过氧化氢本身在不同温度下就存在分解速率的差异,
所以温度除了影响酶的活性外本身也会影响过氧化氢的分解
速率, 不能体现单一变量原则.
温度
反应速率
最适温度
A
B
C
在一定温度范围内,酶促反应速率
随温度的升高而加快
在最适温度时,酶促反应速率最快
AB:
B点:
BC:
超过最适温度,酶促反应速率随温
度升高而减慢,直至酶失活。
2. 温度对酶活性的影响曲线解读:
低温、高温对酶活性的影响一样的吗?
低温抑制酶的活性,但温度升高后,酶仍能恢复活性。但高温会使
酶的 遭到破坏,会导致酶 ,甚至会使其永久失
去活性。所以酶适合在 下保存。
空间结构
变性
低温
3. 最适温度随物种不同而有差异
一般来说,酶的最适温度:
动物:35-40℃之间;
植物:40-50℃之间;
细菌和真菌:差别较大。
有的酶最适温度可达70℃
最适温度
反应速率
最适温度
耐高温的DNA聚合酶最适温度可达94℃
(二) 探究pH对酶活性的影响
过氧化氢溶液、过氧化氢酶、pH=7的缓冲溶液、HCl溶液、NaOH溶液
2H2O2 2H2O + O2
过氧化氢酶
如何设置不同的pH?
2.原理:
1.试剂:
3.思考:
将酶溶液的pH调至实验要求的pH后再让反应物与酶接触,不宜在未达到预设pH前,让反应物与酶接触。
三、酶的作用条件较温和---实验设计
pH影响酶的空间结构从而影响酶的活性,因而影响单位时
间内氧气的生成量,可观察气泡量或用带火星的卫生香燃
烧的情况来检验氧气生成量的多少。
(二)探究pH对过氧化氢酶活性的影响
实 验 步 骤
一 二
三 四 实验现象
结论 各加入3%过氧化氢2mL
几乎无气泡
反应约5min,记录气泡产生情况
较多气泡
几乎无气泡
各加入肝脏研磨液2滴
1号
2号
3号
1mL PH=7的缓冲液
1mL 5%HCl
1mL 5%NaOH
过酸、过碱会影响酶的活性,适宜pH下酶的催化效率最高
为什么选肝脏研磨液,而不选淀粉酶?
酸性条件下淀粉会分解
第二、三步能不能颠倒?
思考:
① 需先控制好条件,再将酶与底物混合。
②本实验中也可将过氧化氢酶和H2O2分别调至同一pH,再混合,
以保证反应一开始便达到预设pH。(必须保证过氧化氢酶
催化H2O2时的pH是需要研究的pH值)
③本实验不宜选用淀粉酶催化淀粉分解,因为淀粉酶催化的底物
淀粉在酸性条件下也会发生水解反应。
1. 注意事项:
3. pH对过氧化氢酶活性的影响---曲线解读:
pH
反应速率
最适pH
A
B
C
在一定pH范围内,酶促反应速率随pH的升高而加快
在最适pH时,酶促反应速率最快
AB:
B点:
BC:
超过最适pH后,酶促反应速率随pH升
高而减慢,直至酶失活。
过酸、过碱对酶活性的影响一样的吗?
过酸、过碱都会使酶的空间结构遭到破坏,使酶永久失活
思考:
7
pH
2
0
1
3
4
5
6
8
9
10
胃蛋白酶
胰蛋白酶
11
反应速率
4. 不同酶的最适PH不同
一般来说,酶的最适pH:
动物:在6.5-8.0之间;
植物:在4.5-6.5之间;
细菌和真菌:差别较大。
不同种类酶的最适pH不同。
胃蛋白酶在强酸环境,小肠内的酶在弱碱性环境发挥作用
酶的名称 最适pH
过氧化氢酶(肝) 6.8
唾液淀粉酶 6.8
脂肪酶 8.3
胰蛋白酶 8.0-9.0
胃蛋白酶 1.5-2.2
5. 关注表格,注意酶的最适pH范围
结论:
四、影响酶促反应速率的因素
影响酶促反应速率的因素
还有:酶浓度、底物浓度、金属离子、酶的激活剂、抑制剂等
温度、PH的综合影响
四、影响酶促反应速率的因素
1. 酶浓度
a
b
c
M
酶浓度
反应速率
O
一定的酶浓度范围(0M),
随酶浓度的增加,反应速
率增加
ab:
bc:
当酶浓度增大到某一值时
(M),反应速率达最大值。
酶浓度较低,底物没有完全被酶结合
底物完全被酶结合
曲线解读:
bc限制因素:
ab限制因素:
底物浓度
酶浓度或酶活性
2. 底物浓度
a
b
c
N
底物浓度
反应速率
O
b
曲线解读:
在一定底物浓度范围内(0N),
随底物浓度增加,反应速率增加
ab:
bc:
当底物浓度增大到某一值时(N),
反应速率达到最大值。
酶没有完全被底物结合
酶完全被底物结合
bc限制因素:
ab限制因素:
底物浓度
酶浓度或酶活性
2. 曲线变化
酶促反应速率
底物浓度
A
B
C
B点的反应底物的浓度足够大,
是酶的数量限制了反应速率的
提高,这时加入少量的酶,会
使反应速率加快。
酶促反应速率
底物浓度
A
B
C
如果A点时温度升高10 ℃,曲线上
升的幅度变小。因为图中原曲线表
示在最适温度下催化速率随底物浓
度的变化。温度高于或低于最适温
度,反应速率都会变慢。
降低化学反应活化能的酶
1773年,意大利科学家斯帕兰札尼做了一个巧妙的实验:将肉块放入小巧的金属笼内,然后让鹰把小笼子吞下去。过一段时间后,他把小笼子取出来,发现笼内的肉块消失了。
讨论:
1、为什么要将肉块放在金属笼内?
2、是什么物质使肉块消失了?
3、怎样才能证明你的推测
问题探讨
便于取出实验材料( 肉块), 排除物理性消化对肉块的影响, 确定其是否发生了化学性消化
化学物质将其分解
收集胃内化学物质,进行体外实验
细胞代谢: 细胞中每时每刻都进行着许多化学反应,统称为细胞代谢。
细胞代谢是细胞生命活动的基础。
资料:细胞代谢是细胞生命活动的基础,但代谢也会产生对细胞有害的物质,如过氧化氢,体内过氧化氢过多会导致皮肤发黄,毛发(包括头发)变白 ,会加速人体衰老。
2H2O2
2H2O + O2↑
1、过氧化氢在体外分解需要什么条件?
加热、强酸、强碱、 加催化剂(如Fecl3)等
2、细胞内的过氧化氢又是怎样被快速分解的呢?
细胞中含有过氧化氢酶。
实验原理
2H2O2 2H2O + O2
常态/加热 /Fe3+/过氧化氢酶
过氧化氢在高温或铁离子或过氧化氢酶的作用下都可分解成水和氧气。
实验目的
通过比较过氧化氢在不同条件下分解的快慢,了解酶的作用和意义。
质量分数为3%的FeCl3溶液
新配制的体积分数为3%的过氧化氢溶液
a.材料:
b.用具:
量筒、试管、滴管、试管架、卫生香、火柴、
酒精灯/试管夹、大烧杯、三脚架、石棉网、温度计
3
材料用具
2
1
比较过氧化氢在不同条件下的分解
试管编号 1 2 3 4
一 H2O2 浓度
剂量
二
剂量
结果
2ml
2ml
2ml
2ml
3%
3%
3%
3%
常温
90℃
FeCl3
新鲜肝脏研磨液
2滴清水
2滴清水
2滴
2滴
不明显
少量
较多
大量
不复燃
不复燃
变亮
复燃
反应条件
步骤
4
方法步骤
气泡产生
卫生香燃烧
讨论
不明显
少量
较多
复燃不明显
大量
迅速复燃
1号
2号
3号
4号
如何判断过氧化氢被分解的快慢?
观察单位时间内产生气泡的多少
观察带火星的卫生香的复燃情况
5
实验现象
1与2对照:________________________________________________
加热能促进过氧化氢的分解,提高反应速率。(为反应提供能量)
1与3对照:________________________________________________
FeCl3在常温下能促进过氧化氢的分解,提高反应速率。(催化作用)
1与4对照:______________________________________________
____________
过氧化氢酶在常温下能促进过氧化氢的分解,提高反应速率。(催化作用)
3与4对照:____________________________
过氧化氢酶比FeCl3的催化效率高。
教材80页
拓展应用1
实验结果讨论分析
6
酶只缩短反应的时间,不改变生成物的量。
m
加酶
加无机
催化剂
无催
化剂
生成物的量
时间
0
1
3
4
反应物量
时间
0
1
3
4
2
加热
2
实验结论
过氧化氢在不同条件下的分解速率不一样,酶在常温、常压下可以高速地完成对化学反应的催化。
7
步骤 试管编号 说明
1 2 3 4 一 H2O2 浓度 3% 3% 3% 3%
剂量 2ml 2ml 2ml 2ml 二 反应条件 常温 90℃ FeCl3溶液 新鲜肝脏研磨液
剂 量 2滴 2滴
结果 气泡产生 不明显 少量 较多 大量
卫生香燃烧 不复燃 不复燃 变亮 复燃 对照组
实验组
实验应遵循的原则:
等量性原则
单一变量原则
随自变量的变化而变化的因素
人为改变的因素
实验中可能存在的一些可变因素,对实验结果有影响
自变量
因变量
无关变量
无关变量
对照实验
变量
实验中可以变化的因素
对照原则
除作为自变量的因素外,其余因素(无关变量)都保持一致,并将结果进行比较的实验叫作对照实验。空白对照、自身对照、条件对照、相互对照(对比实验)
2滴清水
2滴清水
等量性原则
等量性原则
单一变量原则
控制变量
空白对照 不给对照组做任何实验处理,这里的”空白”绝不是什么影响因素都不给予,而是针对实验组所要研究的实验因素给与空白。
对照实验类型
自身对照 对照组和实验组都在同一研究对象上进行。不另设对照组。(不同处理的前后对照)
条件对照 虽给对照组施以某种实验因素的处理。但这种处理是作为对照因素的,不是所要研究的实验因素。这种处理不包括实验研究给定的的自变量。目的是更有效的比较实验组和对照组的结果。
相互对照 不另设对照组,而是几个实验组之间相互对照,其中的每一组既是实验组也是其他组的对照组。
“生物组织中可溶性还原糖的鉴定”实验:实验组:加入试剂
对照组:不加试剂
水浴加热,观察比较现象
如何进行对照实验设计
实验步骤设计
1.分组编号:选取生长状况相同且良好的植株/动物若干,随机平均分为N组,编号为ABC...(甲乙丙组)
2.施加自变量处理:实验组施加自变量处理(单一变量原则),对照组不做处理或加入与自变量等量(等量性原则)的物质(常见如等量蒸馏水、生理盐水等,视情况而定)
3.在相同且适宜的条件下培养一段时间(排除无关变量影响)
5.得出结论:说明自变量对因变量的影响
注:(1)若为探究性实验,结果未知,则表述应为:
若......,则......;若......,则......。
(2)若为验证性实验,结果已知,则表述应为肯定句式。
4.阐明实验现象:说明因变量的变化
分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能
J/mol
酶的作用原理——降低活化能
生物催化剂
常态
终态
活跃状态
活化能
b
a
c
d
反应过程
能量
常态
(反应物)
终态
(产物)
活跃状态
①
②
③
ac______________________________________。
②
①
酶降低的活化能
无催化剂条件下,反应所
需要的活化能
无催化剂
无机催化剂
③
酶
ab 。
酶催化时,反应的活化能
bc 。
分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能
J/mol
语音转文字:我觉得,发酵与活细胞有关,发酵是整个细胞而不是细胞中某些物质起作用。没有活细胞的参与,糖类是不可能变成酒精的。
巴弟弟,恕我不敢苟同,窃以为,引起发酵的是酵母细胞中的物质,这些物质在酵母细胞死亡并裂解后,才能发挥作用。
各位哥哥说的都有道理,且莫争吵,伤了和气,我做了相关实验,
发现酵母细胞中的某些物质能够在酵母细胞破碎后继续起催化作用,就像在活酵母细胞中一样。但由于纯化技术还不到位,我始终无法知道酶的化学本质是什么,恼火啊!!
切赫
奥尔特曼
莫恼,我已从刀豆中提纯脲酶,并证明其化学本质是蛋白质。
群公告:群友们获得胃蛋白酶,胰蛋白酶等许多酶的结晶,并证明这些酶的化学本质是蛋白质。
emmm,那个,好像也不是所有酶的化学本质都是蛋白质,我们也发现少数RNA具有催化作用,我们称其为核酶。
酶的本质深入研究交流群(非大佬勿入)
暗中观察的我
酶的本质
巴斯德之前
发酵是纯化学反应,与生命活动无关
巴斯德(微生物学家)
发酵与活细胞有关,发酵是整个细胞而不是细胞中某些物质起作用
引起发酵的是细胞中的某些物质,但这些物质只有在酵母细胞死亡并裂解后才能发挥作用
毕希纳
酵母细胞中的某些物质能够在酵母细胞破碎后继续起催化作用,就像在活酵母细胞中一样
萨姆纳
提取脲酶,并证明其是蛋白质
李比希(化学家)
切赫、奥尔特曼
少数RNA也具有生物催化功能
定义
绝大多数酶是蛋白质,少数是RNA。
酶的化学本质
酶的来源
酶的功能
活细胞产生的
具有催化作用的
有机物。
一类
一般说来,活细胞都能产生酶
酶可在细胞内、细胞外、体外发挥作用
酶只起催化作用,无调节功能
本质
温馨提示
酶的特性
(一)酶具有高效性:
在相同时间内,4号试管比3号试管产生的气泡数量多,说明过氧化氢酶比FeCl3的催化效率更高。
大量实验数据表明,酶的催化效率是无机催化剂的107~1013倍
加FeCl3
加H2O2酶
正是由于酶具有高效性,才能保证细胞生命活动的正常进行。
用坐标曲线图表示酶的高效性
ta
tb
t
a
b
c
时间
产物浓度
a 加酶
b 加无机催化剂
c 不加催化剂
a、b
对比说明酶具有高效性。
对比说明酶具有催化作用。
a、c
(1)酶的高效性是指酶与无机催化剂相比, 酶的催化效率更高。
平衡点
(2)酶只能缩短达到反应平衡所需时间,不改变反应的平衡点。
反应前后酶的性质和数量不变。
无机催化剂催化的化学反应范围较为广泛,例如,酸既能催化
蛋白质的水解,也能催化脂肪水解,还能催化淀粉水解。
酶能像无机催化剂一样,催化多种化学反应吗?
设计实验探究酶的专一性:
项目 方案一 方案二 对照组 实验组 对照组 实验组
材料 底物A 底物A 底物A 底物B
试剂 酶B 酶A 酶B 酶B
现象 不发生反应 发生反应 不发生反应 发生反应
结论 酶具有专一性 探究酶的专一性实验设计思路:
淀粉酶对淀粉和蔗糖的水解作用
探究 实践
在淀粉溶液和蔗糖溶液中分别加入淀粉酶,再用斐林试剂鉴定溶液中有无还原糖,就可以看出淀粉酶是否只能催化特定的化学反应。
探究淀粉酶是否只能催化特定的化学反应。
淀粉酶溶液,蔗糖酶溶液,淀粉溶液,蔗糖溶液,碘液,
斐林试剂, 热水等。
实验原理:
目的要求:
材料用具:
(底物相同、酶不同)
方法步骤:
方案一
底物不同、酶相同
实验步骤 一 二
三 四 实验现象
结论 加入新鲜淀粉酶溶液2滴,振荡,试管下半部分浸入60℃的
水浴中,反应5min。
2号试管中加入2mL蔗糖溶液
加入斐林试剂
振荡
60℃水浴2min
1号试管中加入2mL淀粉溶液
无变化
砖红色沉淀
淀粉酶只能催化淀粉水解,不能催化蔗糖水解。
取两支洁净试管,编号1、2
不选碘液鉴定的原因是什么?
无法鉴定蔗糖是否反应
注
分析本实验的变量:自变量、因变量、无关变量?
实验步骤 一 二 三
四 实验现象
结论 1号试管加入2滴淀粉酶溶液
向两支试管中各加入2mL淀粉溶液
变蓝
不变蓝
淀粉酶只能催化淀粉水解,不能催化蔗糖水解。
取两支洁净试管,编号1、2
方案二
底物相同、酶不同
2号试管加入2滴蔗糖酶溶液
反应5min后,向两支试管中加入等量的碘液
注
本实验能不能用斐林试剂鉴定?
(可以)
方法步骤:
(二)酶具有专一性:
每一种酶只能催化 化学反应。
一种或一类
酶的活性部位只能与相应底物分子的空间结构相匹配
(1)含义:
(2)原因:
(3)意义:
使细胞代谢有条不紊地进行。
H2O2酶 ——只能使过氧化氢分解。
脲 酶 ——只能催化尿素分解。
底物浓度
反应速率
底物A + 酶A
底物B + 酶A
底物浓度
反应速率
底物A + 酶A
底物A+ 酶B
酶A只能催化底物A参与的
反应,说明酶具有专一性
尝试叙述:
用坐标曲线图表示酶的专一性:
只有酶A能催化底物A参与的
反应,说明酶具有专一性
酶的专一性
锁钥学说:认为整个酶分子的天然构象具有刚性结构,酶表面具有特定
的形状。E与S的结合如同一把钥匙对一把锁一样。
诱导契合
学 说:
酶
酶-底物 复合物
酶-底物 复合物
酶表面并没有一种与底物互补的固定形状,而只是由于底物的诱导才形成了互补形状,从而有利于底物的结合。
设计实验探究影响酶活性的条件:
许多无机催化剂能在高温、高压、强酸或强碱条件下催化化学反应。
细胞代谢需要酶的参与,组成生物体的细胞生活的环境都比较温和。
因此,酶所催化的化学反应一般都是在比较温和的条件下进行的。
用一定条件下酶所催化某一化学反应的速率表示。通常以单位时间
内底物减少的量或产物生成的量来表示酶活性的大小。
酶的活性:
酶的活性的表示:
产物生成量
底物减少量
酶起催化作用需要适宜的温度和酸碱度影响。
酶催化特定化学反应的能力。
探究 实践
影响酶活性的条件
科学探究步骤:
提出问题:
作出假设:
设计实验:
进行实验:
分析结果:
表达与交流:
(温度/pH 会影响酶的活性吗?)
(温度/pH 会影响酶的活性)
(设计方案、预期结果…)
(按预定方案进行实验,仔细观察,认真记录…)
(分析实验结果,得出结论:……)
(总结,写实验报告,绘曲线图,适当交流…)
1、材料:
(一) 温度对酶活性的影响
2、原理:
淀粉酶、淀粉、沸水、冰块、 60 ℃的水、碘液
如何控制温度?
先将酶与底物分别于不同温度下保温一段时间后再混合
确保混合后的酶促反应在预设温度下进行
3、思考:
三、酶的作用条件较温和---实验设计
温度影响酶的活性,从而影响淀粉的水解,滴加碘液,
根据是否出现蓝色及蓝色的深浅来判断酶的活性。
实 验 步 骤 一
二 三 三 四 五 实验现象 结论 蓝色
各加入两滴碘液
振荡
不变蓝
温度对酶的活性有影响,温度偏低或偏高都会降低酶活性
蓝色
1、3、5各加入2mL淀粉溶液, 2、4、6各加入淀粉酶溶液1mL
1号
5号
0 ℃保温约5min
60 ℃保温约5min
100 ℃保温约5min
3、4号试管
溶液混合
5、6号试管
溶液混合
(一) 探究温度对淀粉酶活性的影响
2号
3号
4号
6号
在各自的温度条件下反应约5min
1、2号试管
溶液混合
(1)在温度对酶活性影响的实验中,为什么淀粉和淀粉酶溶液混合
之前要控制好各自的温度?
防止在控制温度之前淀粉酶已将淀粉水解,从而失去对照作用,
影响实验效果。
问题讨论:
(2) 能否在反应后加入新配制的斐林试剂观察是否有砖红色沉淀生成,
来判断试管中的淀粉是否水解了?
不能。因为这个实验要严格控制温度,而斐林试剂的反应需要
水浴加热。
(3) 能否用过氧化氢和过氧化氢酶来做这个实验?
不能,因为过氧化氢本身在不同温度下就存在分解速率的差异,
所以温度除了影响酶的活性外本身也会影响过氧化氢的分解
速率, 不能体现单一变量原则.
温度
反应速率
最适温度
A
B
C
在一定温度范围内,酶促反应速率
随温度的升高而加快
在最适温度时,酶促反应速率最快
AB:
B点:
BC:
超过最适温度,酶促反应速率随温
度升高而减慢,直至酶失活。
2. 温度对酶活性的影响曲线解读:
低温、高温对酶活性的影响一样的吗?
低温抑制酶的活性,但温度升高后,酶仍能恢复活性。但高温会使
酶的 遭到破坏,会导致酶 ,甚至会使其永久失
去活性。所以酶适合在 下保存。
空间结构
变性
低温
3. 最适温度随物种不同而有差异
一般来说,酶的最适温度:
动物:35-40℃之间;
植物:40-50℃之间;
细菌和真菌:差别较大。
有的酶最适温度可达70℃
最适温度
反应速率
最适温度
耐高温的DNA聚合酶最适温度可达94℃
(二) 探究pH对酶活性的影响
过氧化氢溶液、过氧化氢酶、pH=7的缓冲溶液、HCl溶液、NaOH溶液
2H2O2 2H2O + O2
过氧化氢酶
如何设置不同的pH?
2.原理:
1.试剂:
3.思考:
将酶溶液的pH调至实验要求的pH后再让反应物与酶接触,不宜在未达到预设pH前,让反应物与酶接触。
三、酶的作用条件较温和---实验设计
pH影响酶的空间结构从而影响酶的活性,因而影响单位时
间内氧气的生成量,可观察气泡量或用带火星的卫生香燃
烧的情况来检验氧气生成量的多少。
(二)探究pH对过氧化氢酶活性的影响
实 验 步 骤
一 二
三 四 实验现象
结论 各加入3%过氧化氢2mL
几乎无气泡
反应约5min,记录气泡产生情况
较多气泡
几乎无气泡
各加入肝脏研磨液2滴
1号
2号
3号
1mL PH=7的缓冲液
1mL 5%HCl
1mL 5%NaOH
过酸、过碱会影响酶的活性,适宜pH下酶的催化效率最高
为什么选肝脏研磨液,而不选淀粉酶?
酸性条件下淀粉会分解
第二、三步能不能颠倒?
思考:
① 需先控制好条件,再将酶与底物混合。
②本实验中也可将过氧化氢酶和H2O2分别调至同一pH,再混合,
以保证反应一开始便达到预设pH。(必须保证过氧化氢酶
催化H2O2时的pH是需要研究的pH值)
③本实验不宜选用淀粉酶催化淀粉分解,因为淀粉酶催化的底物
淀粉在酸性条件下也会发生水解反应。
1. 注意事项:
3. pH对过氧化氢酶活性的影响---曲线解读:
pH
反应速率
最适pH
A
B
C
在一定pH范围内,酶促反应速率随pH的升高而加快
在最适pH时,酶促反应速率最快
AB:
B点:
BC:
超过最适pH后,酶促反应速率随pH升
高而减慢,直至酶失活。
过酸、过碱对酶活性的影响一样的吗?
过酸、过碱都会使酶的空间结构遭到破坏,使酶永久失活
思考:
7
pH
2
0
1
3
4
5
6
8
9
10
胃蛋白酶
胰蛋白酶
11
反应速率
4. 不同酶的最适PH不同
一般来说,酶的最适pH:
动物:在6.5-8.0之间;
植物:在4.5-6.5之间;
细菌和真菌:差别较大。
不同种类酶的最适pH不同。
胃蛋白酶在强酸环境,小肠内的酶在弱碱性环境发挥作用
酶的名称 最适pH
过氧化氢酶(肝) 6.8
唾液淀粉酶 6.8
脂肪酶 8.3
胰蛋白酶 8.0-9.0
胃蛋白酶 1.5-2.2
5. 关注表格,注意酶的最适pH范围
结论:
四、影响酶促反应速率的因素
影响酶促反应速率的因素
还有:酶浓度、底物浓度、金属离子、酶的激活剂、抑制剂等
温度、PH的综合影响
四、影响酶促反应速率的因素
1. 酶浓度
a
b
c
M
酶浓度
反应速率
O
一定的酶浓度范围(0M),
随酶浓度的增加,反应速
率增加
ab:
bc:
当酶浓度增大到某一值时
(M),反应速率达最大值。
酶浓度较低,底物没有完全被酶结合
底物完全被酶结合
曲线解读:
bc限制因素:
ab限制因素:
底物浓度
酶浓度或酶活性
2. 底物浓度
a
b
c
N
底物浓度
反应速率
O
b
曲线解读:
在一定底物浓度范围内(0N),
随底物浓度增加,反应速率增加
ab:
bc:
当底物浓度增大到某一值时(N),
反应速率达到最大值。
酶没有完全被底物结合
酶完全被底物结合
bc限制因素:
ab限制因素:
底物浓度
酶浓度或酶活性
2. 曲线变化
酶促反应速率
底物浓度
A
B
C
B点的反应底物的浓度足够大,
是酶的数量限制了反应速率的
提高,这时加入少量的酶,会
使反应速率加快。
酶促反应速率
底物浓度
A
B
C
如果A点时温度升高10 ℃,曲线上
升的幅度变小。因为图中原曲线表
示在最适温度下催化速率随底物浓
度的变化。温度高于或低于最适温
度,反应速率都会变慢。
同课章节目录
- 第1章 走近细胞
- 第1节 细胞是生命活动的基本单位
- 第2节 细胞的多样性和统一性
- 第2章 组成细胞的分子
- 第1节 细胞中的元素和化合物
- 第2节 细胞中的无机物
- 第3节 细胞中的糖类和脂质
- 第4节 蛋白质是生命活动的主要承担者
- 第5节 核酸是遗传信息的携带者
- 第3章 细胞的基本结构
- 第1节 细胞膜的结构和功能
- 第2节 细胞器之间的分工合作
- 第3节 细胞核的结构和功能
- 第4章 细胞的物质输入和输出
- 第1节 被动运输
- 第2节 主动运输与胞吞、胞吐
- 第5章 细胞的能量供应和利用
- 第1节 降低化学反应活化能的酶
- 第2节 细胞的能量“货币”ATP
- 第3节 细胞呼吸的原理和应用
- 第4节 光合作用与能量转化
- 第6章 细胞的生命历程
- 第1节 细胞的增殖
- 第2节 细胞的分化
- 第3节 细胞的衰老和死亡
