4.1.1元素周期表 课件(共32张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.1元素周期表 课件(共32张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-13 19:41:21 | ||
图片预览






文档简介
(共32张PPT)
组织建设
第1课时 原子结构与元素周期表
科学史话
门捷列夫与第一张元素周期表
纽兰兹在门捷列夫之前发现了元素性质的周期性。1865年他把当时已知元素按原子量的递增顺序排列,发现每隔7种元素便出现性质相似元素,如同音乐中的音阶一样,因此称为元素八音律。
知识回顾
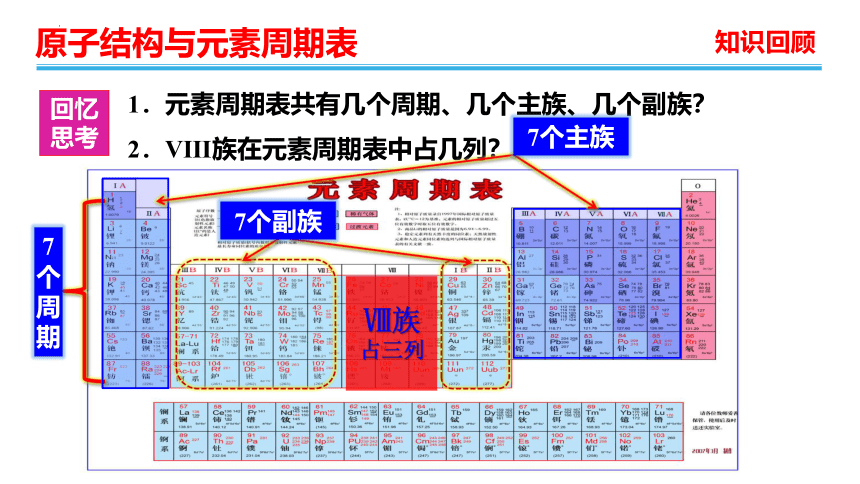
1.元素周期表共有几个周期、几个主族、几个副族?
2.Ⅷ族在元素周期表中占几列?
回忆思考
7个周期
7个主族
7个副族
Ⅷ族
占三列
周期
族
短周期(第一,二,三周期,2,8,8)
长周期(第四,五,六周期,第七周期)
18,18,32, 最多32
主族(ⅠA ~ Ⅶ A,7个纵行)
副族( ⅠB ~ Ⅶ B,7个纵行)
Ⅷ族(8,9,10纵行)
零族
知识回顾
元素周期表结构
7个横行
18个纵行
周期序数 = 电子层数(能层数);
主族元素族序数 = 原子最外层电子数。
问题导学
知识点一、元素周期系
1、碱金属基态原子
完成以下填空
原子序数 周期 基态原子的电子排布式
锂 3 二 或
钠 11 三 或
钾 19 四 或
铷 37 五 1s22s22p63s23p63d104s24p65s1或[Kr]5s1
铯 55 六 1s22s22p63s23p63d104s24p64d105s25p66s1或[Xe]6s1
1s22s1 [He]2s1
1s22s22p63s1 [Ne]3s1
1s22s22p63s23p64s1 [Ar]4s1
思考交流
碱金属元素所在周期与电子层数关系?
相等
最外层电子数关系?
均为1
现象解读
知识点一、元素周期系
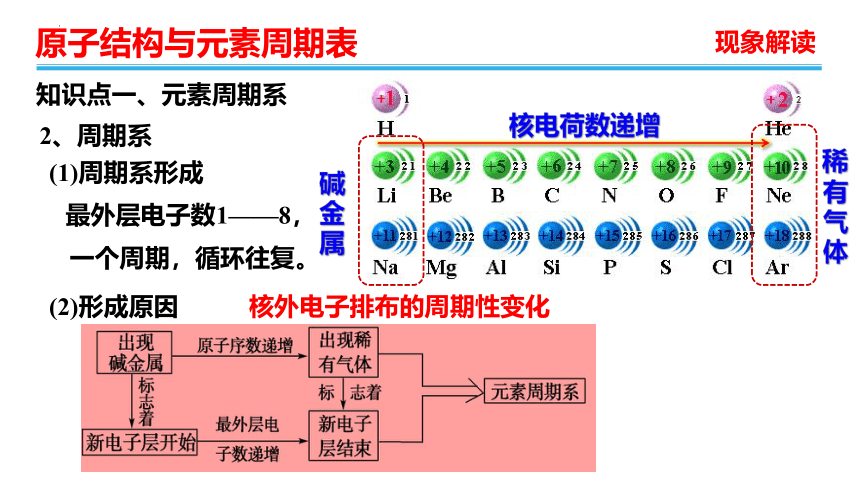
2、周期系
(1)周期系形成
核电荷数递增
碱金属
稀有气体
最外层电子数1——8,
一个周期,循环往复。
(2)形成原因
核外电子排布的周期性变化
要求:背元素周期简表、画简图
碱金属族
碱土金属
碳族
氮族
氧族
卤族
0族
背:7个主族、0族
默写:符号及名称
钪 钛 钒 铬 锰 铁 钴 镍 铜 锌
元素周期简表
复习:用以下问题熟悉元素周期表
1.周期表共 列、 共 族。
每一周期的元素种类为 。
元素种类最多的是 周期? 元素种类最多的是第 列?
Cu在第 列; Mn在第 列,O在第 列
按顺序写出各族名称 。
2.写出稀有气体的原子序数: 。
写出碱金属的原子序数: 。
117在周期表的位置是 。若出现119号元素,位置是 。
3.不查表,推算31、35、53号元素的位置 。
4.同一周期相邻的主族元素原子序数可相差 ?
同主族元素的原子序数可相差 ?(相邻和不相邻)
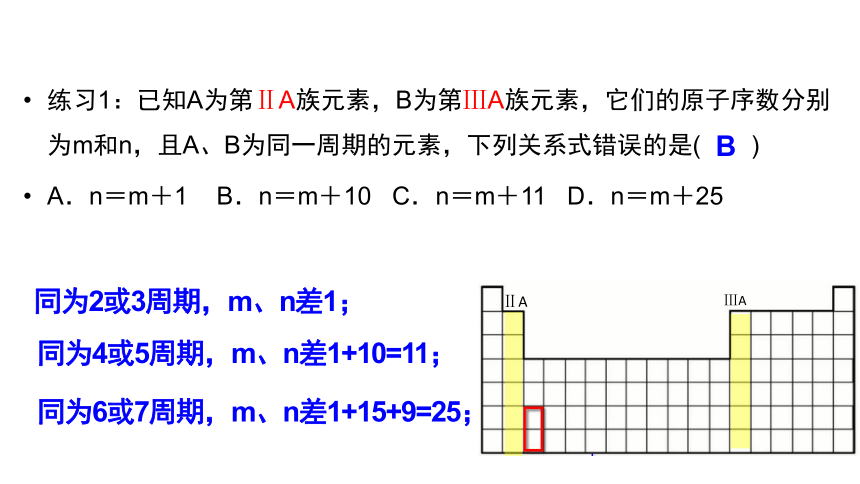
练习1:已知A为第ⅡA族元素,B为第ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期的元素,下列关系式错误的是( )
A.n=m+1 B.n=m+10 C.n=m+11 D.n=m+25
B
同为2或3周期,m、n差1;
同为4或5周期,m、n差1+10=11;
同为6或7周期,m、n差1+15+9=25;
ⅡA
ⅢA
练习2:已知a、b分别为第ⅠA族、ⅦA族的同周期两种元素,它们的原子序数分别为m和n,下列关系式错误的是( )
A.n=m+6 B.n=m+10 C.n=m+16 D.n=m+30
B
同为2或3周期,m、n差5+1;
同为4或5周期,m、n差5+1+10=16;
同为6或7周期,m、n差5+1+15+9=30;
ⅠA
ⅦA
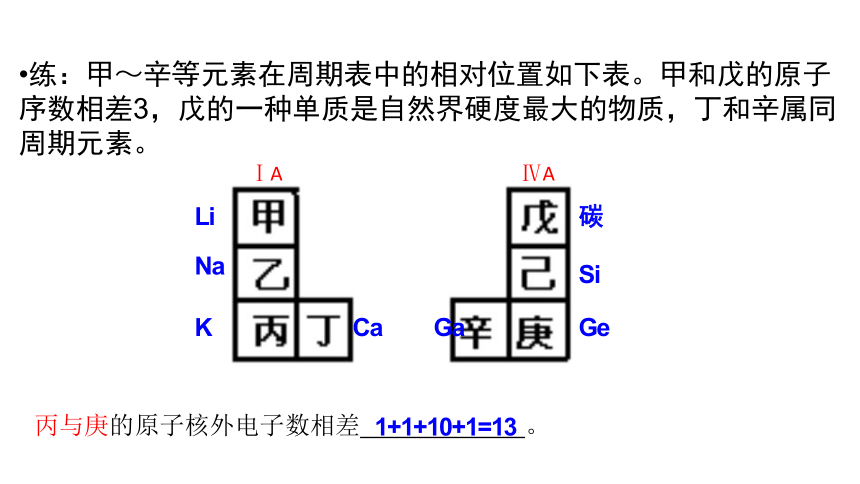
练:甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。
碳
Si
Ge
Ga
Li
Na
K
Ca
丙与庚的原子核外电子数相差 。
1+1+10+1=13
ⅠA
ⅣA
现象解读
知识点一、元素周期系
2、周期系
随着核电荷数的递增,电子填充遵循构造原理,每一周期里元素数目随着周期序号的递增渐渐增多。元素周期系周期发展如同螺壳上的螺旋。
周期 一 二 三 四 五 六 七
元素数目 2 8 8 18 18 32 32
周期 ⅠA 零族 能级组 元素数目
一 1s1 1s2 1s 2
二 [He]2s1 [He]2s22p6 2s2p 8
三 [Ne]3s1 [Ne]3s23p6 3s3p 8
四 [Ar]4s1 [Ar]3d104s24p6 4s3d4p 18
五 [Kr]5s1 [Kr]4d105s25p6 5s4d5p 18
六 [Xe]6s1 [Xe]4f145d106s26p6 6s4f5d7p 32
七 [Rn]7s1 … …
小结:各周期均 s 轨道开始, 以填充满p 轨道告终。(除第一周期外)
问题导学
思考交流
①每周期第一个元素最外
层电子排布式?
②每周期最后元素最外层
电子排布式?
③同主族价电子层规律?
④零族价电子层规律?
(1)周期
周期 ⅠA 零族 能级组 元素数目
一 1s1 1s2 1s 2
二 [He]2s1 [He]2s22p6 2s2p 8
三 [Ne]3s1 [Ne]3s23p6 3s3p 8
四 [Ar]4s1 [Ar]3d104s24p6 4s3d4p 18
五 [Kr]5s1 [Kr]4d105s25p6 5s4d5p 18
六 [Xe]6s1 [Xe]4f145d106s26p6 6s4f5d7p 32
七 [Rn]7s1 … …
各周期均 s 轨道开始, 以填充满p 轨道告终。(除第一周期外)
外围电子1——8
ns1 (n表示电子层数)
第一周期 1s2;其它周期 ns2np6
相同
除氦外,其它相同
知识点二、原子结构与元素周期表
1、周期与族
问题导学
(1)周期
各周期均 s 轨道开始, 以填充
满p 轨道告终。(除第一周期外)
周期 能级组 原子轨道 元素数目 最多电子
1 Ⅰ 1s 2 2
2 Ⅱ 2s 2p 8 8
3 Ⅲ 3s 3p 8 8
4 Ⅳ 4s 3d 4p 18 18
5 Ⅴ 5s 4d 5p 18 18
6 Ⅵ 6s 4f 5d 6p 32 32
7 Ⅶ 7s 5f 6d (未完) 23 (未完) 未满
周期元素数目 = 相应能级组中原子轨道所能容纳的电子总数
周期数 = 电子层数
知识点二、原子结构与元素周期表
1、周期与族
视频导学
(1)周期
各周期均 s 轨道开始, 以填充
满p 轨道告终。(除第一周期外)
(2)族
表中有 个纵列, 三个纵列为第Ⅷ族, 一般每个族序数和价电子数是 的。(除稀有气体外)
主族元素:
族序数=原子的最外层电子数=价电子数
副族元素:
大多数族序数=(n-1)d+ns的电子数=价电子数
18
8.9.10
相等
知识点二、原子结构与元素周期表
1、周期与族
知识探究
探究一
①主族元素:
外围电子数=最外层电子数=主族序数
A、电子总数为3~7,ⅢB~ⅦB
B、电子总数为8~10,Ⅷ
C、电子总数为11~12,ⅠB和ⅡB
②副族元素:
以外围电子 (n-1)d+ns 判断
判断元素所在的族
知识点二、原子结构与元素周期表
1、周期与族
知识探究
探究二
主族元素价电子
族序数与价电子排布关系
零族元素价电子
过渡元素价电子
ⅠB~ⅡB族 (n-1)d10ns1~2
族序数=最外层电子数
ns1~2或ns2np1~5
族序数=价电子数
ns2np6(He除外)
ⅢB~ⅦB族 (n-1)d1~5ns1~2
族序数=价电子数
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
ⅠA 与 ⅡA 共两族两列
价电子层:ns1或2 (n≥1)
注意
①价电子层为ns1或2的不一定在
S区,He(1s2 p区)
②除H外,都是金属元素
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
ⅢA至ⅦA及零族共六族六列
价电子层:ns2 np1-6(n≥2) ,
注意
①He在p区,但它无p电子
②以非金属元素为主
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
ⅢB至ⅦB和Ⅷ族共六族八列
(镧系和锕系属 f 区)
价电子层: (n-1)d1-9ns1-2
注意
①特例 :46Pd 4d10(不合规则)
②均为金属元素
③价电子总数8、9、10,为Ⅷ族
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
ⅠB、ⅡB共两族两列
价电子层: (n-1)d10ns1或2
注意
①价电子总数=所在的列序数
②均为金属元素,d轨道全充
满,一般不成键。
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
镧系与锕系
价电子层(n-2)f0-14(n-1)d0-2ns2
注意
最外层电子数基本相同,((n-1)d相同,一般 (n-2)f不同)因此化学性质相似。
知识点二、原子结构与元素周期表
2、区的划分
(2)依据元素金属性与非金属性
问题导学
非金属 22 种,
金属与非金属交界线(梯形线)附近的非金属元素具有一定金属性,又称半金属或准金属,但不能叫两性非金属。
位于右上角。
注意
s、d、ds区最外层电子数为1-2,反应易失,所以都是金属。
知识点二、原子结构与元素周期表
2、区的划分
(2)依据元素金属性与非金属性
思考交流
1. 为什么副族与VIII族又称过渡元素?
2.为什么表中非金属元素主要集中在右上角三角区内(如图)?
处于金属向非金属过渡区域,因此又称为过渡元素。
同周期元素从左到右非金属性渐强,同主族从上到下非金属性渐弱,结果使右上角的元素主要呈现非金属性。
例.某元素的+3价离子的核外电子排布为1s22s22p63s23p63d5的元素在周期表中的位置是 。
第四周期Ⅷ族
习题导学
例.外围电子构型为4f75d16s2的元素在周期表中的位置是( )
A.第四周期ⅦB族 B.第五周期ⅢB族
C.第六周期ⅦB族 D.第六周期ⅢB族
第六周期
D
5d和6s上电子之和为3,第Ⅲ B族
例3.下列关于元素周期表分区正确的是( )
A.s区全部是金属元素
B.p区全部是非金属元素
C.d区内元素原子的价电子排布式必为(n-1)d1~10ns2
D.ds区全部是金属元素
总结感悟
元素周期表划分
周期
族
课时小结
短周期
长周期
主族
副族
Ⅷ族
0 族
区
s、p、d、ds、f 区
当堂巩固
1、前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有几种( )
A.3种 B.4种 C.5种 D.6种
2、已知M2+的3d轨道中有6个电子。试推断:
(1)M原子的电子排布式:
(2)M原子的最外层电子数为多少?
(3)M元素在周期表中的位置。
依据构造原理、核外电子排布规律
C
第一周期H(1s1)、第二周期C(1s22s22p2)和 O(1s22s22p4)、第三周期P(1s22s22p63s23p3)、
第四周期 Fe(1s22s22p63s23p63d64s2)共5种元素。
1s22s22p63s23p63d64s2
2
第四周期、第Ⅷ族
组织建设
第1课时 原子结构与元素周期表
科学史话
门捷列夫与第一张元素周期表
纽兰兹在门捷列夫之前发现了元素性质的周期性。1865年他把当时已知元素按原子量的递增顺序排列,发现每隔7种元素便出现性质相似元素,如同音乐中的音阶一样,因此称为元素八音律。
知识回顾
1.元素周期表共有几个周期、几个主族、几个副族?
2.Ⅷ族在元素周期表中占几列?
回忆思考
7个周期
7个主族
7个副族
Ⅷ族
占三列
周期
族
短周期(第一,二,三周期,2,8,8)
长周期(第四,五,六周期,第七周期)
18,18,32, 最多32
主族(ⅠA ~ Ⅶ A,7个纵行)
副族( ⅠB ~ Ⅶ B,7个纵行)
Ⅷ族(8,9,10纵行)
零族
知识回顾
元素周期表结构
7个横行
18个纵行
周期序数 = 电子层数(能层数);
主族元素族序数 = 原子最外层电子数。
问题导学
知识点一、元素周期系
1、碱金属基态原子
完成以下填空
原子序数 周期 基态原子的电子排布式
锂 3 二 或
钠 11 三 或
钾 19 四 或
铷 37 五 1s22s22p63s23p63d104s24p65s1或[Kr]5s1
铯 55 六 1s22s22p63s23p63d104s24p64d105s25p66s1或[Xe]6s1
1s22s1 [He]2s1
1s22s22p63s1 [Ne]3s1
1s22s22p63s23p64s1 [Ar]4s1
思考交流
碱金属元素所在周期与电子层数关系?
相等
最外层电子数关系?
均为1
现象解读
知识点一、元素周期系
2、周期系
(1)周期系形成
核电荷数递增
碱金属
稀有气体
最外层电子数1——8,
一个周期,循环往复。
(2)形成原因
核外电子排布的周期性变化
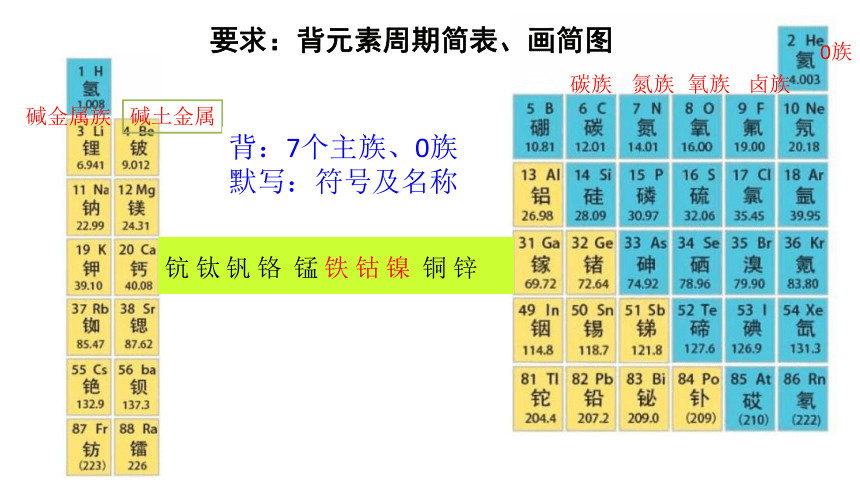
要求:背元素周期简表、画简图
碱金属族
碱土金属
碳族
氮族
氧族
卤族
0族
背:7个主族、0族
默写:符号及名称
钪 钛 钒 铬 锰 铁 钴 镍 铜 锌
元素周期简表
复习:用以下问题熟悉元素周期表
1.周期表共 列、 共 族。
每一周期的元素种类为 。
元素种类最多的是 周期? 元素种类最多的是第 列?
Cu在第 列; Mn在第 列,O在第 列
按顺序写出各族名称 。
2.写出稀有气体的原子序数: 。
写出碱金属的原子序数: 。
117在周期表的位置是 。若出现119号元素,位置是 。
3.不查表,推算31、35、53号元素的位置 。
4.同一周期相邻的主族元素原子序数可相差 ?
同主族元素的原子序数可相差 ?(相邻和不相邻)
练习1:已知A为第ⅡA族元素,B为第ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期的元素,下列关系式错误的是( )
A.n=m+1 B.n=m+10 C.n=m+11 D.n=m+25
B
同为2或3周期,m、n差1;
同为4或5周期,m、n差1+10=11;
同为6或7周期,m、n差1+15+9=25;
ⅡA
ⅢA
练习2:已知a、b分别为第ⅠA族、ⅦA族的同周期两种元素,它们的原子序数分别为m和n,下列关系式错误的是( )
A.n=m+6 B.n=m+10 C.n=m+16 D.n=m+30
B
同为2或3周期,m、n差5+1;
同为4或5周期,m、n差5+1+10=16;
同为6或7周期,m、n差5+1+15+9=30;
ⅠA
ⅦA
练:甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。
碳
Si
Ge
Ga
Li
Na
K
Ca
丙与庚的原子核外电子数相差 。
1+1+10+1=13
ⅠA
ⅣA
现象解读
知识点一、元素周期系
2、周期系
随着核电荷数的递增,电子填充遵循构造原理,每一周期里元素数目随着周期序号的递增渐渐增多。元素周期系周期发展如同螺壳上的螺旋。
周期 一 二 三 四 五 六 七
元素数目 2 8 8 18 18 32 32
周期 ⅠA 零族 能级组 元素数目
一 1s1 1s2 1s 2
二 [He]2s1 [He]2s22p6 2s2p 8
三 [Ne]3s1 [Ne]3s23p6 3s3p 8
四 [Ar]4s1 [Ar]3d104s24p6 4s3d4p 18
五 [Kr]5s1 [Kr]4d105s25p6 5s4d5p 18
六 [Xe]6s1 [Xe]4f145d106s26p6 6s4f5d7p 32
七 [Rn]7s1 … …
小结:各周期均 s 轨道开始, 以填充满p 轨道告终。(除第一周期外)
问题导学
思考交流
①每周期第一个元素最外
层电子排布式?
②每周期最后元素最外层
电子排布式?
③同主族价电子层规律?
④零族价电子层规律?
(1)周期
周期 ⅠA 零族 能级组 元素数目
一 1s1 1s2 1s 2
二 [He]2s1 [He]2s22p6 2s2p 8
三 [Ne]3s1 [Ne]3s23p6 3s3p 8
四 [Ar]4s1 [Ar]3d104s24p6 4s3d4p 18
五 [Kr]5s1 [Kr]4d105s25p6 5s4d5p 18
六 [Xe]6s1 [Xe]4f145d106s26p6 6s4f5d7p 32
七 [Rn]7s1 … …
各周期均 s 轨道开始, 以填充满p 轨道告终。(除第一周期外)
外围电子1——8
ns1 (n表示电子层数)
第一周期 1s2;其它周期 ns2np6
相同
除氦外,其它相同
知识点二、原子结构与元素周期表
1、周期与族
问题导学
(1)周期
各周期均 s 轨道开始, 以填充
满p 轨道告终。(除第一周期外)
周期 能级组 原子轨道 元素数目 最多电子
1 Ⅰ 1s 2 2
2 Ⅱ 2s 2p 8 8
3 Ⅲ 3s 3p 8 8
4 Ⅳ 4s 3d 4p 18 18
5 Ⅴ 5s 4d 5p 18 18
6 Ⅵ 6s 4f 5d 6p 32 32
7 Ⅶ 7s 5f 6d (未完) 23 (未完) 未满
周期元素数目 = 相应能级组中原子轨道所能容纳的电子总数
周期数 = 电子层数
知识点二、原子结构与元素周期表
1、周期与族
视频导学
(1)周期
各周期均 s 轨道开始, 以填充
满p 轨道告终。(除第一周期外)
(2)族
表中有 个纵列, 三个纵列为第Ⅷ族, 一般每个族序数和价电子数是 的。(除稀有气体外)
主族元素:
族序数=原子的最外层电子数=价电子数
副族元素:
大多数族序数=(n-1)d+ns的电子数=价电子数
18
8.9.10
相等
知识点二、原子结构与元素周期表
1、周期与族
知识探究
探究一
①主族元素:
外围电子数=最外层电子数=主族序数
A、电子总数为3~7,ⅢB~ⅦB
B、电子总数为8~10,Ⅷ
C、电子总数为11~12,ⅠB和ⅡB
②副族元素:
以外围电子 (n-1)d+ns 判断
判断元素所在的族
知识点二、原子结构与元素周期表
1、周期与族
知识探究
探究二
主族元素价电子
族序数与价电子排布关系
零族元素价电子
过渡元素价电子
ⅠB~ⅡB族 (n-1)d10ns1~2
族序数=最外层电子数
ns1~2或ns2np1~5
族序数=价电子数
ns2np6(He除外)
ⅢB~ⅦB族 (n-1)d1~5ns1~2
族序数=价电子数
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
ⅠA 与 ⅡA 共两族两列
价电子层:ns1或2 (n≥1)
注意
①价电子层为ns1或2的不一定在
S区,He(1s2 p区)
②除H外,都是金属元素
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
ⅢA至ⅦA及零族共六族六列
价电子层:ns2 np1-6(n≥2) ,
注意
①He在p区,但它无p电子
②以非金属元素为主
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
ⅢB至ⅦB和Ⅷ族共六族八列
(镧系和锕系属 f 区)
价电子层: (n-1)d1-9ns1-2
注意
①特例 :46Pd 4d10(不合规则)
②均为金属元素
③价电子总数8、9、10,为Ⅷ族
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
ⅠB、ⅡB共两族两列
价电子层: (n-1)d10ns1或2
注意
①价电子总数=所在的列序数
②均为金属元素,d轨道全充
满,一般不成键。
知识点二、原子结构与元素周期表
2、区的划分
(1)依据电子排布
问题导学
最后填入电子的能级符号
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 p区
3 s区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 d区 ds区
5
6
7
镧系 f区
锕系
(除ds区)
元素周期表 5 个分区
镧系与锕系
价电子层(n-2)f0-14(n-1)d0-2ns2
注意
最外层电子数基本相同,((n-1)d相同,一般 (n-2)f不同)因此化学性质相似。
知识点二、原子结构与元素周期表
2、区的划分
(2)依据元素金属性与非金属性
问题导学
非金属 22 种,
金属与非金属交界线(梯形线)附近的非金属元素具有一定金属性,又称半金属或准金属,但不能叫两性非金属。
位于右上角。
注意
s、d、ds区最外层电子数为1-2,反应易失,所以都是金属。
知识点二、原子结构与元素周期表
2、区的划分
(2)依据元素金属性与非金属性
思考交流
1. 为什么副族与VIII族又称过渡元素?
2.为什么表中非金属元素主要集中在右上角三角区内(如图)?
处于金属向非金属过渡区域,因此又称为过渡元素。
同周期元素从左到右非金属性渐强,同主族从上到下非金属性渐弱,结果使右上角的元素主要呈现非金属性。
例.某元素的+3价离子的核外电子排布为1s22s22p63s23p63d5的元素在周期表中的位置是 。
第四周期Ⅷ族
习题导学
例.外围电子构型为4f75d16s2的元素在周期表中的位置是( )
A.第四周期ⅦB族 B.第五周期ⅢB族
C.第六周期ⅦB族 D.第六周期ⅢB族
第六周期
D
5d和6s上电子之和为3,第Ⅲ B族
例3.下列关于元素周期表分区正确的是( )
A.s区全部是金属元素
B.p区全部是非金属元素
C.d区内元素原子的价电子排布式必为(n-1)d1~10ns2
D.ds区全部是金属元素
总结感悟
元素周期表划分
周期
族
课时小结
短周期
长周期
主族
副族
Ⅷ族
0 族
区
s、p、d、ds、f 区
当堂巩固
1、前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有几种( )
A.3种 B.4种 C.5种 D.6种
2、已知M2+的3d轨道中有6个电子。试推断:
(1)M原子的电子排布式:
(2)M原子的最外层电子数为多少?
(3)M元素在周期表中的位置。
依据构造原理、核外电子排布规律
C
第一周期H(1s1)、第二周期C(1s22s22p2)和 O(1s22s22p4)、第三周期P(1s22s22p63s23p3)、
第四周期 Fe(1s22s22p63s23p63d64s2)共5种元素。
1s22s22p63s23p63d64s2
2
第四周期、第Ⅷ族
