2.2.1 杂化轨道理论 课件(共23张PPT)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.2.1 杂化轨道理论 课件(共23张PPT)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |
|
|
| 格式 | ppt | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-14 12:13:11 | ||
图片预览




文档简介
(共23张PPT)
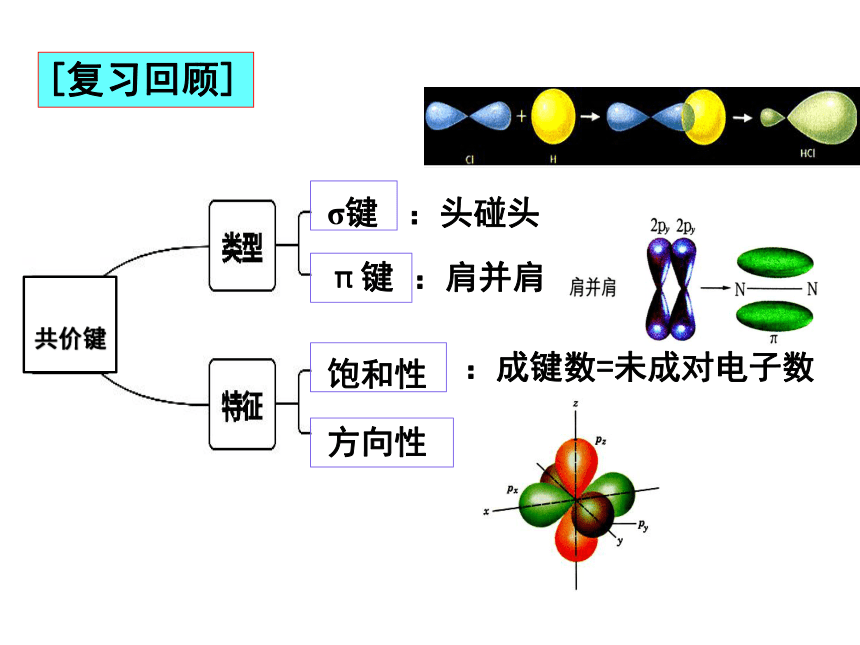
第二节 共价键与分子的空间构型
【学习目标】
1.了解甲烷、乙烯、乙炔、苯等常见分子的空间构型。
2.理解杂化轨道理论的主要内容,并能用杂化轨道理论解释或预测某些分子或离子的空间构型。
CH4
C6H6
NH3
CO2
宏观辨识与微观探析
证据推理与模型认知
第1课时——杂化轨道理论
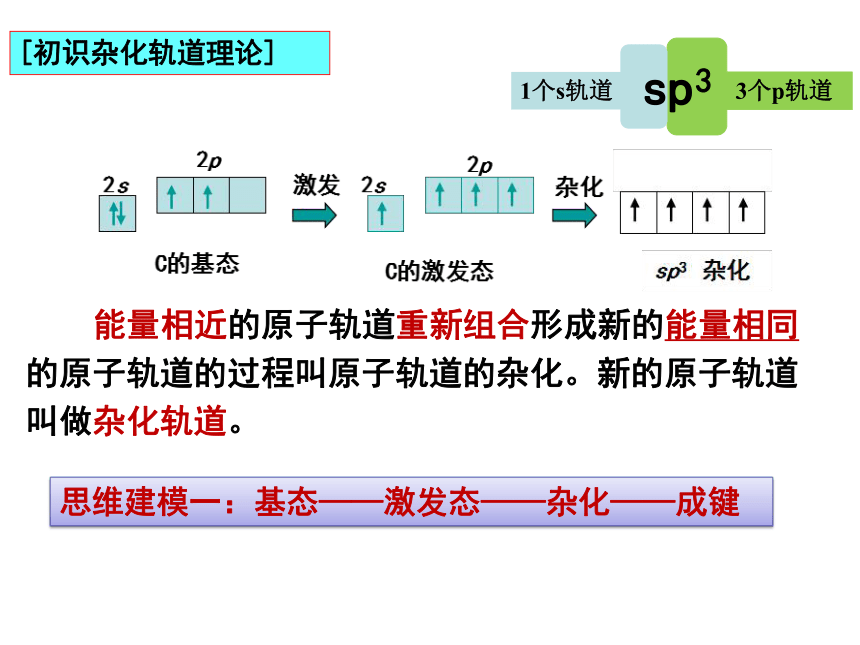
σ键
π键
饱和性
方向性
:头碰头
:肩并肩
[复习回顾]
:成键数=未成对电子数
CH4正四面体结构的探究
1、根据共价键的饱和性,C应形成几个共价键?
2、形成CH4 C原子应该有几个未成对的电子?
怎样才能使C原子具有这个数目的未成对的电子?
3、CH4中的4个C—H键完全相同,碳原子怎样才能有四个完全相同的用于成键的原子轨道?
鲍林 杂化轨道理论
[交流研讨]
C的价电子轨道表示式:
2
4
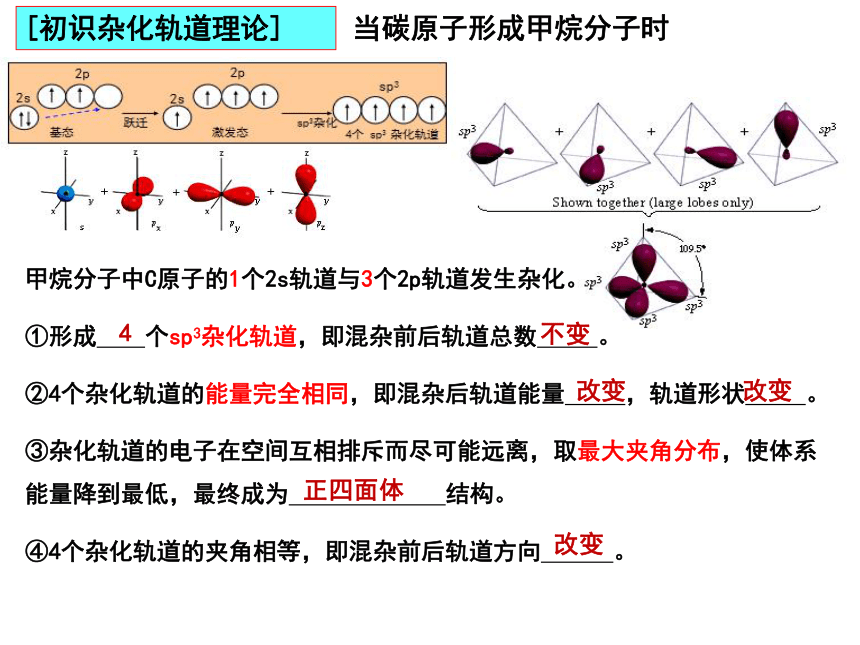
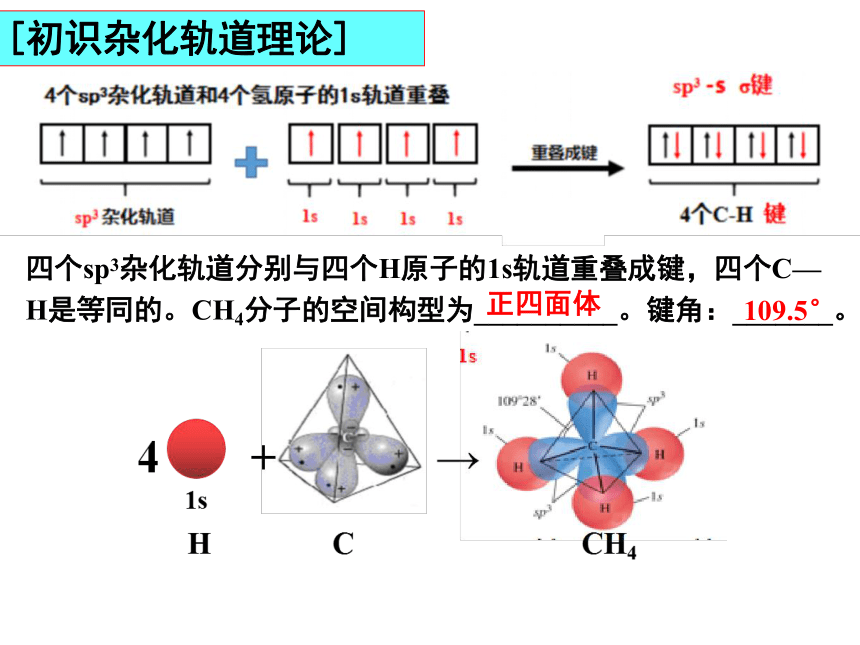
[初识杂化轨道理论]
能量相近的原子轨道重新组合形成新的能量相同的原子轨道的过程叫原子轨道的杂化。新的原子轨道叫做杂化轨道。
思维建模一:基态——激发态——杂化——成键
sp3
1个s轨道
3个p轨道
甲烷分子中C原子的1个2s轨道与3个2p轨道发生杂化。
①形成 个sp3杂化轨道,即混杂前后轨道总数 。
②4个杂化轨道的能量完全相同,即混杂后轨道能量 ,轨道形状 。
③杂化轨道的电子在空间互相排斥而尽可能远离,取最大夹角分布,使体系能量降到最低,最终成为 结构。
④4个杂化轨道的夹角相等,即混杂前后轨道方向 。
4
不变
改变
改变
改变
正四面体
[初识杂化轨道理论]
当碳原子形成甲烷分子时
[初识杂化轨道理论]
四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键,四个C—H是等同的。CH4分子的空间构型为__________。键角:_______。
正四面体
109.5°
1.能量相近的原子轨道才能杂化(如1s和2p不能杂化),中心原子才杂化,形成分子才能杂化;
2.混杂前后轨道总数不变;
3.生成杂化轨道能量相同、方向不同;
4.杂化轨道的方向尽可能使体系能量降到最低
(轨道间的排斥力最小,取最大夹角分布);
5.通过杂化后再和其他原子成键(杂化后成键能力更强)。
6.杂化轨道只用于形成σ键和容纳孤电子对(一个轨道已有两个电子,不再成键),不用于形成π键。
B
F
F
F
BF3平面三角形的探究
[再析杂化轨道理论]
2s
2p
B的基态
2p
2s
激发态
激发
杂化
sp2杂化
2p
未杂化轨道
σ
sp2杂化轨道成键
σ
σ
F原子的2p轨道
sp2 杂化轨道间的夹角是______,为_________形。
120°
平面三角
BF3分子的空间构型为____________,键角:_______。
平面三角形
120°
平面三角形
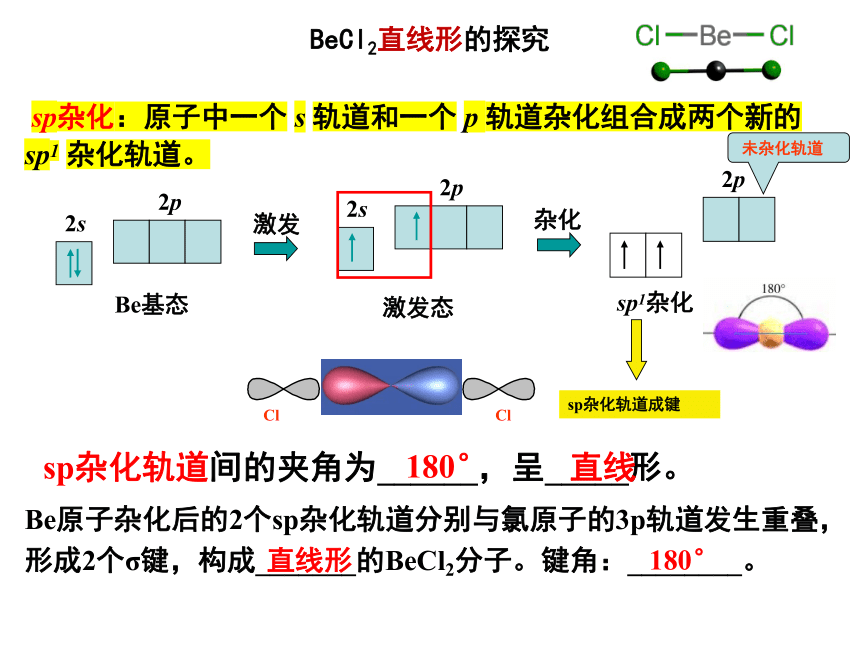
BeCl2直线形的探究
2s
2p
Be基态
2s
2p
激发态
激发
杂化
sp1杂化
2p
未杂化轨道
sp杂化轨道成键
Cl
Cl
sp杂化轨道间的夹角为______,呈_____形。
Be原子杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成_______的BeCl2分子。键角:________。
180°
直线
直线形
180°
4个杂化轨道
空间构形?
3个杂化轨道
空间构形?
2个杂化轨道
空间构形?
[归纳总结]
平面三角形
直线形
[思维建模二]
杂化
类型 杂化轨道数目 键角 空间
构形 图示
3
sp2
4
sp3
2
sp
平面三角形
120°
109.5°
正四面体形
180°
直线形
正四面体
乙烯中每个碳原子成键特点
[深析析杂化轨道理论——多杂化中心]
乙烯CH2=CH2
三个sp2杂化轨道:①1个与另一个碳原子sp2杂化轨道上的电子相互配对,形成一个σ键,②2个分别与两个氢原子1s轨道上的电子配对,形成σ键;
一个未参与杂化的2p轨道(均含有一个未成对电子)以肩并肩方式重叠,形成一个π键。
未杂化轨道
乙炔中每个碳原子成键特点
乙炔CH≡CH
两个sp杂化轨道:①1个与另一个碳原子sp1杂化轨道上的电子相互配对,形成一个σ键,②1个与氢原子1s轨道上的电子配对,形成σ键;
两个未参与杂化的2p轨道(均含有一个未成对电子):以肩并肩方式重叠,形成两个π键。
未杂化轨道
苯中的碳碳键是介于单双键之间的独特的键,到底是什么样的键呢?
根据杂化轨道理论,形成苯分子时每个碳原子都发生了____杂化。
sp2
苯 C6H6:sp2杂化
6个碳原子上各有1个未参与杂化的垂直于碳环平面的2p轨道,这6个轨道以“肩并肩”的方式形成含有__个电子、属于__个C原子的大π键。Π66
在多原子间形成的多电子π键称为大π键。
6
6
sp2
σ
σ
2个分别与邻近的两个碳原子的____杂化轨道上的电子配对形成__键——组成一个正六边形的碳环
三个sp2杂化轨道
1个与一个氢原子的1s电子配对形成__键。
杂化
类型 杂化轨道数目 键角 空间
构型 图示 实例
平面三角形
3
120°
BF3
sp2
4
109.5°
正四面体形
CH4
sp3
2
180°
直线形
BeCl2
sp
C2H4
C6H6
C2H2
[归纳总结]
平面正六边形
直线形
平面结构
[能力拔高:NH3]
[交流研讨]
NH3中N的价电子排布:2s22p3
氮原子发生什么类型的杂化?
提示:氨气是三角锥形结构,键角107.3°
而测得氨分子中N—H键的键角为107.3 ,与90°矛盾!
1、NH3 sp3杂化
[知识梳理]
3、孤电子对对成键电子对的排斥更大,所以使 N-H 键之间的键角被______,使得键角略小于109.5°,变成107.3°
sp3杂化轨道间的夹角为______,呈________形。
109.5°
正四面体
2、 一个sp3 杂化轨道已有两个电子(孤对电子),不再成键。另外三个sp3杂化轨道中各有一个未成对电子,分别与三个H 的1s 轨道重叠,形成三个σ键。因此 NH3 的空间构型为_______形。
三角锥
压缩
[迁移应用——H2O]
测得水中O—H键的键角为104.5°。
O原子发生什么类型的杂化?为什么?
提示:水的结构——角形。
[交流研讨]
[知识梳理]
1、H2O sp3杂化
3、两对孤对电子对对成键电子对的排斥更大,使得键角更小,变成104.5°
sp3杂化轨道间的夹角为______,呈________形。
109.5°
正四面体
2、两个sp3 杂化轨道中容纳了孤对电子,另外两个sp3杂化轨道中各有一个未成对电子,分别与两个H 的1s 轨道重叠,形成两个σ键。所以H2O分子空间构型为___形
角
杂化
类型 杂化轨道数目 键角 空间
构型 图示 实例
平面三角形
3
120°
BF3
sp2
4
109.5°
正四面体形
CH4
sp3
2
180°
直线形
BeCl2
sp
C2H4
平面结构
C6H6
平面正六边形
C2H2
直线形
NH3
H2O
107.3°
104.5°
[课堂小结]
三角锥形
角形
正四面体形
平面三角形
直线形
孤对电子与成键电子对之间的排斥作用>成键电子对与成键电子对之间的排斥作用。
中心原子杂化轨道类型相同时,孤电子对数越多,键角越小。
有机物中碳原子的杂化类型——由碳原子的饱和程度判断
①饱和(4个单键)碳原子:sp3杂化;
②双键碳原子/苯环上的碳原子:sp2杂化;
③叁键碳原子/CO2(连有两个双键)的碳原子:sp杂化。
杂化轨道类型的判断方法
根据分子(或离子)的空间构型/键角判断
①正四面体形/三角锥形 109.5°→sp3杂化;
②平面三角形 120°→sp2杂化;
③直线形 180°→sp杂化。
第二节 共价键与分子的空间构型
【学习目标】
1.了解甲烷、乙烯、乙炔、苯等常见分子的空间构型。
2.理解杂化轨道理论的主要内容,并能用杂化轨道理论解释或预测某些分子或离子的空间构型。
CH4
C6H6
NH3
CO2
宏观辨识与微观探析
证据推理与模型认知
第1课时——杂化轨道理论
σ键
π键
饱和性
方向性
:头碰头
:肩并肩
[复习回顾]
:成键数=未成对电子数
CH4正四面体结构的探究
1、根据共价键的饱和性,C应形成几个共价键?
2、形成CH4 C原子应该有几个未成对的电子?
怎样才能使C原子具有这个数目的未成对的电子?
3、CH4中的4个C—H键完全相同,碳原子怎样才能有四个完全相同的用于成键的原子轨道?
鲍林 杂化轨道理论
[交流研讨]
C的价电子轨道表示式:
2
4
[初识杂化轨道理论]
能量相近的原子轨道重新组合形成新的能量相同的原子轨道的过程叫原子轨道的杂化。新的原子轨道叫做杂化轨道。
思维建模一:基态——激发态——杂化——成键
sp3
1个s轨道
3个p轨道
甲烷分子中C原子的1个2s轨道与3个2p轨道发生杂化。
①形成 个sp3杂化轨道,即混杂前后轨道总数 。
②4个杂化轨道的能量完全相同,即混杂后轨道能量 ,轨道形状 。
③杂化轨道的电子在空间互相排斥而尽可能远离,取最大夹角分布,使体系能量降到最低,最终成为 结构。
④4个杂化轨道的夹角相等,即混杂前后轨道方向 。
4
不变
改变
改变
改变
正四面体
[初识杂化轨道理论]
当碳原子形成甲烷分子时
[初识杂化轨道理论]
四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键,四个C—H是等同的。CH4分子的空间构型为__________。键角:_______。
正四面体
109.5°
1.能量相近的原子轨道才能杂化(如1s和2p不能杂化),中心原子才杂化,形成分子才能杂化;
2.混杂前后轨道总数不变;
3.生成杂化轨道能量相同、方向不同;
4.杂化轨道的方向尽可能使体系能量降到最低
(轨道间的排斥力最小,取最大夹角分布);
5.通过杂化后再和其他原子成键(杂化后成键能力更强)。
6.杂化轨道只用于形成σ键和容纳孤电子对(一个轨道已有两个电子,不再成键),不用于形成π键。
B
F
F
F
BF3平面三角形的探究
[再析杂化轨道理论]
2s
2p
B的基态
2p
2s
激发态
激发
杂化
sp2杂化
2p
未杂化轨道
σ
sp2杂化轨道成键
σ
σ
F原子的2p轨道
sp2 杂化轨道间的夹角是______,为_________形。
120°
平面三角
BF3分子的空间构型为____________,键角:_______。
平面三角形
120°
平面三角形
BeCl2直线形的探究
2s
2p
Be基态
2s
2p
激发态
激发
杂化
sp1杂化
2p
未杂化轨道
sp杂化轨道成键
Cl
Cl
sp杂化轨道间的夹角为______,呈_____形。
Be原子杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成_______的BeCl2分子。键角:________。
180°
直线
直线形
180°
4个杂化轨道
空间构形?
3个杂化轨道
空间构形?
2个杂化轨道
空间构形?
[归纳总结]
平面三角形
直线形
[思维建模二]
杂化
类型 杂化轨道数目 键角 空间
构形 图示
3
sp2
4
sp3
2
sp
平面三角形
120°
109.5°
正四面体形
180°
直线形
正四面体
乙烯中每个碳原子成键特点
[深析析杂化轨道理论——多杂化中心]
乙烯CH2=CH2
三个sp2杂化轨道:①1个与另一个碳原子sp2杂化轨道上的电子相互配对,形成一个σ键,②2个分别与两个氢原子1s轨道上的电子配对,形成σ键;
一个未参与杂化的2p轨道(均含有一个未成对电子)以肩并肩方式重叠,形成一个π键。
未杂化轨道
乙炔中每个碳原子成键特点
乙炔CH≡CH
两个sp杂化轨道:①1个与另一个碳原子sp1杂化轨道上的电子相互配对,形成一个σ键,②1个与氢原子1s轨道上的电子配对,形成σ键;
两个未参与杂化的2p轨道(均含有一个未成对电子):以肩并肩方式重叠,形成两个π键。
未杂化轨道
苯中的碳碳键是介于单双键之间的独特的键,到底是什么样的键呢?
根据杂化轨道理论,形成苯分子时每个碳原子都发生了____杂化。
sp2
苯 C6H6:sp2杂化
6个碳原子上各有1个未参与杂化的垂直于碳环平面的2p轨道,这6个轨道以“肩并肩”的方式形成含有__个电子、属于__个C原子的大π键。Π66
在多原子间形成的多电子π键称为大π键。
6
6
sp2
σ
σ
2个分别与邻近的两个碳原子的____杂化轨道上的电子配对形成__键——组成一个正六边形的碳环
三个sp2杂化轨道
1个与一个氢原子的1s电子配对形成__键。
杂化
类型 杂化轨道数目 键角 空间
构型 图示 实例
平面三角形
3
120°
BF3
sp2
4
109.5°
正四面体形
CH4
sp3
2
180°
直线形
BeCl2
sp
C2H4
C6H6
C2H2
[归纳总结]
平面正六边形
直线形
平面结构
[能力拔高:NH3]
[交流研讨]
NH3中N的价电子排布:2s22p3
氮原子发生什么类型的杂化?
提示:氨气是三角锥形结构,键角107.3°
而测得氨分子中N—H键的键角为107.3 ,与90°矛盾!
1、NH3 sp3杂化
[知识梳理]
3、孤电子对对成键电子对的排斥更大,所以使 N-H 键之间的键角被______,使得键角略小于109.5°,变成107.3°
sp3杂化轨道间的夹角为______,呈________形。
109.5°
正四面体
2、 一个sp3 杂化轨道已有两个电子(孤对电子),不再成键。另外三个sp3杂化轨道中各有一个未成对电子,分别与三个H 的1s 轨道重叠,形成三个σ键。因此 NH3 的空间构型为_______形。
三角锥
压缩
[迁移应用——H2O]
测得水中O—H键的键角为104.5°。
O原子发生什么类型的杂化?为什么?
提示:水的结构——角形。
[交流研讨]
[知识梳理]
1、H2O sp3杂化
3、两对孤对电子对对成键电子对的排斥更大,使得键角更小,变成104.5°
sp3杂化轨道间的夹角为______,呈________形。
109.5°
正四面体
2、两个sp3 杂化轨道中容纳了孤对电子,另外两个sp3杂化轨道中各有一个未成对电子,分别与两个H 的1s 轨道重叠,形成两个σ键。所以H2O分子空间构型为___形
角
杂化
类型 杂化轨道数目 键角 空间
构型 图示 实例
平面三角形
3
120°
BF3
sp2
4
109.5°
正四面体形
CH4
sp3
2
180°
直线形
BeCl2
sp
C2H4
平面结构
C6H6
平面正六边形
C2H2
直线形
NH3
H2O
107.3°
104.5°
[课堂小结]
三角锥形
角形
正四面体形
平面三角形
直线形
孤对电子与成键电子对之间的排斥作用>成键电子对与成键电子对之间的排斥作用。
中心原子杂化轨道类型相同时,孤电子对数越多,键角越小。
有机物中碳原子的杂化类型——由碳原子的饱和程度判断
①饱和(4个单键)碳原子:sp3杂化;
②双键碳原子/苯环上的碳原子:sp2杂化;
③叁键碳原子/CO2(连有两个双键)的碳原子:sp杂化。
杂化轨道类型的判断方法
根据分子(或离子)的空间构型/键角判断
①正四面体形/三角锥形 109.5°→sp3杂化;
②平面三角形 120°→sp2杂化;
③直线形 180°→sp杂化。
