4.1原子结构与元素周期表(第二课时) (共26页课件 ) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1原子结构与元素周期表(第二课时) (共26页课件 ) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 10.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-14 19:54:28 | ||
图片预览

文档简介
(共26张PPT)
元素周期表
新人教版·必修一·第四章
第一节·原子结构与元素周期表·第二课时
问题1:元素之间有什么内在联系?
1、元素周期表的发展
导入:18世纪,人们已发现了不少元素。但科学家们发现,有些元素的性质极为相似,有些则完全不同,某些元素在一些性质方面很相似,但在另一些方面却又差别很大。
?
早期探索
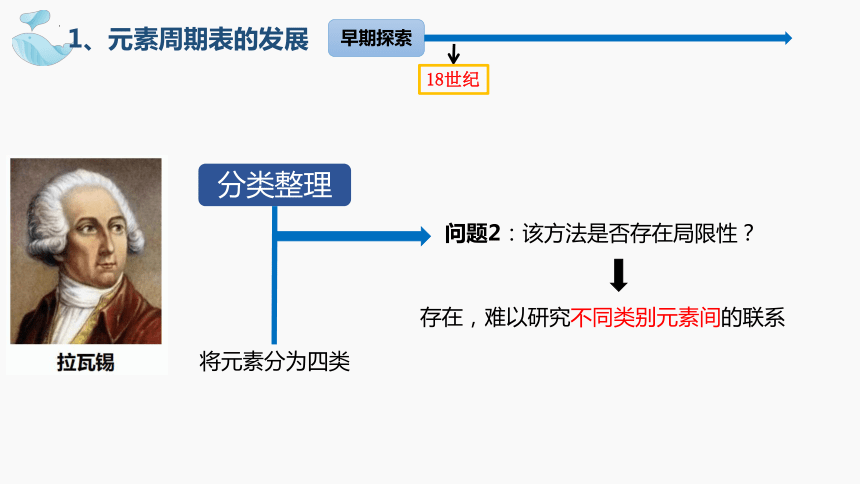
1、元素周期表的发展
分类整理
问题2:该方法是否存在局限性?
存在,难以研究不同类别元素间的联系
将元素分为四类
18世纪
早期探索
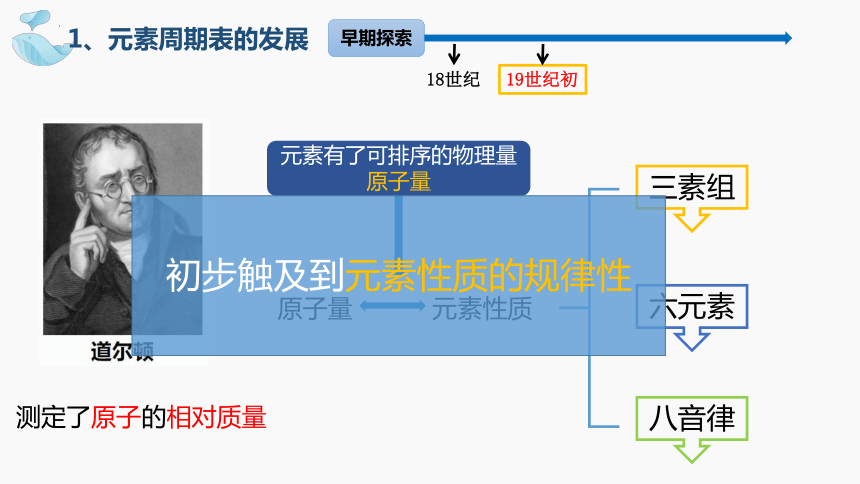
1、元素周期表的发展
18世纪
19世纪初
测定了原子的相对质量
元素有了可排序的物理量
原子量
原子量
元素性质
三素组
六元素
八音律
初步触及到元素性质的规律性
周期表确立
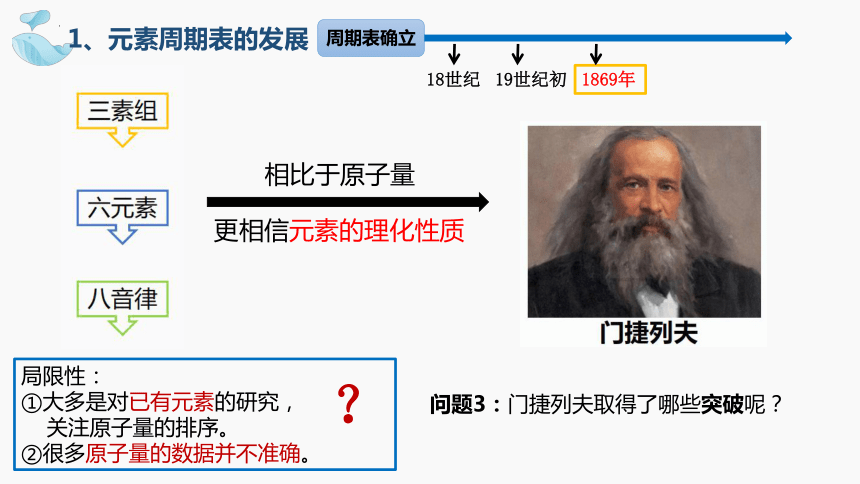
1、元素周期表的发展
18世纪
19世纪初
1869年
局限性:
①大多是对已有元素的研究,
关注原子量的排序。
②很多原子量的数据并不准确。
相比于原子量
更相信元素的理化性质
问题3:门捷列夫取得了哪些突破呢?
?
周期表确立
1、元素周期表的发展
18世纪
19世纪初
1869年
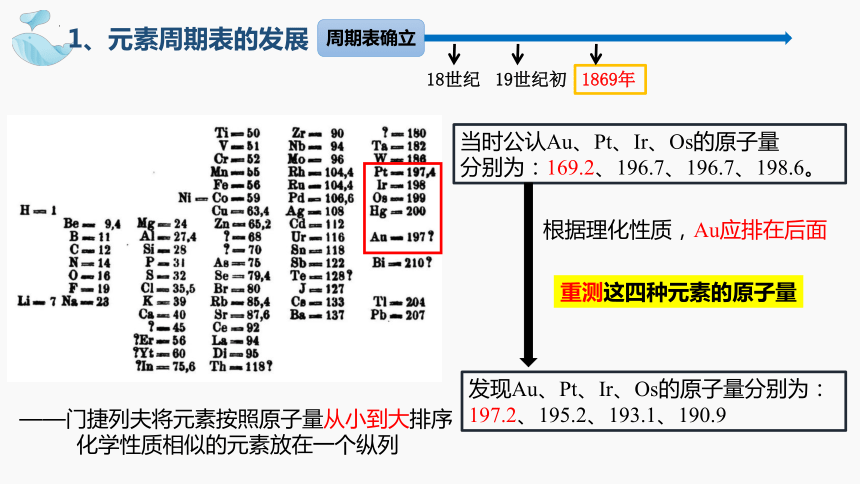
当时公认Au、Pt、Ir、Os的原子量
分别为:169.2、196.7、196.7、198.6。
——门捷列夫将元素按照原子量从小到大排序
化学性质相似的元素放在一个纵列
根据理化性质,Au应排在后面
发现Au、Pt、Ir、Os的原子量分别为:
197.2、195.2、193.1、190.9
重测这四种元素的原子量
周期表发展
1、元素周期表的发展
18世纪
19世纪初
1869年
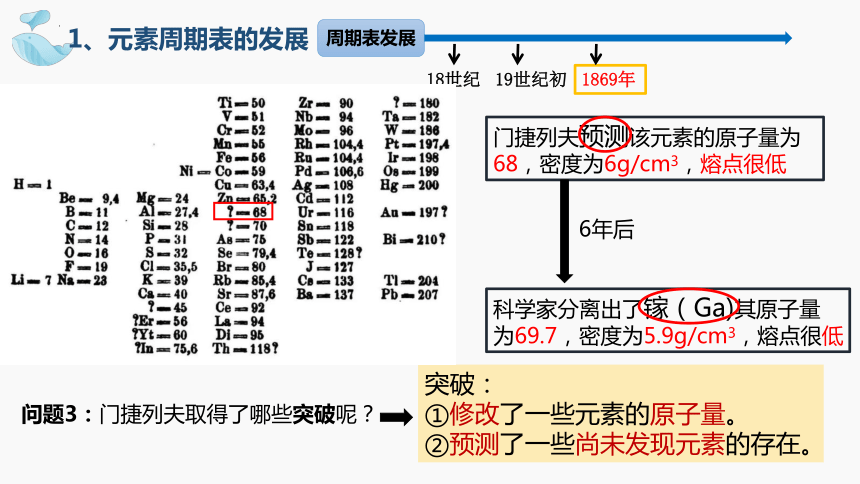
突破:
①修改了一些元素的原子量。
②预测了一些尚未发现元素的存在。
门捷列夫预测该元素的原子量为68,密度为6g/cm3,熔点很低
科学家分离出了镓(Ga)其原子量
为69.7,密度为5.9g/cm3,熔点很低
6年后
问题3:门捷列夫取得了哪些突破呢?
周期表确立
1、元素周期表的发展
18世纪
19世纪初
1869年
19世纪末20世纪初
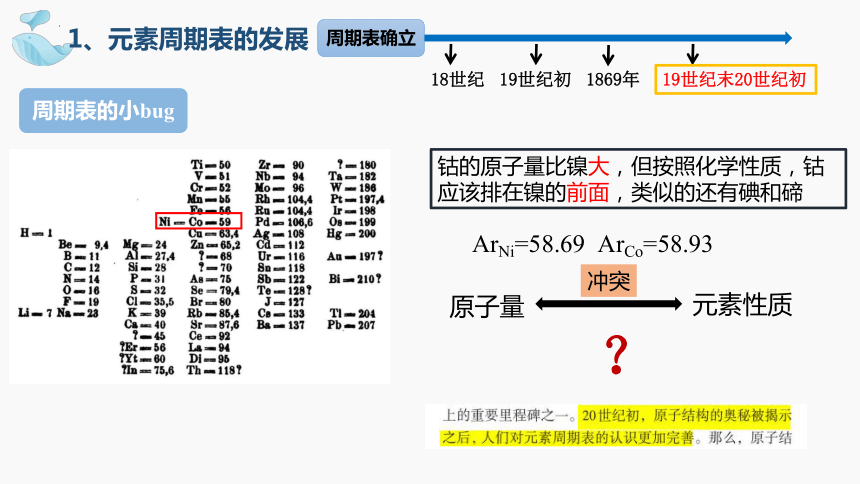
钴的原子量比镍大,但按照化学性质,钴应该排在镍的前面,类似的还有碘和碲
原子量
元素性质
冲突
ArNi=58.69 ArCo=58.93
周期表的小bug
?
周期表确立
1、元素周期表的发展
18世纪
19世纪初
1869年
19世纪末20世纪初
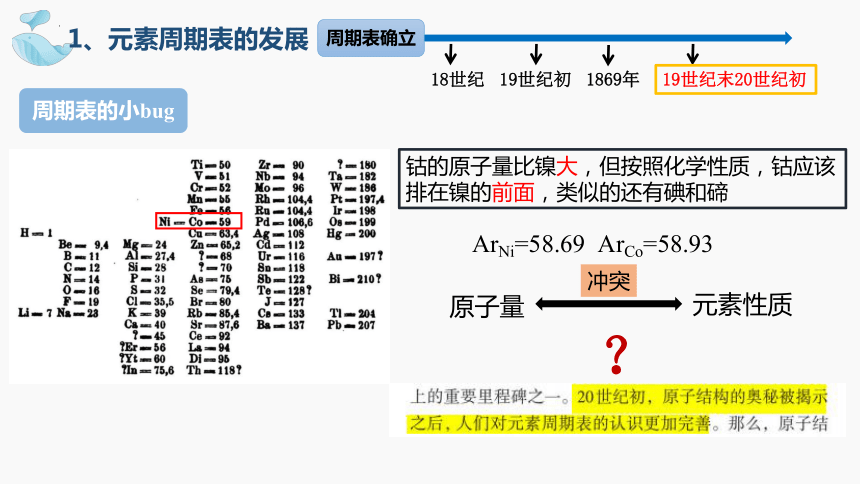
钴的原子量比镍大,但按照化学性质,钴应该排在镍的前面,类似的还有碘和碲
原子量
元素性质
冲突
ArNi=58.69 ArCo=58.93
周期表的小bug
?
周期表发展
1、元素周期表的发展
18世纪
19世纪初
1869年
19世纪末20世纪初
理论证明:
通过实验测定的元素特征谱线频率来确定元素在周期表上的位置
只有Co-Ni、Ar-K、Te-I相邻元素处原子序数发生了改变
核外电子
核电荷数
原子序数
=
元素周期表中的排序依据由相对原子质量→原子的核电荷数
质子数
核外电子数
=
=
周期表发展
1、元素周期表的发展
18世纪
19世纪初
1869年
19世纪末20世纪初
问题3:了解了科学家们对元素周期表探索的历程,
你有什么感悟吗?
2、认识元素周期表
周期:把电子层数目相同的元素,……排成横行,每一个横行叫做一个周期
2、认识元素周期表
元素周期表共有 个横行,故元素周期表共有 个周期。
周期序数 起止元素 元素种数 核外电子层数
1 1H—2He
2 3Li—10Ne
3 11Na—18Ar
4 19K—36Kr
5 37Rb—54Xe
6 55Cs—86Rn
7 87Fr—118Og
1
2
3
4
5
6
7
2
8
8
18
18
32
32
周期序数 = 核外电子层数
7
7
短周期
长周期
提出模型
修正模型
建构新模
2、认识元素周期表
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
IA
IIA
IIIB IVB VB VIB VIIB
VIII
IB IIB
IIIA IVA VA VIA VIIA
0
7个主族(A),7个副族(B),1个第Ⅷ族,1个0族
碱
金
属
元
素
过渡元素
卤
族
元
素
稀
有
气
体
元
素
把最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵列,每一个纵列叫做一个族(8、9、10三个纵列共同组成第Ⅷ族)。
由长周期和短周期
元素共同构成族
只有长周期元素构成族
2、认识元素周期表
小结:元素周期表的基本规律
原子序数=核电荷数=质子数=核外电子数
周期数=电子层数
主族序数=最外层电子数
问题:已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?
例:Cl的位置的描述:
第七主族
VII族
VIIA族
第III周期
第三周期
第3周期
2、认识元素周期表
思考1:如何确定元素在周期表中的位置?
1.根据原子结构示意图判断元素在周期表中的位置
2.“0族”法确定元素在周期表中的位置
周期序数 一 二 三 四 五 六 七
稀有气体原子序数 2 10 18 36 54 86 118
(1)原子的电子层数=周期序数
(2)最外层电子数=族序数
熟记0族元素的相应周期数和原子序数
思考2:氦(He)元素原子最外层有两个电子,为什么不把它排在ⅡA族?
最外层填充两个电子已达饱和,性质与ⅡA族的元素完全不同,但与0族元素性质相似,所以不排在第ⅡA族,而排在0族。
2、认识元素周期表
练习1:请描述出Na、C、Al、S在周期表中的位置。
Na:第三周期第ⅠA族; C: 第二周期第ⅣA族;
Al:第三周期第ⅢA族 S:第三周期第ⅥA族
练习2:元素周期表中铊元素的数据如图,下列说法正确的是( )
D
A.铊元素的质量数是204.4
B.铊原子的中子数为81
C.铊对应的氢氧化物有两性
D.铊元素位于第ⅢA族
1S1
1
H
氢
1.008
原子序数
元素符号
元素名称
相对原子质量
通过能级表示核外电子排布
核素的定义
核素与元素的关系
核素的应用价值
3、认识核素与同位素
问题1:H的质量数为什么有3个呢?
回顾:元素是具有相同核电荷数(核内质子数)的同一类原子的总称。即同种元素原子的原子核中质子数是相同的。
太阳内部核聚变:
“原子”是化学变化中最小微粒
在化学学科研究领域之外,存在比原子更小的粒子
问题2:该变化属于化学反应吗?
×
核素的定义
核素与元素的关系
核素的应用价值
3、认识核素与同位素
回顾原子的结构
原子
原子核
核外电子
质子
中子
(正电)
不显
电性
(负电)
(正电)
(不带电)
核电荷数=质子数=核外电子数=原子序数
质量数(A)=质子数(Z)+中子数(N)
问题3:一种元素是否一定只有一种原子呢?
质子数 中子数 原子名称 原子符号
1 0 氕
1 1 氘 或D
1 2 氚 或T
同种元素的原子只是质子数相同,中子数不一定相同。
核素
氢元素的不同核素
核素的定义
核素与元素的关系
核素的应用价值
3、认识核素与同位素
核素:
同位素:
质子数相同而中子数不同的同一种元素的不同原子互称为同位素。
几乎完全相同
特点:
①同位素的化学性质 ____ , 某些物理性质略有不同。
②天然存在的同位素,相互之间保持一定的比率。
具有一定数目的质子和一定数目的中子的一种原子。
如 就各为一种核素
如 互为同位素
核素的质子相同,在元素周期表中占有相同的位置
核素的定义
核素与元素的关系
核素的应用价值
3、认识核素与同位素
许多元素都有同位素
同位素的用途
1、给金属探伤、诊断和治疗疾病
2、元素半衰期用于考古年代换算
3、氘、氚用于制造氢弹
医疗上
农业上
能源上
考古上
4、同位素示踪技术用于生物基因工程、射线育种
有利有弊,合理利用
核素与元素的关系
核素的定义
核素的应用价值
3、认识核素与同位素
问题4:元素、核素、同位素以及同素异形体间有什么区别与联系?
元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只有种类 , 没有个数 化学反应中 的最小微粒 化学性质几乎完全相同 , 因质量数不同,物理性质不同 组成元素相同 ,
性质不同
联系:
3、认识核素与同位素
思考:为什么H的相对原子质量1.008,这个数值是怎么来的?
元素的相对原子质量≠原子的相对原子质量
班上某个同学的身高 核素的相对原子质量
班上同学的平均身高 元素的平均相对原子质量
班上某个同学的近似身高 核素的近似相对原子质量(质量数)
班上同学的平均近似身高 元素的平均近似相对原子质量
元素的相对原子质量是其各种核素的相对原子质量分别与各种核素在自然界里的丰度的乘积之和。
例如——氢元素的三种核素: 氕,Ar=1.0079,丰度为99.985%, 氘,Ar=2.014,丰度为0.015%,氚,痕量(计算时忽略)。
因此,氢元素的相对原子质量为1.0079*99.985%+ 2.014*0.015% ≈1.008。
(某种核素在这种元素的所有天然核素中所占的比例)
核素与元素的关系
核素的定义
核素的应用价值
3、认识核素与同位素
练习:1、镁有三种天然同位素:24Mg、25Mg、26Mg,其中24Mg原子占镁元素的原子百分数为78.70%,25Mg原子为10.1%,26Mg原子为11.2%,求镁元素的相对原子质量。
解:镁元素的相对原子质量为
24×78.70% + 25×10.1% + 26×11.2% =24.324
2、下列说法不正确的是( )
①质子数相同的粒子一定是同一元素
②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子
③电子数相同的粒子不一定是同种元素
④一种元素不可以形成不同单质
⑤某元素的相对原子质量取整数值就是质量数
A.②④⑤ B.①④⑤ C.②③④ D.①②③④⑤
B
核素与元素的关系
核素的定义
核素的应用价值
3、认识核素与同位素
4、下列说法不正确的是( )
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③同位素的化学性质几乎相同
④质子数相同、电子数也相同的两种微粒,不可能是一种分子和离子
⑤Cl2中35Cl与37Cl两种核素的个数之比与HCl中35Cl与37Cl的个数之比相等
A.③ B.④ C.②⑤ D.①
D
D
3、某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
核素与元素的关系
核素的定义
核素的应用价值
3、认识核素与同位素
核素的应用价值
核素的定义
核素与元素的关系
元素周期表
新人教版·必修一·第四章
第一节·原子结构与元素周期表·第二课时
问题1:元素之间有什么内在联系?
1、元素周期表的发展
导入:18世纪,人们已发现了不少元素。但科学家们发现,有些元素的性质极为相似,有些则完全不同,某些元素在一些性质方面很相似,但在另一些方面却又差别很大。
?
早期探索
1、元素周期表的发展
分类整理
问题2:该方法是否存在局限性?
存在,难以研究不同类别元素间的联系
将元素分为四类
18世纪
早期探索
1、元素周期表的发展
18世纪
19世纪初
测定了原子的相对质量
元素有了可排序的物理量
原子量
原子量
元素性质
三素组
六元素
八音律
初步触及到元素性质的规律性
周期表确立
1、元素周期表的发展
18世纪
19世纪初
1869年
局限性:
①大多是对已有元素的研究,
关注原子量的排序。
②很多原子量的数据并不准确。
相比于原子量
更相信元素的理化性质
问题3:门捷列夫取得了哪些突破呢?
?
周期表确立
1、元素周期表的发展
18世纪
19世纪初
1869年
当时公认Au、Pt、Ir、Os的原子量
分别为:169.2、196.7、196.7、198.6。
——门捷列夫将元素按照原子量从小到大排序
化学性质相似的元素放在一个纵列
根据理化性质,Au应排在后面
发现Au、Pt、Ir、Os的原子量分别为:
197.2、195.2、193.1、190.9
重测这四种元素的原子量
周期表发展
1、元素周期表的发展
18世纪
19世纪初
1869年
突破:
①修改了一些元素的原子量。
②预测了一些尚未发现元素的存在。
门捷列夫预测该元素的原子量为68,密度为6g/cm3,熔点很低
科学家分离出了镓(Ga)其原子量
为69.7,密度为5.9g/cm3,熔点很低
6年后
问题3:门捷列夫取得了哪些突破呢?
周期表确立
1、元素周期表的发展
18世纪
19世纪初
1869年
19世纪末20世纪初
钴的原子量比镍大,但按照化学性质,钴应该排在镍的前面,类似的还有碘和碲
原子量
元素性质
冲突
ArNi=58.69 ArCo=58.93
周期表的小bug
?
周期表确立
1、元素周期表的发展
18世纪
19世纪初
1869年
19世纪末20世纪初
钴的原子量比镍大,但按照化学性质,钴应该排在镍的前面,类似的还有碘和碲
原子量
元素性质
冲突
ArNi=58.69 ArCo=58.93
周期表的小bug
?
周期表发展
1、元素周期表的发展
18世纪
19世纪初
1869年
19世纪末20世纪初
理论证明:
通过实验测定的元素特征谱线频率来确定元素在周期表上的位置
只有Co-Ni、Ar-K、Te-I相邻元素处原子序数发生了改变
核外电子
核电荷数
原子序数
=
元素周期表中的排序依据由相对原子质量→原子的核电荷数
质子数
核外电子数
=
=
周期表发展
1、元素周期表的发展
18世纪
19世纪初
1869年
19世纪末20世纪初
问题3:了解了科学家们对元素周期表探索的历程,
你有什么感悟吗?
2、认识元素周期表
周期:把电子层数目相同的元素,……排成横行,每一个横行叫做一个周期
2、认识元素周期表
元素周期表共有 个横行,故元素周期表共有 个周期。
周期序数 起止元素 元素种数 核外电子层数
1 1H—2He
2 3Li—10Ne
3 11Na—18Ar
4 19K—36Kr
5 37Rb—54Xe
6 55Cs—86Rn
7 87Fr—118Og
1
2
3
4
5
6
7
2
8
8
18
18
32
32
周期序数 = 核外电子层数
7
7
短周期
长周期
提出模型
修正模型
建构新模
2、认识元素周期表
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
IA
IIA
IIIB IVB VB VIB VIIB
VIII
IB IIB
IIIA IVA VA VIA VIIA
0
7个主族(A),7个副族(B),1个第Ⅷ族,1个0族
碱
金
属
元
素
过渡元素
卤
族
元
素
稀
有
气
体
元
素
把最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵列,每一个纵列叫做一个族(8、9、10三个纵列共同组成第Ⅷ族)。
由长周期和短周期
元素共同构成族
只有长周期元素构成族
2、认识元素周期表
小结:元素周期表的基本规律
原子序数=核电荷数=质子数=核外电子数
周期数=电子层数
主族序数=最外层电子数
问题:已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?
例:Cl的位置的描述:
第七主族
VII族
VIIA族
第III周期
第三周期
第3周期
2、认识元素周期表
思考1:如何确定元素在周期表中的位置?
1.根据原子结构示意图判断元素在周期表中的位置
2.“0族”法确定元素在周期表中的位置
周期序数 一 二 三 四 五 六 七
稀有气体原子序数 2 10 18 36 54 86 118
(1)原子的电子层数=周期序数
(2)最外层电子数=族序数
熟记0族元素的相应周期数和原子序数
思考2:氦(He)元素原子最外层有两个电子,为什么不把它排在ⅡA族?
最外层填充两个电子已达饱和,性质与ⅡA族的元素完全不同,但与0族元素性质相似,所以不排在第ⅡA族,而排在0族。
2、认识元素周期表
练习1:请描述出Na、C、Al、S在周期表中的位置。
Na:第三周期第ⅠA族; C: 第二周期第ⅣA族;
Al:第三周期第ⅢA族 S:第三周期第ⅥA族
练习2:元素周期表中铊元素的数据如图,下列说法正确的是( )
D
A.铊元素的质量数是204.4
B.铊原子的中子数为81
C.铊对应的氢氧化物有两性
D.铊元素位于第ⅢA族
1S1
1
H
氢
1.008
原子序数
元素符号
元素名称
相对原子质量
通过能级表示核外电子排布
核素的定义
核素与元素的关系
核素的应用价值
3、认识核素与同位素
问题1:H的质量数为什么有3个呢?
回顾:元素是具有相同核电荷数(核内质子数)的同一类原子的总称。即同种元素原子的原子核中质子数是相同的。
太阳内部核聚变:
“原子”是化学变化中最小微粒
在化学学科研究领域之外,存在比原子更小的粒子
问题2:该变化属于化学反应吗?
×
核素的定义
核素与元素的关系
核素的应用价值
3、认识核素与同位素
回顾原子的结构
原子
原子核
核外电子
质子
中子
(正电)
不显
电性
(负电)
(正电)
(不带电)
核电荷数=质子数=核外电子数=原子序数
质量数(A)=质子数(Z)+中子数(N)
问题3:一种元素是否一定只有一种原子呢?
质子数 中子数 原子名称 原子符号
1 0 氕
1 1 氘 或D
1 2 氚 或T
同种元素的原子只是质子数相同,中子数不一定相同。
核素
氢元素的不同核素
核素的定义
核素与元素的关系
核素的应用价值
3、认识核素与同位素
核素:
同位素:
质子数相同而中子数不同的同一种元素的不同原子互称为同位素。
几乎完全相同
特点:
①同位素的化学性质 ____ , 某些物理性质略有不同。
②天然存在的同位素,相互之间保持一定的比率。
具有一定数目的质子和一定数目的中子的一种原子。
如 就各为一种核素
如 互为同位素
核素的质子相同,在元素周期表中占有相同的位置
核素的定义
核素与元素的关系
核素的应用价值
3、认识核素与同位素
许多元素都有同位素
同位素的用途
1、给金属探伤、诊断和治疗疾病
2、元素半衰期用于考古年代换算
3、氘、氚用于制造氢弹
医疗上
农业上
能源上
考古上
4、同位素示踪技术用于生物基因工程、射线育种
有利有弊,合理利用
核素与元素的关系
核素的定义
核素的应用价值
3、认识核素与同位素
问题4:元素、核素、同位素以及同素异形体间有什么区别与联系?
元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只有种类 , 没有个数 化学反应中 的最小微粒 化学性质几乎完全相同 , 因质量数不同,物理性质不同 组成元素相同 ,
性质不同
联系:
3、认识核素与同位素
思考:为什么H的相对原子质量1.008,这个数值是怎么来的?
元素的相对原子质量≠原子的相对原子质量
班上某个同学的身高 核素的相对原子质量
班上同学的平均身高 元素的平均相对原子质量
班上某个同学的近似身高 核素的近似相对原子质量(质量数)
班上同学的平均近似身高 元素的平均近似相对原子质量
元素的相对原子质量是其各种核素的相对原子质量分别与各种核素在自然界里的丰度的乘积之和。
例如——氢元素的三种核素: 氕,Ar=1.0079,丰度为99.985%, 氘,Ar=2.014,丰度为0.015%,氚,痕量(计算时忽略)。
因此,氢元素的相对原子质量为1.0079*99.985%+ 2.014*0.015% ≈1.008。
(某种核素在这种元素的所有天然核素中所占的比例)
核素与元素的关系
核素的定义
核素的应用价值
3、认识核素与同位素
练习:1、镁有三种天然同位素:24Mg、25Mg、26Mg,其中24Mg原子占镁元素的原子百分数为78.70%,25Mg原子为10.1%,26Mg原子为11.2%,求镁元素的相对原子质量。
解:镁元素的相对原子质量为
24×78.70% + 25×10.1% + 26×11.2% =24.324
2、下列说法不正确的是( )
①质子数相同的粒子一定是同一元素
②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子
③电子数相同的粒子不一定是同种元素
④一种元素不可以形成不同单质
⑤某元素的相对原子质量取整数值就是质量数
A.②④⑤ B.①④⑤ C.②③④ D.①②③④⑤
B
核素与元素的关系
核素的定义
核素的应用价值
3、认识核素与同位素
4、下列说法不正确的是( )
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③同位素的化学性质几乎相同
④质子数相同、电子数也相同的两种微粒,不可能是一种分子和离子
⑤Cl2中35Cl与37Cl两种核素的个数之比与HCl中35Cl与37Cl的个数之比相等
A.③ B.④ C.②⑤ D.①
D
D
3、某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
核素与元素的关系
核素的定义
核素的应用价值
3、认识核素与同位素
核素的应用价值
核素的定义
核素与元素的关系
