4.1原子结构与元素周期表(第一课时) (共20页课件) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1原子结构与元素周期表(第一课时) (共20页课件) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-14 19:56:04 | ||
图片预览



文档简介
(共20张PPT)
原子结构
新人教版·必修一·第四章
第一节·原子结构与元素周期表·第一课时
提出模型
修正模型
建构新模
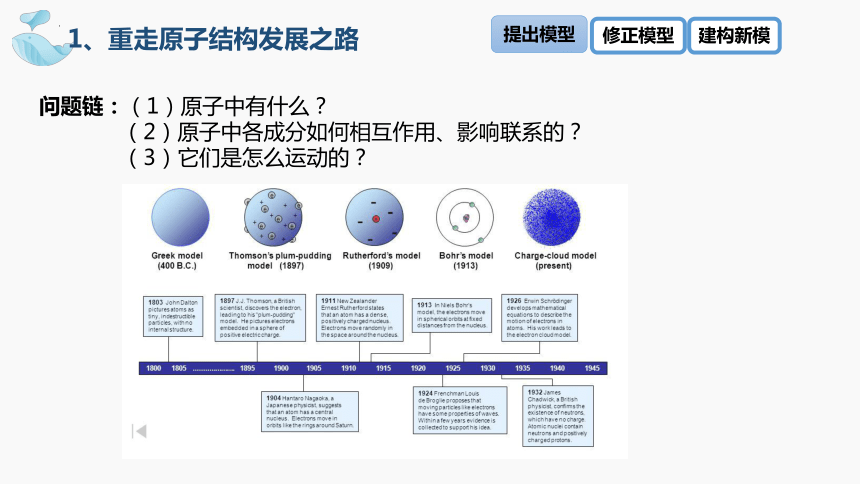
问题1:提起原子结构模型,你首先想到的哪一种?
1、重走原子结构发展之路
Plum Pudding Model
活动1:回顾初中所学知识,描述原子的结构
提出模型
修正模型
建构新模
问题链:(1)原子中有什么?
(2)原子中各成分如何相互作用、影响联系的?
(3)它们是怎么运动的?
1、重走原子结构发展之路
提出模型
修正模型
建构新模
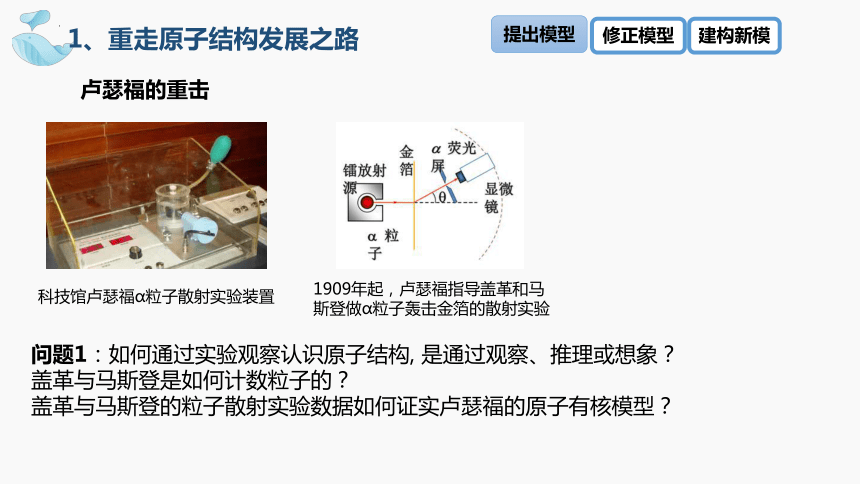
问题1:如何通过实验观察认识原子结构, 是通过观察、推理或想象?
盖革与马斯登是如何计数粒子的?
盖革与马斯登的粒子散射实验数据如何证实卢瑟福的原子有核模型?
1、重走原子结构发展之路
卢瑟福的重击
科技馆卢瑟福α粒子散射实验装置
1909年起,卢瑟福指导盖革和马斯登做α粒子轰击金箔的散射实验
修正模型
提出模型
建构新模
1、重走原子结构发展之路
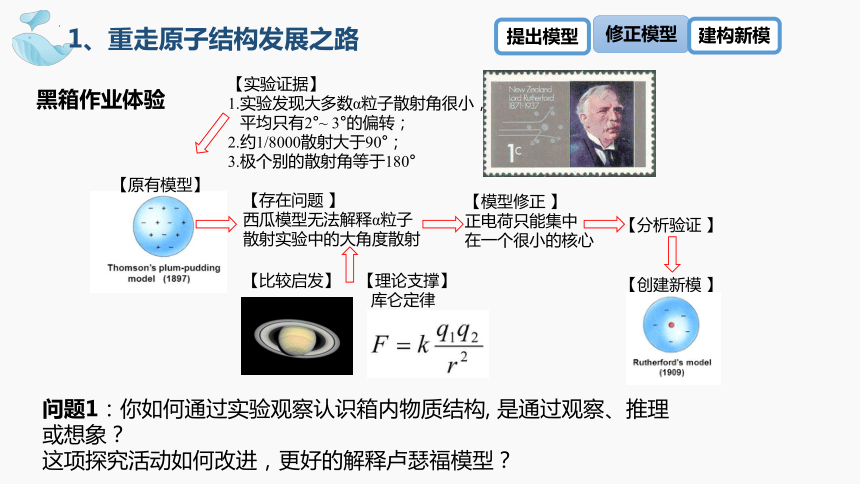
【实验证据】
1.实验发现大多数α粒子散射角很小,
平均只有2°~ 3°的偏转;
2.约1/8000散射大于90°;
3.极个别的散射角等于180°
【理论支撑】
库仑定律
【原有模型】
【存在问题 】
西瓜模型无法解释α粒子
散射实验中的大角度散射
【比较启发】
【模型修正 】
正电荷只能集中
在一个很小的核心
【分析验证 】
【创建新模 】
问题1:你如何通过实验观察认识箱内物质结构, 是通过观察、推理或想象?
这项探究活动如何改进,更好的解释卢瑟福模型?
黑箱作业体验
修正模型
提出模型
建构模型
1、重走原子结构发展之路
问题1:对于卢瑟福原子结构模型与“行星-太阳”体系类比,可比的特征有哪些?(如太阳——原子核)
从关系、属性等角度绘制类比图像
一砂一世界
库伦定律与 万有引力定律类比
修正模型
提出模型
建构新模
1、重走原子结构发展之路
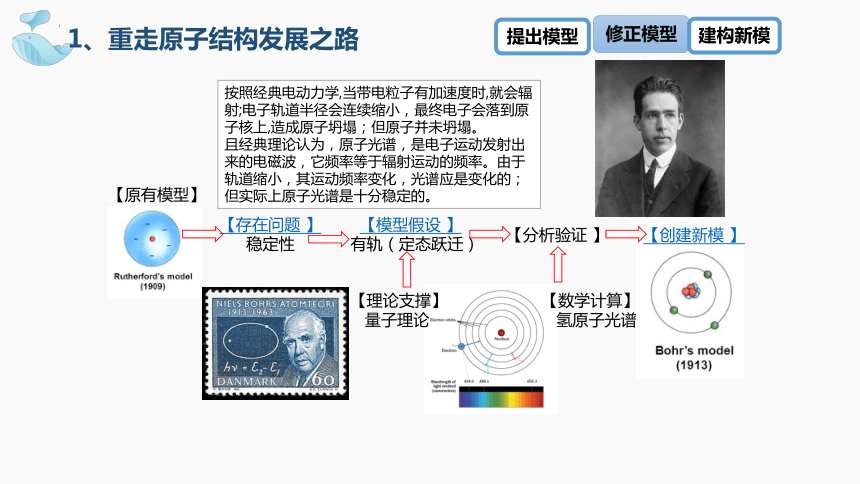
【理论支撑】
量子理论
【原有模型】
【存在问题 】
稳定性
【模型假设 】
有轨(定态跃迁)
【分析验证 】
【创建新模 】
按照经典电动力学,当带电粒子有加速度时,就会辐射;电子轨道半径会连续缩小,最终电子会落到原子核上,造成原子坍塌;但原子并未坍塌。
且经典理论认为,原子光谱,是电子运动发射出来的电磁波,它频率等于辐射运动的频率。由于轨道缩小,其运动频率变化,光谱应是变化的;但实际上原子光谱是十分稳定的。
【数学计算】
氢原子光谱
建构新模
提出模型
修正模型
1、重走原子结构发展之路
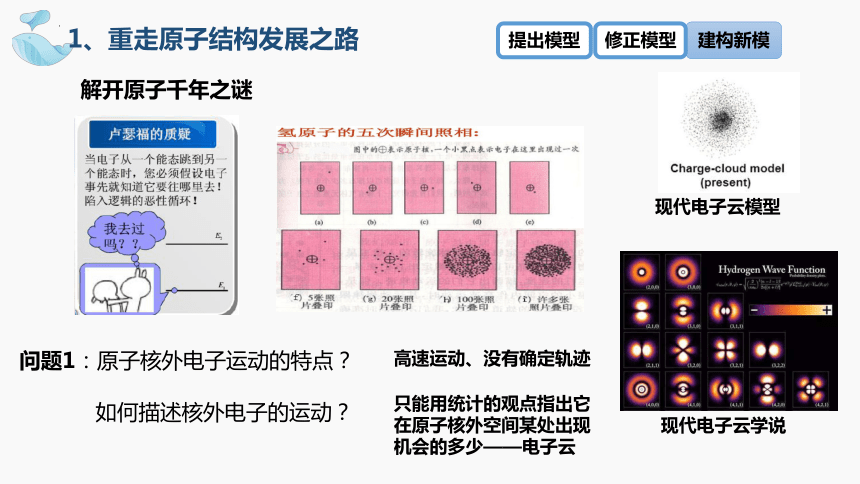
问题1:原子核外电子运动的特点?
如何描述核外电子的运动?
解开原子千年之谜
现代电子云模型
现代电子云学说
高速运动、没有确定轨迹
只能用统计的观点指出它在原子核外空间某处出现机会的多少——电子云
建构新模
提出模型
修正模型
1、重走原子结构发展之路
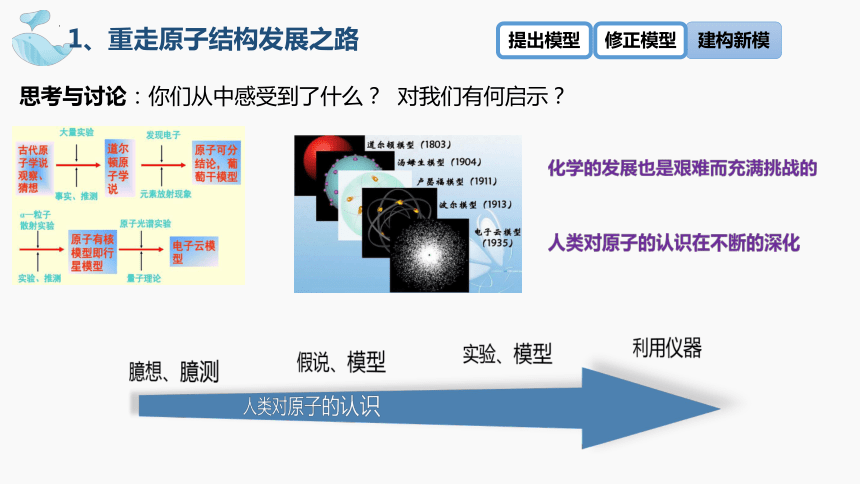
思考与讨论:你们从中感受到了什么? 对我们有何启示?
人类对原子的认识在不断的深化
人类对原子的认识
臆想、臆测
假说、模型
实验、模型
利用仪器
化学的发展也是艰难而充满挑战的
提出模型
修正模型
建构新模
问题:构成原子的粒子有哪些?它们是怎样构成原子的?
2、回顾原子的构成
原子
原子核
核外电子
质子
中子
(正电)
不显
电性
(负电)
(正电)
(不带电)
分层排布
与物质化学性质
密切相关
核电荷数=质子数=核外电子数=原子序数
活动:将几种原子的质子数和中子数之和(质量数)填入上表
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
19
23
27
几种原子的质子数、中子数、质量数和相对原子质量
问题:质量数与原子的相对原子质量作比较,你能得出什么结论
提出模型
修正模型
建构新模
2、回顾原子的构成
质量数
原子的质量主要集中在 ,质子和中子的相对质量都近似为1,若忽略电子质量,将核内所有质子和中子的相对质量取近似整数值相加,所得数值即为 _ ,用符号___表示。
两个等式关系
①原子序数=核电荷数=质子数=核外电子数
(原子中的数量关系)
②质量数(A)= + (质量关系)
原子核
质量数
A
质子数(Z)
中子数(N)
质量数(A)
质子数(Z)
±a
化合价
x±
电荷数
b
原子数
+1
1+
2
提出模型
修正模型
建构新模
2、回顾原子的构成
练习2
1、一种原子的核内有6个质子和6个中子,另一种原子的核内有6个质子和7个中子,则它们不同的是( )
A、核电荷数 B、核外电子数 C、原子的质量 D、元素的种类
3、美国科学家将两种元素铅和氪的原子相撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A、57 B、47 C、61 D、293
A
C
B
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
(1)概念:在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。
电子层
多电子的电子云图片
由图片可以发现:在含有多个电子的原子里,电子分别在能量不同的区域内运动。
(2)不同电子层的表示及能量关系
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
问题:由于原子中的电子是处在原子核的引力场中(类似于地球上的万物处于地心引力场中),电子一般总是先从内层排起,当一层充满后再填充下一层。下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
活动:试写出原子序数为118的元素原子核外电子排布规律
核外电子总是尽可能先排布在 的电子层上,然后 依次排布在 的电子层上。
①各电子层最多容纳2n2个电子。
②最外层电子数目最多不能超过8个(K层为最外层时不能超过2个)。
④倒数第三层不超过32个电子。
③次外层最多能容纳的电子数不超过18个。
⑤未容纳满的内层电子数符合2n2的数字特征。
能量最低
由内向外
能量较高
即按K→L→M→N……顺序排列
(3)原子核外电子分层排布规律
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
①原子结构示意图
以钠原子结构示意图为例
硒原子的结构示意图
铁原子的结构示意图
Fe
铁
55.85
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
②离子结构示意图
离子与原子结构示意图各符号含义一样,但注意原子结构示意图中质子数=核外电子数,而离子结构示意图中质子数≠核外电子数。如:Cl- ;Na+ 。
练习1 今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是( )
A.硅原子和钠原子 B.硼原子和氢原子
C.氯原子和碳原子 D.碳原子和铝原子
电子层 K L M
A原子 2 x y
B原子 2 2x y+3
D
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
问题:核电荷数为1-20的原子结构示意图如下,你从中获取哪些信息?
非金属原子
稀有气体原子
金属原子
元素的化学性质与其原子的最外层电子数有关。
(原子最外层电子数相同,其化学性质相似,氢和氦除外)
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
“10电子微粒”和“18电子微粒”
(1)10电子微粒
(2)18电子微粒
概念应用
概念建构
概念引入
练习
1.某元素的原子核外有三个电子层,M层的电子数是L层电子数的 1/2,则该元素的原子是( )
A.Li B.Si C.Al D.K
4.已知A、B、C三种元素的原子中,质子数为A(1)三种元素的名称和符号:A , B , C
(2)画出三种元素的原子结构示意图:A , B , C
3、探究原子的电子层排布规律
碳C
硅Si
氯Cl
B
原子结构
新人教版·必修一·第四章
第一节·原子结构与元素周期表·第一课时
提出模型
修正模型
建构新模
问题1:提起原子结构模型,你首先想到的哪一种?
1、重走原子结构发展之路
Plum Pudding Model
活动1:回顾初中所学知识,描述原子的结构
提出模型
修正模型
建构新模
问题链:(1)原子中有什么?
(2)原子中各成分如何相互作用、影响联系的?
(3)它们是怎么运动的?
1、重走原子结构发展之路
提出模型
修正模型
建构新模
问题1:如何通过实验观察认识原子结构, 是通过观察、推理或想象?
盖革与马斯登是如何计数粒子的?
盖革与马斯登的粒子散射实验数据如何证实卢瑟福的原子有核模型?
1、重走原子结构发展之路
卢瑟福的重击
科技馆卢瑟福α粒子散射实验装置
1909年起,卢瑟福指导盖革和马斯登做α粒子轰击金箔的散射实验
修正模型
提出模型
建构新模
1、重走原子结构发展之路
【实验证据】
1.实验发现大多数α粒子散射角很小,
平均只有2°~ 3°的偏转;
2.约1/8000散射大于90°;
3.极个别的散射角等于180°
【理论支撑】
库仑定律
【原有模型】
【存在问题 】
西瓜模型无法解释α粒子
散射实验中的大角度散射
【比较启发】
【模型修正 】
正电荷只能集中
在一个很小的核心
【分析验证 】
【创建新模 】
问题1:你如何通过实验观察认识箱内物质结构, 是通过观察、推理或想象?
这项探究活动如何改进,更好的解释卢瑟福模型?
黑箱作业体验
修正模型
提出模型
建构模型
1、重走原子结构发展之路
问题1:对于卢瑟福原子结构模型与“行星-太阳”体系类比,可比的特征有哪些?(如太阳——原子核)
从关系、属性等角度绘制类比图像
一砂一世界
库伦定律与 万有引力定律类比
修正模型
提出模型
建构新模
1、重走原子结构发展之路
【理论支撑】
量子理论
【原有模型】
【存在问题 】
稳定性
【模型假设 】
有轨(定态跃迁)
【分析验证 】
【创建新模 】
按照经典电动力学,当带电粒子有加速度时,就会辐射;电子轨道半径会连续缩小,最终电子会落到原子核上,造成原子坍塌;但原子并未坍塌。
且经典理论认为,原子光谱,是电子运动发射出来的电磁波,它频率等于辐射运动的频率。由于轨道缩小,其运动频率变化,光谱应是变化的;但实际上原子光谱是十分稳定的。
【数学计算】
氢原子光谱
建构新模
提出模型
修正模型
1、重走原子结构发展之路
问题1:原子核外电子运动的特点?
如何描述核外电子的运动?
解开原子千年之谜
现代电子云模型
现代电子云学说
高速运动、没有确定轨迹
只能用统计的观点指出它在原子核外空间某处出现机会的多少——电子云
建构新模
提出模型
修正模型
1、重走原子结构发展之路
思考与讨论:你们从中感受到了什么? 对我们有何启示?
人类对原子的认识在不断的深化
人类对原子的认识
臆想、臆测
假说、模型
实验、模型
利用仪器
化学的发展也是艰难而充满挑战的
提出模型
修正模型
建构新模
问题:构成原子的粒子有哪些?它们是怎样构成原子的?
2、回顾原子的构成
原子
原子核
核外电子
质子
中子
(正电)
不显
电性
(负电)
(正电)
(不带电)
分层排布
与物质化学性质
密切相关
核电荷数=质子数=核外电子数=原子序数
活动:将几种原子的质子数和中子数之和(质量数)填入上表
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
19
23
27
几种原子的质子数、中子数、质量数和相对原子质量
问题:质量数与原子的相对原子质量作比较,你能得出什么结论
提出模型
修正模型
建构新模
2、回顾原子的构成
质量数
原子的质量主要集中在 ,质子和中子的相对质量都近似为1,若忽略电子质量,将核内所有质子和中子的相对质量取近似整数值相加,所得数值即为 _ ,用符号___表示。
两个等式关系
①原子序数=核电荷数=质子数=核外电子数
(原子中的数量关系)
②质量数(A)= + (质量关系)
原子核
质量数
A
质子数(Z)
中子数(N)
质量数(A)
质子数(Z)
±a
化合价
x±
电荷数
b
原子数
+1
1+
2
提出模型
修正模型
建构新模
2、回顾原子的构成
练习2
1、一种原子的核内有6个质子和6个中子,另一种原子的核内有6个质子和7个中子,则它们不同的是( )
A、核电荷数 B、核外电子数 C、原子的质量 D、元素的种类
3、美国科学家将两种元素铅和氪的原子相撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A、57 B、47 C、61 D、293
A
C
B
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
(1)概念:在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。
电子层
多电子的电子云图片
由图片可以发现:在含有多个电子的原子里,电子分别在能量不同的区域内运动。
(2)不同电子层的表示及能量关系
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
问题:由于原子中的电子是处在原子核的引力场中(类似于地球上的万物处于地心引力场中),电子一般总是先从内层排起,当一层充满后再填充下一层。下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
活动:试写出原子序数为118的元素原子核外电子排布规律
核外电子总是尽可能先排布在 的电子层上,然后 依次排布在 的电子层上。
①各电子层最多容纳2n2个电子。
②最外层电子数目最多不能超过8个(K层为最外层时不能超过2个)。
④倒数第三层不超过32个电子。
③次外层最多能容纳的电子数不超过18个。
⑤未容纳满的内层电子数符合2n2的数字特征。
能量最低
由内向外
能量较高
即按K→L→M→N……顺序排列
(3)原子核外电子分层排布规律
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
①原子结构示意图
以钠原子结构示意图为例
硒原子的结构示意图
铁原子的结构示意图
Fe
铁
55.85
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
②离子结构示意图
离子与原子结构示意图各符号含义一样,但注意原子结构示意图中质子数=核外电子数,而离子结构示意图中质子数≠核外电子数。如:Cl- ;Na+ 。
练习1 今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是( )
A.硅原子和钠原子 B.硼原子和氢原子
C.氯原子和碳原子 D.碳原子和铝原子
电子层 K L M
A原子 2 x y
B原子 2 2x y+3
D
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
问题:核电荷数为1-20的原子结构示意图如下,你从中获取哪些信息?
非金属原子
稀有气体原子
金属原子
元素的化学性质与其原子的最外层电子数有关。
(原子最外层电子数相同,其化学性质相似,氢和氦除外)
提出模型
修正模型
建构新模
3、探究原子的电子层排布规律
“10电子微粒”和“18电子微粒”
(1)10电子微粒
(2)18电子微粒
概念应用
概念建构
概念引入
练习
1.某元素的原子核外有三个电子层,M层的电子数是L层电子数的 1/2,则该元素的原子是( )
A.Li B.Si C.Al D.K
4.已知A、B、C三种元素的原子中,质子数为A
(2)画出三种元素的原子结构示意图:A , B , C
3、探究原子的电子层排布规律
碳C
硅Si
氯Cl
B
