第三单元 《物质构成的奥秘》测试题(答案详解)
文档属性
| 名称 | 第三单元 《物质构成的奥秘》测试题(答案详解) |  | |
| 格式 | docx | ||
| 文件大小 | 335.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-17 15:45:13 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第三单元 《物质构成的奥秘》 测试题
一、单选题
1.下列关于原子的叙述中,正确的是( )
A. 原子的质量主要集中在原子核上
B. 原子呈电中性是因为原子中质子数与中子数相等
C. 原子一定是由质子、中子、电子三种微粒构成
D. 相同的原子无法构成不同的分子
2.锌和铁是人体必需的微量元素,锌元素和铁元素的根本区别是( )
A. 质子数不同 B. 相对原子质量不同
C. 电子数不同 D. 最外层电子数不同
3.下列宏观事实的微观解释错误的是( )
A. 氧气和二氧化碳有不同的化学性质——分子构成不同
B. 物质的热胀冷缩现象——分子受热变大,遇冷变小
C. 湿衣服晒在阳光下容易干——温度越高,分子运动速率越快
D. 氢气燃烧生成水——分子种类改变
4.2019年是元素周期表诞生的第150周年,下列关于元素周期表的叙述正确的是( )
A. 元素周期表最早是由张青莲发现的
B. 目前通用的元素周期表中的元素是按照相对原子质量由小到大进行排序的
C. 元素周期表中每一周期都是以非金属元素结束的
D. 目前通用的元素周期表一共有七个周期、16个族
5.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
A. H B. Hg C. N2 D. KCl
6.某种核能原料的原子核中含有1个质子和2个中子,下列说法正确的是()
A. 该原子属于氢元素
B. 该原子属于金属元素
C. 该原子核外有3个电子
D. 该原子核带2个单位的正电荷
7.核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电.锶元素在元素周期表中显示的信息和粒子结构示意图如图所示.以下表述中正确的是( )
A. 图2、图3都属于锶元素
B. 图3所表示粒子的化学符号是Sr
C. 锶原子的中子数为38
D. 锶原子的相对原子质量是87.62g
8.下列对分子、原子、离子、元素的认识,正确的是( )
A. 氮气、氧气的化学性质不同,是因为构成它们的分子不同
B. 不同元素的本质区别是电子数不同
C. 钠离子核外电子层数等于钠元素所在周期序数
D. 元素周期表中可以获得元素符号、元素原子序数、元素在自然界分布的信息
9.以下说法正确的是 ( )
A. 氯离子比氯原子多一个电子,所以氯离子比氯原子的质量大得多
B. 构成物质的粒子有分子、原子、离子,所以分子不是保持物质化学性质的唯一粒子
C. 原子中质子数等于核外电子数,所以质子数等于核外电子数的粒子一定是原子
D. 离子是带电荷的微粒,所以带电荷的微粒一定是离子
10.如图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子。下列说法正确的是( )
A. 反应后生成了四种物质
B. 分子在化学变化中是不可分的
C. 参加反应的两种分子的个数比为1∶1
D. 催化剂参与了化学反应,化学性质和质量都发生了变化
11.下列关于物质组成与构成的说法,错误的是( )
A. 原子中核外电子,特别是最外层电子,是决定原子构成物质的关键因素
B. 原子在分子中的配置(原子的种类、数量和排列方式)决定了分子的种类
C. 化学元素只有一百多种,却组成了所有的化学物质
D. 原子得失电子变成离子后,元素的种类发生了改变
12.反电子、反质子跟普通电子、质子的质量、电量均相等,电性相反。反氢原子是由反质子和反电子构成。1997年年初和年底,欧洲和美洲的研究机构分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。请推测反氢原子的结构可能是( )
A. 由一个带正电荷的质子与一个带负电荷的电子构成
B. 由一个带负电荷的质子与一个带正电荷的电子构成
C. 由一个不带电荷的中子与一个带负电荷的电子构成
D. 由一个带负电荷的质子与一个带负电荷的电子构成
二、填空题
13.从①质子数 ②中子数 ③最外层电子数 ④原子核等选项中选择填空.(填序号)
(1)原子的核电荷数决定于原子结构中的________;
(2)原子序数主要决定于原子结构中的________;
(3)原子的相对原子质量决定于原子结构中的________;
(4)原子的质量主要集中在原子结构中的________;
(5)元素的种类决定于原子结构中的________;
(6)元素的化学性质主要决定于原子结构中的________;
(7)元素的分类主要决定于原子结构中的________.
14.有下列五种粒子的结构示意图。回答下列问题:
(1)以上示意图中,共有________种元素。
(2)E粒子中的电子数为________。
(3)上述五种粒子中,化学性质相似的原子是________。
(4)上述五种粒子中,属于阴离子的是________。
(5)写出A粒子的化学符号________。
15.科学研究证实,物质从宏观上讲是由元素组成,从微观上讲是粒子构成的,例如铁是由铁原子构成的。请你在下列空格里,用“元素、原子、分子、离子、质子、中子、电子等填空:
(1)水是由氧、氢两种________组成的;
(2)保持氢气化学性质的最小粒子是氢________;
(3)化学变化中的最小粒子是________;
(4)体温计中的汞是由汞________构成的;
(5)供给人呼吸的氧气是由氧________构成的;
(6)用于配制生理盐水的氯化钠晶体是由________构成的。
16.如图所示为元素周期表中部分元素的相关信息
请利用图示信息回答相关问题:
(1)氖原子的核电荷数为________。
(2)11号元素的原子在化学反应中比较容易________(填“得”或“失”)电子,该元素属于________(填“金属”或“非金属”)元素。
(3)元素周期表中第三周期一共有________种金属元素。
(4)16号元素的原子结构为 ,其中 为________,该元素的原子容易得到电子形成离子,写出该离子符号:________。
三、实验探究题
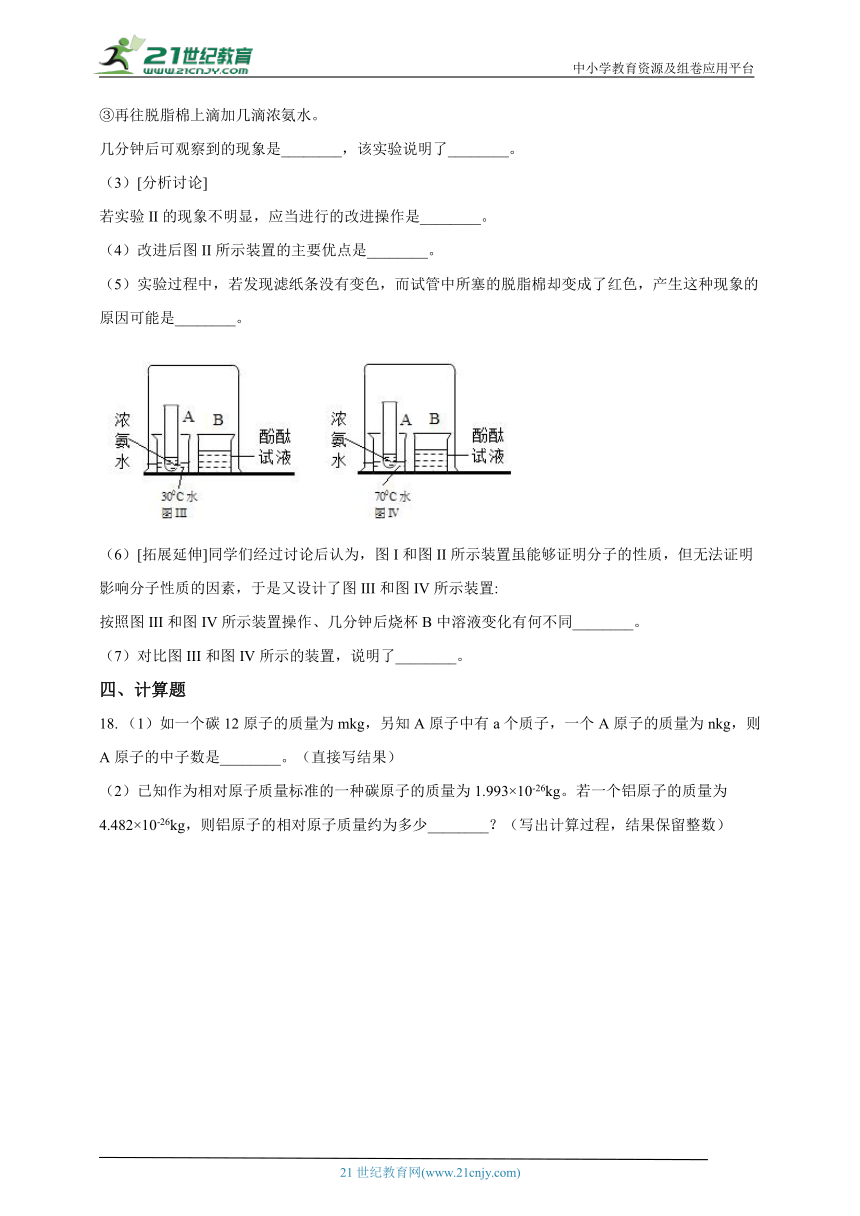
17.某同学设计了如下图所示的实验装置探究“分子的性质”,请据图回答下列问题:
(1)[进行实验]图I是课本中的某个探究实验,几分钟后烧杯甲中可观察到的现象是________,此实验说明了分子________。
(2)[实验改进]老师对图I所示的装置进行了改进(如图II所示),并进行了下列操作:
①取一长条形滤纸,等距离滴加无色酚酞试液;
②将滴加了无色酚酞的长条形滤纸放入一洁净的试管中,并在试管口塞一团脱脂棉;
③再往脱脂棉上滴加几滴浓氨水。
几分钟后可观察到的现象是________,该实验说明了________。
(3)[分析讨论]
若实验II的现象不明显,应当进行的改进操作是________。
(4)改进后图II所示装置的主要优点是________。
(5)实验过程中,若发现滤纸条没有变色,而试管中所塞的脱脂棉却变成了红色,产生这种现象的原因可能是________。
(6)[拓展延伸]同学们经过讨论后认为,图I和图II所示装置虽能够证明分子的性质,但无法证明影响分子性质的因素,于是又设计了图III和图IV所示装置:
按照图III和图IV所示装置操作、几分钟后烧杯B中溶液变化有何不同________。
(7)对比图III和图IV所示的装置,说明了________。
四、计算题
18. (1)如一个碳12原子的质量为mkg,另知A原子中有a个质子,一个A原子的质量为nkg,则A原子的中子数是________。(直接写结果)
(2)已知作为相对原子质量标准的一种碳原子的质量为1.993×10-26kg。若一个铝原子的质量为4.482×10-26kg,则铝原子的相对原子质量约为多少________?(写出计算过程,结果保留整数)
第三单元 《物质构成的奥秘》 测试题
答案解析
一、单选题
1.【答案】 A
【解析】A. 原子是由质子中子电子构成,质子和中子在原子核上,由于电子质量较小,所以原子的质量主要由质子和中子决定,故A符合题意;
B. 原子不显电性的原因是:质子所带的正电荷和核外电子所带的负电荷电量相等,电性相反,恰好完全中和。故B不符合题意;
C. 氢原子是由质子和电子构成,没有中子,故C不符合题意;
D. 氧气分子(O2)、臭氧分子(O3)都是由氧原子构成,故D不符合题意;
故答案为:A。
【分析】A、电子的质量很小,可以忽略不计。
B、在原子中,质子数=核外电子数。
C、有一种氢原子中,没有中子。
D、根据同素异形体,进行分析。
2.【答案】 A
【解析】元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同,所以锌元素和铁元素的本质区别是质子数(即核电荷数)不同。
故答案为:A。
【分析】根据不同种元素质子数不同分析。
3.【答案】 B
【解析】A. 氧气和二氧化碳具有不同的化学性质,是因为它们分子的构成不同,不同种的分子性质不同,故解释正确,不符合题意。
B. 物体具有热胀冷缩现象,是因为分子间的间隔(而不是大小)随温度的变化而改变,故解释错误,符合题意。
C. 湿衣服在阳光下比在阴凉处干得快,是因为温度升高,分子运动的速率加快,故解释正确,不符合题意。
D. 氢气燃烧生成水,是因为氢分子、氧分子分裂成了氢原子和氧原子,然后氢原子、氧原子重新组合形成水分子,故解释正确,不符合题意。
故答案为:B。
【分析】根据分子的定义和性质进行分析:分子的体积、质量很小;分子间有一定的间隔;分子在不停的运动;分子可以构成物质,分子在化学变化中还可以被分成更小的微粒,进行分析。
4.【答案】 D
【解析】A、元素周期表最早是由门捷列夫发现的,说法不符合题意。
B、目前通用的元素周期表中的元素是按照核电荷数由小到大进行排序的,说法不符合题意。
C、元素周期表中每一周期都是以稀有气体元素结束的,说法不符合题意。
D、目前通用的元素周期表一共有七个周期;纵向共有18个纵行,每一个纵行叫做一个族(8、9、10三个纵行共同组成一个族),即共有16个族,说法符合题意。
故答案为:D。
【分析】A、根据元素周期表最早是由门捷列夫发现分析;
B、根据元素周期表中原子序数与质子数相等分析;
C、根据元素周期表中每一周期都是以稀有气体元素结束分析;
D、根据元素周期表一共有七个周期、有16个族分析。
5.【答案】 B
【解析】A、H可表示氢元素,表示一个氢原子,但不能表示一种物质,故A不符合题意;
B、Hg属于金属元素,可表示汞元素,表示一个汞原子,还能表示汞这一纯净物,故B符合题意;
C、N2是氮气的化学式,不是元素符号,故C不符合题意;
D、KCl是氯化钾的化学式,不是元素符号,故D不符合题意。
故答案为:B。
【分析】根据元素符号的含义分析。
6.【答案】 A
【解析】A、元素的种类由质子数决定,该原子核中含有1个质子,故属于氢元素,A符合题意;
B、根据元素汉字名称的偏旁可辨别元素的种类,氢元素的名称有“气”字头,故属于非金属元素,B不符合题意;
C、在原子中,质子数=核外电子数,可知该原子核外有1个电子,C不符合题意;
D、在原子中,质子数=核电荷数,可知该原子核带1个单位的正电荷,D不符合题意。
故答案为:A
【分析】根据质子数决定元素种类,在原子中,质子数=核电荷数=核外电子数=原子序数,据此分析
7.【答案】 A
【解析】A、根据锶元素在元素周期表中显示的信息可知,其原子序数是38,又核内质子数=原子序数,因此锶元素的核内质子数等于38,图2、图3中的微粒的核内质子数都为38,根据元素的种类取决于核内质子数可以知道图2、图3都属于锶元素,故说法正确;
B、图3所表示粒子的核内质子数是38,核外电子数是36,核内质子数大于核外电子数,是锶离子,带2个单位的正电荷,其化学符号是Sr2+;故说法错误;
C、根据锶元素在元素周期表中显示的信息可知,其相对原子质量为87.62,又其核内质子数=原子序数=38,根据相对原子质量约等于质子数加中子数可知,锶原子的中子数不等于38,故说法错误;
D、根据锶元素在元素周期表中显示的信息可知,锶原子的相对原子质量是87.62,不是87.62g,故说法错误;
故选A.
【分析】A、根据元素的种类取决于核内质子数进行分析;
B、根据核内质子数与核外电子数的关系确定微粒的化学符号;
C、根据相对原子质量约等于质子数加中子数进行分析;
D、根据锶元素在元素周期表中显示的信息可以知道其相对原子质量.
8.【答案】 A
【解析】A、氮气是由氮分子构成,氧气是由氧分子构成,分子构成不同,因此化学性质不同,故A符合题意;
B、不同元素的本质区别是质子数不同,故B不符合题意;
C、钠原子的核外电子层数 等于钠元素所在周期序数 ,故C不符合题意;
D、 元素周期表中可以获得元素符号、元素原子序数 ,但是不能获得元素在自然界的分布信息,故D不符合题意;
故答案为:A
【分析】A、根据物质的结构决定物质的性质分析
B、根据元素的概念分析
C、根据原子核外电子层数和元素周期数的关系分析
D、根据元素周期表一格的信息分析
9.【答案】 B
【解析】A. 氯离子比氯原子多一个电子,所以氯离子比氯原子的质量相差不大,故说法错误,不符合题意;
B. 构成物质的粒子有分子、原子、离子,所以分子不是保持物质化学性质的唯一粒子,故说法正确,符合题意;
C. 原子中质子数等于核外电子数,所以质子数等于核外电子数的粒子不一定是原子,可能是分子,故说法错误,不符合题意;
D. 离子是带电荷的微粒,但是带电荷的微粒可能是离子,电子,质子,故说法错误,不符合题意;
故答案为:B。
【分析】A、1个电子的质量很小,可以忽略不计。
B、分子、原子、离子是构成物质的粒子。
C、原子、分子都不显电性,成电中性。
D、根据带电荷的微粒,进行分析。
10.【答案】 C
【解析】A. 从图中可知,反应后有一种分子是过量的反应物,反应后生成了两种物质,故不符合题意;
B. 从图中反映出的分子变化情况可知,反应物分子破裂,所含各原子重新组合生成新的分子,因此分子在化学变化中是可分的,故不符合题意;
C. 从图中分子的变化可见,参加反应的两种分子的个数比为1∶1,故符合题意;
D. 根据催化剂的概念,催化剂参与化学反应,但其化学性质和质量在反应前后都不发生变化,故不符合题意。
故答案为:C。
【分析】首先要对模型图进行观察,分析物质的微观构成、物质的类别,再找出物质之间的微粒数目关系,写出反应的方程式,然后再对题中各问加以分析解答。
11.【答案】 D
【解析】A、原子中核外电子,特别是最外层电子,决定原子化学性质,是决定原子构成物质的关键因素,说法不符合题意。
B、原子在分子中的配置(原子的种类、数量和排列方式)决定了分子的种类,说法不符合题意。
C、组成和结构不同,物质种类不同,化学元素只有一百多种,却组成了所有的化学物质,说法不符合题意。
D、元素的种类是由原子核内质子数决定。原子得失电子变成离子后,核内的质子数没有改变,元素的种类没有发生改变,符合题意。
故答案为:D。
【分析】A、根据决定元素化学性质的是最外层电子数分析
B、根据元素的概念分析
C、根据物质是由元素组成的分析
D、根据元素的概念分析
12.【答案】 B
【解析】反电子、反质子跟普通电子、质子的质量、电量均相等,电性相反。
所以反电子带1个单位的正电荷,反质子带1个单位的负电荷。
所以反氢原子是由1个带负电荷的质子与1个带正电荷的电子构成。
故答案为:B。
【分析】根据氢原子由1个带正电荷的质子和一个带负电荷的电子构成及题中所给反应粒子的信息分析。
二、填空题
13.【答案】 (1)①(2)①(3)①②(4)④(5)①(6)③(7)③
【解析】解:(1)核电荷数是指原子核所带的电荷数,而原子核由质子和中子构成,中子不带电,一个质子带一个单位的正电荷,所以质子数决定了原子的核电荷数;(2)原子序数与质子数相等,故决定原子序数的是质子数;(3)原子的相对原子质量近似的等于质子数和中子数之和;(4)电子的质量是质子质量的 ,所以电子的质量可以忽略不计,故原子的质量主要集中在原子核上;(5)元素是具有相同核电荷数(或质子数)的一类原子的总称,故原子的种类取决于原子的质子数;(6)元素的化学性质取决于原子的最外层电子数;(7)元素的分类主要取决于最外层电子数,金属元素最外层电子一般小于4个电子,而非金属元素最外层电子一般大于或等于4个电子;
故答案为:(1)①;(2)①;(3)①②;(4)④;(5)①;(6)③;(7)③.
【分析】根据原子的结构和性质及原子的构成粒子,并知道它们对原子及元素的性质的关系来解答.
14.【答案】 (1)4(2)31(3)C和E(4)D(5)
【解析】(1)以上示意图中,共有4种质子数,共有4种元素。(2)E粒子中的电子数为2+8+18+3=31。(3)上述五种粒子中,C和E是原子,它们的化学性质相似,因为它们最外层电子数均为3。(4)上述五种粒子中,属于阴离子的是D,因为D中质子数<核外电子数。(5)A粒子质子数为13,为铝元素,核外电子数为10,为铝离子,化学符号为 。
【分析】原子结构示意图中,圆圈表示原子核,圈外的弧线表示电子层,弧线上的数表示该层上的电子数,据此分析
15.【答案】 (1)元素(2)分子(3)原子(4)原子(5)分子(6)离子
【解析】解:(1)物质是由元素组成的,所以水是由氧、氢两种元素组成的;(2)分子是保持物质化学性质的最小微粒,所以保持氢气化学性质的最小粒子是氢分子;(3)化学变化中的最小微粒是原子;(4)金属单质是由原子直接构成的,所以体温计中的汞是由汞原子构成的;(5)供给人呼吸的氧气是由氧分子构成的;(6)氯化钠是由钠离子和氯离子构成的;
故答案为:(1)元素;(2)分子;(3)原子;(4)原子;(5)分子;(6)离子
【分析】(1)根据物质由元素组成分析;
(2)根据分子是保持物质化学性质的粒子分析;
(3)根据原子是化学变化中的最小粒子分析;
(4)根据金属由原子构成分析;
(5)根据氧气由氧分子构成分析;
(6)根据氯化钠由离子构成分析。
16.【答案】 (1)10(2)失;金属(3)3(4)8;S2-
【解析】(1)由图可知,氖为10号元素,原子的核电荷数为10;
(2)11号元素的原子最外层有一个电子,在化学反应中比较容易失去电子;11号元素为钠元素,该元素属于金属元素;
(3)由图可知,元素周期表中第三周期一共有钠元素、镁元素、铝元素3种金属元素;
(4)原子中质子数等于核外电子数;16号元素为硫元素,原子结构为 ,16=2+x+6,x=8;该元素的原子最外层有6个电子,容易得到两个电子形成带两个单位负电荷的阴离子S2-。
【分析】(1)根据在元素周期表一格中信息可知,左上角的数表示原子序数,右上角的字母表示元素符号,汉字下面是的数字表示原子的相对原子质量。
(2)原子的最外层电子数小于4,在化学反应中比较容易失去电子,达到稳定结构。
(3)元素周期数=原子的核外电子层数。
(4)在原子中,质子数=核外电子数。
三、实验探究题
17.【答案】 (1)烧杯甲中的酚酞溶液变红;在不停地运动
(2)长条形滤纸条上的酚酞点从右到左依次变红;分子在不停地运动
(3)在试管下面放一张白纸
(4)药品的用量较少(或节约药品)
(5)酚酞与氨水的位置滴反了
(6)图III所示装置中,烧杯B变红的速率较慢,图IV所示装置中,烧杯B变红的速率较快
(7)分子在不断的运动,且温度越高,分子运动越剧烈
【解析】
[进行实验]氨水溶液呈碱性,能使酚酞试液变红,几分钟后烧杯甲中可观察到的现象是烧杯甲中的酚酞溶液变红,此实验说明了分子在不停地运动;
[实验改进] 几分钟后可观察到的现象是长条形滤纸条上的酚酞点从右到左依次变红,该实验说明了分子在不停地运动;
[分析讨论](3)若实验II的现象不明显,应当进行的改进操作是为了便于观察到颜色及颜色变化,在在试管下面放一张白纸;
(4)改进后图II所示装置的主要优点是药品用量少,可以达到节约药品的目的,同时可以减少污染物的排放;
(5)实验过程中,若发现滤纸条没有变色,而试管中所塞的脱脂棉却变成了红色,产生这种现象的原因可能是氨水和酚酞试液位置放反了,或者氨水和酚酞试液都放在了棉花团上;
[拓展延伸](6)按照图III和图IV所示装置操作、几分钟后烧杯B中溶液变化:图III所示装置中,烧杯B变红的速率较慢,图IV所示装置中,烧杯B变红的速率较快;(7)对比图III和图IV所示的装置,说明了分子的远动速率受温度影响,且温度越高,分子运动速率越快。
【分析】【进行实验】浓氨水具有挥发性,能挥发出氨气,浓氨水显碱性,能使酚酞溶液变红,所以几分钟后可以看到的现象是甲中的溶液变红色,其中烧杯乙是对比实验的;
【实验改进】改进后的实验中,由于氨分子是不断运动的,氨水从棉花上开始运动,当运动到滤纸条上的酚酞试液上时,和水结合生成氨水,氨水显碱性,能使酚酞溶液变红,因此实验现象是几分钟后观察到的现象是滤纸上的酚酞由右向左依次变红。再次证明了分子是不断运动的;
【分析讨论】(3)在改进实验中,滤纸如果变色不明显是,需在试管下面放一张白纸,起一个衬托作用,使滤纸变色更加明显;
(4)改进后的实验,药品的使用量明显减少,节约了药品,由于氨水有刺激性气味,会污染空气,由于药品的使用量减少,减少了污染;
(5)实验中,要求将氨水滴在棉花上,酚酞滴在滤纸条上,然后将滤纸条放入到试管里,如果将药品滴反了,就会出现滤纸条没有变色,而试管中所塞的脱脂棉却变成了红色的错误实验现象;
【拓展延伸】由于分子是不断运动的,温度越高,运动的越快;图III和图IV中的变量是温度,温度高的实验中氨分子的运动速度快,B烧杯中酚酞变红的速率较快;
四、计算题
18.【答案】 (1)(2)27
【解析】(1)根据相对原子质量的定义,A原子的相对原子质量为 ÷ = ,原子中,相对分子质量=质子数+中子数,所以A原子的中子数是 a。
(2)解:根据相对原子质量的定义,铝原子的相对原子质量= ÷ ≈27答:铝原子的相对原子质量约为27。
【分析】根据原子的相对原子质量的定义进行解答。以一种碳原子的1/12作为标准,其他原子的质量与它相比较所得的比,作为这种原子的相对原子质量。原子的相对原子质量=质子数+中子数。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第三单元 《物质构成的奥秘》 测试题
一、单选题
1.下列关于原子的叙述中,正确的是( )
A. 原子的质量主要集中在原子核上
B. 原子呈电中性是因为原子中质子数与中子数相等
C. 原子一定是由质子、中子、电子三种微粒构成
D. 相同的原子无法构成不同的分子
2.锌和铁是人体必需的微量元素,锌元素和铁元素的根本区别是( )
A. 质子数不同 B. 相对原子质量不同
C. 电子数不同 D. 最外层电子数不同
3.下列宏观事实的微观解释错误的是( )
A. 氧气和二氧化碳有不同的化学性质——分子构成不同
B. 物质的热胀冷缩现象——分子受热变大,遇冷变小
C. 湿衣服晒在阳光下容易干——温度越高,分子运动速率越快
D. 氢气燃烧生成水——分子种类改变
4.2019年是元素周期表诞生的第150周年,下列关于元素周期表的叙述正确的是( )
A. 元素周期表最早是由张青莲发现的
B. 目前通用的元素周期表中的元素是按照相对原子质量由小到大进行排序的
C. 元素周期表中每一周期都是以非金属元素结束的
D. 目前通用的元素周期表一共有七个周期、16个族
5.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
A. H B. Hg C. N2 D. KCl
6.某种核能原料的原子核中含有1个质子和2个中子,下列说法正确的是()
A. 该原子属于氢元素
B. 该原子属于金属元素
C. 该原子核外有3个电子
D. 该原子核带2个单位的正电荷
7.核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电.锶元素在元素周期表中显示的信息和粒子结构示意图如图所示.以下表述中正确的是( )
A. 图2、图3都属于锶元素
B. 图3所表示粒子的化学符号是Sr
C. 锶原子的中子数为38
D. 锶原子的相对原子质量是87.62g
8.下列对分子、原子、离子、元素的认识,正确的是( )
A. 氮气、氧气的化学性质不同,是因为构成它们的分子不同
B. 不同元素的本质区别是电子数不同
C. 钠离子核外电子层数等于钠元素所在周期序数
D. 元素周期表中可以获得元素符号、元素原子序数、元素在自然界分布的信息
9.以下说法正确的是 ( )
A. 氯离子比氯原子多一个电子,所以氯离子比氯原子的质量大得多
B. 构成物质的粒子有分子、原子、离子,所以分子不是保持物质化学性质的唯一粒子
C. 原子中质子数等于核外电子数,所以质子数等于核外电子数的粒子一定是原子
D. 离子是带电荷的微粒,所以带电荷的微粒一定是离子
10.如图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子。下列说法正确的是( )
A. 反应后生成了四种物质
B. 分子在化学变化中是不可分的
C. 参加反应的两种分子的个数比为1∶1
D. 催化剂参与了化学反应,化学性质和质量都发生了变化
11.下列关于物质组成与构成的说法,错误的是( )
A. 原子中核外电子,特别是最外层电子,是决定原子构成物质的关键因素
B. 原子在分子中的配置(原子的种类、数量和排列方式)决定了分子的种类
C. 化学元素只有一百多种,却组成了所有的化学物质
D. 原子得失电子变成离子后,元素的种类发生了改变
12.反电子、反质子跟普通电子、质子的质量、电量均相等,电性相反。反氢原子是由反质子和反电子构成。1997年年初和年底,欧洲和美洲的研究机构分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。请推测反氢原子的结构可能是( )
A. 由一个带正电荷的质子与一个带负电荷的电子构成
B. 由一个带负电荷的质子与一个带正电荷的电子构成
C. 由一个不带电荷的中子与一个带负电荷的电子构成
D. 由一个带负电荷的质子与一个带负电荷的电子构成
二、填空题
13.从①质子数 ②中子数 ③最外层电子数 ④原子核等选项中选择填空.(填序号)
(1)原子的核电荷数决定于原子结构中的________;
(2)原子序数主要决定于原子结构中的________;
(3)原子的相对原子质量决定于原子结构中的________;
(4)原子的质量主要集中在原子结构中的________;
(5)元素的种类决定于原子结构中的________;
(6)元素的化学性质主要决定于原子结构中的________;
(7)元素的分类主要决定于原子结构中的________.
14.有下列五种粒子的结构示意图。回答下列问题:
(1)以上示意图中,共有________种元素。
(2)E粒子中的电子数为________。
(3)上述五种粒子中,化学性质相似的原子是________。
(4)上述五种粒子中,属于阴离子的是________。
(5)写出A粒子的化学符号________。
15.科学研究证实,物质从宏观上讲是由元素组成,从微观上讲是粒子构成的,例如铁是由铁原子构成的。请你在下列空格里,用“元素、原子、分子、离子、质子、中子、电子等填空:
(1)水是由氧、氢两种________组成的;
(2)保持氢气化学性质的最小粒子是氢________;
(3)化学变化中的最小粒子是________;
(4)体温计中的汞是由汞________构成的;
(5)供给人呼吸的氧气是由氧________构成的;
(6)用于配制生理盐水的氯化钠晶体是由________构成的。
16.如图所示为元素周期表中部分元素的相关信息
请利用图示信息回答相关问题:
(1)氖原子的核电荷数为________。
(2)11号元素的原子在化学反应中比较容易________(填“得”或“失”)电子,该元素属于________(填“金属”或“非金属”)元素。
(3)元素周期表中第三周期一共有________种金属元素。
(4)16号元素的原子结构为 ,其中 为________,该元素的原子容易得到电子形成离子,写出该离子符号:________。
三、实验探究题
17.某同学设计了如下图所示的实验装置探究“分子的性质”,请据图回答下列问题:
(1)[进行实验]图I是课本中的某个探究实验,几分钟后烧杯甲中可观察到的现象是________,此实验说明了分子________。
(2)[实验改进]老师对图I所示的装置进行了改进(如图II所示),并进行了下列操作:
①取一长条形滤纸,等距离滴加无色酚酞试液;
②将滴加了无色酚酞的长条形滤纸放入一洁净的试管中,并在试管口塞一团脱脂棉;
③再往脱脂棉上滴加几滴浓氨水。
几分钟后可观察到的现象是________,该实验说明了________。
(3)[分析讨论]
若实验II的现象不明显,应当进行的改进操作是________。
(4)改进后图II所示装置的主要优点是________。
(5)实验过程中,若发现滤纸条没有变色,而试管中所塞的脱脂棉却变成了红色,产生这种现象的原因可能是________。
(6)[拓展延伸]同学们经过讨论后认为,图I和图II所示装置虽能够证明分子的性质,但无法证明影响分子性质的因素,于是又设计了图III和图IV所示装置:
按照图III和图IV所示装置操作、几分钟后烧杯B中溶液变化有何不同________。
(7)对比图III和图IV所示的装置,说明了________。
四、计算题
18. (1)如一个碳12原子的质量为mkg,另知A原子中有a个质子,一个A原子的质量为nkg,则A原子的中子数是________。(直接写结果)
(2)已知作为相对原子质量标准的一种碳原子的质量为1.993×10-26kg。若一个铝原子的质量为4.482×10-26kg,则铝原子的相对原子质量约为多少________?(写出计算过程,结果保留整数)
第三单元 《物质构成的奥秘》 测试题
答案解析
一、单选题
1.【答案】 A
【解析】A. 原子是由质子中子电子构成,质子和中子在原子核上,由于电子质量较小,所以原子的质量主要由质子和中子决定,故A符合题意;
B. 原子不显电性的原因是:质子所带的正电荷和核外电子所带的负电荷电量相等,电性相反,恰好完全中和。故B不符合题意;
C. 氢原子是由质子和电子构成,没有中子,故C不符合题意;
D. 氧气分子(O2)、臭氧分子(O3)都是由氧原子构成,故D不符合题意;
故答案为:A。
【分析】A、电子的质量很小,可以忽略不计。
B、在原子中,质子数=核外电子数。
C、有一种氢原子中,没有中子。
D、根据同素异形体,进行分析。
2.【答案】 A
【解析】元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同,所以锌元素和铁元素的本质区别是质子数(即核电荷数)不同。
故答案为:A。
【分析】根据不同种元素质子数不同分析。
3.【答案】 B
【解析】A. 氧气和二氧化碳具有不同的化学性质,是因为它们分子的构成不同,不同种的分子性质不同,故解释正确,不符合题意。
B. 物体具有热胀冷缩现象,是因为分子间的间隔(而不是大小)随温度的变化而改变,故解释错误,符合题意。
C. 湿衣服在阳光下比在阴凉处干得快,是因为温度升高,分子运动的速率加快,故解释正确,不符合题意。
D. 氢气燃烧生成水,是因为氢分子、氧分子分裂成了氢原子和氧原子,然后氢原子、氧原子重新组合形成水分子,故解释正确,不符合题意。
故答案为:B。
【分析】根据分子的定义和性质进行分析:分子的体积、质量很小;分子间有一定的间隔;分子在不停的运动;分子可以构成物质,分子在化学变化中还可以被分成更小的微粒,进行分析。
4.【答案】 D
【解析】A、元素周期表最早是由门捷列夫发现的,说法不符合题意。
B、目前通用的元素周期表中的元素是按照核电荷数由小到大进行排序的,说法不符合题意。
C、元素周期表中每一周期都是以稀有气体元素结束的,说法不符合题意。
D、目前通用的元素周期表一共有七个周期;纵向共有18个纵行,每一个纵行叫做一个族(8、9、10三个纵行共同组成一个族),即共有16个族,说法符合题意。
故答案为:D。
【分析】A、根据元素周期表最早是由门捷列夫发现分析;
B、根据元素周期表中原子序数与质子数相等分析;
C、根据元素周期表中每一周期都是以稀有气体元素结束分析;
D、根据元素周期表一共有七个周期、有16个族分析。
5.【答案】 B
【解析】A、H可表示氢元素,表示一个氢原子,但不能表示一种物质,故A不符合题意;
B、Hg属于金属元素,可表示汞元素,表示一个汞原子,还能表示汞这一纯净物,故B符合题意;
C、N2是氮气的化学式,不是元素符号,故C不符合题意;
D、KCl是氯化钾的化学式,不是元素符号,故D不符合题意。
故答案为:B。
【分析】根据元素符号的含义分析。
6.【答案】 A
【解析】A、元素的种类由质子数决定,该原子核中含有1个质子,故属于氢元素,A符合题意;
B、根据元素汉字名称的偏旁可辨别元素的种类,氢元素的名称有“气”字头,故属于非金属元素,B不符合题意;
C、在原子中,质子数=核外电子数,可知该原子核外有1个电子,C不符合题意;
D、在原子中,质子数=核电荷数,可知该原子核带1个单位的正电荷,D不符合题意。
故答案为:A
【分析】根据质子数决定元素种类,在原子中,质子数=核电荷数=核外电子数=原子序数,据此分析
7.【答案】 A
【解析】A、根据锶元素在元素周期表中显示的信息可知,其原子序数是38,又核内质子数=原子序数,因此锶元素的核内质子数等于38,图2、图3中的微粒的核内质子数都为38,根据元素的种类取决于核内质子数可以知道图2、图3都属于锶元素,故说法正确;
B、图3所表示粒子的核内质子数是38,核外电子数是36,核内质子数大于核外电子数,是锶离子,带2个单位的正电荷,其化学符号是Sr2+;故说法错误;
C、根据锶元素在元素周期表中显示的信息可知,其相对原子质量为87.62,又其核内质子数=原子序数=38,根据相对原子质量约等于质子数加中子数可知,锶原子的中子数不等于38,故说法错误;
D、根据锶元素在元素周期表中显示的信息可知,锶原子的相对原子质量是87.62,不是87.62g,故说法错误;
故选A.
【分析】A、根据元素的种类取决于核内质子数进行分析;
B、根据核内质子数与核外电子数的关系确定微粒的化学符号;
C、根据相对原子质量约等于质子数加中子数进行分析;
D、根据锶元素在元素周期表中显示的信息可以知道其相对原子质量.
8.【答案】 A
【解析】A、氮气是由氮分子构成,氧气是由氧分子构成,分子构成不同,因此化学性质不同,故A符合题意;
B、不同元素的本质区别是质子数不同,故B不符合题意;
C、钠原子的核外电子层数 等于钠元素所在周期序数 ,故C不符合题意;
D、 元素周期表中可以获得元素符号、元素原子序数 ,但是不能获得元素在自然界的分布信息,故D不符合题意;
故答案为:A
【分析】A、根据物质的结构决定物质的性质分析
B、根据元素的概念分析
C、根据原子核外电子层数和元素周期数的关系分析
D、根据元素周期表一格的信息分析
9.【答案】 B
【解析】A. 氯离子比氯原子多一个电子,所以氯离子比氯原子的质量相差不大,故说法错误,不符合题意;
B. 构成物质的粒子有分子、原子、离子,所以分子不是保持物质化学性质的唯一粒子,故说法正确,符合题意;
C. 原子中质子数等于核外电子数,所以质子数等于核外电子数的粒子不一定是原子,可能是分子,故说法错误,不符合题意;
D. 离子是带电荷的微粒,但是带电荷的微粒可能是离子,电子,质子,故说法错误,不符合题意;
故答案为:B。
【分析】A、1个电子的质量很小,可以忽略不计。
B、分子、原子、离子是构成物质的粒子。
C、原子、分子都不显电性,成电中性。
D、根据带电荷的微粒,进行分析。
10.【答案】 C
【解析】A. 从图中可知,反应后有一种分子是过量的反应物,反应后生成了两种物质,故不符合题意;
B. 从图中反映出的分子变化情况可知,反应物分子破裂,所含各原子重新组合生成新的分子,因此分子在化学变化中是可分的,故不符合题意;
C. 从图中分子的变化可见,参加反应的两种分子的个数比为1∶1,故符合题意;
D. 根据催化剂的概念,催化剂参与化学反应,但其化学性质和质量在反应前后都不发生变化,故不符合题意。
故答案为:C。
【分析】首先要对模型图进行观察,分析物质的微观构成、物质的类别,再找出物质之间的微粒数目关系,写出反应的方程式,然后再对题中各问加以分析解答。
11.【答案】 D
【解析】A、原子中核外电子,特别是最外层电子,决定原子化学性质,是决定原子构成物质的关键因素,说法不符合题意。
B、原子在分子中的配置(原子的种类、数量和排列方式)决定了分子的种类,说法不符合题意。
C、组成和结构不同,物质种类不同,化学元素只有一百多种,却组成了所有的化学物质,说法不符合题意。
D、元素的种类是由原子核内质子数决定。原子得失电子变成离子后,核内的质子数没有改变,元素的种类没有发生改变,符合题意。
故答案为:D。
【分析】A、根据决定元素化学性质的是最外层电子数分析
B、根据元素的概念分析
C、根据物质是由元素组成的分析
D、根据元素的概念分析
12.【答案】 B
【解析】反电子、反质子跟普通电子、质子的质量、电量均相等,电性相反。
所以反电子带1个单位的正电荷,反质子带1个单位的负电荷。
所以反氢原子是由1个带负电荷的质子与1个带正电荷的电子构成。
故答案为:B。
【分析】根据氢原子由1个带正电荷的质子和一个带负电荷的电子构成及题中所给反应粒子的信息分析。
二、填空题
13.【答案】 (1)①(2)①(3)①②(4)④(5)①(6)③(7)③
【解析】解:(1)核电荷数是指原子核所带的电荷数,而原子核由质子和中子构成,中子不带电,一个质子带一个单位的正电荷,所以质子数决定了原子的核电荷数;(2)原子序数与质子数相等,故决定原子序数的是质子数;(3)原子的相对原子质量近似的等于质子数和中子数之和;(4)电子的质量是质子质量的 ,所以电子的质量可以忽略不计,故原子的质量主要集中在原子核上;(5)元素是具有相同核电荷数(或质子数)的一类原子的总称,故原子的种类取决于原子的质子数;(6)元素的化学性质取决于原子的最外层电子数;(7)元素的分类主要取决于最外层电子数,金属元素最外层电子一般小于4个电子,而非金属元素最外层电子一般大于或等于4个电子;
故答案为:(1)①;(2)①;(3)①②;(4)④;(5)①;(6)③;(7)③.
【分析】根据原子的结构和性质及原子的构成粒子,并知道它们对原子及元素的性质的关系来解答.
14.【答案】 (1)4(2)31(3)C和E(4)D(5)
【解析】(1)以上示意图中,共有4种质子数,共有4种元素。(2)E粒子中的电子数为2+8+18+3=31。(3)上述五种粒子中,C和E是原子,它们的化学性质相似,因为它们最外层电子数均为3。(4)上述五种粒子中,属于阴离子的是D,因为D中质子数<核外电子数。(5)A粒子质子数为13,为铝元素,核外电子数为10,为铝离子,化学符号为 。
【分析】原子结构示意图中,圆圈表示原子核,圈外的弧线表示电子层,弧线上的数表示该层上的电子数,据此分析
15.【答案】 (1)元素(2)分子(3)原子(4)原子(5)分子(6)离子
【解析】解:(1)物质是由元素组成的,所以水是由氧、氢两种元素组成的;(2)分子是保持物质化学性质的最小微粒,所以保持氢气化学性质的最小粒子是氢分子;(3)化学变化中的最小微粒是原子;(4)金属单质是由原子直接构成的,所以体温计中的汞是由汞原子构成的;(5)供给人呼吸的氧气是由氧分子构成的;(6)氯化钠是由钠离子和氯离子构成的;
故答案为:(1)元素;(2)分子;(3)原子;(4)原子;(5)分子;(6)离子
【分析】(1)根据物质由元素组成分析;
(2)根据分子是保持物质化学性质的粒子分析;
(3)根据原子是化学变化中的最小粒子分析;
(4)根据金属由原子构成分析;
(5)根据氧气由氧分子构成分析;
(6)根据氯化钠由离子构成分析。
16.【答案】 (1)10(2)失;金属(3)3(4)8;S2-
【解析】(1)由图可知,氖为10号元素,原子的核电荷数为10;
(2)11号元素的原子最外层有一个电子,在化学反应中比较容易失去电子;11号元素为钠元素,该元素属于金属元素;
(3)由图可知,元素周期表中第三周期一共有钠元素、镁元素、铝元素3种金属元素;
(4)原子中质子数等于核外电子数;16号元素为硫元素,原子结构为 ,16=2+x+6,x=8;该元素的原子最外层有6个电子,容易得到两个电子形成带两个单位负电荷的阴离子S2-。
【分析】(1)根据在元素周期表一格中信息可知,左上角的数表示原子序数,右上角的字母表示元素符号,汉字下面是的数字表示原子的相对原子质量。
(2)原子的最外层电子数小于4,在化学反应中比较容易失去电子,达到稳定结构。
(3)元素周期数=原子的核外电子层数。
(4)在原子中,质子数=核外电子数。
三、实验探究题
17.【答案】 (1)烧杯甲中的酚酞溶液变红;在不停地运动
(2)长条形滤纸条上的酚酞点从右到左依次变红;分子在不停地运动
(3)在试管下面放一张白纸
(4)药品的用量较少(或节约药品)
(5)酚酞与氨水的位置滴反了
(6)图III所示装置中,烧杯B变红的速率较慢,图IV所示装置中,烧杯B变红的速率较快
(7)分子在不断的运动,且温度越高,分子运动越剧烈
【解析】
[进行实验]氨水溶液呈碱性,能使酚酞试液变红,几分钟后烧杯甲中可观察到的现象是烧杯甲中的酚酞溶液变红,此实验说明了分子在不停地运动;
[实验改进] 几分钟后可观察到的现象是长条形滤纸条上的酚酞点从右到左依次变红,该实验说明了分子在不停地运动;
[分析讨论](3)若实验II的现象不明显,应当进行的改进操作是为了便于观察到颜色及颜色变化,在在试管下面放一张白纸;
(4)改进后图II所示装置的主要优点是药品用量少,可以达到节约药品的目的,同时可以减少污染物的排放;
(5)实验过程中,若发现滤纸条没有变色,而试管中所塞的脱脂棉却变成了红色,产生这种现象的原因可能是氨水和酚酞试液位置放反了,或者氨水和酚酞试液都放在了棉花团上;
[拓展延伸](6)按照图III和图IV所示装置操作、几分钟后烧杯B中溶液变化:图III所示装置中,烧杯B变红的速率较慢,图IV所示装置中,烧杯B变红的速率较快;(7)对比图III和图IV所示的装置,说明了分子的远动速率受温度影响,且温度越高,分子运动速率越快。
【分析】【进行实验】浓氨水具有挥发性,能挥发出氨气,浓氨水显碱性,能使酚酞溶液变红,所以几分钟后可以看到的现象是甲中的溶液变红色,其中烧杯乙是对比实验的;
【实验改进】改进后的实验中,由于氨分子是不断运动的,氨水从棉花上开始运动,当运动到滤纸条上的酚酞试液上时,和水结合生成氨水,氨水显碱性,能使酚酞溶液变红,因此实验现象是几分钟后观察到的现象是滤纸上的酚酞由右向左依次变红。再次证明了分子是不断运动的;
【分析讨论】(3)在改进实验中,滤纸如果变色不明显是,需在试管下面放一张白纸,起一个衬托作用,使滤纸变色更加明显;
(4)改进后的实验,药品的使用量明显减少,节约了药品,由于氨水有刺激性气味,会污染空气,由于药品的使用量减少,减少了污染;
(5)实验中,要求将氨水滴在棉花上,酚酞滴在滤纸条上,然后将滤纸条放入到试管里,如果将药品滴反了,就会出现滤纸条没有变色,而试管中所塞的脱脂棉却变成了红色的错误实验现象;
【拓展延伸】由于分子是不断运动的,温度越高,运动的越快;图III和图IV中的变量是温度,温度高的实验中氨分子的运动速度快,B烧杯中酚酞变红的速率较快;
四、计算题
18.【答案】 (1)(2)27
【解析】(1)根据相对原子质量的定义,A原子的相对原子质量为 ÷ = ,原子中,相对分子质量=质子数+中子数,所以A原子的中子数是 a。
(2)解:根据相对原子质量的定义,铝原子的相对原子质量= ÷ ≈27答:铝原子的相对原子质量约为27。
【分析】根据原子的相对原子质量的定义进行解答。以一种碳原子的1/12作为标准,其他原子的质量与它相比较所得的比,作为这种原子的相对原子质量。原子的相对原子质量=质子数+中子数。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
