课题三 《制取氧气》 同步测试题(答案详解)
文档属性
| 名称 | 课题三 《制取氧气》 同步测试题(答案详解) |  | |
| 格式 | docx | ||
| 文件大小 | 421.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-17 15:14:22 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
课题三 《制取氧气》 同步测试
一、单选题
1.下列制取氧气的方法中不属于化学变化的是( )
A. 加热高锰酸钾制氧气
B. 分离液态空气制氧气
C. 加热氯酸钾制氧气
D. 绿色植物光合作用制氧气
2.工业上用的大量氧气,主要使用分离液态空气法制取的。这种方法主要是利用了( )
A. 化学性质不同 B. 溶解性不同
C. 气体沸点不同 D. 密度不同
3.工业上用分离液态空气法制取氧气的依据是( )
A. 氧气和氮气的沸点不同
B. 氧气和氮气在水中的溶解性不同
C. 氧气和氮气的密度不同
D. 氧气和氮气的化学性质不同
4.下列关于催化剂的说法中,正确的是( )
A. 催化剂一定能加快化学反应速率
B. 反应前后催化剂的质量和性质不变
C. 一种催化剂只能催化一个化学反应
D. 一个化学反应可能存在多种催化剂
5.实验室用高锰酸钾制氧气,有如下操作:①加热 ②检查装置的气密性 ③加入药品,按装置图接好装置 ④用排水法收集氧气 ⑤从水槽中取出导管 ⑥熄灭酒精灯,正确的操作顺序是( )
A. ②③①④⑤⑥ B. ②③①④⑥⑤
C. ③②①④⑥⑤ D. ③②①④⑤⑥
6.下列属于分解反应的是( )
A. 蒸发食盐水得食盐
B. 分离液态空气得氧气
C. 过氧化氢分解制取氧气
D. 蜡烛燃烧生成水和二氧化碳
7.下图是实验室制备、收集、验满、验证性质的操作,其中正确的是( )
A. 高锰酸钾制取氧气 B. 收集氧气 C. 氧气验满 D. 细铁丝在氧气中燃烧
8.制氧时,小明同学未能收集到两瓶氧气,其不可能的原因是( )
A. 没有塞紧橡皮塞
B. 没有及时更换收集第二瓶
C. 药品的量不足
D. 加热前已将两集气瓶灌满水倒立于水槽
9.实验室用过氧化氢溶液制氧气和用氯酸钾制氧气相比较,下列说法不正确的( )
A. 都是分解反应
B. 可以用相同的催化剂
C. 可以用相同的发生装置
D. 可以用相同的收集装置
10.下列有关实验基本操作中先后顺序的叙述错误的是( )
A. 用托盘天平称量药品时,先调节天平平衡,后称量
B. 制备气体时,先检查装置的气密性,后装入药品
C. 双氧水制氧气的实验中,先加入双氧水,后加入二氧化锰
D. 给试管中的药品加热时,先对试管均匀加热,后对准装药品的部位集中加热
11.实验室需收集一瓶约含1/4空气的氧气,下列操作正确的是( )
A. 集气瓶中灌 体积的水 B. 集气瓶中灌 体积的水
C. 导管伸入到集气瓶体积的 处 D. 导管伸入到集气瓶体积的 处
12.加热氯酸钾和高锰酸钾混合物一段时间后,试管内剩余固体种类不可能是( )
A. 5种 B. 4种 C. 3种 D. 2种
13.一定质量的氯酸钾和一定质量的二氧化锰混合后,下列有关质量随着时间的变化图象正确的是( )
A. B. C. D.
二、综合题
14.工业制取氧气主要有下列步骤。
将经过除尘、除二氧化碳、除水的空气进行下列操作:
(1)工业制氧气属于________;
(2)从步骤②可以得出氮气的沸点比氧气的沸点________(填“高”或“低”);
(3)步骤②剩余液体为________(填“有色”或“无色”)
(4)储存在蓝色钢瓶里的“工业液氧”是________(填“纯净物”或“混合物”);
(5)用________可以区分空气、“工业液氧”和二氧化碳;
(6)蓝色钢瓶中的液氧的用途________(举一例),蒸发出的氮气的用途________(举一例)。
15.某兴趣小组利用下列装置进行气体的实验室制取和收集实验,请回答:
(1)图中仪器名称①________②________。
(2)若用高锰酸钾制取氧气选用的发生装置是________(填字母)。你认为该装置中还缺少________。
(3)若用过氧化氢制取氧气,还需要用到________(填名称),其起________作用,能否用高锰酸钾制取氧气后的剩余物代替该物质________(填“能”或“否”)。
(4)用D装置收集氧气时,当气泡________再开始收集,收集满氧气后,应用玻璃片盖住集气瓶口,并且应________(填“正放”或“倒放”)在桌上。用C装置收集氧气时,验满的方法是用________。
(5)若用F装置收集该气体,则气体从________处导管进入(填“c”或“d”), 若要用水将瓶中氧气排出使用,水应从________处导管进入。
(6)某同学在用加热高锰酸钾制氧气的过程中,发现试管炸裂,试你帮她分析一下造成此后果的原因可能有(至少答两点)________; ________。
(7)实验结束后,有人问:“我用带火星的木条伸入集气瓶内,为什么不会复燃?”请你推测导致这种现象的可能原因________(写一个)。
16.A、B…H八种物质,有如图所示关系:其中A是一种暗紫色固体,B、G都是黑色固体,D能使带火星的木条复燃,E是一种无色液体,H是一种能使澄清石灰水变浑浊的气体,在②的反应前后B的质量和化学性质都不改变.
请你根据上述信息,推断出下列物质:
A________、B________、D________、E________、H________.
三、实验探究题(共2题;共19分)
17.根据如图装置回答问题。
(1)请写出仪器①的名称:________。
(2)用氯酸钾和二氧化锰为原料制取较纯净的氧气可选用的装置组合为________(填字母,下同),若使用高锰酸钾制取氧气,其反应文字表达式:________,装置A还需做的一点改动是________ ,实验结束时应先把导管移出水面,后熄灭酒精灯,原因是________。
(3)用过氧化氢和二氧化锰为原料制取氧气可选用的发生装置为________,文字表达式________。
(4)已知氢气密度比空气小,难溶于水,用排空气法收集选用装置________,使用F收集时气体从________端进入(填“a”或“b”)。
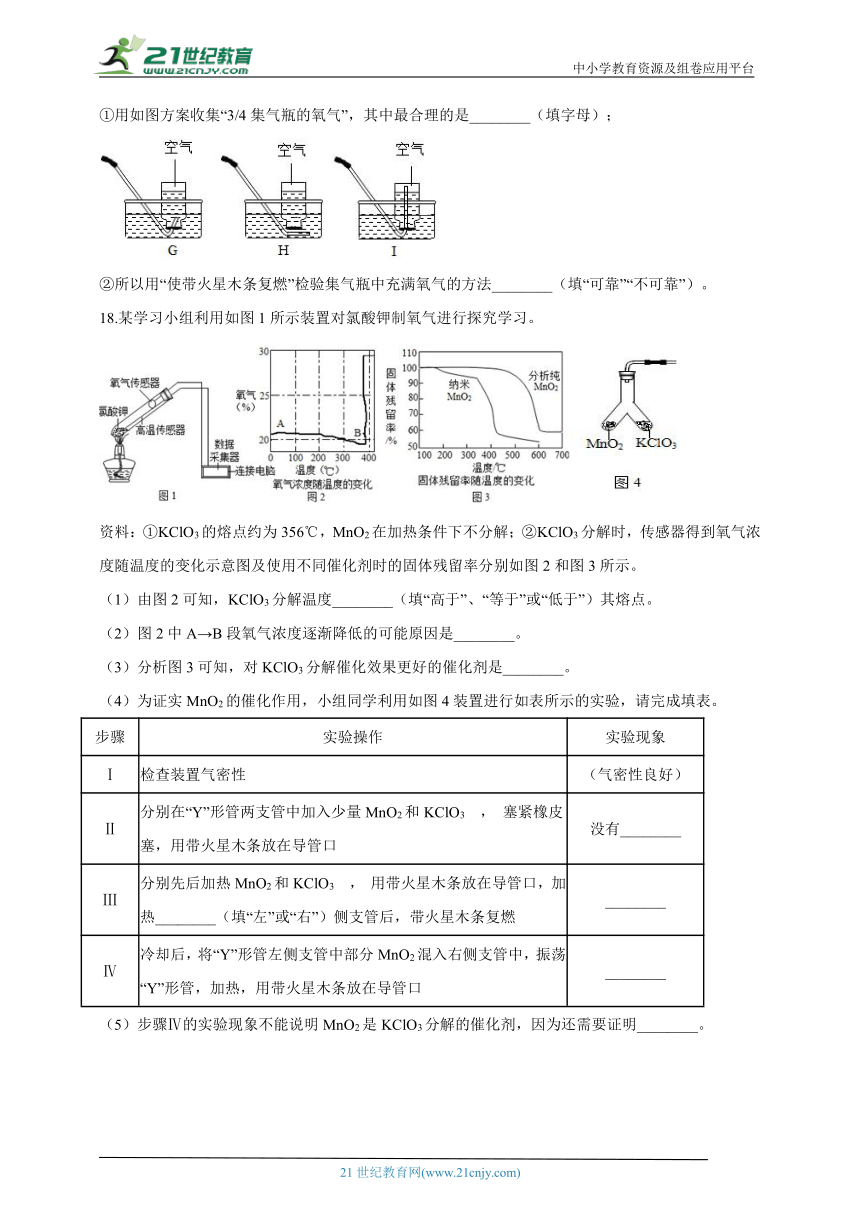
(5)小曹老师带领学生进行上述实验时,发现“一同学不慎碰倒装满氧气的集气瓶,迅速扶起后,瓶中剩余的氧气仍能使带火星的木条复燃”;对此,小曹老师让该同学往集气瓶装入半瓶水,再用排水法收集3/4集气瓶的氧气,发现瓶中的氧气也能使带火星木条复燃。
①用如图方案收集“3/4集气瓶的氧气”,其中最合理的是________(填字母);
②所以用“使带火星木条复燃”检验集气瓶中充满氧气的方法________(填“可靠”“不可靠”)。
18.某学习小组利用如图1所示装置对氯酸钾制氧气进行探究学习。
资料:①KClO3的熔点约为356℃,MnO2在加热条件下不分解;②KClO3分解时,传感器得到氧气浓度随温度的变化示意图及使用不同催化剂时的固体残留率分别如图2和图3所示。
(1)由图2可知,KClO3分解温度________(填“高于”、“等于”或“低于”)其熔点。
(2)图2中A→B段氧气浓度逐渐降低的可能原因是________。
(3)分析图3可知,对KClO3分解催化效果更好的催化剂是________。
(4)为证实MnO2的催化作用,小组同学利用如图4装置进行如表所示的实验,请完成填表。
步骤 实验操作 实验现象
Ⅰ 检查装置气密性 (气密性良好)
Ⅱ 分别在“Y”形管两支管中加入少量MnO2和KClO3 , 塞紧橡皮塞,用带火星木条放在导管口 没有________
Ⅲ 分别先后加热MnO2和KClO3 , 用带火星木条放在导管口,加热________(填“左”或“右”)侧支管后,带火星木条复燃 ________
Ⅳ 冷却后,将“Y”形管左侧支管中部分MnO2混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口 ________
(5)步骤Ⅳ的实验现象不能说明MnO2是KClO3分解的催化剂,因为还需要证明________。
课题三 《制取氧气》 同步测试题
答案解析
一、单选题
1.【答案】 B
【解析】物理变化和化学变化的根本区别在于是否有新物质生成,如果有新物质生成,则属于化学变化;反之,则是物理变化。A、加热高锰酸钾制氧气,生成新的物质,属于化学变化,错误,B、分离液态空气制氧气是利用物质的沸点不同加以分离,没有生成新的物质,属于物理变化,正确,C、加热氯酸钾制氧气生成新的物质,属于化学变化,错误,D、绿色植物光合作用制氧气生成新的物质,属于化学变化,错误,故选B
2.【答案】 C
【解析】工业上用的大量氧气,主要使用分离液态空气法制取的,是利用了液态氮和液态氧沸点的不同,C符合题意。
故答案为:C。
【分析】根据工业制氧气利用各气体的沸点不同进行制取的分析
3.【答案】 A
【解析】工业上制取氧气利用了氧气和氮气的沸点不同从而分离液态空气的办法得到氧气.
故答案为:A.
【分析】根据工业制氧气是利用各气体成分的沸点不同分析
4.【答案】 D
【解析】A、催化剂能改变其他物质的化学反应速率,可以加快也可减慢某些化学反应的速率,说法不符合题意;
B、催化剂在化学反应前后质量和化学性质(而不是性质)不变,说法不符合题意;
C、一种催化剂可能催化多个反应例如过氧化氢分解、氯酸钾分解的催化剂都是二氧化锰,说法不符合题意;
D、一个化学反应可能存在多种催化剂,例如过氧化氢分解的催化剂可以是二氧化锰、氧化铁等,说法符合题意。
故答案为:D。
【分析】催化剂是能改变物质的反应速率,但是本身的质量和化学性质不变的物质,据此分析
5.【答案】 A
【解析】实验室高锰酸钾制取氧气的操作顺序是:组装好仪器后检查装置的气密性(查)、装药品(装)、固定仪器(定)、点燃酒精灯(点)、收集氧气(收)、撤离导管(离)、熄灭酒精灯(熄);
故答案为:A。
【分析】根据实验室高锰酸钾制取氧气的操作,进行分析。
6.【答案】 C
【解析】A、蒸发食盐水得食盐,没有新物质生成,属于物理变化,不符合题意。
B、分离液态空气得氧气,是利用了液态氮和液态氧沸点的不同,分离过程中没有新物质生成,属于物理变化,不符合题意。
C、过氧化氢在二氧化锰的催化作用下生成水和氧气,该反应符合“一变多”的特征,属于分解反应,符合题意。
D、蜡烛燃烧生成水和二氧化碳,该反应的反应物是两种,不符合“一变多”的特征,不属于分解反应,不符合题意。
故答案为:C。
【分析】分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”,据此进行分析判断即可.
7.【答案】 A
【解析】A、此图是加热高锰酸钾制氧气的发生装置图,注意试管口略向下倾斜,试管口处应放一团棉花防止高锰酸钾粉末进入导管,此装置图符合题意,故A符合题意;
B、收集氧气应用向上排空气法收集气体,注意导管要伸入到集气瓶底,此图中导管未伸入到集气瓶底部,故B不符合题意;
C、检验氧气是否集满,应使用的带火星的小木条放在集气瓶口,此图中小木条伸入到了集气瓶内部,故C不符合题意;
D、做铁丝在氧气中燃烧的实验时,注意要预先在瓶内放少许水或在瓶底铺上一些细沙,防止高温熔化物溅落使瓶底炸裂,此图中瓶底无细沙或水,故D不符合题意。
故答案为:A。
【分析】本题考查氧气的制取、收集、验满和验证性质的实验装置及操作步骤。
8.【答案】 D
【解析】A、没有塞紧橡皮塞,使氧气部分扩散到空中,收集的氧气减少,故A不符合题意;
B、没有及时更换集气瓶,使收集的氧气减少,故B不符合题意;
C、药品的量不足,会导致收集到的氧气量太少,故C不符合题意;
D、加热前已将集气瓶灌满水倒立于水槽中,不会造成生成的氧气减少,故D符合题意。
故答案为:D。
【分析】排水法收集气体的时候必须将集气瓶里装满水,倒立在水槽中;
9.【答案】 C
【解析】A. 过氧化氢溶液制氧气和用氯酸钾制氧气 ,都是一种物质生成多种物质的反应,属于分解反应,故A不符合题意;
B.过氧化氢溶液制氧气和用氯酸钾制氧气 ,都用二氧化锰作催化剂,故B不符合题意;
C.过氧化氢溶液制取氧气采用的是固液不加热制取气体的装置,氯酸钾和二氧化锰加热制取氧气采用的是固固加热制取气体的装置,故C符合题意
D.收集的都是氧气,因此收集装置一致,故D不符合题意
故答案为:C
【分析】A、根据反应的特点进行分析
B、根据反应的原理进行分析
C、根据反应物的状态和反应条件进行分析
D、根据气体的密度和水溶性分析
10.【答案】 C
【解析】A、用托盘天平称量药品时,先调节天平平衡,后称量,此选项不符合题意;
B、制备气体时,先检查装置的气密性,以防由于装置漏气而收集不到气体,然后装入药品,此选项不符合题意;
C、加入药品时,先加固体后加液体,所以双氧水制氧气的实验中,先加入二氧化锰,后加入双氧水,此选项符合题意;
D、给试管中的药品加热时,先对试管均匀加热,以防试管炸裂,后对准装药品的部位集中加热,此选项不符合题意。
故答案为:C。
【分析】A、根据天平的使用方法分析
B、根据制备气体的步骤进行分析
C、根据固液反应先固后液分析
D、根据给试管中药品加热的方法分析
11.【答案】 B
【解析】A、集气瓶中灌 体积的水,收集的氧气的体积约为 ,空气的体积约为 ,故A不符合题意;
B、集气瓶中灌 体积的水,收集的氧气的体积约为 ,空气的体积约为 ,故B符合题意;
C、导管伸入到集气瓶体积的 处,收集的氧气的体积小于 ,空气的体积大于 ,故C不符合题意;
D、导管伸入到集气瓶体积的 处,收集的氧气的体积小于 ,空气的体积大于 ,故D不符合题意;
故答案为:B。
【分析】氧气不易溶于水,用排水法收集,氧气密度比空气大,用向上排空气法收集。
12.【答案】 D
【解析】A、加热氯酸钾和高锰酸钾混合物一段时间后,氯酸钾和高锰酸钾都没有完全分解,剩余固体中有:高锰酸钾、锰酸钾、二氧化锰、氯酸钾、氯化钾5种物质,不符合题意。
B、加热氯酸钾和高锰酸钾混合物一段时间后,高锰酸钾未分解完全,氯酸钾分解完全,剩余固体中含有:高锰酸钾、锰酸钾、二氧化锰、氯化钾4中物质,不符合题意。
C、加热氯酸钾和高锰酸钾混合物一段时间后,高锰酸钾和氯酸钾都分解完全,剩余固体中含有:锰酸钾、二氧化锰、氯化钾3种,不符合题意。
D、加热氯酸钾和高锰酸钾混合物一段时间后,至少含有锰酸钾、二氧化锰、氯化钾3种,符合题意。
故答案为:D。
【分析】加热氯酸钾生成氯化钾和氧气,加热高锰酸钾生成锰酸钾、二氧化锰和氧气。加热氯酸钾和高锰酸钾混合物一段时间后,试管内剩余的固体不可能只有两种。
13.【答案】 D
【解析】A、氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,随着反应进行,固体质量减小,该选项对应关系不符合题意;
B、加热一段时间生成氧气,因此氧气质量是0,完全反应后氧气质量不再变化,该选项对应关系不符合题意;
C、过程中二氧化锰是催化剂,质量始终不变,该选项对应关系不符合题意;
D、加热一段时间后,氯酸钾反应生成氯化钾和氧气,完全反应后氯化钾质量不再变化,该选项对应关系符合题意。
故答案为:D。
【分析】根据氯酸钾在二氧化锰的催化下加热生成氯化钾和氧气进行分析
二、综合题
14.【答案】
(1)物理变化
(2)低
(3)有色
(4)混合物
(5)燃着的木条
(6)医疗急救(答案合理即可);作保护气(答案合理即可)
【解析】(1)工业制氧气,是利用氮、氧气的沸点不同。进行分离液态空气的方法,属于物理变化。
(2)从步骤②可以,看出,先分离出液态氮气,说明氮气的沸点比氧气的沸点低。
(3)液态的氧气是淡蓝色,所以步骤②剩余液体为有色的。
(4)储存在蓝色钢瓶里的“工业液氧”混合物,还含有少量的二氧化碳,稀有气体等。
(5)用燃着的木条可以区分空气、“工业液氧”和二氧化碳,燃烧现象不变时空气;剧烈燃烧的是液态氧气;熄灭的是二氧化碳。
(6)蓝色钢瓶中的液氧的用途如医疗急救,蒸发出的氮气的用途如作保护气。
【分析】根据工业上分离液态空气来制取氧气的方法,进行分析。
15.【答案】
(1)试管;酒精灯
(2)A;棉花
(3)二氧化锰;催化;能
(4)连续且比较均匀冒出时;正放;把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满
(5)c;b
(6)没有预热就直接加热;试管外壁有水
(7)装置漏气(或集气瓶未装满水)
【解析】(1)①是试管,常用作反应容器;②是酒精灯,常用作热源;(2)用高锰酸钾制取氧气时需要加热,应选用的发生装置是A装置。为了防止高锰酸钾进入导管,应该在试管口塞一团棉花;(3)若用过氧化氢制取氧气,还需要用到二氧化锰,在反应中起催化作用,能够加快过氧化氢的分解,另外高锰酸钾受热分解后的剩余物中含有二氧化锰,可以用作过氧化氢分解的催化剂;(4)用D装置收集氧气时,当气泡均匀且连续时开始收集,收集好后应将瓶子正放在桌面上,用C装置收集氧气时,判断该装置已收集满的方法是:把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满;(5)若用F装置收集该气体,则气体从c处导管进入,若要用水将瓶中氧气排出使用,水应从b处导管进入;(6)加热高锰酸钾制氧气的过程中,发现试管炸裂,很可能是没有预热就直接加热或者试管外部有水;(7)装置漏气、刚出现气泡就开始收集、收集前集气瓶中的水不满、氧气中含有较多的水蒸气,都能够导致收集的氧气不纯,用带火星的木条伸入集气瓶内时不会复燃。
故答案为:(1)试管;酒精灯(2)A;棉花(3)二氧化锰;催化;能(4)连续且比较均匀冒出时;正放;把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满;(5)c;b(6)没有预热就直接加热;试管外壁有水(7)装置漏气(或集气瓶未装满水)
【分析】(1)根据常用仪器的名称和用途分析解答
(2)根据高锰酸钾制氧气的反应物是固体,反应条件是加热,在试管口放一团棉花可以防止高锰酸钾进入导管解答
(3)根据实验室利用过氧化氢制氧气时用二氧化锰做催化剂,高锰酸钾加热能生成二氧化锰解答
(4)根据实验室制取氧气,用排水法收集氧气,当气泡均匀冒出时收集,收集满后,由于氧气的密度大于空气密度,正放在桌面上,氧气具有助燃性
(5)根据氧气密度比水小,不易溶于水解答
(6)根据玻璃是热的不良导体,受热不均匀会炸裂
(7)实验结束后,带火星的木条不复燃,可能的原因是装置漏气或未装满水
16.【答案】 高锰酸钾;二氧化锰;氧气;过氧化氢溶液;二氧化碳
【解析】D能使带火星的木条复燃,所以D是氧气,H是一种能使澄清石灰水变白色浑浊的气体,所以H是二氧化碳,G是木炭,在②的反应前后B的质量和化学性质都不改变,所以B是反应②的催化剂,通常状况下E为无色液体,E在催化剂B的作用下生成无色液体和氧气,结合实验室制取氧气的药品和方法可知,所以B是二氧化锰,E是过氧化氢,F就是水,A是一种暗紫色固体,A在加热的条件下生成二氧化锰、氧气和C,所以A是高锰酸钾,C就是锰酸钾,经过验证,推断正确。
由以上分析可知:A是高锰酸钾,B是二氧化锰,D是氧气,E是过氧化氢溶液,H是二氧化碳。
【分析】根据题中给出的信息结合实验室制取氧气的方法进行分析
三、实验探究题
17.【答案】
(1)酒精灯
(2)AD;;试管口放一团棉花;防止水倒吸使试管炸裂
(3)B;
(4)E或F;b
(5)G;不可靠
【解析】(1)仪器①的名称:酒精灯;
(2)实验室用氯酸钾在二氧化锰催化下加热生成锰酸钾和氧气,发生装置选A,氧气不易溶于水,也不与水反应,排水法收集到气体较为纯净,收集装置选D,可选用的装置组合为:AD;高锰酸钾加热生成锰酸钾、二氧化锰和氧气,该反应的文字表达式为: ;为了防止高锰酸钾被氧气冲入玻璃导管,还需在试管口放一团棉花,实验结束时应先把导管移出水面,后熄灭酒精灯,原因是防止水倒吸使试管炸裂;
(3)过氧化氢在二氧化锰催化下生成水和氧气,可选用的发生装置为B,该反应的文字表达式为: ;
(4)氢气密度比空气小,用排空气法选用装置E或F,使用F收集气体使,气体从b导管进,因为氢气的密度比空气小,空气从长导管a排出;
(5)① 用如图方案收集 集气瓶的氧气,其中最合理的是G,H不合理,是因为导管口在集气瓶口外,I不合理,是因为导管伸入集气瓶太长;
② 不纯净的氧气也能使带火星的木条复燃,所以用“使带火星的木条复燃”检验集气瓶中充满氧气的方法不可靠。
【分析】(2)根据实验室用氯酸钾制取氧气的反应原理,属于姑姑加热型反应,选择发生装置。
根据氧气的物理性质,选择收集装置。
根据高锰酸钾加热生成锰酸钾、二氧化锰和氧气,写出文字表达式。
(3)根据过氧化氢制取氧气的反应原理,属于固液常温型反应,选择发生装置。
(4)根据气体密度比空气小,使用F收集气体使,气体从短导管进,空气从长导管排出。
(5)纯净的氧气能使带火星的木条复燃。
18.【答案】
(1)高于
(2)温度升高,试管中气压增大,部分空气排出
(3)纳米二氧化锰
(4)明显现象;右;加加热左侧支管后,带火星木条不复燃,加热右侧支管,木条复燃;加热右侧支管后,带火星木条能复燃,加热时间短于步骤Ⅲ
(5)反应前后MnO2的质量和化学性质不变
【解析】(1)由图2可知,KClO3分解温度接近400℃高于其熔点356℃,故填:高于。(2)图2中A→B段氧气浓度逐渐降低的可能原因是温度升高,试管中气压增大,部分空气排出,故填:温度升高,试管中气压增大,部分空气排出。(3)纳米MnO2 , 200℃时,固体开始分解,而分析纯MnO2需要500℃才分解,分析图3可知,对KClO3分解催化效果更好的催化剂是纳米二氧化锰,故填:纳米二氧化锰。(4)氯酸钾在加热时才能生成氯化钾和氧气,在常温下不分解,二氧化锰不分解,故分别在“Y”形管两支管中加入少量MnO2和KClO3 , 二氧化锰和氯酸钾都不能生成氧气,塞紧橡皮塞,用带火星木条放在导管口无现象,故填:明显现象。(5)分别先后加热MnO2和KClO3 , 氯酸钾分解生成氯化钾和氧气,二氧化锰不能生成氧气,用带火星木条放在导管口,加热右侧支管后,带火星木条复燃左侧带火星木条不复燃,故填:右;加热左侧支管后,带火星木条不复燃,加热右侧支管,木条复燃。(6)将二氧化锰和氯酸钾混合后,二氧化锰是催化剂加快反应速率,加热右侧支管后,带火星木条很快复燃,加热时间短于步骤Ⅲ,故填:加热右侧支管后,带火星木条能复燃,加热时间短于步骤Ⅲ;(7)催化剂能改变反应速率,且质量和化学性质反应前后都不变,步骤Ⅳ的实验现象不能说明MnO2是KClO3分解的催化剂,因为还需要证明反应前后MnO2的质量和化学性质不变,故填:反应前后MnO2的质量和化学性质不变。
【分析】(1)根据图像2进行分析
(2)根据温度升高,气压增大分析
(3)根据催化需要的温度进行分析
(4)根据固体溶解和反应生成气体都能使装置内的气压增大分析
(5)根据催化剂的概念分析
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
课题三 《制取氧气》 同步测试
一、单选题
1.下列制取氧气的方法中不属于化学变化的是( )
A. 加热高锰酸钾制氧气
B. 分离液态空气制氧气
C. 加热氯酸钾制氧气
D. 绿色植物光合作用制氧气
2.工业上用的大量氧气,主要使用分离液态空气法制取的。这种方法主要是利用了( )
A. 化学性质不同 B. 溶解性不同
C. 气体沸点不同 D. 密度不同
3.工业上用分离液态空气法制取氧气的依据是( )
A. 氧气和氮气的沸点不同
B. 氧气和氮气在水中的溶解性不同
C. 氧气和氮气的密度不同
D. 氧气和氮气的化学性质不同
4.下列关于催化剂的说法中,正确的是( )
A. 催化剂一定能加快化学反应速率
B. 反应前后催化剂的质量和性质不变
C. 一种催化剂只能催化一个化学反应
D. 一个化学反应可能存在多种催化剂
5.实验室用高锰酸钾制氧气,有如下操作:①加热 ②检查装置的气密性 ③加入药品,按装置图接好装置 ④用排水法收集氧气 ⑤从水槽中取出导管 ⑥熄灭酒精灯,正确的操作顺序是( )
A. ②③①④⑤⑥ B. ②③①④⑥⑤
C. ③②①④⑥⑤ D. ③②①④⑤⑥
6.下列属于分解反应的是( )
A. 蒸发食盐水得食盐
B. 分离液态空气得氧气
C. 过氧化氢分解制取氧气
D. 蜡烛燃烧生成水和二氧化碳
7.下图是实验室制备、收集、验满、验证性质的操作,其中正确的是( )
A. 高锰酸钾制取氧气 B. 收集氧气 C. 氧气验满 D. 细铁丝在氧气中燃烧
8.制氧时,小明同学未能收集到两瓶氧气,其不可能的原因是( )
A. 没有塞紧橡皮塞
B. 没有及时更换收集第二瓶
C. 药品的量不足
D. 加热前已将两集气瓶灌满水倒立于水槽
9.实验室用过氧化氢溶液制氧气和用氯酸钾制氧气相比较,下列说法不正确的( )
A. 都是分解反应
B. 可以用相同的催化剂
C. 可以用相同的发生装置
D. 可以用相同的收集装置
10.下列有关实验基本操作中先后顺序的叙述错误的是( )
A. 用托盘天平称量药品时,先调节天平平衡,后称量
B. 制备气体时,先检查装置的气密性,后装入药品
C. 双氧水制氧气的实验中,先加入双氧水,后加入二氧化锰
D. 给试管中的药品加热时,先对试管均匀加热,后对准装药品的部位集中加热
11.实验室需收集一瓶约含1/4空气的氧气,下列操作正确的是( )
A. 集气瓶中灌 体积的水 B. 集气瓶中灌 体积的水
C. 导管伸入到集气瓶体积的 处 D. 导管伸入到集气瓶体积的 处
12.加热氯酸钾和高锰酸钾混合物一段时间后,试管内剩余固体种类不可能是( )
A. 5种 B. 4种 C. 3种 D. 2种
13.一定质量的氯酸钾和一定质量的二氧化锰混合后,下列有关质量随着时间的变化图象正确的是( )
A. B. C. D.
二、综合题
14.工业制取氧气主要有下列步骤。
将经过除尘、除二氧化碳、除水的空气进行下列操作:
(1)工业制氧气属于________;
(2)从步骤②可以得出氮气的沸点比氧气的沸点________(填“高”或“低”);
(3)步骤②剩余液体为________(填“有色”或“无色”)
(4)储存在蓝色钢瓶里的“工业液氧”是________(填“纯净物”或“混合物”);
(5)用________可以区分空气、“工业液氧”和二氧化碳;
(6)蓝色钢瓶中的液氧的用途________(举一例),蒸发出的氮气的用途________(举一例)。
15.某兴趣小组利用下列装置进行气体的实验室制取和收集实验,请回答:
(1)图中仪器名称①________②________。
(2)若用高锰酸钾制取氧气选用的发生装置是________(填字母)。你认为该装置中还缺少________。
(3)若用过氧化氢制取氧气,还需要用到________(填名称),其起________作用,能否用高锰酸钾制取氧气后的剩余物代替该物质________(填“能”或“否”)。
(4)用D装置收集氧气时,当气泡________再开始收集,收集满氧气后,应用玻璃片盖住集气瓶口,并且应________(填“正放”或“倒放”)在桌上。用C装置收集氧气时,验满的方法是用________。
(5)若用F装置收集该气体,则气体从________处导管进入(填“c”或“d”), 若要用水将瓶中氧气排出使用,水应从________处导管进入。
(6)某同学在用加热高锰酸钾制氧气的过程中,发现试管炸裂,试你帮她分析一下造成此后果的原因可能有(至少答两点)________; ________。
(7)实验结束后,有人问:“我用带火星的木条伸入集气瓶内,为什么不会复燃?”请你推测导致这种现象的可能原因________(写一个)。
16.A、B…H八种物质,有如图所示关系:其中A是一种暗紫色固体,B、G都是黑色固体,D能使带火星的木条复燃,E是一种无色液体,H是一种能使澄清石灰水变浑浊的气体,在②的反应前后B的质量和化学性质都不改变.
请你根据上述信息,推断出下列物质:
A________、B________、D________、E________、H________.
三、实验探究题(共2题;共19分)
17.根据如图装置回答问题。
(1)请写出仪器①的名称:________。
(2)用氯酸钾和二氧化锰为原料制取较纯净的氧气可选用的装置组合为________(填字母,下同),若使用高锰酸钾制取氧气,其反应文字表达式:________,装置A还需做的一点改动是________ ,实验结束时应先把导管移出水面,后熄灭酒精灯,原因是________。
(3)用过氧化氢和二氧化锰为原料制取氧气可选用的发生装置为________,文字表达式________。
(4)已知氢气密度比空气小,难溶于水,用排空气法收集选用装置________,使用F收集时气体从________端进入(填“a”或“b”)。
(5)小曹老师带领学生进行上述实验时,发现“一同学不慎碰倒装满氧气的集气瓶,迅速扶起后,瓶中剩余的氧气仍能使带火星的木条复燃”;对此,小曹老师让该同学往集气瓶装入半瓶水,再用排水法收集3/4集气瓶的氧气,发现瓶中的氧气也能使带火星木条复燃。
①用如图方案收集“3/4集气瓶的氧气”,其中最合理的是________(填字母);
②所以用“使带火星木条复燃”检验集气瓶中充满氧气的方法________(填“可靠”“不可靠”)。
18.某学习小组利用如图1所示装置对氯酸钾制氧气进行探究学习。
资料:①KClO3的熔点约为356℃,MnO2在加热条件下不分解;②KClO3分解时,传感器得到氧气浓度随温度的变化示意图及使用不同催化剂时的固体残留率分别如图2和图3所示。
(1)由图2可知,KClO3分解温度________(填“高于”、“等于”或“低于”)其熔点。
(2)图2中A→B段氧气浓度逐渐降低的可能原因是________。
(3)分析图3可知,对KClO3分解催化效果更好的催化剂是________。
(4)为证实MnO2的催化作用,小组同学利用如图4装置进行如表所示的实验,请完成填表。
步骤 实验操作 实验现象
Ⅰ 检查装置气密性 (气密性良好)
Ⅱ 分别在“Y”形管两支管中加入少量MnO2和KClO3 , 塞紧橡皮塞,用带火星木条放在导管口 没有________
Ⅲ 分别先后加热MnO2和KClO3 , 用带火星木条放在导管口,加热________(填“左”或“右”)侧支管后,带火星木条复燃 ________
Ⅳ 冷却后,将“Y”形管左侧支管中部分MnO2混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口 ________
(5)步骤Ⅳ的实验现象不能说明MnO2是KClO3分解的催化剂,因为还需要证明________。
课题三 《制取氧气》 同步测试题
答案解析
一、单选题
1.【答案】 B
【解析】物理变化和化学变化的根本区别在于是否有新物质生成,如果有新物质生成,则属于化学变化;反之,则是物理变化。A、加热高锰酸钾制氧气,生成新的物质,属于化学变化,错误,B、分离液态空气制氧气是利用物质的沸点不同加以分离,没有生成新的物质,属于物理变化,正确,C、加热氯酸钾制氧气生成新的物质,属于化学变化,错误,D、绿色植物光合作用制氧气生成新的物质,属于化学变化,错误,故选B
2.【答案】 C
【解析】工业上用的大量氧气,主要使用分离液态空气法制取的,是利用了液态氮和液态氧沸点的不同,C符合题意。
故答案为:C。
【分析】根据工业制氧气利用各气体的沸点不同进行制取的分析
3.【答案】 A
【解析】工业上制取氧气利用了氧气和氮气的沸点不同从而分离液态空气的办法得到氧气.
故答案为:A.
【分析】根据工业制氧气是利用各气体成分的沸点不同分析
4.【答案】 D
【解析】A、催化剂能改变其他物质的化学反应速率,可以加快也可减慢某些化学反应的速率,说法不符合题意;
B、催化剂在化学反应前后质量和化学性质(而不是性质)不变,说法不符合题意;
C、一种催化剂可能催化多个反应例如过氧化氢分解、氯酸钾分解的催化剂都是二氧化锰,说法不符合题意;
D、一个化学反应可能存在多种催化剂,例如过氧化氢分解的催化剂可以是二氧化锰、氧化铁等,说法符合题意。
故答案为:D。
【分析】催化剂是能改变物质的反应速率,但是本身的质量和化学性质不变的物质,据此分析
5.【答案】 A
【解析】实验室高锰酸钾制取氧气的操作顺序是:组装好仪器后检查装置的气密性(查)、装药品(装)、固定仪器(定)、点燃酒精灯(点)、收集氧气(收)、撤离导管(离)、熄灭酒精灯(熄);
故答案为:A。
【分析】根据实验室高锰酸钾制取氧气的操作,进行分析。
6.【答案】 C
【解析】A、蒸发食盐水得食盐,没有新物质生成,属于物理变化,不符合题意。
B、分离液态空气得氧气,是利用了液态氮和液态氧沸点的不同,分离过程中没有新物质生成,属于物理变化,不符合题意。
C、过氧化氢在二氧化锰的催化作用下生成水和氧气,该反应符合“一变多”的特征,属于分解反应,符合题意。
D、蜡烛燃烧生成水和二氧化碳,该反应的反应物是两种,不符合“一变多”的特征,不属于分解反应,不符合题意。
故答案为:C。
【分析】分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”,据此进行分析判断即可.
7.【答案】 A
【解析】A、此图是加热高锰酸钾制氧气的发生装置图,注意试管口略向下倾斜,试管口处应放一团棉花防止高锰酸钾粉末进入导管,此装置图符合题意,故A符合题意;
B、收集氧气应用向上排空气法收集气体,注意导管要伸入到集气瓶底,此图中导管未伸入到集气瓶底部,故B不符合题意;
C、检验氧气是否集满,应使用的带火星的小木条放在集气瓶口,此图中小木条伸入到了集气瓶内部,故C不符合题意;
D、做铁丝在氧气中燃烧的实验时,注意要预先在瓶内放少许水或在瓶底铺上一些细沙,防止高温熔化物溅落使瓶底炸裂,此图中瓶底无细沙或水,故D不符合题意。
故答案为:A。
【分析】本题考查氧气的制取、收集、验满和验证性质的实验装置及操作步骤。
8.【答案】 D
【解析】A、没有塞紧橡皮塞,使氧气部分扩散到空中,收集的氧气减少,故A不符合题意;
B、没有及时更换集气瓶,使收集的氧气减少,故B不符合题意;
C、药品的量不足,会导致收集到的氧气量太少,故C不符合题意;
D、加热前已将集气瓶灌满水倒立于水槽中,不会造成生成的氧气减少,故D符合题意。
故答案为:D。
【分析】排水法收集气体的时候必须将集气瓶里装满水,倒立在水槽中;
9.【答案】 C
【解析】A. 过氧化氢溶液制氧气和用氯酸钾制氧气 ,都是一种物质生成多种物质的反应,属于分解反应,故A不符合题意;
B.过氧化氢溶液制氧气和用氯酸钾制氧气 ,都用二氧化锰作催化剂,故B不符合题意;
C.过氧化氢溶液制取氧气采用的是固液不加热制取气体的装置,氯酸钾和二氧化锰加热制取氧气采用的是固固加热制取气体的装置,故C符合题意
D.收集的都是氧气,因此收集装置一致,故D不符合题意
故答案为:C
【分析】A、根据反应的特点进行分析
B、根据反应的原理进行分析
C、根据反应物的状态和反应条件进行分析
D、根据气体的密度和水溶性分析
10.【答案】 C
【解析】A、用托盘天平称量药品时,先调节天平平衡,后称量,此选项不符合题意;
B、制备气体时,先检查装置的气密性,以防由于装置漏气而收集不到气体,然后装入药品,此选项不符合题意;
C、加入药品时,先加固体后加液体,所以双氧水制氧气的实验中,先加入二氧化锰,后加入双氧水,此选项符合题意;
D、给试管中的药品加热时,先对试管均匀加热,以防试管炸裂,后对准装药品的部位集中加热,此选项不符合题意。
故答案为:C。
【分析】A、根据天平的使用方法分析
B、根据制备气体的步骤进行分析
C、根据固液反应先固后液分析
D、根据给试管中药品加热的方法分析
11.【答案】 B
【解析】A、集气瓶中灌 体积的水,收集的氧气的体积约为 ,空气的体积约为 ,故A不符合题意;
B、集气瓶中灌 体积的水,收集的氧气的体积约为 ,空气的体积约为 ,故B符合题意;
C、导管伸入到集气瓶体积的 处,收集的氧气的体积小于 ,空气的体积大于 ,故C不符合题意;
D、导管伸入到集气瓶体积的 处,收集的氧气的体积小于 ,空气的体积大于 ,故D不符合题意;
故答案为:B。
【分析】氧气不易溶于水,用排水法收集,氧气密度比空气大,用向上排空气法收集。
12.【答案】 D
【解析】A、加热氯酸钾和高锰酸钾混合物一段时间后,氯酸钾和高锰酸钾都没有完全分解,剩余固体中有:高锰酸钾、锰酸钾、二氧化锰、氯酸钾、氯化钾5种物质,不符合题意。
B、加热氯酸钾和高锰酸钾混合物一段时间后,高锰酸钾未分解完全,氯酸钾分解完全,剩余固体中含有:高锰酸钾、锰酸钾、二氧化锰、氯化钾4中物质,不符合题意。
C、加热氯酸钾和高锰酸钾混合物一段时间后,高锰酸钾和氯酸钾都分解完全,剩余固体中含有:锰酸钾、二氧化锰、氯化钾3种,不符合题意。
D、加热氯酸钾和高锰酸钾混合物一段时间后,至少含有锰酸钾、二氧化锰、氯化钾3种,符合题意。
故答案为:D。
【分析】加热氯酸钾生成氯化钾和氧气,加热高锰酸钾生成锰酸钾、二氧化锰和氧气。加热氯酸钾和高锰酸钾混合物一段时间后,试管内剩余的固体不可能只有两种。
13.【答案】 D
【解析】A、氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,随着反应进行,固体质量减小,该选项对应关系不符合题意;
B、加热一段时间生成氧气,因此氧气质量是0,完全反应后氧气质量不再变化,该选项对应关系不符合题意;
C、过程中二氧化锰是催化剂,质量始终不变,该选项对应关系不符合题意;
D、加热一段时间后,氯酸钾反应生成氯化钾和氧气,完全反应后氯化钾质量不再变化,该选项对应关系符合题意。
故答案为:D。
【分析】根据氯酸钾在二氧化锰的催化下加热生成氯化钾和氧气进行分析
二、综合题
14.【答案】
(1)物理变化
(2)低
(3)有色
(4)混合物
(5)燃着的木条
(6)医疗急救(答案合理即可);作保护气(答案合理即可)
【解析】(1)工业制氧气,是利用氮、氧气的沸点不同。进行分离液态空气的方法,属于物理变化。
(2)从步骤②可以,看出,先分离出液态氮气,说明氮气的沸点比氧气的沸点低。
(3)液态的氧气是淡蓝色,所以步骤②剩余液体为有色的。
(4)储存在蓝色钢瓶里的“工业液氧”混合物,还含有少量的二氧化碳,稀有气体等。
(5)用燃着的木条可以区分空气、“工业液氧”和二氧化碳,燃烧现象不变时空气;剧烈燃烧的是液态氧气;熄灭的是二氧化碳。
(6)蓝色钢瓶中的液氧的用途如医疗急救,蒸发出的氮气的用途如作保护气。
【分析】根据工业上分离液态空气来制取氧气的方法,进行分析。
15.【答案】
(1)试管;酒精灯
(2)A;棉花
(3)二氧化锰;催化;能
(4)连续且比较均匀冒出时;正放;把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满
(5)c;b
(6)没有预热就直接加热;试管外壁有水
(7)装置漏气(或集气瓶未装满水)
【解析】(1)①是试管,常用作反应容器;②是酒精灯,常用作热源;(2)用高锰酸钾制取氧气时需要加热,应选用的发生装置是A装置。为了防止高锰酸钾进入导管,应该在试管口塞一团棉花;(3)若用过氧化氢制取氧气,还需要用到二氧化锰,在反应中起催化作用,能够加快过氧化氢的分解,另外高锰酸钾受热分解后的剩余物中含有二氧化锰,可以用作过氧化氢分解的催化剂;(4)用D装置收集氧气时,当气泡均匀且连续时开始收集,收集好后应将瓶子正放在桌面上,用C装置收集氧气时,判断该装置已收集满的方法是:把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满;(5)若用F装置收集该气体,则气体从c处导管进入,若要用水将瓶中氧气排出使用,水应从b处导管进入;(6)加热高锰酸钾制氧气的过程中,发现试管炸裂,很可能是没有预热就直接加热或者试管外部有水;(7)装置漏气、刚出现气泡就开始收集、收集前集气瓶中的水不满、氧气中含有较多的水蒸气,都能够导致收集的氧气不纯,用带火星的木条伸入集气瓶内时不会复燃。
故答案为:(1)试管;酒精灯(2)A;棉花(3)二氧化锰;催化;能(4)连续且比较均匀冒出时;正放;把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满;(5)c;b(6)没有预热就直接加热;试管外壁有水(7)装置漏气(或集气瓶未装满水)
【分析】(1)根据常用仪器的名称和用途分析解答
(2)根据高锰酸钾制氧气的反应物是固体,反应条件是加热,在试管口放一团棉花可以防止高锰酸钾进入导管解答
(3)根据实验室利用过氧化氢制氧气时用二氧化锰做催化剂,高锰酸钾加热能生成二氧化锰解答
(4)根据实验室制取氧气,用排水法收集氧气,当气泡均匀冒出时收集,收集满后,由于氧气的密度大于空气密度,正放在桌面上,氧气具有助燃性
(5)根据氧气密度比水小,不易溶于水解答
(6)根据玻璃是热的不良导体,受热不均匀会炸裂
(7)实验结束后,带火星的木条不复燃,可能的原因是装置漏气或未装满水
16.【答案】 高锰酸钾;二氧化锰;氧气;过氧化氢溶液;二氧化碳
【解析】D能使带火星的木条复燃,所以D是氧气,H是一种能使澄清石灰水变白色浑浊的气体,所以H是二氧化碳,G是木炭,在②的反应前后B的质量和化学性质都不改变,所以B是反应②的催化剂,通常状况下E为无色液体,E在催化剂B的作用下生成无色液体和氧气,结合实验室制取氧气的药品和方法可知,所以B是二氧化锰,E是过氧化氢,F就是水,A是一种暗紫色固体,A在加热的条件下生成二氧化锰、氧气和C,所以A是高锰酸钾,C就是锰酸钾,经过验证,推断正确。
由以上分析可知:A是高锰酸钾,B是二氧化锰,D是氧气,E是过氧化氢溶液,H是二氧化碳。
【分析】根据题中给出的信息结合实验室制取氧气的方法进行分析
三、实验探究题
17.【答案】
(1)酒精灯
(2)AD;;试管口放一团棉花;防止水倒吸使试管炸裂
(3)B;
(4)E或F;b
(5)G;不可靠
【解析】(1)仪器①的名称:酒精灯;
(2)实验室用氯酸钾在二氧化锰催化下加热生成锰酸钾和氧气,发生装置选A,氧气不易溶于水,也不与水反应,排水法收集到气体较为纯净,收集装置选D,可选用的装置组合为:AD;高锰酸钾加热生成锰酸钾、二氧化锰和氧气,该反应的文字表达式为: ;为了防止高锰酸钾被氧气冲入玻璃导管,还需在试管口放一团棉花,实验结束时应先把导管移出水面,后熄灭酒精灯,原因是防止水倒吸使试管炸裂;
(3)过氧化氢在二氧化锰催化下生成水和氧气,可选用的发生装置为B,该反应的文字表达式为: ;
(4)氢气密度比空气小,用排空气法选用装置E或F,使用F收集气体使,气体从b导管进,因为氢气的密度比空气小,空气从长导管a排出;
(5)① 用如图方案收集 集气瓶的氧气,其中最合理的是G,H不合理,是因为导管口在集气瓶口外,I不合理,是因为导管伸入集气瓶太长;
② 不纯净的氧气也能使带火星的木条复燃,所以用“使带火星的木条复燃”检验集气瓶中充满氧气的方法不可靠。
【分析】(2)根据实验室用氯酸钾制取氧气的反应原理,属于姑姑加热型反应,选择发生装置。
根据氧气的物理性质,选择收集装置。
根据高锰酸钾加热生成锰酸钾、二氧化锰和氧气,写出文字表达式。
(3)根据过氧化氢制取氧气的反应原理,属于固液常温型反应,选择发生装置。
(4)根据气体密度比空气小,使用F收集气体使,气体从短导管进,空气从长导管排出。
(5)纯净的氧气能使带火星的木条复燃。
18.【答案】
(1)高于
(2)温度升高,试管中气压增大,部分空气排出
(3)纳米二氧化锰
(4)明显现象;右;加加热左侧支管后,带火星木条不复燃,加热右侧支管,木条复燃;加热右侧支管后,带火星木条能复燃,加热时间短于步骤Ⅲ
(5)反应前后MnO2的质量和化学性质不变
【解析】(1)由图2可知,KClO3分解温度接近400℃高于其熔点356℃,故填:高于。(2)图2中A→B段氧气浓度逐渐降低的可能原因是温度升高,试管中气压增大,部分空气排出,故填:温度升高,试管中气压增大,部分空气排出。(3)纳米MnO2 , 200℃时,固体开始分解,而分析纯MnO2需要500℃才分解,分析图3可知,对KClO3分解催化效果更好的催化剂是纳米二氧化锰,故填:纳米二氧化锰。(4)氯酸钾在加热时才能生成氯化钾和氧气,在常温下不分解,二氧化锰不分解,故分别在“Y”形管两支管中加入少量MnO2和KClO3 , 二氧化锰和氯酸钾都不能生成氧气,塞紧橡皮塞,用带火星木条放在导管口无现象,故填:明显现象。(5)分别先后加热MnO2和KClO3 , 氯酸钾分解生成氯化钾和氧气,二氧化锰不能生成氧气,用带火星木条放在导管口,加热右侧支管后,带火星木条复燃左侧带火星木条不复燃,故填:右;加热左侧支管后,带火星木条不复燃,加热右侧支管,木条复燃。(6)将二氧化锰和氯酸钾混合后,二氧化锰是催化剂加快反应速率,加热右侧支管后,带火星木条很快复燃,加热时间短于步骤Ⅲ,故填:加热右侧支管后,带火星木条能复燃,加热时间短于步骤Ⅲ;(7)催化剂能改变反应速率,且质量和化学性质反应前后都不变,步骤Ⅳ的实验现象不能说明MnO2是KClO3分解的催化剂,因为还需要证明反应前后MnO2的质量和化学性质不变,故填:反应前后MnO2的质量和化学性质不变。
【分析】(1)根据图像2进行分析
(2)根据温度升高,气压增大分析
(3)根据催化需要的温度进行分析
(4)根据固体溶解和反应生成气体都能使装置内的气压增大分析
(5)根据催化剂的概念分析
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
