1.3.2 氧化剂和还原剂 课件(共25张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2 氧化剂和还原剂 课件(共25张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 21.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-14 20:27:07 | ||
图片预览






文档简介
(共25张PPT)
第一章 物质的分类及转化
第三节 氧化还原反应(第二课时)
氧化剂和还原剂
1.认识氧化剂(氧化性)、还原剂(还原性)等基本概念。
2.了解常见的氧化剂、还原剂。
3.会比较物质氧化性或还原性的强弱。
4.了解氧化还原反应在生活、生产中的应用。
学习目标
课前复习
1.在反应 MnO2 + 4HCl MnCl2 + 2H2O + Cl2↑中,_____元素化合价升高,被_______(填“氧化”或“还原”),发生____(填“氧化”或“还原”)反应;
______元素化合价降低,被_________ (填“氧化”或“还原”),发生_________(填“氧化”或“还原”)反应。
2.下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失或偏移
CuO + H2 Cu + H2O
得电子,化合价降低,被还原(发生还原反应)
失电子,化合价升高,被氧化(发生氧化反应)
氧化剂
还原剂
还原产物
氧化产物
试一试
用双线桥法,找出氧化剂和还原剂
口决:升失氧化还原剂 降得还原氧化剂
一、氧化剂和还原剂概念
1.概念
(1)还原剂:在反应中失去电子(或化合价升高)的物质
(2)氧化剂:在反应中得到电子(或化合价降低)的物质
(3)氧化性:指得电子的能力,得电子能力越强,氧化性越强
具有氧化性的物质发生反应有元素化合价降低。
(4)还原性:指失电子的能力,失电子能力越强,还原性越强
具有还原性的物质发生反应有元素化合价升高。
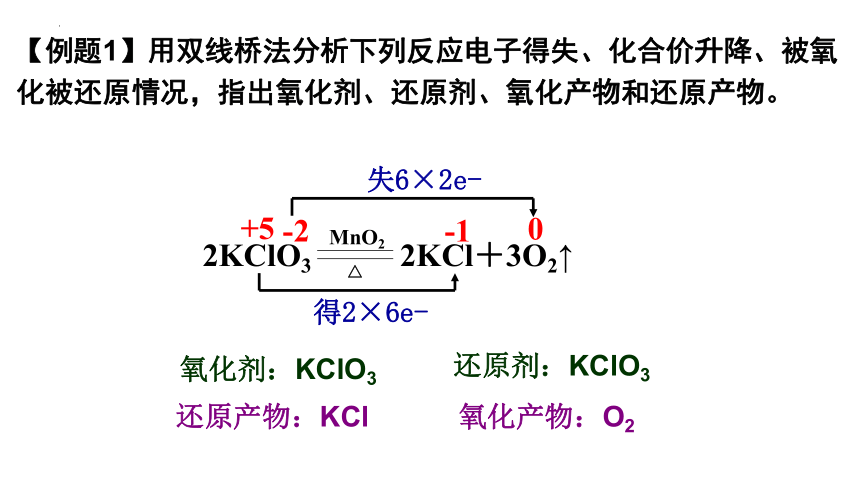
【例题1】用双线桥法分析下列反应电子得失、化合价升降、被氧化被还原情况,指出氧化剂、还原剂、氧化产物和还原产物。
-2
-1
0
+5
得2×6e-
失6×2e-
氧化剂:KClO3
还原产物:KCl
还原剂:KClO3
氧化产物:O2
2KClO3 2KCl+3O2↑
MnO2
△
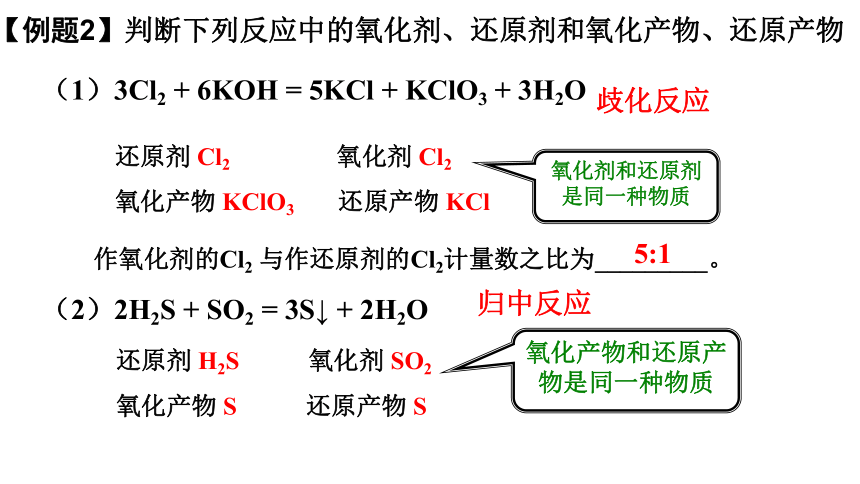
(1)3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
还原剂 Cl2 氧化剂 Cl2
氧化产物 KClO3 还原产物 KCl
氧化剂和还原剂是同一种物质
歧化反应
还原剂 H2S 氧化剂 SO2
氧化产物 S 还原产物 S
(2)2H2S + SO2 = 3S↓ + 2H2O
氧化产物和还原产物是同一种物质
归中反应
【例题2】判断下列反应中的氧化剂、还原剂和氧化产物、还原产物
作氧化剂的Cl2 与作还原剂的Cl2计量数之比为_________。
5:1
2、单线桥法(表示电子转移情况)
标出变价元素的化合价。
反应物中,失去电子的原子指向得到电子的原子,
即化合价升高的元素指向化合价降低 的元素。
写出转移的电子总数,用ne-表示,不写“得到”“失去”。
标价态
连单线
写总数
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0 +1 -1
1e-
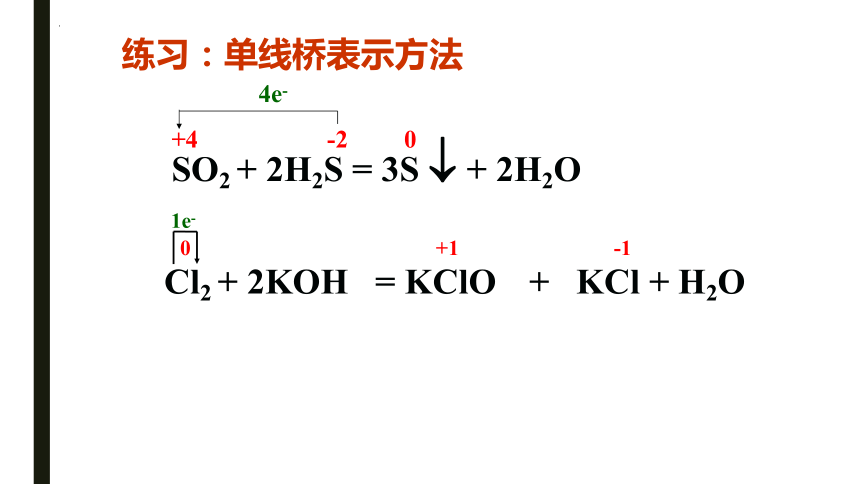
SO2 + 2H2S = 3S + 2H2O
+4 -2 0
4e-
练习:单线桥表示方法
Cl2 + 2KOH = KClO + KCl + H2O
【思考1】如何判断某物质在氧化还原反应中是做氧化剂是还原剂?
中心元素具有降价趋势的物质常做氧化剂
中心元素具有升价趋势的物质常做还原剂
确定中心元素
了解中心元素常见价态
判断中心元素变价趋势
含锰元素的常见物质:Mn、 MnCl2、MnO2、K2MnO4、 KMnO4
0
+2
+4
+7
+6
容易变价的元素
为什么KMnO4做氧化剂?
+7
二、判断物质氧化性、还原性
【思考2】 H2S、 S、SO2 和浓H2SO4各自体现什么性质呢?
化合价
0
+4
+6
-2
浓H2SO4
SO2
S
H2S
只有氧化性
只有还原性
既有氧化性
又有还原性
结论:元素处于最高价态时,只有氧化性;
元素处于中间价态时,既有氧化性又有还原性;
元素处于最低价态时,只有还原性;
即”高价氧,低价还,中间价态两边转“
1.根据元素价态判断物质的氧化性、还原性强弱
(1) H2O2 + H2S 2 H2O +S ↓
(2) H2O2 + Cl2 HCl + O2
(3)2H2O2 2 H2O + O2 ↑
氧化剂
还原剂
既做氧化剂
又做还原剂
-1
-2
-2
0
-1
-1
0
0
-1
0
-2
Δ
【例题3】 从氧化剂还原剂的角度,分析下列三个反应中H2O2的作用
常见的还原剂(含最低价态的物质只有还原性)
(1)活泼金属单质:K Ca Na Mg Al Zn Fe
(2)某些非金属单质:H2 C
(3)较低价态的化合物:H2S NH3 KI CO SO2 H2SO3
(4)较低价态的离子:I- S2- SO32-
常见的氧化剂(含最高价态的物质只有氧化性)
(1)活泼非金属单质:Cl2 O2
浓H2SO4 HNO3 KClO3
(2)含有高价态的物质
Fe3+ Cu2+ MnO4-
(3)含有中间价态的化合物: HClO H2O2 Na2O2
【练习1】下列微粒中,只有氧化性的是( )
①S2- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg
A.①⑦ B.②④ C.③⑤⑥ D.②④⑤⑥
C
【练习2】在Fe3+、Fe2+、Al3+、H+、S、Zn、Cl-等粒子中只有氧化性的是_______ ___,只有还原性的是____________,兼有氧化性和还原性的是____________________。
【归纳整理】元素常见化合价:
Fe:0, +2, +3 S:-2, 0 ,+4, +6 H:0 ,+1
Al:0 ,+3 Cl:-1 ,0, +1, +5, +7
2、物质氧化性、还原性相对强弱的比较:
(1)根据氧化化学方程式比较
Zn + CuSO4 = Cu + ZnSO4
在同一个氧化还原反应中:
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
Zn + FeSO4 = Fe + ZnSO4
Fe + CuSO4 = Cu + FeSO4
还原剂
氧化剂
还原剂
氧化剂
氧化产物
氧化产物
还原产物
还原产物
还原性:
Zn > Fe > Cu
氧化性: Zn2+将足量的锌加入到含Fe2+、 Cu2+混合溶液中,则会发生什么反应?
(2)根据金属活动性顺序比较
金属单质的还原性越强,对应阳离子的氧化性越弱。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ (Fe3+) Hg2+ Ag+
氧化性逐渐增强
(3)根据生成物中元素价态高低比较
①相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
氧化性:Cl2>S
②相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。
(3)根据生成物中元素价态高低比较
还原性:Zn>Cu
规律:反应的条件越简单,反应就越容易发生,
对应物质的氧化性(或还原性)越强。
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
O2 + 4HCl(浓) 2Cl2+2H2O
氧化性:_____________________________
△
△
KMnO4>MnO2>O2
催化剂
(4)根据氧化还原反应条件的难易判断
(5)依据影响因素判断
(1)浓度:同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;
还原性:浓HCl>稀HCl。
(2)温度:同一种物质,温度越高其氧化性越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
(3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化(还原)性越强。
氧化性:KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
红酒中添加SO2具有抗氧化的作用
食品包装中的脱氧剂——还原铁粉
三、氧化还原反应的存在应用
1.有利于人类生活和生产:金属的冶炼、电镀、燃料的燃烧等。
2.对人类生活和生产不利: 、 、
易燃物的自燃
食物的腐败
钢铁的锈蚀
【思考与讨论】
第一章 物质的分类及转化
第三节 氧化还原反应(第二课时)
氧化剂和还原剂
1.认识氧化剂(氧化性)、还原剂(还原性)等基本概念。
2.了解常见的氧化剂、还原剂。
3.会比较物质氧化性或还原性的强弱。
4.了解氧化还原反应在生活、生产中的应用。
学习目标
课前复习
1.在反应 MnO2 + 4HCl MnCl2 + 2H2O + Cl2↑中,_____元素化合价升高,被_______(填“氧化”或“还原”),发生____(填“氧化”或“还原”)反应;
______元素化合价降低,被_________ (填“氧化”或“还原”),发生_________(填“氧化”或“还原”)反应。
2.下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失或偏移
CuO + H2 Cu + H2O
得电子,化合价降低,被还原(发生还原反应)
失电子,化合价升高,被氧化(发生氧化反应)
氧化剂
还原剂
还原产物
氧化产物
试一试
用双线桥法,找出氧化剂和还原剂
口决:升失氧化还原剂 降得还原氧化剂
一、氧化剂和还原剂概念
1.概念
(1)还原剂:在反应中失去电子(或化合价升高)的物质
(2)氧化剂:在反应中得到电子(或化合价降低)的物质
(3)氧化性:指得电子的能力,得电子能力越强,氧化性越强
具有氧化性的物质发生反应有元素化合价降低。
(4)还原性:指失电子的能力,失电子能力越强,还原性越强
具有还原性的物质发生反应有元素化合价升高。
【例题1】用双线桥法分析下列反应电子得失、化合价升降、被氧化被还原情况,指出氧化剂、还原剂、氧化产物和还原产物。
-2
-1
0
+5
得2×6e-
失6×2e-
氧化剂:KClO3
还原产物:KCl
还原剂:KClO3
氧化产物:O2
2KClO3 2KCl+3O2↑
MnO2
△
(1)3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
还原剂 Cl2 氧化剂 Cl2
氧化产物 KClO3 还原产物 KCl
氧化剂和还原剂是同一种物质
歧化反应
还原剂 H2S 氧化剂 SO2
氧化产物 S 还原产物 S
(2)2H2S + SO2 = 3S↓ + 2H2O
氧化产物和还原产物是同一种物质
归中反应
【例题2】判断下列反应中的氧化剂、还原剂和氧化产物、还原产物
作氧化剂的Cl2 与作还原剂的Cl2计量数之比为_________。
5:1
2、单线桥法(表示电子转移情况)
标出变价元素的化合价。
反应物中,失去电子的原子指向得到电子的原子,
即化合价升高的元素指向化合价降低 的元素。
写出转移的电子总数,用ne-表示,不写“得到”“失去”。
标价态
连单线
写总数
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0 +1 -1
1e-
SO2 + 2H2S = 3S + 2H2O
+4 -2 0
4e-
练习:单线桥表示方法
Cl2 + 2KOH = KClO + KCl + H2O
【思考1】如何判断某物质在氧化还原反应中是做氧化剂是还原剂?
中心元素具有降价趋势的物质常做氧化剂
中心元素具有升价趋势的物质常做还原剂
确定中心元素
了解中心元素常见价态
判断中心元素变价趋势
含锰元素的常见物质:Mn、 MnCl2、MnO2、K2MnO4、 KMnO4
0
+2
+4
+7
+6
容易变价的元素
为什么KMnO4做氧化剂?
+7
二、判断物质氧化性、还原性
【思考2】 H2S、 S、SO2 和浓H2SO4各自体现什么性质呢?
化合价
0
+4
+6
-2
浓H2SO4
SO2
S
H2S
只有氧化性
只有还原性
既有氧化性
又有还原性
结论:元素处于最高价态时,只有氧化性;
元素处于中间价态时,既有氧化性又有还原性;
元素处于最低价态时,只有还原性;
即”高价氧,低价还,中间价态两边转“
1.根据元素价态判断物质的氧化性、还原性强弱
(1) H2O2 + H2S 2 H2O +S ↓
(2) H2O2 + Cl2 HCl + O2
(3)2H2O2 2 H2O + O2 ↑
氧化剂
还原剂
既做氧化剂
又做还原剂
-1
-2
-2
0
-1
-1
0
0
-1
0
-2
Δ
【例题3】 从氧化剂还原剂的角度,分析下列三个反应中H2O2的作用
常见的还原剂(含最低价态的物质只有还原性)
(1)活泼金属单质:K Ca Na Mg Al Zn Fe
(2)某些非金属单质:H2 C
(3)较低价态的化合物:H2S NH3 KI CO SO2 H2SO3
(4)较低价态的离子:I- S2- SO32-
常见的氧化剂(含最高价态的物质只有氧化性)
(1)活泼非金属单质:Cl2 O2
浓H2SO4 HNO3 KClO3
(2)含有高价态的物质
Fe3+ Cu2+ MnO4-
(3)含有中间价态的化合物: HClO H2O2 Na2O2
【练习1】下列微粒中,只有氧化性的是( )
①S2- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg
A.①⑦ B.②④ C.③⑤⑥ D.②④⑤⑥
C
【练习2】在Fe3+、Fe2+、Al3+、H+、S、Zn、Cl-等粒子中只有氧化性的是_______ ___,只有还原性的是____________,兼有氧化性和还原性的是____________________。
【归纳整理】元素常见化合价:
Fe:0, +2, +3 S:-2, 0 ,+4, +6 H:0 ,+1
Al:0 ,+3 Cl:-1 ,0, +1, +5, +7
2、物质氧化性、还原性相对强弱的比较:
(1)根据氧化化学方程式比较
Zn + CuSO4 = Cu + ZnSO4
在同一个氧化还原反应中:
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
Zn + FeSO4 = Fe + ZnSO4
Fe + CuSO4 = Cu + FeSO4
还原剂
氧化剂
还原剂
氧化剂
氧化产物
氧化产物
还原产物
还原产物
还原性:
Zn > Fe > Cu
氧化性: Zn2+
(2)根据金属活动性顺序比较
金属单质的还原性越强,对应阳离子的氧化性越弱。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ (Fe3+) Hg2+ Ag+
氧化性逐渐增强
(3)根据生成物中元素价态高低比较
①相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
氧化性:Cl2>S
②相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。
(3)根据生成物中元素价态高低比较
还原性:Zn>Cu
规律:反应的条件越简单,反应就越容易发生,
对应物质的氧化性(或还原性)越强。
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
O2 + 4HCl(浓) 2Cl2+2H2O
氧化性:_____________________________
△
△
KMnO4>MnO2>O2
催化剂
(4)根据氧化还原反应条件的难易判断
(5)依据影响因素判断
(1)浓度:同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;
还原性:浓HCl>稀HCl。
(2)温度:同一种物质,温度越高其氧化性越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
(3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化(还原)性越强。
氧化性:KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
红酒中添加SO2具有抗氧化的作用
食品包装中的脱氧剂——还原铁粉
三、氧化还原反应的存在应用
1.有利于人类生活和生产:金属的冶炼、电镀、燃料的燃烧等。
2.对人类生活和生产不利: 、 、
易燃物的自燃
食物的腐败
钢铁的锈蚀
【思考与讨论】
