2.3.1人类认识原子结构的历程 原子核的构成 课件(共53张PPT)高中化学苏教版必修第一册
文档属性
| 名称 | 2.3.1人类认识原子结构的历程 原子核的构成 课件(共53张PPT)高中化学苏教版必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-15 21:22:40 | ||
图片预览







文档简介
(共53张PPT)
第三单元 人类对原子结构的认识
第1课时 人类认识原子结构的历程 原子核的构成
课标定位素养阐释
1.从宏观和微观的角度理解原子结构提出的证据,初步形成模型建构的认知方式。
2.从微观角度对原子结构的构成微粒进行认识,能够说出元素、核素、同位素的区别和联系,会表示特定数目质子数、质量数的原子。
3.能够利用质量数、质子数和中子数的数量关系进行简单的计算,从定量角度认识构成原子的微粒间的数量关系。
4.能说出常见同位素在医疗、科技等领域的用途。
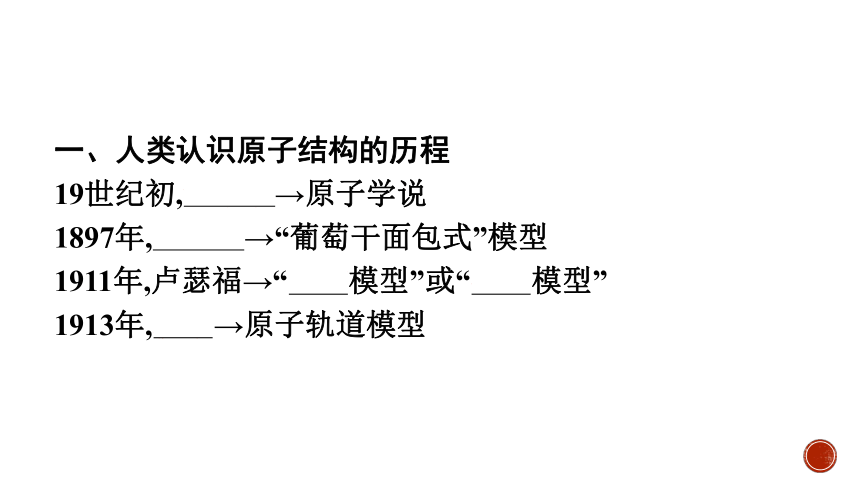
一、人类认识原子结构的历程
19世纪初,道尔顿→原子学说
1897年,汤姆生→“葡萄干面包式”模型
1911年,卢瑟福→“有核模型”或“行星模型”
1913年,玻尔→原子轨道模型
二、原子的构成及质量数
1.原子的构成。
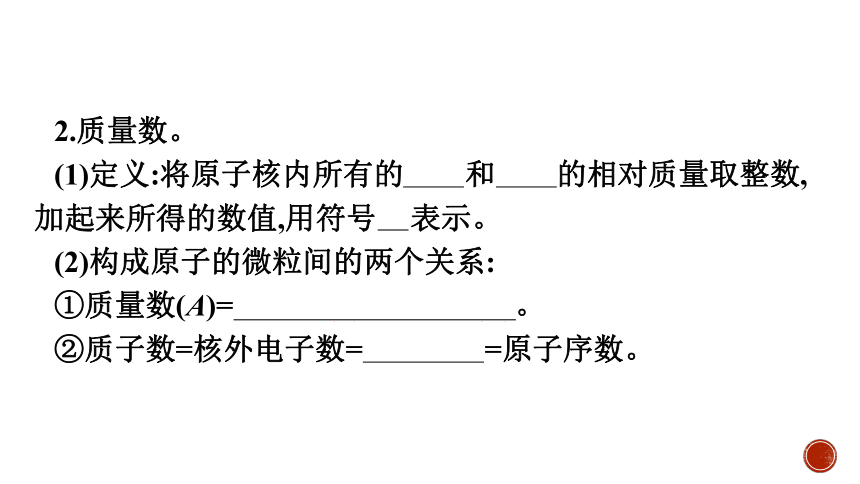
2.质量数。
(1)定义:将原子核内所有的质子和中子的相对质量取整数,加起来所得的数值,用符号 A 表示。
(2)构成原子的微粒间的两个关系:
①质量数(A)=质子数(Z)+中子数(N)。
②质子数=核外电子数=核电荷数=原子序数。
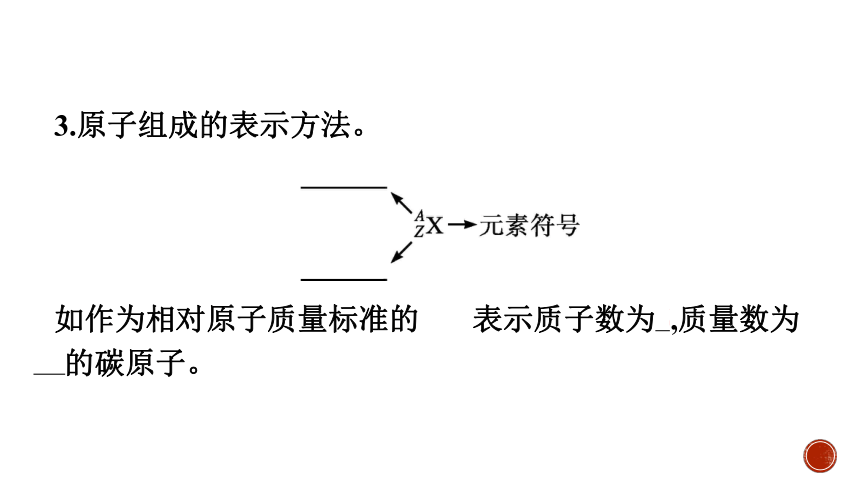
3.原子组成的表示方法。
如作为相对原子质量标准的 表示质子数为6,质量数为12的碳原子。
三、核素及同位素
1.核素。
(1)定义:具有一定质子数和一定中子数的一种原子称为一种核素。
(2)实例:
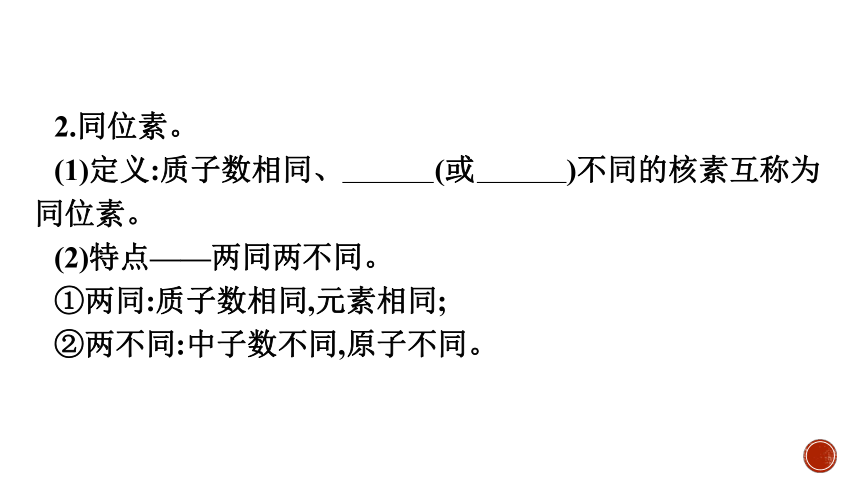
2.同位素。
(1)定义:质子数相同、质量数(或中子数)不同的核素互称为同位素。
(2)特点——两同两不同。
①两同:质子数相同,元素相同;
②两不同:中子数不同,原子不同。
(3)用途:
③放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
【自主思考1】 原子是化学变化中的最小微粒,原子由质子、中子、电子等基本粒子构成。那么,基本粒子可不可以再分呢
提示:可以。科学家研究证明:质子、中子由更小的夸克构成。
【自主思考2】 任何原子都是由质子、中子和电子构成的吗
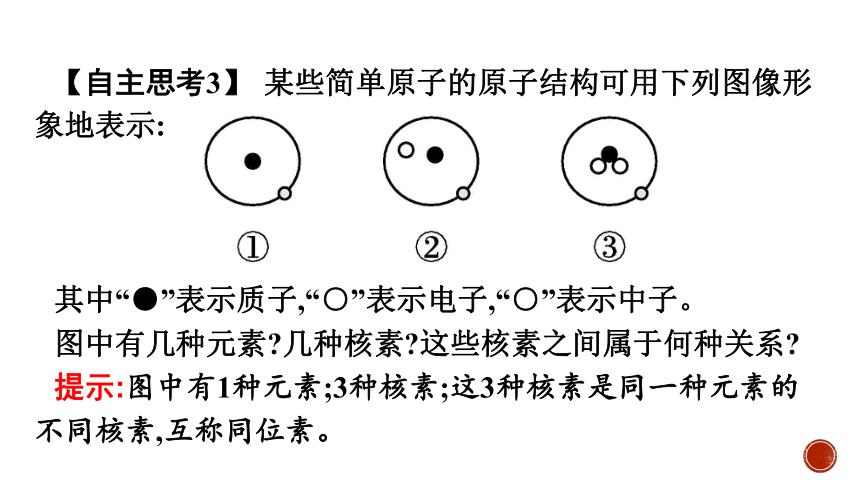
【自主思考3】 某些简单原子的原子结构可用下列图像形象地表示:
其中“●”表示质子,“○”表示电子,“○”表示中子。
图中有几种元素 几种核素 这些核素之间属于何种关系
提示:图中有1种元素;3种核素;这3种核素是同一种元素的不同核素,互称同位素。
【自主思考4】 原子的质量数与其相对原子质量有何不同
提示:质量数忽略了电子的质量,将质子与中子的相对质量均取近似整数值相加而得,它一定是整数,一般等于质子数与中子数之和;而相对原子质量是整个原子的质量(包括电子、质子、中子的质量)与一个12C原子质量的 相比而得到的数值,它没有忽略电子的质量,而且质子和中子的质量也没有取整数值,所以相对原子质量一般不是整数。如16O的质量数为16,相对原子质量为15.994。由于原子的质量数与其相对原子质量极为接近,因此在近似计算时,质量数≈原子的相对原子质量。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)道尔顿的原子学说、汤姆生的“葡萄干面包式”原子结构模型均是不完善的,对科学发展毫无意义。( )
(2)原子核中质子带正电,中子不带电,核外电子带负电,原子呈电中性。( )
(3)所有原子均有质子、中子和电子。( )
×
√
×
×
(5)质子数相同而中子数不同的微粒互称同位素。( )
×
√
(1)表示核素的符号共 种。
(2)互为同位素的是 和 。
(3)中子数相等,但质子数不相等的核素是 和 。
问题引领
在1911年前后,物理学家卢瑟福把一束
高速运动的α粒子(质量数为4的带2个单
位正电荷的质子粒)射向一片极薄的金
箔。他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔竟能让大多数α粒子畅通无阻地通过,就像金箔不在那儿似的。但也有极少数的α粒子发生偏转,或被笔直地弹回。
探究任务1 原子结构模型的演变
1.根据以上实验现象能得出关于金箔中Au原子结构的一些结论。试写出其中的三点。
提示:(1)金原子不是“实心球”,原子中存在原子核,它占原子中极小的体积;
(2)金原子核带正电荷,且电荷数远大于α粒子;
(3)金的原子核质量远大于α粒子。
2.通过上述研究,你对教材中道尔顿提出的“物质由原子组成,原子不能被创造,也不能被毁灭,它们在化学变化中不可再分割。”这些观点有什么看法
提示:物质不是都由原子构成的,原子还可以再分,在化学变化中原子既不能被创造也不能被消灭,只是分子分裂为原子,原子再重新组成新的分子的过程。
3.通过对原子结构模型的演变的历史过程的认识,你有什么启示
提示:原子结构模型的演变过程反映了科学家具有质疑、创新、求实等良好的科学品质,随着现代科学技术的发展,人类对原子的认识还会不断深化。科学探究是漫长、艰辛的过程,科学的发展总是在不断纠错中前进,科学的发展是永无止境的。(合理即可)
归纳提升
原子结构模型的演变:
典型例题
【例题1】 人类对原子结构的认识经历了漫长的历史阶段。下列实验事实与原子结构模型建立的关系正确的是( )。
A.电子的发现:道尔顿的原子结构模型
B.α粒子散射:卢瑟福原子结构模型
C.α粒子散射:玻尔原子结构模型
D.氢原子光谱:卢瑟福原子结构模型
答案:B
解析:道尔顿的原子结构模型是道尔顿通过对大气的物理性质进行研究而提出的;卢瑟福原子结构模型是通过α粒子散射实验提出的;玻尔原子结构模型是玻尔在牛顿力学的基础上吸收了量子论和光子学说的思想建立起来的。
【变式训练1】 关于原子模型的演变过程,下列说法正确的是( )。
A.汤姆生原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型
B.汤姆生原子模型→卢瑟福原子模型→玻尔原子模型→道尔顿原子模型
C.道尔顿原子模型→卢瑟福原子模型→汤姆生原子模型→玻尔原子模型
D.道尔顿原子模型→汤姆生原子模型→卢瑟福原子模型→玻尔原子模型
答案:D
解析:本题考查原子模型的演变过程。原子模型的演变过程是:道尔顿原子模型、汤姆生原子模型、卢瑟福原子模型、玻尔原子模型。
问题引领
原子是由原子核和核外电子所构成的,那原子核可不可以再分呢 大多数原子的原子核由质子和中子构成,下表列出了一个原子中电子、质子和中子间的质量和电性关系:
探究任务2 原子核的构成
表 质子、中子和电子的质量和带电荷量
1.原子的质量主要由哪些微粒决定
提示:质子和中子。原子由原子核和核外电子构成,电子的质量非常小,往往忽略不计,所以原子质量主要集中在原子核上,原子核由质子和中子构成。
2.对于原子、阴离子、阳离子来说,核外电子数与质子数有什么关系
提示:①原子中:质子数=核电荷数=核外电子数。
②阳离子中:质子数=核电荷数=核外电子数+离子所带电荷数。
③阴离子中:质子数=核电荷数=核外电子数-离子所带电荷数。
归纳提升
1.构成原子的微粒。
2.有关微粒间的关系。
(1)质量关系。
①质量数(A)=质子数(Z)+中子数(N)。
②原子的相对原子质量近似等于质量数。
(2)电性关系。
①电中性微粒(原子或分子):
核电荷数=核内质子数=核外电子数。
②带电离子。质子数≠电子数,具体如下表:
(3)数量关系。
原子序数=质子数。
典型例题
【例题2】 已知R2+核外有a个电子,核内有b个中子。下列能正确表示R的原子符号的是( )。
答案:C
解析:R2+核外有a个电子,因此R原子核外有a+2个电子,R原子的核外电子数、质子数、核电荷数均为a+2,其质量数为中子数与质子数之和,即a+b+2。
注意:利用A=N+Z(A为质量数,N为中子数,Z为质子数)关系式,当已知其中的两项时可以求第三项,当为离子时要注意Z为质子数,与核外电子数不同;中子数与质子数(或核外电子数)之差=A-2Z。
【变式训练2】 某元素的一个原子形成的离子可表示为 ,下列说法正确的是( )。
答案:D
解析:A项,中子数应为b-a;B项,电子数应为a+n;C项,质量数应为b。
问题引领
14C断代技术在考古学中是一种最常见并且是应用最广泛的确定文物年代的技术,因为考古所发现的物品一般都含有碳,所以人们设法利用样品中所含有的碳的有关性质来探测它们的年龄。由于取样过程简单,对埋藏条件的限制少,并且出土后若干年的文物都可以利用14C断代技术进行分析,所以此技术得以推广。
探究任务3 元素、核素、同位素的辨析
1.14C的常见同位素是什么 它们有哪些异同点
提示: 12C、13C;质子数相同,中子数不同,质量数不同,物理性质不同,化学性质相似。
2.质子数相同而中子数不同的微粒一定是同位素吗
提示:不一定,如 和H2O中质子数相同,中子数不同,但两者不是同位素。
归纳提升
典型例题
【例题3】 现有下列基本微粒:1H、2H、3H、1H+、234U、
235U、238U、40K、40Ca、Cl2、14N、14C,请回答下列问题:
(1)其中,它们分属 种元素,属于氢元素的核素有
种,属于铀元素的核素有 种。互为同位素的原子分别为 , 。
(2)质量数相等的微粒为 , , (可不填满,也可补充)。
(3)氢的同位素1H、2H、3H与氧的同位素16O、17O、18O相互结合为水,可得水分子的种数为 ;可得相对分子质量不同的水分子种数为 。
答案:(1)7 3 3 1H、2H、3H 234U、235U、238U
(2)40K、40Ca 14N、14C 1H、1H+
(3)18 7
解析:(1)本题列出的12种微粒分属H、U、K、Ca、Cl、N、C 7种元素,1H和1H+是同一种核素的不同微粒,1H、2H、3H属于氢元素的3种不同核素,且互为同位素。234U、235U、238U属于铀元素的3种不同核素,也互为同位素。
(2)本小题是“质量数相等的微粒”,而非“质量数相等的原子”,否则,“1H和1H+”不为答案。
(3)氢的同位素与氧的同位素16O形成的H2O有以下6种:1H1H16O、2H2H16O、3H3H16O、1H2H16O、1H3H16O、
2H3H16O。把16O换为17O、18O又各有6种,故总共有18种水分子。所得18种水分子中,相对分子质量最小的为
量为19、20、21、22、23的5种水分子,故共有7种相对分子质量不同的水分子。
注意: 同位素、核素概念理解的易错点:
(1)一种元素可能有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。
(3)不同核素之间转化时原子核发生变化,因此不属于化学变化。
【变式训练3】 (双选)下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )。
A.体积相等时密度不相等
B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的质子数相等
答案:AC
解析:由于12C18O和14N2的相对分子质量不相等,故同温同压下体积相等的两种气体的质量不相等,因此密度不相等,A项正确;1个12C18O分子中有16个中子,1个14N2分子中含有14个中子,二者均为双原子分子,原子数相等时分子数相等,但中子数不相等,B项错误;12C18O和14N2均为14电子分子,同温同压下,体积相等时分子数相等,所具有的电子数相等,C项正确; 12C18O和14N2分子中均有14个质子,由于二者的相对分子质量不相等,故等质量的两种分子所具有的质子数不相等,D项错误。
第三单元 人类对原子结构的认识
第1课时 人类认识原子结构的历程 原子核的构成
课标定位素养阐释
1.从宏观和微观的角度理解原子结构提出的证据,初步形成模型建构的认知方式。
2.从微观角度对原子结构的构成微粒进行认识,能够说出元素、核素、同位素的区别和联系,会表示特定数目质子数、质量数的原子。
3.能够利用质量数、质子数和中子数的数量关系进行简单的计算,从定量角度认识构成原子的微粒间的数量关系。
4.能说出常见同位素在医疗、科技等领域的用途。
一、人类认识原子结构的历程
19世纪初,道尔顿→原子学说
1897年,汤姆生→“葡萄干面包式”模型
1911年,卢瑟福→“有核模型”或“行星模型”
1913年,玻尔→原子轨道模型
二、原子的构成及质量数
1.原子的构成。
2.质量数。
(1)定义:将原子核内所有的质子和中子的相对质量取整数,加起来所得的数值,用符号 A 表示。
(2)构成原子的微粒间的两个关系:
①质量数(A)=质子数(Z)+中子数(N)。
②质子数=核外电子数=核电荷数=原子序数。
3.原子组成的表示方法。
如作为相对原子质量标准的 表示质子数为6,质量数为12的碳原子。
三、核素及同位素
1.核素。
(1)定义:具有一定质子数和一定中子数的一种原子称为一种核素。
(2)实例:
2.同位素。
(1)定义:质子数相同、质量数(或中子数)不同的核素互称为同位素。
(2)特点——两同两不同。
①两同:质子数相同,元素相同;
②两不同:中子数不同,原子不同。
(3)用途:
③放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
【自主思考1】 原子是化学变化中的最小微粒,原子由质子、中子、电子等基本粒子构成。那么,基本粒子可不可以再分呢
提示:可以。科学家研究证明:质子、中子由更小的夸克构成。
【自主思考2】 任何原子都是由质子、中子和电子构成的吗
【自主思考3】 某些简单原子的原子结构可用下列图像形象地表示:
其中“●”表示质子,“○”表示电子,“○”表示中子。
图中有几种元素 几种核素 这些核素之间属于何种关系
提示:图中有1种元素;3种核素;这3种核素是同一种元素的不同核素,互称同位素。
【自主思考4】 原子的质量数与其相对原子质量有何不同
提示:质量数忽略了电子的质量,将质子与中子的相对质量均取近似整数值相加而得,它一定是整数,一般等于质子数与中子数之和;而相对原子质量是整个原子的质量(包括电子、质子、中子的质量)与一个12C原子质量的 相比而得到的数值,它没有忽略电子的质量,而且质子和中子的质量也没有取整数值,所以相对原子质量一般不是整数。如16O的质量数为16,相对原子质量为15.994。由于原子的质量数与其相对原子质量极为接近,因此在近似计算时,质量数≈原子的相对原子质量。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)道尔顿的原子学说、汤姆生的“葡萄干面包式”原子结构模型均是不完善的,对科学发展毫无意义。( )
(2)原子核中质子带正电,中子不带电,核外电子带负电,原子呈电中性。( )
(3)所有原子均有质子、中子和电子。( )
×
√
×
×
(5)质子数相同而中子数不同的微粒互称同位素。( )
×
√
(1)表示核素的符号共 种。
(2)互为同位素的是 和 。
(3)中子数相等,但质子数不相等的核素是 和 。
问题引领
在1911年前后,物理学家卢瑟福把一束
高速运动的α粒子(质量数为4的带2个单
位正电荷的质子粒)射向一片极薄的金
箔。他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔竟能让大多数α粒子畅通无阻地通过,就像金箔不在那儿似的。但也有极少数的α粒子发生偏转,或被笔直地弹回。
探究任务1 原子结构模型的演变
1.根据以上实验现象能得出关于金箔中Au原子结构的一些结论。试写出其中的三点。
提示:(1)金原子不是“实心球”,原子中存在原子核,它占原子中极小的体积;
(2)金原子核带正电荷,且电荷数远大于α粒子;
(3)金的原子核质量远大于α粒子。
2.通过上述研究,你对教材中道尔顿提出的“物质由原子组成,原子不能被创造,也不能被毁灭,它们在化学变化中不可再分割。”这些观点有什么看法
提示:物质不是都由原子构成的,原子还可以再分,在化学变化中原子既不能被创造也不能被消灭,只是分子分裂为原子,原子再重新组成新的分子的过程。
3.通过对原子结构模型的演变的历史过程的认识,你有什么启示
提示:原子结构模型的演变过程反映了科学家具有质疑、创新、求实等良好的科学品质,随着现代科学技术的发展,人类对原子的认识还会不断深化。科学探究是漫长、艰辛的过程,科学的发展总是在不断纠错中前进,科学的发展是永无止境的。(合理即可)
归纳提升
原子结构模型的演变:
典型例题
【例题1】 人类对原子结构的认识经历了漫长的历史阶段。下列实验事实与原子结构模型建立的关系正确的是( )。
A.电子的发现:道尔顿的原子结构模型
B.α粒子散射:卢瑟福原子结构模型
C.α粒子散射:玻尔原子结构模型
D.氢原子光谱:卢瑟福原子结构模型
答案:B
解析:道尔顿的原子结构模型是道尔顿通过对大气的物理性质进行研究而提出的;卢瑟福原子结构模型是通过α粒子散射实验提出的;玻尔原子结构模型是玻尔在牛顿力学的基础上吸收了量子论和光子学说的思想建立起来的。
【变式训练1】 关于原子模型的演变过程,下列说法正确的是( )。
A.汤姆生原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型
B.汤姆生原子模型→卢瑟福原子模型→玻尔原子模型→道尔顿原子模型
C.道尔顿原子模型→卢瑟福原子模型→汤姆生原子模型→玻尔原子模型
D.道尔顿原子模型→汤姆生原子模型→卢瑟福原子模型→玻尔原子模型
答案:D
解析:本题考查原子模型的演变过程。原子模型的演变过程是:道尔顿原子模型、汤姆生原子模型、卢瑟福原子模型、玻尔原子模型。
问题引领
原子是由原子核和核外电子所构成的,那原子核可不可以再分呢 大多数原子的原子核由质子和中子构成,下表列出了一个原子中电子、质子和中子间的质量和电性关系:
探究任务2 原子核的构成
表 质子、中子和电子的质量和带电荷量
1.原子的质量主要由哪些微粒决定
提示:质子和中子。原子由原子核和核外电子构成,电子的质量非常小,往往忽略不计,所以原子质量主要集中在原子核上,原子核由质子和中子构成。
2.对于原子、阴离子、阳离子来说,核外电子数与质子数有什么关系
提示:①原子中:质子数=核电荷数=核外电子数。
②阳离子中:质子数=核电荷数=核外电子数+离子所带电荷数。
③阴离子中:质子数=核电荷数=核外电子数-离子所带电荷数。
归纳提升
1.构成原子的微粒。
2.有关微粒间的关系。
(1)质量关系。
①质量数(A)=质子数(Z)+中子数(N)。
②原子的相对原子质量近似等于质量数。
(2)电性关系。
①电中性微粒(原子或分子):
核电荷数=核内质子数=核外电子数。
②带电离子。质子数≠电子数,具体如下表:
(3)数量关系。
原子序数=质子数。
典型例题
【例题2】 已知R2+核外有a个电子,核内有b个中子。下列能正确表示R的原子符号的是( )。
答案:C
解析:R2+核外有a个电子,因此R原子核外有a+2个电子,R原子的核外电子数、质子数、核电荷数均为a+2,其质量数为中子数与质子数之和,即a+b+2。
注意:利用A=N+Z(A为质量数,N为中子数,Z为质子数)关系式,当已知其中的两项时可以求第三项,当为离子时要注意Z为质子数,与核外电子数不同;中子数与质子数(或核外电子数)之差=A-2Z。
【变式训练2】 某元素的一个原子形成的离子可表示为 ,下列说法正确的是( )。
答案:D
解析:A项,中子数应为b-a;B项,电子数应为a+n;C项,质量数应为b。
问题引领
14C断代技术在考古学中是一种最常见并且是应用最广泛的确定文物年代的技术,因为考古所发现的物品一般都含有碳,所以人们设法利用样品中所含有的碳的有关性质来探测它们的年龄。由于取样过程简单,对埋藏条件的限制少,并且出土后若干年的文物都可以利用14C断代技术进行分析,所以此技术得以推广。
探究任务3 元素、核素、同位素的辨析
1.14C的常见同位素是什么 它们有哪些异同点
提示: 12C、13C;质子数相同,中子数不同,质量数不同,物理性质不同,化学性质相似。
2.质子数相同而中子数不同的微粒一定是同位素吗
提示:不一定,如 和H2O中质子数相同,中子数不同,但两者不是同位素。
归纳提升
典型例题
【例题3】 现有下列基本微粒:1H、2H、3H、1H+、234U、
235U、238U、40K、40Ca、Cl2、14N、14C,请回答下列问题:
(1)其中,它们分属 种元素,属于氢元素的核素有
种,属于铀元素的核素有 种。互为同位素的原子分别为 , 。
(2)质量数相等的微粒为 , , (可不填满,也可补充)。
(3)氢的同位素1H、2H、3H与氧的同位素16O、17O、18O相互结合为水,可得水分子的种数为 ;可得相对分子质量不同的水分子种数为 。
答案:(1)7 3 3 1H、2H、3H 234U、235U、238U
(2)40K、40Ca 14N、14C 1H、1H+
(3)18 7
解析:(1)本题列出的12种微粒分属H、U、K、Ca、Cl、N、C 7种元素,1H和1H+是同一种核素的不同微粒,1H、2H、3H属于氢元素的3种不同核素,且互为同位素。234U、235U、238U属于铀元素的3种不同核素,也互为同位素。
(2)本小题是“质量数相等的微粒”,而非“质量数相等的原子”,否则,“1H和1H+”不为答案。
(3)氢的同位素与氧的同位素16O形成的H2O有以下6种:1H1H16O、2H2H16O、3H3H16O、1H2H16O、1H3H16O、
2H3H16O。把16O换为17O、18O又各有6种,故总共有18种水分子。所得18种水分子中,相对分子质量最小的为
量为19、20、21、22、23的5种水分子,故共有7种相对分子质量不同的水分子。
注意: 同位素、核素概念理解的易错点:
(1)一种元素可能有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。
(3)不同核素之间转化时原子核发生变化,因此不属于化学变化。
【变式训练3】 (双选)下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )。
A.体积相等时密度不相等
B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的质子数相等
答案:AC
解析:由于12C18O和14N2的相对分子质量不相等,故同温同压下体积相等的两种气体的质量不相等,因此密度不相等,A项正确;1个12C18O分子中有16个中子,1个14N2分子中含有14个中子,二者均为双原子分子,原子数相等时分子数相等,但中子数不相等,B项错误;12C18O和14N2均为14电子分子,同温同压下,体积相等时分子数相等,所具有的电子数相等,C项正确; 12C18O和14N2分子中均有14个质子,由于二者的相对分子质量不相等,故等质量的两种分子所具有的质子数不相等,D项错误。
