2.3.2原子核外电子排布 课件(共30张PPT)高中化学苏教版必修第一册
文档属性
| 名称 | 2.3.2原子核外电子排布 课件(共30张PPT)高中化学苏教版必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-15 21:23:49 | ||
图片预览









文档简介
(共30张PPT)
第三单元 人类对原子结构的认识
第2课时 原子核外电子排布
课标定位素养阐释
1.通过认识原子核外电子的排布规律,能根据原子结构的特征确定元素。
2.能根据核外电子排布规律画出常见简单离子的结构示意图。
原子核外电子排布
1.表示方法。
原子结构示意图,如
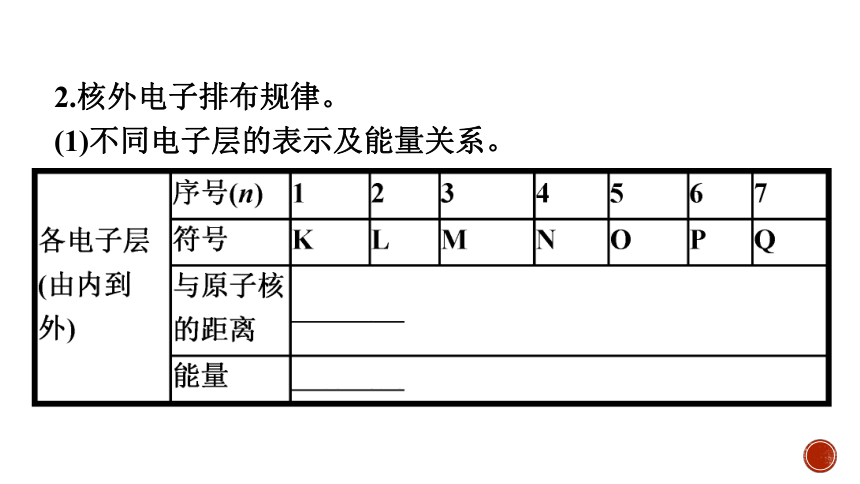
2.核外电子排布规律。
(1)不同电子层的表示及能量关系。
(2)核外电子排布的规律。
①原子核外各电子层最多能容纳的电子数是一定的,而且电子在原子核外排布时,总是尽量先排在能量最低的电子层,即最先排K层,当K层排满后,再排L层等。
②原子核外各电子层最多能容纳的电子数为2n2,最外电子层最多只能容纳8个电子(K层为最外层时,最多只能容纳2个电子)。
③稀有气体元素原子中最外电子层都已经填满,形成了稳定的电子层结构。
3.元素的化学性质与原子核外电子排布的关系。
(1)化学反应的特点:原子核不发生变化,但核外电子可能发生变化。
(2)元素的化学性质与原子结构的关系。
①活泼金属元素的原子最外层电子数较少,容易失去电子;
②活泼非金属元素的原子最外层电子数较多,容易从外界
获得电子;
③稀有气体元素原子最外层有8个(He为2个)电子,化学性质稳定,不易得失电子。
(3)化合价和核外电子排布的关系。
①活泼金属在反应中,一般失去电子,表现正化合价。
②活泼非金属在反应中,一般得到电子,表现负化合价。
【自主思考】 M电子层最多可容纳18个电子,为什么钾原
子的核外电子排布不是 而是
提示:若钾原子的M层排布9个电子,此时M层就成为最外层,这和电子排布规律中“最外层最多只能容纳8个电子”相矛盾,不符合电子排布规律。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)锂的原子结构示意图是 。( )
(2)某原子M层电子数为L层电子数的4倍。( )
(3)某离子M层和L层电子数均为K层的4倍。( )
(4)离子的核电荷数一定等于其核外电子数。( )
×
×
√
×
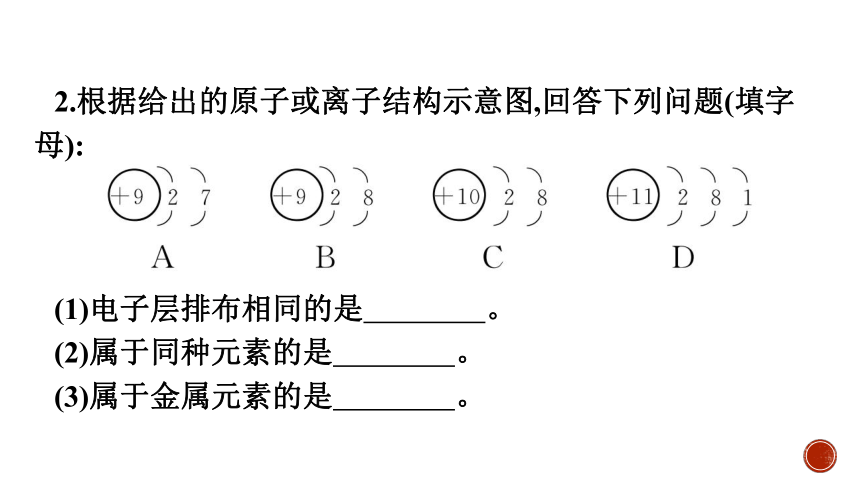
2.根据给出的原子或离子结构示意图,回答下列问题(填字母):
(1)电子层排布相同的是 。
(2)属于同种元素的是 。
(3)属于金属元素的是 。
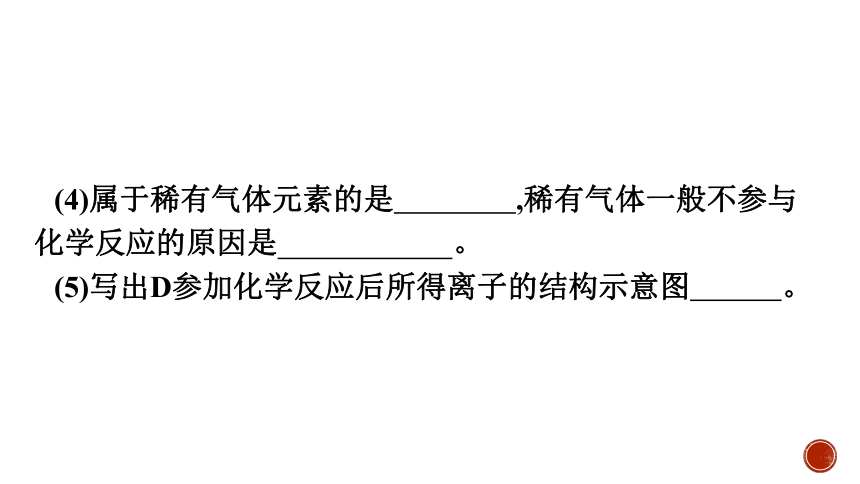
(4)属于稀有气体元素的是 ,稀有气体一般不参与化学反应的原因是 。
(5)写出D参加化学反应后所得离子的结构示意图 。
答案:(1)BC (2)AB (3)D (4)C 原子的最外层电子已达到8(或2)电子的稳定结构,既不易失去电子也不易得到电子
(5)
解析:电子层排布相同是指电子层数和各电子层上的电子数均相同;决定元素种类的是核内质子数,即核电荷数;金属元素原子的最外电子层上的电子数一般较少;稀有气体元素原子最外电子层上一般为8个电子,He最外层为2个电子。
问题引领
1.K层、L层最多容纳多少个电子 试总结各电子层(n)中最多容纳的电子数。最外层最多容纳多少个电子
提示:根据核外电子排布规律,K层最多容纳2个电子,L层最多容纳8个电子。每一层最多容纳的电子数为2n2(n为电子层序数)。最外层最多容纳8个电子(K层为最外层时,最多只能容纳2个电子)。
探究任务 原子核外电子排布规律
2.当N层上有电子时,M层上的电子是否已排满
提示:不一定。因M层排满时是18个电子,但当M层为最外层时不能超过8个电子,故M层电子数多于8个电子时,就会先
排布在N层上。例如:钙原子 。
3.写出硫原子和硫离子的结构示意图。
提示:
归纳提升
1.利用“能量规律”和“数量规律”确定原子核外电子排布状况。
2.原子核外电子排布的表示方法。
(1)原子结构示意图。
①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
(2)离子结构示意图。
①部分金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成稳定的电子层结构。
②非金属元素的原子得电子形成简单离子时,形成稳定的电子层结构。
3.元素化合价与得失电子数目的关系。
(1)金属元素在化合物中为正化合价,失去电子的数目即为化合价的数值。
(2)非金属元素在化合物中既可以为正化合价也可以为负化合价,活泼非金属元素的最低负化合价的数值即为得到电子的数目。
(3)元素化合价与最外层电子数目的关系:
①一般情况下,活泼金属元素的正化合价=原子最外层电子数。
②非金属元素的最低价=原子最外层电子数-8。
4.10电子与18电子微粒及其推断。
(1)10电子微粒及其推断。
(2)18电子微粒及其推断。
①单核:
②多核:HCl、H2S、PH3、SiH4、F2、H2O2等。
典型例题
【例题】 下列微粒的结构示意图中,错误的是( )。
A.②③④⑤ B.①④⑤⑥ C.①②③⑥ D.①②④⑤
D
解析:①错误,K层最多容纳2个电子;②错误,Cl的核电荷数为17;④错误,最外层电子数不能超过8个;⑤错误,L层上电子数应为8个,M层上电子数应为5个。
注意:(1)原子核外电子排布的“四最”。
①一个最低:核外电子总是先排布在能量最低的电子层,然后由内向外从能量较低的电子层逐步向能量较高的电子层排布。
②三个最多:各电子层最多容纳的电子数是2n2,如K、L、M、N层最多容纳的电子数分别为2、8、18、32。
最外层电子数最多是8(K层是最外层时,最多不超过2)。
次外层电子数最多是18。
以上规律是互相联系的,不能孤立地理解。
(2)1~18号元素中与元素推断相关的“突破口”。
①最外层电子数为1的原子有H、Li、Na。
②最外层电子数为2的原子有He、Be、Mg。
③最外层电子数与次外层电子数相等的原子有Be、Ar。
④最外层电子数是次外层电子数2倍的原子是C。
⑤最外层电子数是次外层电子数3倍的原子是O。
⑥最外层电子数是次外层电子数4倍的原子是Ne。
⑦次外层电子数是最外层电子数2倍的原子有Li、Si。
⑧内层电子总数是最外层电子数2倍的原子有Li、P。
⑨电子层数与最外层电子数相等的原子有H、Be、Al。
⑩电子层数为最外层电子数2倍的原子是Li。
11最外层电子数是电子层数2倍的原子有He、C、S。
12最外层电子数是电子层数3倍的原子是O。
【变式训练】 根据下列叙述,写出元素名称并画出原子结构示意图。
信息 元素名称 原子结构示意图
A元素原子核外M层电子数是L层电子数的一半
B元素原子最外层电子数是次外层电子数的1.5倍
C元素+1价离子C+的电子层排布与Ne的相同
D元素原子次外层电子数是最外层电子数的
解析:A元素原子核外M层电子数是L层电子数的一半,因L层有8个电子,则M层有4个电子,故A为硅元素,其原子结构示意图为 。B元素原子最外层电子数是次外层电子数的1.5倍,当次外层为K层时,则最外层电子数为3,B是硼元素,其原子结构示意图为 ;当次外层为L层时,最外层电子数为1.5×8=12,违背了最外层电子数最多只能排8个电子的规律,故不可能。
C元素+1价离子C+的电子层排布与Ne的相同,则C元素原子的质子数为10+1=11,故C为钠元素,其原子结构示意图为 。D元素原子次外层电子数是最外层电子数的 ,当次外层为K层时,D为氧元素,其原子结构示意图为 ;当次外层为L层时,最外层则有24个电子,故此种情况不合理。
第三单元 人类对原子结构的认识
第2课时 原子核外电子排布
课标定位素养阐释
1.通过认识原子核外电子的排布规律,能根据原子结构的特征确定元素。
2.能根据核外电子排布规律画出常见简单离子的结构示意图。
原子核外电子排布
1.表示方法。
原子结构示意图,如
2.核外电子排布规律。
(1)不同电子层的表示及能量关系。
(2)核外电子排布的规律。
①原子核外各电子层最多能容纳的电子数是一定的,而且电子在原子核外排布时,总是尽量先排在能量最低的电子层,即最先排K层,当K层排满后,再排L层等。
②原子核外各电子层最多能容纳的电子数为2n2,最外电子层最多只能容纳8个电子(K层为最外层时,最多只能容纳2个电子)。
③稀有气体元素原子中最外电子层都已经填满,形成了稳定的电子层结构。
3.元素的化学性质与原子核外电子排布的关系。
(1)化学反应的特点:原子核不发生变化,但核外电子可能发生变化。
(2)元素的化学性质与原子结构的关系。
①活泼金属元素的原子最外层电子数较少,容易失去电子;
②活泼非金属元素的原子最外层电子数较多,容易从外界
获得电子;
③稀有气体元素原子最外层有8个(He为2个)电子,化学性质稳定,不易得失电子。
(3)化合价和核外电子排布的关系。
①活泼金属在反应中,一般失去电子,表现正化合价。
②活泼非金属在反应中,一般得到电子,表现负化合价。
【自主思考】 M电子层最多可容纳18个电子,为什么钾原
子的核外电子排布不是 而是
提示:若钾原子的M层排布9个电子,此时M层就成为最外层,这和电子排布规律中“最外层最多只能容纳8个电子”相矛盾,不符合电子排布规律。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)锂的原子结构示意图是 。( )
(2)某原子M层电子数为L层电子数的4倍。( )
(3)某离子M层和L层电子数均为K层的4倍。( )
(4)离子的核电荷数一定等于其核外电子数。( )
×
×
√
×
2.根据给出的原子或离子结构示意图,回答下列问题(填字母):
(1)电子层排布相同的是 。
(2)属于同种元素的是 。
(3)属于金属元素的是 。
(4)属于稀有气体元素的是 ,稀有气体一般不参与化学反应的原因是 。
(5)写出D参加化学反应后所得离子的结构示意图 。
答案:(1)BC (2)AB (3)D (4)C 原子的最外层电子已达到8(或2)电子的稳定结构,既不易失去电子也不易得到电子
(5)
解析:电子层排布相同是指电子层数和各电子层上的电子数均相同;决定元素种类的是核内质子数,即核电荷数;金属元素原子的最外电子层上的电子数一般较少;稀有气体元素原子最外电子层上一般为8个电子,He最外层为2个电子。
问题引领
1.K层、L层最多容纳多少个电子 试总结各电子层(n)中最多容纳的电子数。最外层最多容纳多少个电子
提示:根据核外电子排布规律,K层最多容纳2个电子,L层最多容纳8个电子。每一层最多容纳的电子数为2n2(n为电子层序数)。最外层最多容纳8个电子(K层为最外层时,最多只能容纳2个电子)。
探究任务 原子核外电子排布规律
2.当N层上有电子时,M层上的电子是否已排满
提示:不一定。因M层排满时是18个电子,但当M层为最外层时不能超过8个电子,故M层电子数多于8个电子时,就会先
排布在N层上。例如:钙原子 。
3.写出硫原子和硫离子的结构示意图。
提示:
归纳提升
1.利用“能量规律”和“数量规律”确定原子核外电子排布状况。
2.原子核外电子排布的表示方法。
(1)原子结构示意图。
①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
(2)离子结构示意图。
①部分金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成稳定的电子层结构。
②非金属元素的原子得电子形成简单离子时,形成稳定的电子层结构。
3.元素化合价与得失电子数目的关系。
(1)金属元素在化合物中为正化合价,失去电子的数目即为化合价的数值。
(2)非金属元素在化合物中既可以为正化合价也可以为负化合价,活泼非金属元素的最低负化合价的数值即为得到电子的数目。
(3)元素化合价与最外层电子数目的关系:
①一般情况下,活泼金属元素的正化合价=原子最外层电子数。
②非金属元素的最低价=原子最外层电子数-8。
4.10电子与18电子微粒及其推断。
(1)10电子微粒及其推断。
(2)18电子微粒及其推断。
①单核:
②多核:HCl、H2S、PH3、SiH4、F2、H2O2等。
典型例题
【例题】 下列微粒的结构示意图中,错误的是( )。
A.②③④⑤ B.①④⑤⑥ C.①②③⑥ D.①②④⑤
D
解析:①错误,K层最多容纳2个电子;②错误,Cl的核电荷数为17;④错误,最外层电子数不能超过8个;⑤错误,L层上电子数应为8个,M层上电子数应为5个。
注意:(1)原子核外电子排布的“四最”。
①一个最低:核外电子总是先排布在能量最低的电子层,然后由内向外从能量较低的电子层逐步向能量较高的电子层排布。
②三个最多:各电子层最多容纳的电子数是2n2,如K、L、M、N层最多容纳的电子数分别为2、8、18、32。
最外层电子数最多是8(K层是最外层时,最多不超过2)。
次外层电子数最多是18。
以上规律是互相联系的,不能孤立地理解。
(2)1~18号元素中与元素推断相关的“突破口”。
①最外层电子数为1的原子有H、Li、Na。
②最外层电子数为2的原子有He、Be、Mg。
③最外层电子数与次外层电子数相等的原子有Be、Ar。
④最外层电子数是次外层电子数2倍的原子是C。
⑤最外层电子数是次外层电子数3倍的原子是O。
⑥最外层电子数是次外层电子数4倍的原子是Ne。
⑦次外层电子数是最外层电子数2倍的原子有Li、Si。
⑧内层电子总数是最外层电子数2倍的原子有Li、P。
⑨电子层数与最外层电子数相等的原子有H、Be、Al。
⑩电子层数为最外层电子数2倍的原子是Li。
11最外层电子数是电子层数2倍的原子有He、C、S。
12最外层电子数是电子层数3倍的原子是O。
【变式训练】 根据下列叙述,写出元素名称并画出原子结构示意图。
信息 元素名称 原子结构示意图
A元素原子核外M层电子数是L层电子数的一半
B元素原子最外层电子数是次外层电子数的1.5倍
C元素+1价离子C+的电子层排布与Ne的相同
D元素原子次外层电子数是最外层电子数的
解析:A元素原子核外M层电子数是L层电子数的一半,因L层有8个电子,则M层有4个电子,故A为硅元素,其原子结构示意图为 。B元素原子最外层电子数是次外层电子数的1.5倍,当次外层为K层时,则最外层电子数为3,B是硼元素,其原子结构示意图为 ;当次外层为L层时,最外层电子数为1.5×8=12,违背了最外层电子数最多只能排8个电子的规律,故不可能。
C元素+1价离子C+的电子层排布与Ne的相同,则C元素原子的质子数为10+1=11,故C为钠元素,其原子结构示意图为 。D元素原子次外层电子数是最外层电子数的 ,当次外层为K层时,D为氧元素,其原子结构示意图为 ;当次外层为L层时,最外层则有24个电子,故此种情况不合理。
