2022年广东省高中学业平合格考试(新课标)化学试题(含解析)
文档属性
| 名称 | 2022年广东省高中学业平合格考试(新课标)化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 823.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-15 22:34:26 | ||
图片预览



文档简介
2022年广东省高中学业平合格考试(新课标)化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.清晨漫步在树林里,看到缕缕光束穿过薄雾铺洒在地面上。这种美丽的光束主要缘于
A.光的反射 B.尘埃聚集 C.水蒸气流动 D.丁达尔效应
2.中国国家博物馆藏品“错金银云纹青铜犀尊”工艺精湛,体现了我国古代科学技术的高超水平。该藏品所含金属元素的单质能与稀盐酸发生反应的有
A.金 B.银 C.锡 D.铜
3.下图为多电子原子的电子层模型示意图。有关描述不正确的是
A.K层电子的能量高于L层 B.核外电子从K层开始填充
C.L层最多能容纳8个电子 D.原子由原子核与核外电子构成
4.采用灼烧后的热铜丝催化氧化乙醇的实验中,需要注意的安全事项不包括
A. B. C. D.
5.2021年我国首制大型豪华邮轮全船贯通。制造此邮轮使用的薄钢板属于
A.合成高分子材料 B.金属材料
C.无机非金属材料 D.天然高分子材料
6.人体需要维持体内的电解质平衡才能保证正常的生理活动。下列属于电解质的是
A.O2 B.脂肪 C.NaCl D.葡萄糖
7.践行绿色化学理念,建设美丽家园。下列做法不符合绿色化学理念的是
A.回收利用废旧铜制品
B.焚烧、填埋废弃塑料
C.以水代替有机溶剂发展水性涂料
D.乙烯制备环氧乙烷实现原子利用率100%
8.我国化学家用氧化铟(In2O3)负载的Ag催化剂实现了CO2加氢制备CH3OH,原理如图所示。关于该反应的说法正确的是
A.发生了氧化反应
B.Ag催化剂不参与反应
C.22.4L 含有个氧原子
D.每消耗2mol 生成1mol
9.规范操作是实验安全的保障。下列操作符合实验安全要求的是
A.将未用完的Na丢入废液缸 B.用力吸闻集气瓶中SO2的气味
C.皮肤不慎接触烧碱立即用抹布擦 D.用漏斗向酒精灯缓慢注入适量酒精
10.氯气可用于自来水杀菌、消毒。有关氯气的叙述不正确的是
A.Cl2具有强氧化性 B.纯净的H2能在Cl2中安静地燃烧
C.氯气、液氯和氯水是同一种物质 D.加热条件下浓盐酸与MnO2反应制得Cl2
11.用如图装置除去CH4中的少量C2H4,溶液a为
A.稀盐酸 B.NaOH溶液 C.饱和食盐水 D.溴的CCl4溶液
12.物质的性质决定其用途。下列物质的性质与其用途相关的是
选项 性质 用途
A 受热易分解 用于泡沫灭火器
B NaClO溶液有碱性 用作漂白液
C 可与反应 用于呼吸面具
D 乙烯能在空气中燃烧 生产聚乙烯
A.A B.B C.C D.D
13.佳佳同学炒菜时不小心把少许食盐洒在炉火上,可看到
A.黄色火焰 B.绿色火焰 C.紫色火焰 D.洋红色火焰
14.有机物构成了生机勃勃的生命世界,也是燃料、材料和食品等的重要来源。有机物
A.均易挥发、易燃烧
B.参与的化学反应常伴有副反应
C.仅含C、H两种元素
D.均易溶于酒精、苯等有机溶剂
15.检验芹菜中铁元素的实验操作有:①剪碎芹菜,研磨;②取少量滤液,滴加稀;③加入蒸馏水,搅拌,过滤;④滴加几滴KSCN溶液,振荡,观察。正确操作顺序为
A.③①④② B.①②③④ C.②①④③ D.①③②④
16.将铁片和铜片贴在浸润过稀硫酸的滤纸两侧,用导线连接电流计,制成简易电池,装置如图。关于该电池的说法正确的是
A.铜片上有产生
B.负极反应为
C.铁电极附近溶液中的增大
D.放电时电子流向:铜片→电流计→铁片
17.某工厂废水中含有大量、、和,其中可能大量存在的阴离子是
A. B. C. D.
18.对实验现象及其内涵的建构能发展学生的宏观辨识和微观探析素养。下列实验对应的离子方程式书写正确的是
选项 实验与现象 离子方程式
A 铝片插入CuSO4溶液,析出红色物质
B 稀H2SO4中滴加Ba(OH)2溶液,产生白色沉淀
C 在大理石上滴稀盐酸,产生气泡
D Fe2(SO4)3溶液中滴加氨水,产生红褐色沉淀
A.A B.B C.C D.D
19.一定条件下,恒容密闭容器中发生可逆反应。下列说法正确的是
A.和可完全转化为
B.平衡时,正、逆反应速率相等
C.充入,正、逆反应速率都降低
D.平衡时,、和的浓度一定相等
20.工业上从海水中提取镁的生产流程如图所示。关于该流程说法不正确的是
A.煅烧:贝壳高温分解生成
B.沉淀:海水与石灰乳反应获得
C.中和:与盐酸反应生成
D.电解:熔融电解生成金属Mg和
二、实验题
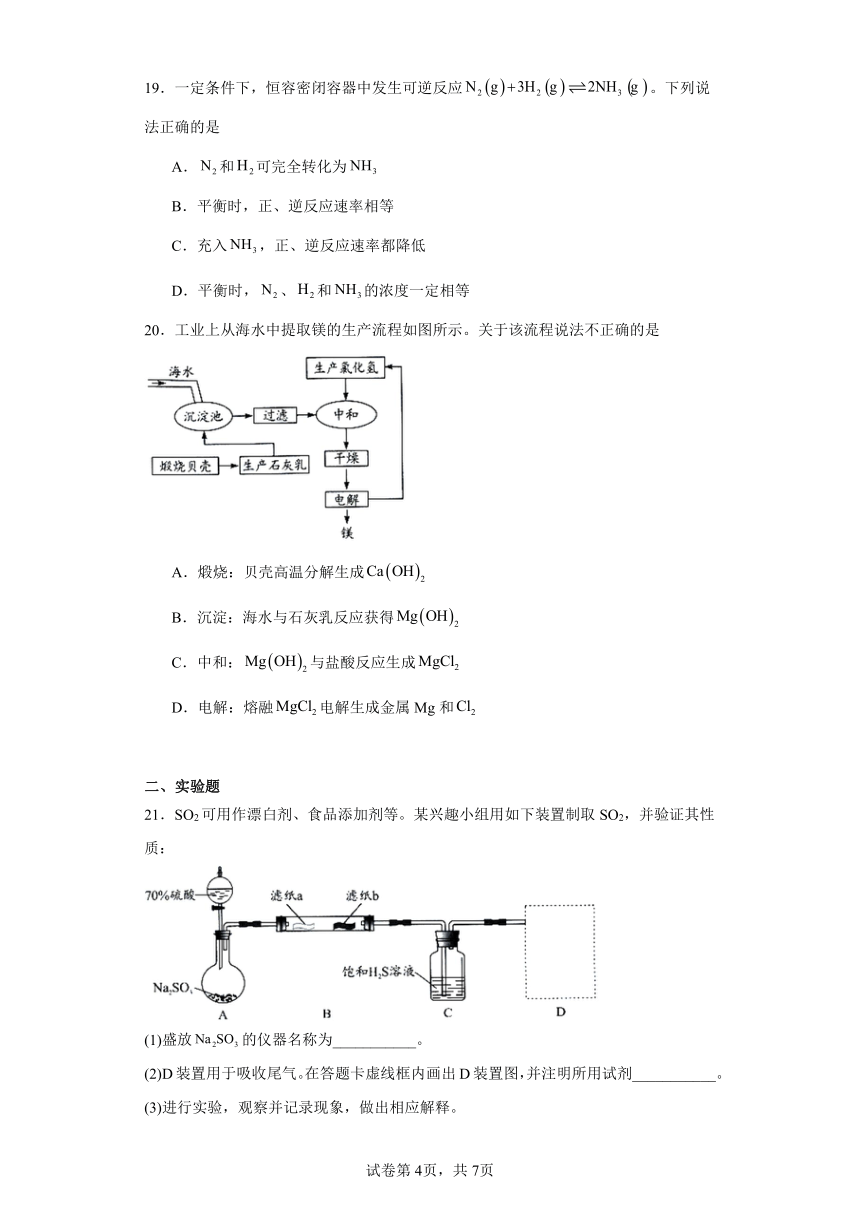
21.SO2可用作漂白剂、食品添加剂等。某兴趣小组用如下装置制取SO2,并验证其性质:
(1)盛放的仪器名称为___________。
(2)D装置用于吸收尾气。在答题卡虚线框内画出D装置图,并注明所用试剂___________。
(3)进行实验,观察并记录现象,做出相应解释。
实验操作 实验现象 分析与解释
打开装置A中的漏斗活塞 A装置中有气泡产生 化学方程式为___________
B装置中浸润过品红溶液的滤纸a的颜色___________ 具有___________作用
B装置中浸润过酸性溶液的滤纸b褪色 具有___________性
C装置中的现象是___________ 具有氧化性
三、元素或物质推断题
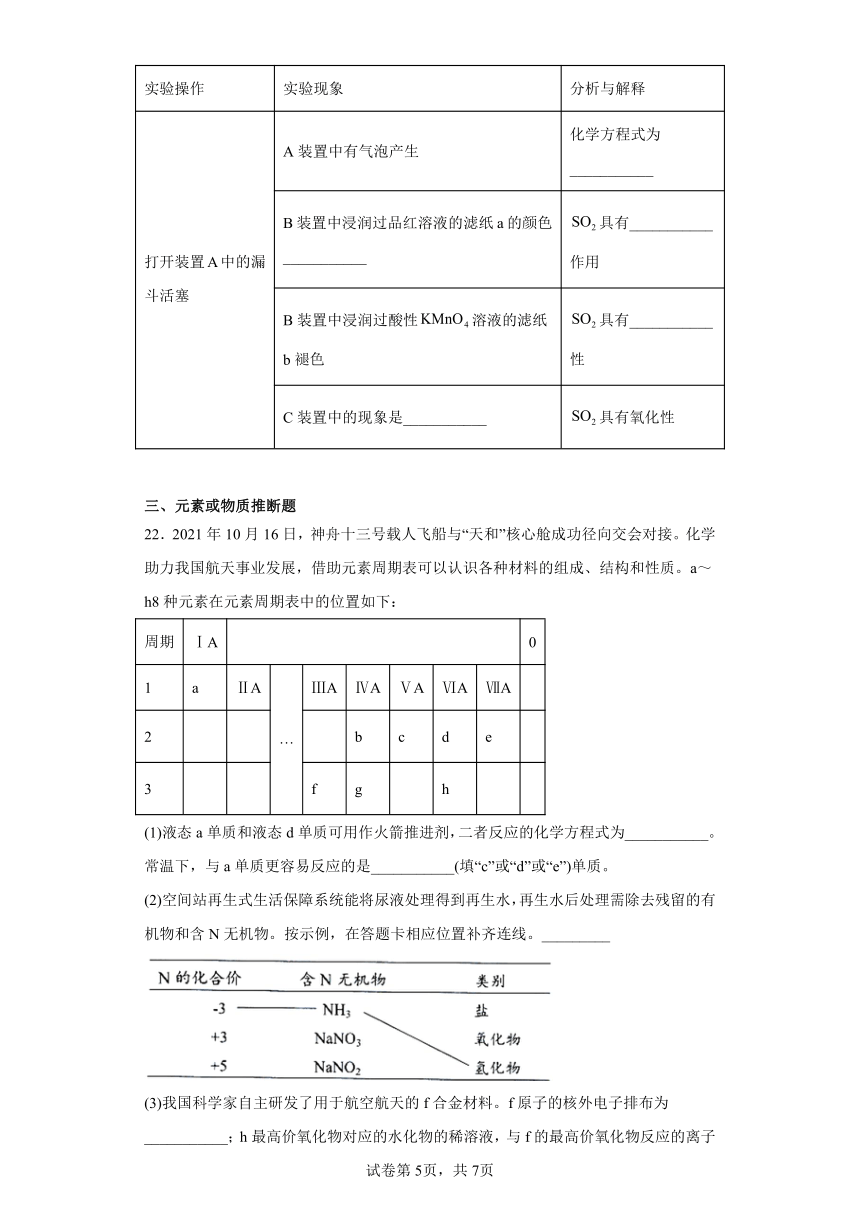
22.2021年10月16日,神舟十三号载人飞船与“天和”核心舱成功径向交会对接。化学助力我国航天事业发展,借助元素周期表可以认识各种材料的组成、结构和性质。a~h8种元素在元素周期表中的位置如下:
周期 ⅠA 0
1 a ⅡA … ⅢA ⅣA ⅤA ⅥA ⅦA
2 b c d e
3 f g h
(1)液态a单质和液态d单质可用作火箭推进剂,二者反应的化学方程式为___________。常温下,与a单质更容易反应的是___________(填“c”或“d”或“e”)单质。
(2)空间站再生式生活保障系统能将尿液处理得到再生水,再生水后处理需除去残留的有机物和含N无机物。按示例,在答题卡相应位置补齐连线。_________
(3)我国科学家自主研发了用于航空航天的f合金材料。f原子的核外电子排布为___________;h最高价氧化物对应的水化物的稀溶液,与f的最高价氧化物反应的离子方程式为___________。
(4)g单质在太阳能电池和芯片制造等领域有着重要应用。g最高价氧化物的化学式为___________;b和g组成的化合物可作为新型陶瓷材料,其化学式为___________。上述g的两种化合物含有的化学键类型均为___________。
四、有机推断题
23.乙酰水杨酸,俗称阿司匹林,具有解热、镇痛、消炎和免疫调节等作用。阿司匹林可由水杨酸与乙酸酐反应得到:
已知:
(1)乙酸酐的分子式为___________。
(2)水杨酸与阿司匹林含有的相同含氧官能团是___________(写名称)。
(3)乙酸()和甲酸甲酯()互为___________。
(4)由水杨酸与乙酸酐制备阿司匹林的反应类型是___________ (填字母)。
A.取代反应 B.加成反应 C.聚合反应
(5)与乙酸类似,阿司匹林可发生酯化反应。下列物质能与阿司匹林发生酯化反应的是___________(填字母)。
A. B. C. D.
(6)补充完整以为原料合成乙酸酐的路线(写化合物的结构简式);__________
→___________→___________→
五、填空题
24.2021年10月20日,央视新闻报道:
a.2022年冬奥会火种抵达北京,火炬传递方案确定;
b.我国自主研制的世界最大推力整体式固体火箭发动机试车成功;
c.我国将加快推进汽车动力电池回收利用立法。
(1)关于奥运火炬燃料、固体火箭发动机燃料和汽车动力电池,下列说法正确的是___________(填字母)。
A.作为奥运火炬燃料的主要成分,丙烷和丁烷互为同系物
B.固体火箭发动机燃料燃烧时,发生剧烈氧化还原反应
C.汽车动力电池只能将化学能转化为电能
(2)结合上述新闻报道,从多个角度谈谈你的认识___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】树林中空气含有大量的水蒸气,形成气溶胶,当有光照射时,从树叶中间透过光束就会在胶体中形成一条光亮的通路,这个现象为丁达尔效应,故选D。
2.C
【详解】按金属活动性顺序表,金、银和铜在金属活动性顺序表中都排在氢的后面,故都不能与稀盐酸反应,锡排在氢的前面,能与稀盐酸反应;
选C。
3.A
【详解】A.原子核外电子在核外排布在能量不连续的电子层中,由里向外能量依次升高,故K层电子的能量低于L层,A错误;
B.原子核外电子排布遵循能量最低原则,即核外电子总是优先排在离核近的能量低的电子层里,即总是从K层开始填充,B正确;
C.由核外电子排布规律可知,每一层最多排布的电子为2n2个(n为电子层序数),故第二层即L层最多能容纳8个电子,C正确;
D.原子由原子核与核外电子构成,D正确;
故答案为:A。
4.C
【详解】A.灼热的铜丝伸入乙醇中时,可能因为温度过高而产生试管炸裂、液体飞溅现象,所以实验操作中需要护目镜保护眼睛,A不合题意;
B.使用酒精灯加热时,要注意防止酒精着火,为防止火灾发生,实验操作中要注意用火安全,B不合题意;
C.该实验中不需要使用电器,所以实验操作中不需要注意用电安全,C符合题意;
D.该实验中铜丝需要加热,要防止灼热的铜丝烧伤手,所以实验中要注意安全操作,D不合题意;
故答案为:C。
5.B
【详解】薄钢板属于铁和碳的合金,属于金属材料,故答案为:B。
6.C
【详解】A.O2是单质,既不是电解质也不是非电解质,故A不符合题意;
B.脂肪是有机物,不能在水溶液中和熔融状态下不导电,不属于电解质,故B不符合题意;
C.NaCl为溶于水或熔融状态下导电的化合物,属于电解质,故C符合题意;
D.葡萄糖是有机物,不能在水溶液中和熔融状态下不导电,属于非电解质,故D不符合题意;
答案为C。
7.B
【分析】根据绿色化学就是从源头上消除对环境的污染,其中原则最经济理论最符合绿色化学思想,分析解题。
【详解】A.回收利用废旧铜制品,可以减少环境污染,同时变废为宝,节约资源,符合绿色化学思想,A不合题意;
B.焚烧废弃塑料将释放出有毒有害气体,造成大气污染,而废弃塑料的深埋处理也会污染土壤,故不符合绿色化学的概念,B符合题意;
C.研制开发以水代替有机溶剂的化工涂料,可以减少环境污染,符合绿色化学思想,C不合题意;
D.乙烯制备环氧乙烷实现原子利用率100%,符合原子最经济理论,符合绿色化学思想,D不合题意;
故答案为:B。
8.A
【分析】由题干原理图示信息可知,该转化的总反应为:CO2+3H2CH3OH+H2O,据此分析解题。
【详解】A.由分析可知,转化中H2中H的化合价升高,即发生了氧化反应,A正确;
B.催化剂在反应过程中是参与反应的,只是反应前后其性质和质量保持不变,即Ag催化剂参与反应,B错误;
C.H2O为液体,且未告知标准状况,即无法计算22.4L 含有个氧原子,C错误;
D.由分析可知,每消耗3mol 生成1mol ,D错误;
故答案为:A。
9.D
【详解】A.Na性质活泼,会和废缸中的水剧烈反应,未用完的Na应放回原试剂瓶,A错误;
B.不能用力吸闻集气瓶中SO2的气味,否则可能中毒,B错误;
C.皮肤不慎接触烧碱应立即用大量的水冲洗,再涂上稀硼酸溶液,C错误;
D.向酒精灯中添加酒精要用漏斗缓慢注入,D正确;
故选D。
10.C
【详解】A.Cl2能与大多数金属、某些非金属和多种KI等还原剂反应,得到电子,氯元素化合价降低,具有强氧化性,A正确;
B.点燃下氢气和氯气发生反应产生氯化氢气体,纯净的H2能在Cl2中安静地燃烧, B正确;
C. 氯气和液氯都是纯净物、由氯分子构成,氯水是混合物,是氯气的水溶液, C不正确;
D. 加热条件下浓盐酸与MnO2发生氧化还原反应生成氯气,该反应可用于在实验室制Cl2,D正确;
答案选C。
11.D
【详解】A.CH4和C2H4均不与稀盐酸反应,不能用稀盐酸来除去CH4中的C2H4,A不合题意;
B.CH4和C2H4均不与NaOH溶液反应,不能用NaOH溶液来除去CH4中的C2H4,B不合题意;
C.CH4和C2H4均不与饱和食盐水反应,不能用饱和食盐水来除去CH4中的C2H4,C不合题意;
D.乙烯能与溴单质反应生成无色液体1,2-二溴乙烷而溶于CCl4中,CH4不反应,故可用溴的CCl4溶液来除去CH4中的C2H4,D符合题意;
故答案为:D。
12.C
【详解】A.泡沐灭火器中硫酸铝和碳酸氢钠溶液灭火,原理,A错误;
B.NaClO具有强氧化性,能漂白,可用作漂白液,B错误;
C.Na2O2与CO2反应生成氧气,用作呼吸面具,C正确;
D.乙烯发生加聚反应生成聚乙烯,D错误;
故答案为:C。
13.A
【详解】钠的焰色为黄色,氯化钠在火焰上灼烧可看到黄色火焰;
答案为A。
14.B
【详解】A.不是所有的有机物均易挥发、易燃烧,如沸点很高的糖类、油脂、蛋白质等不易挥发,CCl4等不易燃烧,A错误;
B.有机物参与的化学反应往往比较复杂,常伴有副反应,故有机反应方程式中用“→”表示主要反应,B正确;
C.有机物包含烃和烃的衍生物,仅含C、H两种元素的化合物为烃,而烃的衍生物包含C、H之外的元素,C错误;
D.有些有机物难溶于乙醇,如酚醛树脂,D错误;
故答案为:B。
15.D
【详解】将芹菜粉碎加水浸泡后过滤,将滤液加入HNO3,将滤液中的铁元素氧化为铁离子,最后加入KSCN,溶液如果变为血红色,则证明溶液中含有铁离子;
故答案为:D。
16.B
【分析】将铁片和铜片贴在浸润过稀硫酸的滤纸两侧,用导线连接电流计,制成简易电池,该原电池中Fe作负极,电极反应为:Fe-2e-=Fe2+,Cu作正极,电极反应为:2H++2e-=H2↑,据此分析解题。
【详解】A.由分析可知,铜片上有H2产生,A错误;
B.由分析可知,Fe作负极,负极反应为,B正确;
C.由分析可知,H+由负极移向正极,即铁电极附近溶液中的减小,C错误;
D.原电池放电时电子流向:负极即铁片铁片→电流计→正极即铜片,D错误;
故答案为:B。
17.B
【详解】A.与氢离子结合成弱电解质H2SO3,故A错误;
B.与废水中的阳离子都能共存,故B正确;
C.与结合有强氧化性,能将废水中的氧化成,故C错误;
D.与会生成白色沉淀,不能大量共存,故D错误;
故答案选B。
18.A
【详解】A.铝片插入CuSO4溶液,析出红色物质,反应方程式为:2Al+3CuSO4=Al2(SO4)3+3Cu,故离子方程式为:,A正确;
B.稀H2SO4中滴加Ba(OH)2溶液,产生白色沉淀BaSO4和H2O,原离子方程式漏写了部分离子方程式,故正确离子方程式为:,B错误;
C.CaCO3是沉淀,在离子方程式书写时不能拆,故在大理石上滴稀盐酸,产生气泡的离子方程式为:,C错误;
D.已知氨水为弱碱,在离子方程式书写时不能拆,Fe2(SO4)3溶液中滴加氨水,产生红褐色沉淀的离子方程式为:,D错误;
故答案为:A。
19.B
【详解】A.此反应为可逆反应,不能反应完全,故A错误;
B.平衡时,正反应速率等于逆反应速率,生成和消耗的量相等,达到动态平衡,故B正确;
C.充入的为生成物,生成物浓度增大,使逆反应速率增大,正反应速率减小,故C错误;
D.平衡时,各组分浓度不再变化,但不一定相等,故D错误;
故答案选B。
20.A
【详解】A.贝壳的主要成分是CaCO3,故高温煅烧贝壳分解生成CaO,A错误;
B.海水中含有较多的Mg2+,故沉淀过程中海水与石灰乳反应获得Mg(OH)2,B正确;
C.由题干工艺流程图可知,中和过程为Mg(OH)2与盐酸反应生成MgCl2,C正确;
D.工业上采用电解熔融MgCl2的方法来制备金属Mg和Cl2,D正确;
故答案为:A。
21.(1)圆底烧瓶
(2)
(3) Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 红色褪去 漂白 还原 溶液变浑浊或有淡黄色沉淀生成
【分析】如题干实验装置可知,装置A为SO2的制备装置,原理为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,装置B为SO2的性质实验,装置C为SO2与H2S反应的装置以验证SO2的弱氧化性,反应原理为:2H2S+SO2=3S↓+2H2O,装置D为尾气吸收装置,可以用NaOH溶液来吸收多余的SO2,据此分析解题。
【详解】(1)由题干图示实验装置可知,盛放的仪器名称为圆底烧瓶,故答案为:圆底烧瓶;
(2)二氧化硫酸性气体尾气用浓的氢氧化钠吸收,装置为;
(3)打开装置A中的漏斗活塞,A装置中有气泡产生即制备出了SO2,该化学方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,SO2具有漂白性,能够漂白品红、纸张和草帽辫等,则B装置中浸润过品红溶液的滤纸a的颜色红色褪去,说明SO2具有漂白性,SO2具有强还原性,能够被酸性高锰酸钾溶液氧化,故B装置中浸润过酸性KMnO4溶液的滤纸b褪色,证明SO2具有还原性,C 装置为SO2与H2S反应的装置以验证SO2的弱氧化性,反应原理为:2H2S+SO2=3S↓+2H2O,C装置中的现象是溶液变浑浊或有淡黄色沉淀生成,故答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;红色褪去;漂白;还原;溶液变浑浊或有淡黄色沉淀生成。
22.(1) 2H2+O22H2O e
(2)
(3) 2、8、3 Al2O3+6H+=2Al3++3H2O
(4) SiO2 SiC 共价键(或极性共价键)
【分析】由题干部分元素周期表可知,a为H、b为C、c为N、d为O、e为F、f为Al、g为Si、h为S,据此分析解题。
【详解】(1)由分析可知,液态a单质即H2和液态d单质即O2可用作火箭推进剂,二者反应的化学方程式为2H2+O22H2O,元素的非金属越强,其单质与H2化合越容易,非金属性F>O>N,即常温下,与a单质更容易反应的是e单质,故答案为:2H2+O22H2O;e;
(2)NaNO3中N的化合价为+5价,属于硝酸盐,而NaNO2中N的化合价为+3价,属于亚硝酸盐,故答案为:;
(3)由分析可知,f为Al,Al是13号元素,故f原子的核外电子排布为:2、8、3;h为Cl,h最高价氧化物对应的水化物即HClO4的稀溶液,与f的最高价氧化物即Al2O3,二者反应的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:2、8、3;Al2O3+6H+=2Al3++3H2O;
(4)由分析可知,g为Si,则g最高价氧化物的化学式为SiO2,b即C和g为Si组成的化合物可作为新型陶瓷材料,其化学式为SiC,上述g的两种化合物即SiO2和SiC含有的化学键类型均为共价键(或极性共价键),故答案为:SiO2;SiC;共价键(或极性共价键)。
23.(1)C3H6O3
(2)羧基
(3)同分异构体
(4)A
(5)D
(6) CH3CHOCHCOOH 。
【分析】乙烯发生氧化反应生成乙醛,乙醛氧化为乙酸,2分子乙酸脱水生成乙酸酐,水杨酸和乙酸酐发生取代反应生成阿司匹林和乙酸。
【详解】(1)根据乙酸酐的结构简式,可知分子式为C3H6O3;
(2)水杨酸中含有羧基、羟基;阿司匹林含有羧基、酯基,含有的相同含氧官能团是羧基。
(3)乙酸()和甲酸甲酯()结构不同、分子式都是C2H4O2,互为同分异构体;
(4)由水杨酸与乙酸酐制备阿司匹林,水杨酸羟基上的H被-COCH3代替,反应类型是取代反应,选A。
(5)阿司匹林分子中含有羧基,含有羟基,阿司匹林能与乙醇发生酯化反应,选D。
(6)氧化为乙醛,乙醛氧化为乙酸,乙酸脱水生成乙酸酐,合成路线为 CH3CHOCHCOOH 。
24.(1)AB
(2)一方面,随着我国综合国力提升,我国在国际上的影响力与日俱增,科技发展也日新月异,取得了令人瞩目的成果。另一方面,我国极有大国担当,尤其在环境保护方面,积极促进资源的回收再利用,积极保护环境,为整个人类作出应有的贡献;
【详解】(1)A.作为奥运火炬燃料的主要成分,丙烷和丁烷结构相似,在分子组成上相差一个CH2原子团,二者属于同系物,故A正确;
B.固体火箭发动机燃料燃烧时,发生剧烈氧化还原反应,喷射出大量气体,故B正确;
C.汽车动力电池为可充电电池,放电时将化学能转化为电能,充电时将电能转化为化学能,故C错误;
故答案为:AB;
(2)一方面,随着我国综合国力提升,我国在国际上的影响力与日俱增,科技发展也日新月异,取得了令人瞩目的成果。另一方面,我国极有大国担当,尤其在环境保护方面,积极促进资源的回收再利用,积极保护环境,为整个人类作出应有的贡献;
故答案为:见解析。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.清晨漫步在树林里,看到缕缕光束穿过薄雾铺洒在地面上。这种美丽的光束主要缘于
A.光的反射 B.尘埃聚集 C.水蒸气流动 D.丁达尔效应
2.中国国家博物馆藏品“错金银云纹青铜犀尊”工艺精湛,体现了我国古代科学技术的高超水平。该藏品所含金属元素的单质能与稀盐酸发生反应的有
A.金 B.银 C.锡 D.铜
3.下图为多电子原子的电子层模型示意图。有关描述不正确的是
A.K层电子的能量高于L层 B.核外电子从K层开始填充
C.L层最多能容纳8个电子 D.原子由原子核与核外电子构成
4.采用灼烧后的热铜丝催化氧化乙醇的实验中,需要注意的安全事项不包括
A. B. C. D.
5.2021年我国首制大型豪华邮轮全船贯通。制造此邮轮使用的薄钢板属于
A.合成高分子材料 B.金属材料
C.无机非金属材料 D.天然高分子材料
6.人体需要维持体内的电解质平衡才能保证正常的生理活动。下列属于电解质的是
A.O2 B.脂肪 C.NaCl D.葡萄糖
7.践行绿色化学理念,建设美丽家园。下列做法不符合绿色化学理念的是
A.回收利用废旧铜制品
B.焚烧、填埋废弃塑料
C.以水代替有机溶剂发展水性涂料
D.乙烯制备环氧乙烷实现原子利用率100%
8.我国化学家用氧化铟(In2O3)负载的Ag催化剂实现了CO2加氢制备CH3OH,原理如图所示。关于该反应的说法正确的是
A.发生了氧化反应
B.Ag催化剂不参与反应
C.22.4L 含有个氧原子
D.每消耗2mol 生成1mol
9.规范操作是实验安全的保障。下列操作符合实验安全要求的是
A.将未用完的Na丢入废液缸 B.用力吸闻集气瓶中SO2的气味
C.皮肤不慎接触烧碱立即用抹布擦 D.用漏斗向酒精灯缓慢注入适量酒精
10.氯气可用于自来水杀菌、消毒。有关氯气的叙述不正确的是
A.Cl2具有强氧化性 B.纯净的H2能在Cl2中安静地燃烧
C.氯气、液氯和氯水是同一种物质 D.加热条件下浓盐酸与MnO2反应制得Cl2
11.用如图装置除去CH4中的少量C2H4,溶液a为
A.稀盐酸 B.NaOH溶液 C.饱和食盐水 D.溴的CCl4溶液
12.物质的性质决定其用途。下列物质的性质与其用途相关的是
选项 性质 用途
A 受热易分解 用于泡沫灭火器
B NaClO溶液有碱性 用作漂白液
C 可与反应 用于呼吸面具
D 乙烯能在空气中燃烧 生产聚乙烯
A.A B.B C.C D.D
13.佳佳同学炒菜时不小心把少许食盐洒在炉火上,可看到
A.黄色火焰 B.绿色火焰 C.紫色火焰 D.洋红色火焰
14.有机物构成了生机勃勃的生命世界,也是燃料、材料和食品等的重要来源。有机物
A.均易挥发、易燃烧
B.参与的化学反应常伴有副反应
C.仅含C、H两种元素
D.均易溶于酒精、苯等有机溶剂
15.检验芹菜中铁元素的实验操作有:①剪碎芹菜,研磨;②取少量滤液,滴加稀;③加入蒸馏水,搅拌,过滤;④滴加几滴KSCN溶液,振荡,观察。正确操作顺序为
A.③①④② B.①②③④ C.②①④③ D.①③②④
16.将铁片和铜片贴在浸润过稀硫酸的滤纸两侧,用导线连接电流计,制成简易电池,装置如图。关于该电池的说法正确的是
A.铜片上有产生
B.负极反应为
C.铁电极附近溶液中的增大
D.放电时电子流向:铜片→电流计→铁片
17.某工厂废水中含有大量、、和,其中可能大量存在的阴离子是
A. B. C. D.
18.对实验现象及其内涵的建构能发展学生的宏观辨识和微观探析素养。下列实验对应的离子方程式书写正确的是
选项 实验与现象 离子方程式
A 铝片插入CuSO4溶液,析出红色物质
B 稀H2SO4中滴加Ba(OH)2溶液,产生白色沉淀
C 在大理石上滴稀盐酸,产生气泡
D Fe2(SO4)3溶液中滴加氨水,产生红褐色沉淀
A.A B.B C.C D.D
19.一定条件下,恒容密闭容器中发生可逆反应。下列说法正确的是
A.和可完全转化为
B.平衡时,正、逆反应速率相等
C.充入,正、逆反应速率都降低
D.平衡时,、和的浓度一定相等
20.工业上从海水中提取镁的生产流程如图所示。关于该流程说法不正确的是
A.煅烧:贝壳高温分解生成
B.沉淀:海水与石灰乳反应获得
C.中和:与盐酸反应生成
D.电解:熔融电解生成金属Mg和
二、实验题
21.SO2可用作漂白剂、食品添加剂等。某兴趣小组用如下装置制取SO2,并验证其性质:
(1)盛放的仪器名称为___________。
(2)D装置用于吸收尾气。在答题卡虚线框内画出D装置图,并注明所用试剂___________。
(3)进行实验,观察并记录现象,做出相应解释。
实验操作 实验现象 分析与解释
打开装置A中的漏斗活塞 A装置中有气泡产生 化学方程式为___________
B装置中浸润过品红溶液的滤纸a的颜色___________ 具有___________作用
B装置中浸润过酸性溶液的滤纸b褪色 具有___________性
C装置中的现象是___________ 具有氧化性
三、元素或物质推断题
22.2021年10月16日,神舟十三号载人飞船与“天和”核心舱成功径向交会对接。化学助力我国航天事业发展,借助元素周期表可以认识各种材料的组成、结构和性质。a~h8种元素在元素周期表中的位置如下:
周期 ⅠA 0
1 a ⅡA … ⅢA ⅣA ⅤA ⅥA ⅦA
2 b c d e
3 f g h
(1)液态a单质和液态d单质可用作火箭推进剂,二者反应的化学方程式为___________。常温下,与a单质更容易反应的是___________(填“c”或“d”或“e”)单质。
(2)空间站再生式生活保障系统能将尿液处理得到再生水,再生水后处理需除去残留的有机物和含N无机物。按示例,在答题卡相应位置补齐连线。_________
(3)我国科学家自主研发了用于航空航天的f合金材料。f原子的核外电子排布为___________;h最高价氧化物对应的水化物的稀溶液,与f的最高价氧化物反应的离子方程式为___________。
(4)g单质在太阳能电池和芯片制造等领域有着重要应用。g最高价氧化物的化学式为___________;b和g组成的化合物可作为新型陶瓷材料,其化学式为___________。上述g的两种化合物含有的化学键类型均为___________。
四、有机推断题
23.乙酰水杨酸,俗称阿司匹林,具有解热、镇痛、消炎和免疫调节等作用。阿司匹林可由水杨酸与乙酸酐反应得到:
已知:
(1)乙酸酐的分子式为___________。
(2)水杨酸与阿司匹林含有的相同含氧官能团是___________(写名称)。
(3)乙酸()和甲酸甲酯()互为___________。
(4)由水杨酸与乙酸酐制备阿司匹林的反应类型是___________ (填字母)。
A.取代反应 B.加成反应 C.聚合反应
(5)与乙酸类似,阿司匹林可发生酯化反应。下列物质能与阿司匹林发生酯化反应的是___________(填字母)。
A. B. C. D.
(6)补充完整以为原料合成乙酸酐的路线(写化合物的结构简式);__________
→___________→___________→
五、填空题
24.2021年10月20日,央视新闻报道:
a.2022年冬奥会火种抵达北京,火炬传递方案确定;
b.我国自主研制的世界最大推力整体式固体火箭发动机试车成功;
c.我国将加快推进汽车动力电池回收利用立法。
(1)关于奥运火炬燃料、固体火箭发动机燃料和汽车动力电池,下列说法正确的是___________(填字母)。
A.作为奥运火炬燃料的主要成分,丙烷和丁烷互为同系物
B.固体火箭发动机燃料燃烧时,发生剧烈氧化还原反应
C.汽车动力电池只能将化学能转化为电能
(2)结合上述新闻报道,从多个角度谈谈你的认识___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】树林中空气含有大量的水蒸气,形成气溶胶,当有光照射时,从树叶中间透过光束就会在胶体中形成一条光亮的通路,这个现象为丁达尔效应,故选D。
2.C
【详解】按金属活动性顺序表,金、银和铜在金属活动性顺序表中都排在氢的后面,故都不能与稀盐酸反应,锡排在氢的前面,能与稀盐酸反应;
选C。
3.A
【详解】A.原子核外电子在核外排布在能量不连续的电子层中,由里向外能量依次升高,故K层电子的能量低于L层,A错误;
B.原子核外电子排布遵循能量最低原则,即核外电子总是优先排在离核近的能量低的电子层里,即总是从K层开始填充,B正确;
C.由核外电子排布规律可知,每一层最多排布的电子为2n2个(n为电子层序数),故第二层即L层最多能容纳8个电子,C正确;
D.原子由原子核与核外电子构成,D正确;
故答案为:A。
4.C
【详解】A.灼热的铜丝伸入乙醇中时,可能因为温度过高而产生试管炸裂、液体飞溅现象,所以实验操作中需要护目镜保护眼睛,A不合题意;
B.使用酒精灯加热时,要注意防止酒精着火,为防止火灾发生,实验操作中要注意用火安全,B不合题意;
C.该实验中不需要使用电器,所以实验操作中不需要注意用电安全,C符合题意;
D.该实验中铜丝需要加热,要防止灼热的铜丝烧伤手,所以实验中要注意安全操作,D不合题意;
故答案为:C。
5.B
【详解】薄钢板属于铁和碳的合金,属于金属材料,故答案为:B。
6.C
【详解】A.O2是单质,既不是电解质也不是非电解质,故A不符合题意;
B.脂肪是有机物,不能在水溶液中和熔融状态下不导电,不属于电解质,故B不符合题意;
C.NaCl为溶于水或熔融状态下导电的化合物,属于电解质,故C符合题意;
D.葡萄糖是有机物,不能在水溶液中和熔融状态下不导电,属于非电解质,故D不符合题意;
答案为C。
7.B
【分析】根据绿色化学就是从源头上消除对环境的污染,其中原则最经济理论最符合绿色化学思想,分析解题。
【详解】A.回收利用废旧铜制品,可以减少环境污染,同时变废为宝,节约资源,符合绿色化学思想,A不合题意;
B.焚烧废弃塑料将释放出有毒有害气体,造成大气污染,而废弃塑料的深埋处理也会污染土壤,故不符合绿色化学的概念,B符合题意;
C.研制开发以水代替有机溶剂的化工涂料,可以减少环境污染,符合绿色化学思想,C不合题意;
D.乙烯制备环氧乙烷实现原子利用率100%,符合原子最经济理论,符合绿色化学思想,D不合题意;
故答案为:B。
8.A
【分析】由题干原理图示信息可知,该转化的总反应为:CO2+3H2CH3OH+H2O,据此分析解题。
【详解】A.由分析可知,转化中H2中H的化合价升高,即发生了氧化反应,A正确;
B.催化剂在反应过程中是参与反应的,只是反应前后其性质和质量保持不变,即Ag催化剂参与反应,B错误;
C.H2O为液体,且未告知标准状况,即无法计算22.4L 含有个氧原子,C错误;
D.由分析可知,每消耗3mol 生成1mol ,D错误;
故答案为:A。
9.D
【详解】A.Na性质活泼,会和废缸中的水剧烈反应,未用完的Na应放回原试剂瓶,A错误;
B.不能用力吸闻集气瓶中SO2的气味,否则可能中毒,B错误;
C.皮肤不慎接触烧碱应立即用大量的水冲洗,再涂上稀硼酸溶液,C错误;
D.向酒精灯中添加酒精要用漏斗缓慢注入,D正确;
故选D。
10.C
【详解】A.Cl2能与大多数金属、某些非金属和多种KI等还原剂反应,得到电子,氯元素化合价降低,具有强氧化性,A正确;
B.点燃下氢气和氯气发生反应产生氯化氢气体,纯净的H2能在Cl2中安静地燃烧, B正确;
C. 氯气和液氯都是纯净物、由氯分子构成,氯水是混合物,是氯气的水溶液, C不正确;
D. 加热条件下浓盐酸与MnO2发生氧化还原反应生成氯气,该反应可用于在实验室制Cl2,D正确;
答案选C。
11.D
【详解】A.CH4和C2H4均不与稀盐酸反应,不能用稀盐酸来除去CH4中的C2H4,A不合题意;
B.CH4和C2H4均不与NaOH溶液反应,不能用NaOH溶液来除去CH4中的C2H4,B不合题意;
C.CH4和C2H4均不与饱和食盐水反应,不能用饱和食盐水来除去CH4中的C2H4,C不合题意;
D.乙烯能与溴单质反应生成无色液体1,2-二溴乙烷而溶于CCl4中,CH4不反应,故可用溴的CCl4溶液来除去CH4中的C2H4,D符合题意;
故答案为:D。
12.C
【详解】A.泡沐灭火器中硫酸铝和碳酸氢钠溶液灭火,原理,A错误;
B.NaClO具有强氧化性,能漂白,可用作漂白液,B错误;
C.Na2O2与CO2反应生成氧气,用作呼吸面具,C正确;
D.乙烯发生加聚反应生成聚乙烯,D错误;
故答案为:C。
13.A
【详解】钠的焰色为黄色,氯化钠在火焰上灼烧可看到黄色火焰;
答案为A。
14.B
【详解】A.不是所有的有机物均易挥发、易燃烧,如沸点很高的糖类、油脂、蛋白质等不易挥发,CCl4等不易燃烧,A错误;
B.有机物参与的化学反应往往比较复杂,常伴有副反应,故有机反应方程式中用“→”表示主要反应,B正确;
C.有机物包含烃和烃的衍生物,仅含C、H两种元素的化合物为烃,而烃的衍生物包含C、H之外的元素,C错误;
D.有些有机物难溶于乙醇,如酚醛树脂,D错误;
故答案为:B。
15.D
【详解】将芹菜粉碎加水浸泡后过滤,将滤液加入HNO3,将滤液中的铁元素氧化为铁离子,最后加入KSCN,溶液如果变为血红色,则证明溶液中含有铁离子;
故答案为:D。
16.B
【分析】将铁片和铜片贴在浸润过稀硫酸的滤纸两侧,用导线连接电流计,制成简易电池,该原电池中Fe作负极,电极反应为:Fe-2e-=Fe2+,Cu作正极,电极反应为:2H++2e-=H2↑,据此分析解题。
【详解】A.由分析可知,铜片上有H2产生,A错误;
B.由分析可知,Fe作负极,负极反应为,B正确;
C.由分析可知,H+由负极移向正极,即铁电极附近溶液中的减小,C错误;
D.原电池放电时电子流向:负极即铁片铁片→电流计→正极即铜片,D错误;
故答案为:B。
17.B
【详解】A.与氢离子结合成弱电解质H2SO3,故A错误;
B.与废水中的阳离子都能共存,故B正确;
C.与结合有强氧化性,能将废水中的氧化成,故C错误;
D.与会生成白色沉淀,不能大量共存,故D错误;
故答案选B。
18.A
【详解】A.铝片插入CuSO4溶液,析出红色物质,反应方程式为:2Al+3CuSO4=Al2(SO4)3+3Cu,故离子方程式为:,A正确;
B.稀H2SO4中滴加Ba(OH)2溶液,产生白色沉淀BaSO4和H2O,原离子方程式漏写了部分离子方程式,故正确离子方程式为:,B错误;
C.CaCO3是沉淀,在离子方程式书写时不能拆,故在大理石上滴稀盐酸,产生气泡的离子方程式为:,C错误;
D.已知氨水为弱碱,在离子方程式书写时不能拆,Fe2(SO4)3溶液中滴加氨水,产生红褐色沉淀的离子方程式为:,D错误;
故答案为:A。
19.B
【详解】A.此反应为可逆反应,不能反应完全,故A错误;
B.平衡时,正反应速率等于逆反应速率,生成和消耗的量相等,达到动态平衡,故B正确;
C.充入的为生成物,生成物浓度增大,使逆反应速率增大,正反应速率减小,故C错误;
D.平衡时,各组分浓度不再变化,但不一定相等,故D错误;
故答案选B。
20.A
【详解】A.贝壳的主要成分是CaCO3,故高温煅烧贝壳分解生成CaO,A错误;
B.海水中含有较多的Mg2+,故沉淀过程中海水与石灰乳反应获得Mg(OH)2,B正确;
C.由题干工艺流程图可知,中和过程为Mg(OH)2与盐酸反应生成MgCl2,C正确;
D.工业上采用电解熔融MgCl2的方法来制备金属Mg和Cl2,D正确;
故答案为:A。
21.(1)圆底烧瓶
(2)
(3) Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 红色褪去 漂白 还原 溶液变浑浊或有淡黄色沉淀生成
【分析】如题干实验装置可知,装置A为SO2的制备装置,原理为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,装置B为SO2的性质实验,装置C为SO2与H2S反应的装置以验证SO2的弱氧化性,反应原理为:2H2S+SO2=3S↓+2H2O,装置D为尾气吸收装置,可以用NaOH溶液来吸收多余的SO2,据此分析解题。
【详解】(1)由题干图示实验装置可知,盛放的仪器名称为圆底烧瓶,故答案为:圆底烧瓶;
(2)二氧化硫酸性气体尾气用浓的氢氧化钠吸收,装置为;
(3)打开装置A中的漏斗活塞,A装置中有气泡产生即制备出了SO2,该化学方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,SO2具有漂白性,能够漂白品红、纸张和草帽辫等,则B装置中浸润过品红溶液的滤纸a的颜色红色褪去,说明SO2具有漂白性,SO2具有强还原性,能够被酸性高锰酸钾溶液氧化,故B装置中浸润过酸性KMnO4溶液的滤纸b褪色,证明SO2具有还原性,C 装置为SO2与H2S反应的装置以验证SO2的弱氧化性,反应原理为:2H2S+SO2=3S↓+2H2O,C装置中的现象是溶液变浑浊或有淡黄色沉淀生成,故答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;红色褪去;漂白;还原;溶液变浑浊或有淡黄色沉淀生成。
22.(1) 2H2+O22H2O e
(2)
(3) 2、8、3 Al2O3+6H+=2Al3++3H2O
(4) SiO2 SiC 共价键(或极性共价键)
【分析】由题干部分元素周期表可知,a为H、b为C、c为N、d为O、e为F、f为Al、g为Si、h为S,据此分析解题。
【详解】(1)由分析可知,液态a单质即H2和液态d单质即O2可用作火箭推进剂,二者反应的化学方程式为2H2+O22H2O,元素的非金属越强,其单质与H2化合越容易,非金属性F>O>N,即常温下,与a单质更容易反应的是e单质,故答案为:2H2+O22H2O;e;
(2)NaNO3中N的化合价为+5价,属于硝酸盐,而NaNO2中N的化合价为+3价,属于亚硝酸盐,故答案为:;
(3)由分析可知,f为Al,Al是13号元素,故f原子的核外电子排布为:2、8、3;h为Cl,h最高价氧化物对应的水化物即HClO4的稀溶液,与f的最高价氧化物即Al2O3,二者反应的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:2、8、3;Al2O3+6H+=2Al3++3H2O;
(4)由分析可知,g为Si,则g最高价氧化物的化学式为SiO2,b即C和g为Si组成的化合物可作为新型陶瓷材料,其化学式为SiC,上述g的两种化合物即SiO2和SiC含有的化学键类型均为共价键(或极性共价键),故答案为:SiO2;SiC;共价键(或极性共价键)。
23.(1)C3H6O3
(2)羧基
(3)同分异构体
(4)A
(5)D
(6) CH3CHOCHCOOH 。
【分析】乙烯发生氧化反应生成乙醛,乙醛氧化为乙酸,2分子乙酸脱水生成乙酸酐,水杨酸和乙酸酐发生取代反应生成阿司匹林和乙酸。
【详解】(1)根据乙酸酐的结构简式,可知分子式为C3H6O3;
(2)水杨酸中含有羧基、羟基;阿司匹林含有羧基、酯基,含有的相同含氧官能团是羧基。
(3)乙酸()和甲酸甲酯()结构不同、分子式都是C2H4O2,互为同分异构体;
(4)由水杨酸与乙酸酐制备阿司匹林,水杨酸羟基上的H被-COCH3代替,反应类型是取代反应,选A。
(5)阿司匹林分子中含有羧基,含有羟基,阿司匹林能与乙醇发生酯化反应,选D。
(6)氧化为乙醛,乙醛氧化为乙酸,乙酸脱水生成乙酸酐,合成路线为 CH3CHOCHCOOH 。
24.(1)AB
(2)一方面,随着我国综合国力提升,我国在国际上的影响力与日俱增,科技发展也日新月异,取得了令人瞩目的成果。另一方面,我国极有大国担当,尤其在环境保护方面,积极促进资源的回收再利用,积极保护环境,为整个人类作出应有的贡献;
【详解】(1)A.作为奥运火炬燃料的主要成分,丙烷和丁烷结构相似,在分子组成上相差一个CH2原子团,二者属于同系物,故A正确;
B.固体火箭发动机燃料燃烧时,发生剧烈氧化还原反应,喷射出大量气体,故B正确;
C.汽车动力电池为可充电电池,放电时将化学能转化为电能,充电时将电能转化为化学能,故C错误;
故答案为:AB;
(2)一方面,随着我国综合国力提升,我国在国际上的影响力与日俱增,科技发展也日新月异,取得了令人瞩目的成果。另一方面,我国极有大国担当,尤其在环境保护方面,积极促进资源的回收再利用,积极保护环境,为整个人类作出应有的贡献;
故答案为:见解析。
答案第1页,共2页
答案第1页,共2页
同课章节目录
