第一章 第二节 课时3 电负性及其应用(18张)2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第一章 第二节 课时3 电负性及其应用(18张)2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-15 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
主要内容:电负性及其应用
第二节 课时3
电负性的提出
电负性的递变规律
电负性的应用
元素周期律
原子半径
电负性
电离能
原子半径的递变规律
原子半径的决定因素
电离能及其递变规律
电离能与化合价的联系
元素性质
复习
元素相互化合,可理解为原子之间产生化学作用力,形象地叫做化学键,原子中用于形成化学键的电子称为键合电子
1.键合电子
新概念
2.电负性
用来描述不同元素的原子对键合电子吸引力的大小,电负性越大的原子,对键合电子的吸引力越大。
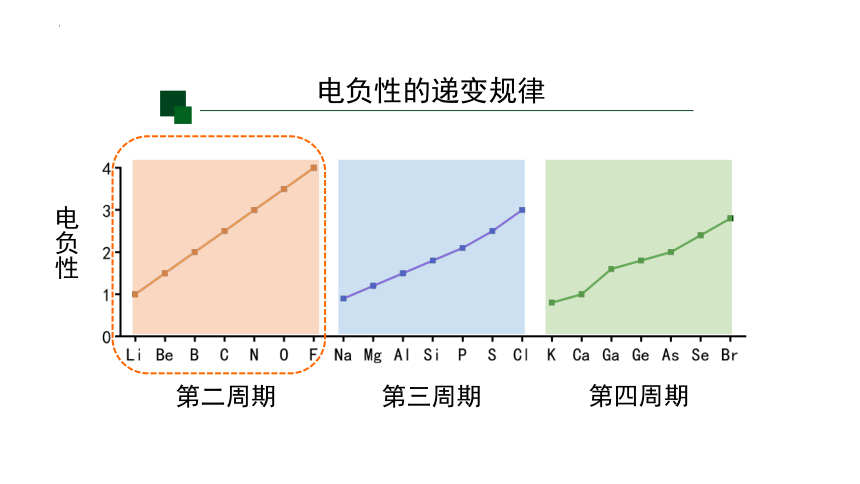
用实验数据进行了理论计算:以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性(稀有气体未计)。
问题:元素的电负性随原子序数的递增,同周期或者同族有什么规律?
电负性的递变规律
第二周期
第三周期
第四周期
电负性
电负性的递变规律
电负性
第IA族
第VIA族
第VIIA族
电负性的递变规律
电负性
电负性呈现周期性递变
H
F
键合电子
小结
电负性
不同元素的原子对吸引键合电子能力的大小
应用1:判断金属性与非金属性
电负性变大
电负性变大
非金属性增强
金属性减弱
非金属性增强,金属性减弱
应用1:判断金属性与非金属性
成键原子之间的电负性差值可作化学键类型的判断依据
应用2:判断化学键的类型
电负性的差值较小 共价键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性差 0.4
电负性 2.1
2.5
+
H
H
当两种原子电负性之差大于1.7时,以离子键为主,电负性之差小于1.7以共价键为主。
H
Cl
-1
+1
应用3:判断共价化合物中元素化合价的正负
显负价
显正价
H
C
H
H
H
H
Si
H
H
H
甲硅烷
甲烷
SiH4
+4
-1
CH4
-4
+1
SiH4 + 2O2 SiO2 + 2H2O
甲硅烷是一种较强还原剂
+4
-1
+1
+4
-2
-2
0
氧化产物
CH4 + 2O2 CO2 + 2H2O
点燃
氧化产物
-4
+1
+1
+4
-2
-2
0
应用3:判断共价化合物中元素的化合价的正负
电负性
金属性
应用
金属性/非金属性
元素类型
电负性
不同元素的原子对吸引键合电子能力的大小
电负性呈现周期性的递变
非金属性
小结
化学键类型
化合价
H
F
键合电子
总结
电负性
电离能
金属性
原子半径/电离能/电负性呈现周期性的递变
非金属性
原子半径
大
大
大
大
强
强
小
小
小
小
KBr溶液+氯水
(加入CCl4)
Cl2 + 2Br- 2Cl- + Br2
KI溶液+氯水
(加入CCl4)
Cl2 + 2I- 2Cl- + I2
KI溶液+溴水
(加入CCl4)
Br2 + 2I- 2Br- + I2
卤素的活泼性的顺序
卤素的化学性质
卤素单质的氧化性的顺序:
F2 > Cl2 > Br2 > I2
原子半径增大 非金属性逐渐减弱
卤素的活泼性的顺序
F > Cl > Br > I
卤素的化学性质
主要内容:电负性及其应用
第二节 课时3
电负性的提出
电负性的递变规律
电负性的应用
元素周期律
原子半径
电负性
电离能
原子半径的递变规律
原子半径的决定因素
电离能及其递变规律
电离能与化合价的联系
元素性质
复习
元素相互化合,可理解为原子之间产生化学作用力,形象地叫做化学键,原子中用于形成化学键的电子称为键合电子
1.键合电子
新概念
2.电负性
用来描述不同元素的原子对键合电子吸引力的大小,电负性越大的原子,对键合电子的吸引力越大。
用实验数据进行了理论计算:以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性(稀有气体未计)。
问题:元素的电负性随原子序数的递增,同周期或者同族有什么规律?
电负性的递变规律
第二周期
第三周期
第四周期
电负性
电负性的递变规律
电负性
第IA族
第VIA族
第VIIA族
电负性的递变规律
电负性
电负性呈现周期性递变
H
F
键合电子
小结
电负性
不同元素的原子对吸引键合电子能力的大小
应用1:判断金属性与非金属性
电负性变大
电负性变大
非金属性增强
金属性减弱
非金属性增强,金属性减弱
应用1:判断金属性与非金属性
成键原子之间的电负性差值可作化学键类型的判断依据
应用2:判断化学键的类型
电负性的差值较小 共价键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性差 0.4
电负性 2.1
2.5
+
H
H
当两种原子电负性之差大于1.7时,以离子键为主,电负性之差小于1.7以共价键为主。
H
Cl
-1
+1
应用3:判断共价化合物中元素化合价的正负
显负价
显正价
H
C
H
H
H
H
Si
H
H
H
甲硅烷
甲烷
SiH4
+4
-1
CH4
-4
+1
SiH4 + 2O2 SiO2 + 2H2O
甲硅烷是一种较强还原剂
+4
-1
+1
+4
-2
-2
0
氧化产物
CH4 + 2O2 CO2 + 2H2O
点燃
氧化产物
-4
+1
+1
+4
-2
-2
0
应用3:判断共价化合物中元素的化合价的正负
电负性
金属性
应用
金属性/非金属性
元素类型
电负性
不同元素的原子对吸引键合电子能力的大小
电负性呈现周期性的递变
非金属性
小结
化学键类型
化合价
H
F
键合电子
总结
电负性
电离能
金属性
原子半径/电离能/电负性呈现周期性的递变
非金属性
原子半径
大
大
大
大
强
强
小
小
小
小
KBr溶液+氯水
(加入CCl4)
Cl2 + 2Br- 2Cl- + Br2
KI溶液+氯水
(加入CCl4)
Cl2 + 2I- 2Cl- + I2
KI溶液+溴水
(加入CCl4)
Br2 + 2I- 2Br- + I2
卤素的活泼性的顺序
卤素的化学性质
卤素单质的氧化性的顺序:
F2 > Cl2 > Br2 > I2
原子半径增大 非金属性逐渐减弱
卤素的活泼性的顺序
F > Cl > Br > I
卤素的化学性质
