第五章化工生产中的重要非金属元素综合复习教案(表格式)高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章化工生产中的重要非金属元素综合复习教案(表格式)高一下学期化学人教版(2019)必修第二册 |
|
|
| 格式 | docx | ||
| 文件大小 | 624.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-15 23:21:41 | ||
图片预览


文档简介
年级 高一 学科 化学 活动时间
备课组长 主讲人 活动地点
组员
未参加人员
课题 第五章 化工生产中的重要非金属元素章节复习 课题总用课时数 1
教学目标 1.了解硫、氮及其化合物的性质,理解其相互之间的转化关系,会写常见的化学方程式。 2.了解氨气的实验室制法,进一步掌握气体制备的思路及其常见的实验装置。 3.理解喷泉实验,掌握喷泉实验实验的原理及实际应用。 4.了解无机非金属材料的性能及应用。 5.掌握硝酸与金属反应的相关计算原理和技巧。
教学重难点 1.硫、氮及其化合物的性质,理解其相互之间的转化关系,会写常见的化学方程式。 2.氨气的实验室制法及喷泉实验原理和应用。
学情分析 通过本章学习,充分认识某些化学过程对人类健康和社会发展带来的双重影响。既了解硫、氮及其化合物和无机非金属材料对人类社会发展的贡献;又熟知硫、氮及其化合物对环境的影响。如:工业生产和日常生活中大量使用化石燃料产生的二氧化硫、氮氧化物都能形成酸雨,严重威胁自然生态环境和人类生存环境。培养学生的环保意识,提升化学学科素养。
教学准备
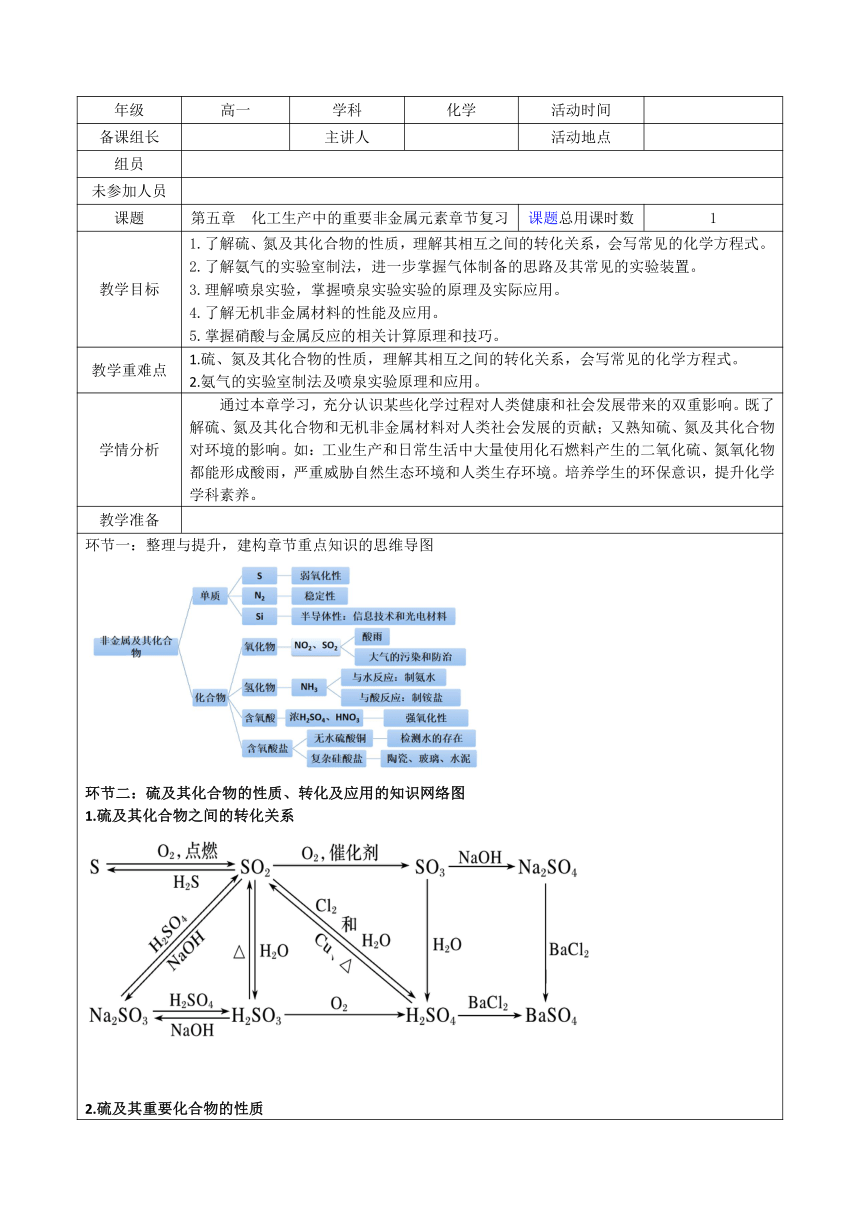
环节一:整理与提升,建构章节重点知识的思维导图 环节二:硫及其化合物的性质、转化及应用的知识网络图 1.硫及其化合物之间的转化关系 2.硫及其重要化合物的性质 3.硫及其重要化合物重点专题突破 1)二氧化硫的漂白性和还原性 例1 下列变化可以说明SO2具有漂白性的是( ) A.SO2通入溴水中,溴水褪色 B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去 C.SO2通入品红溶液中,溶液的红色褪去 D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去 例2 等物质的量的SO2、Cl2通入水中,所得的溶液( ) A.具有中性、漂白性 B.具有酸性、漂白性 C.只有漂白性 D.只有酸性 2)二氧化硫和二氧化碳的比较与鉴别 例3 下列溶液中能用来区别SO2和CO2气体的是( ) ①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液 A.①⑤ B.③④⑤ C.②⑥ D.②③④⑥ 例4 :如何检验某混合气体中含有SO2和CO2? 分析:SO2和CO2都是酸性氧化物,既有共同的性质又有差异,鉴别要应用它们性质上差异来区分, SO2有不同于CO2 的一些特性;SO2能使品红溶液褪色,使KMnO4溶液、溴水褪色,故先检验SO2,且确保SO2完全除尽,再检验CO2,故采用下列试剂及装置进行。 环节三:氮元素及其化合物的性质、转化及应用的知识网络图 1.氮及其化合物之间的转化关系 2.氮及其重要化合物的性质 3.氮及其重要化合物重点专题突破 1)喷泉实验的原理与判断 例5 如图是喷泉实验装置图,下列说法正确的是( ) A.烧瓶中的溶液呈红色,则原气体一定是SO2 B.形成喷泉的原因是烧瓶内压强大于外界大气压 C.烧瓶中的溶液呈蓝色,则原气体一定属于碱性气体 D.若将石蕊溶液改成氢氧化钠溶液,则CO、CO2均能形成喷泉 例6 如图的装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管,下列与实验事实不相符的是( ) A.CO2(浓NaOH溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉 C.SO2(浓NaOH溶液)/红色喷泉 D.HCl(AgNO3溶液)/白色喷泉 2)“浓酸反应变稀”对其反应的影响 例7 用NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.50 mL 18.4 mol·L-1的浓硫酸与足量的铜在加热条件下反应,生成SO2分子的数目为0.46NA B.3.2 g Cu与足量浓硝酸反应生成的气体为0.1 mol C.在标准状况下,含4 mol HCl的浓盐酸与足量的MnO2反应可生成22.4 L氯气 D.1 mol Cu在加热条件下与足量浓硫酸反应产生1 mol SO2 例8 化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是( ) A.铁片与过量浓硝酸(常温) B.铜粉与过量浓硝酸(常温) C.浓盐酸与过量二氧化锰(共热) D.浓硫酸与过量铜片(共热) 3)NO3-在离子共存判断中的特殊性 例9 下列各组离子,在指定溶液中一定能大量共存的是( ) A.在酸性溶液中:Na+、Ba2+、NO3-、CO32- B.在酸性溶液中:NH4+、Fe2+、SO42-、NO3- C.在pH>7的溶液中:Na+、K+、NO3-、Cl- D.常温下,在pH为7的溶液中:Ag+、K+、SO42-、Cl- 例10 在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是( ) ①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3 A.只有①② B.只有②④ C.只有①②③ D.①②③④ 4)硝酸与金属反应的计算 ①原子守恒:n(参加反应的HNO3)=n(硝酸盐中的NO3-)+n(还原产物中的N原子)=n(被氧化的硝酸)+2n(Cu2+) ②电子得失守恒法 HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属电子的物质的量。 ③电荷守恒法 HNO3过量时反应后溶液中(不考虑OH-)则有: ④利用离子方程式计算法 金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO3- 在H2SO4 提供H+的条件下能继续与金属反应,因此,此类题目应用离子方程式来计算。 环节四:无机非金属材料的知识建构 环节五:小结
板书设计 第五章 化工生产中的重要非金属元素章节复习 1、硫及其化合物的性质、转化及应用的知识网络图 2、氮元素及其化合物的性质、转化及应用的知识网络图 3、无机非金属材料的知识建构
作业布置
课后反思
备课组长 主讲人 活动地点
组员
未参加人员
课题 第五章 化工生产中的重要非金属元素章节复习 课题总用课时数 1
教学目标 1.了解硫、氮及其化合物的性质,理解其相互之间的转化关系,会写常见的化学方程式。 2.了解氨气的实验室制法,进一步掌握气体制备的思路及其常见的实验装置。 3.理解喷泉实验,掌握喷泉实验实验的原理及实际应用。 4.了解无机非金属材料的性能及应用。 5.掌握硝酸与金属反应的相关计算原理和技巧。
教学重难点 1.硫、氮及其化合物的性质,理解其相互之间的转化关系,会写常见的化学方程式。 2.氨气的实验室制法及喷泉实验原理和应用。
学情分析 通过本章学习,充分认识某些化学过程对人类健康和社会发展带来的双重影响。既了解硫、氮及其化合物和无机非金属材料对人类社会发展的贡献;又熟知硫、氮及其化合物对环境的影响。如:工业生产和日常生活中大量使用化石燃料产生的二氧化硫、氮氧化物都能形成酸雨,严重威胁自然生态环境和人类生存环境。培养学生的环保意识,提升化学学科素养。
教学准备
环节一:整理与提升,建构章节重点知识的思维导图 环节二:硫及其化合物的性质、转化及应用的知识网络图 1.硫及其化合物之间的转化关系 2.硫及其重要化合物的性质 3.硫及其重要化合物重点专题突破 1)二氧化硫的漂白性和还原性 例1 下列变化可以说明SO2具有漂白性的是( ) A.SO2通入溴水中,溴水褪色 B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去 C.SO2通入品红溶液中,溶液的红色褪去 D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去 例2 等物质的量的SO2、Cl2通入水中,所得的溶液( ) A.具有中性、漂白性 B.具有酸性、漂白性 C.只有漂白性 D.只有酸性 2)二氧化硫和二氧化碳的比较与鉴别 例3 下列溶液中能用来区别SO2和CO2气体的是( ) ①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液 A.①⑤ B.③④⑤ C.②⑥ D.②③④⑥ 例4 :如何检验某混合气体中含有SO2和CO2? 分析:SO2和CO2都是酸性氧化物,既有共同的性质又有差异,鉴别要应用它们性质上差异来区分, SO2有不同于CO2 的一些特性;SO2能使品红溶液褪色,使KMnO4溶液、溴水褪色,故先检验SO2,且确保SO2完全除尽,再检验CO2,故采用下列试剂及装置进行。 环节三:氮元素及其化合物的性质、转化及应用的知识网络图 1.氮及其化合物之间的转化关系 2.氮及其重要化合物的性质 3.氮及其重要化合物重点专题突破 1)喷泉实验的原理与判断 例5 如图是喷泉实验装置图,下列说法正确的是( ) A.烧瓶中的溶液呈红色,则原气体一定是SO2 B.形成喷泉的原因是烧瓶内压强大于外界大气压 C.烧瓶中的溶液呈蓝色,则原气体一定属于碱性气体 D.若将石蕊溶液改成氢氧化钠溶液,则CO、CO2均能形成喷泉 例6 如图的装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管,下列与实验事实不相符的是( ) A.CO2(浓NaOH溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉 C.SO2(浓NaOH溶液)/红色喷泉 D.HCl(AgNO3溶液)/白色喷泉 2)“浓酸反应变稀”对其反应的影响 例7 用NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.50 mL 18.4 mol·L-1的浓硫酸与足量的铜在加热条件下反应,生成SO2分子的数目为0.46NA B.3.2 g Cu与足量浓硝酸反应生成的气体为0.1 mol C.在标准状况下,含4 mol HCl的浓盐酸与足量的MnO2反应可生成22.4 L氯气 D.1 mol Cu在加热条件下与足量浓硫酸反应产生1 mol SO2 例8 化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是( ) A.铁片与过量浓硝酸(常温) B.铜粉与过量浓硝酸(常温) C.浓盐酸与过量二氧化锰(共热) D.浓硫酸与过量铜片(共热) 3)NO3-在离子共存判断中的特殊性 例9 下列各组离子,在指定溶液中一定能大量共存的是( ) A.在酸性溶液中:Na+、Ba2+、NO3-、CO32- B.在酸性溶液中:NH4+、Fe2+、SO42-、NO3- C.在pH>7的溶液中:Na+、K+、NO3-、Cl- D.常温下,在pH为7的溶液中:Ag+、K+、SO42-、Cl- 例10 在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是( ) ①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3 A.只有①② B.只有②④ C.只有①②③ D.①②③④ 4)硝酸与金属反应的计算 ①原子守恒:n(参加反应的HNO3)=n(硝酸盐中的NO3-)+n(还原产物中的N原子)=n(被氧化的硝酸)+2n(Cu2+) ②电子得失守恒法 HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属电子的物质的量。 ③电荷守恒法 HNO3过量时反应后溶液中(不考虑OH-)则有: ④利用离子方程式计算法 金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO3- 在H2SO4 提供H+的条件下能继续与金属反应,因此,此类题目应用离子方程式来计算。 环节四:无机非金属材料的知识建构 环节五:小结
板书设计 第五章 化工生产中的重要非金属元素章节复习 1、硫及其化合物的性质、转化及应用的知识网络图 2、氮元素及其化合物的性质、转化及应用的知识网络图 3、无机非金属材料的知识建构
作业布置
课后反思
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
