第2章《官能团与有机化学反应烃的衍生物》单元测试卷(含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 第2章《官能团与有机化学反应烃的衍生物》单元测试卷(含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修3 |
|
|
| 格式 | docx | ||
| 文件大小 | 969.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-15 23:44:40 | ||
图片预览



文档简介
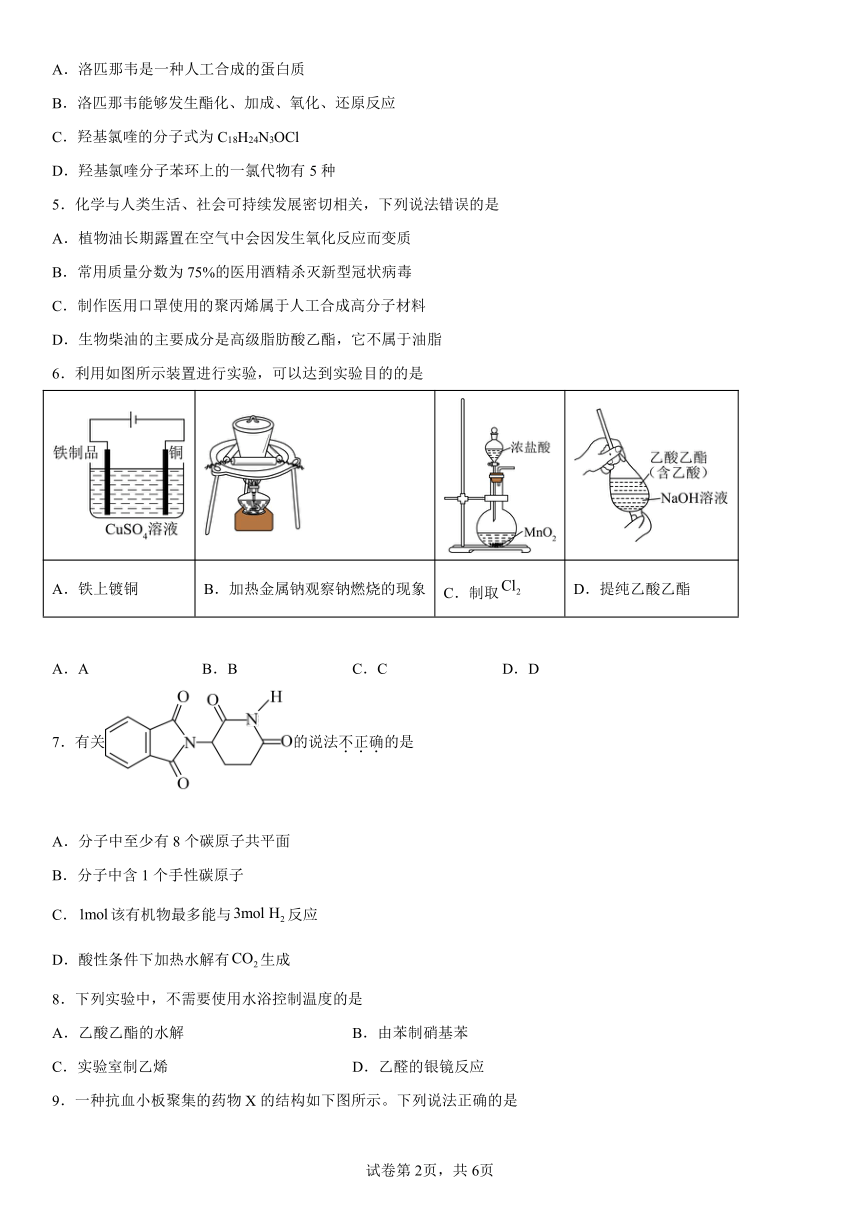
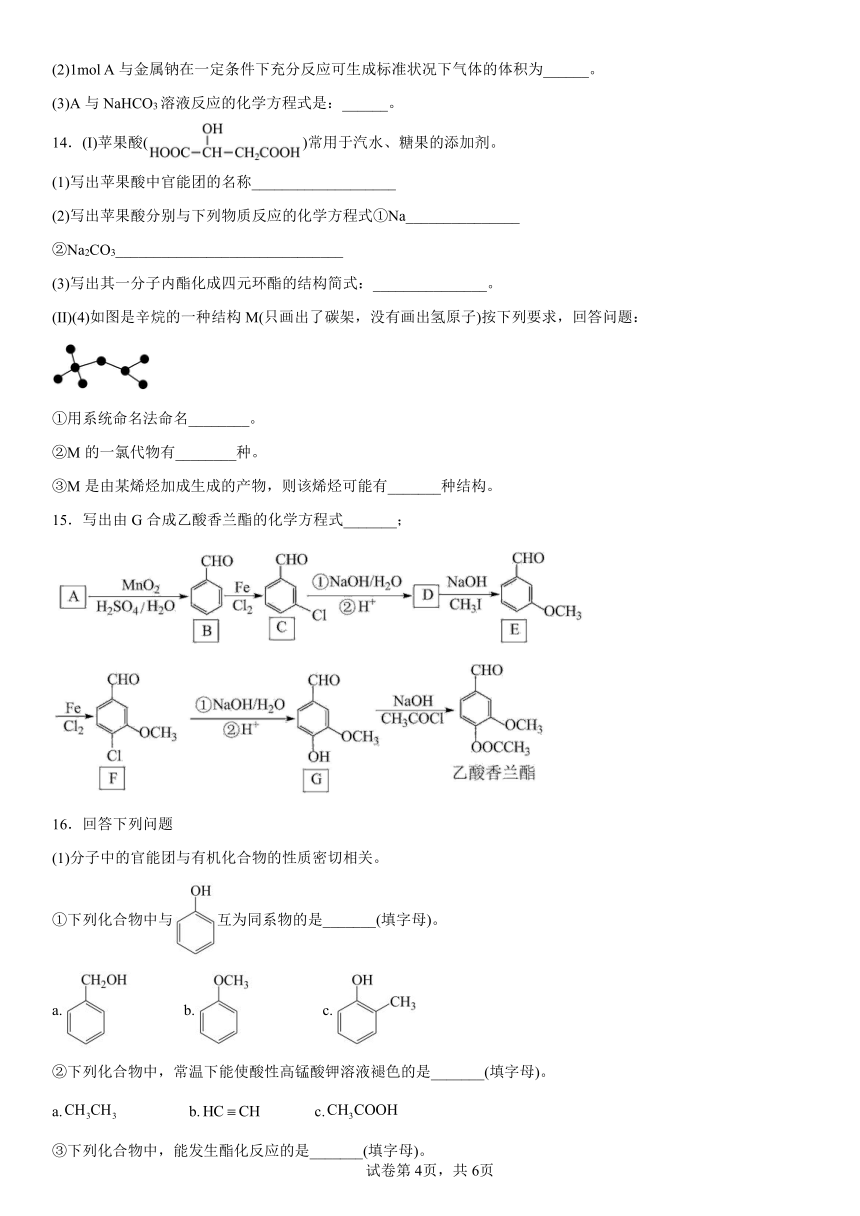
第2章《官能团与有机化学反应 烃的衍生物》单元测试卷
一、单选题
1.下列各组有机化合物中,互为同分异构体的是
A.甲酸和甲酸甲酯 B.乙酸和甲酸甲酯
C.乙酸和乙酸乙酯 D.甲酸和蚁酸
2.已知半胱氨酸的结构简式为,则下列说法错误的是
A.半胱氨酸属于-氨基酸
B.半胱氨酸是一种两性化合物
C.两分子半胱氨酸脱水形成的二肽的结构简式为
D. 可与溶液反应放出一种碱性气体
3.劳动创造幸福未来。下列劳动项目与所述的化学知识关联不合理的是
选项 劳动项目 化学知识
A 科学研究:燃煤脱硫 增大煤燃烧放出的热量
B 工厂生产:冶炼钢铁 涉及氧化还原反应
C 社会服务:推广使用免洗手酒精消毒液 酒精消毒液酒精能使蛋白质变性
D 家务劳动:饭后用热的纯碱溶液洗涤餐具 油脂在碱性条件下发生水解
A.A B.B C.C D.D
4.《新型冠状病毒肺炎诊疗方案(试行第七版)》中指出,洛匹那韦(Lopinavir)与氯喹类药物均可用于治疗新冠肺炎。洛匹那韦(Lopinavir)(图1)和羟基氯喹(图2)的结构分别如图所示,对这两种有机化合物描述正确的是
A.洛匹那韦是一种人工合成的蛋白质
B.洛匹那韦能够发生酯化、加成、氧化、还原反应
C.羟基氯喹的分子式为C18H24N3OCl
D.羟基氯喹分子苯环上的一氯代物有5种
5.化学与人类生活、社会可持续发展密切相关,下列说法错误的是
A.植物油长期露置在空气中会因发生氧化反应而变质
B.常用质量分数为75%的医用酒精杀灭新型冠状病毒
C.制作医用口罩使用的聚丙烯属于人工合成高分子材料
D.生物柴油的主要成分是高级脂肪酸乙酯,它不属于油脂
6.利用如图所示装置进行实验,可以达到实验目的的是
A.铁上镀铜 B.加热金属钠观察钠燃烧的现象 C.制取 D.提纯乙酸乙酯
A.A B.B C.C D.D
7.有关的说法不正确的是
A.分子中至少有8个碳原子共平面
B.分子中含1个手性碳原子
C.该有机物最多能与反应
D.酸性条件下加热水解有生成
8.下列实验中,不需要使用水浴控制温度的是
A.乙酸乙酯的水解 B.由苯制硝基苯
C.实验室制乙烯 D.乙醛的银镜反应
9.一种抗血小板聚集的药物X的结构如下图所示。下列说法正确的是
A.1个X含有2个手性碳原子
B.X中存在4种含氧官能团
C.1molX最多能与2molNaOH发生反应
D.1分子X中含有3个sp3杂化的C原子
10.下列物质提纯的方法正确的是
A 除去NO2中的NO 与足量O2混合
B 除去CO2中的SO2 通过足量的澄清石灰水
C 除去KCl溶液中的K2CO3 加入适量BaCl2溶液后过滤
D 除去乙酸中混有的乙醇 加入生石灰后蒸馏
A.A B.B C.C D.D
11.下列事实与盐类水解无关的是
A.明矾常用作净水剂 B.热的纯碱溶液去油污效果好
C.胆矾与石灰乳配成杀虫农药波尔多液 D.配制氯化铁溶液时将氯化铁溶于稀盐酸
12.下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++=CO2↑+H2O
B.甲酸溶液与新制氢氧化铜共热反应:2HCOOH+Cu(OH)2Cu2++2HCOO—+2H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O—+CO2+H2O→2C6H5OH+
D.乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH—CH3COO—++2Ag↓+3NH3↑+H2O
二、填空题
13.某有机物A的结构简式如图。
(1)1mol A与NaOH溶液充分反应,消耗NaOH的物质的量是______。
(2)1mol A与金属钠在一定条件下充分反应可生成标准状况下气体的体积为______。
(3)A与NaHCO3溶液反应的化学方程式是:______。
14.(I)苹果酸()常用于汽水、糖果的添加剂。
(1)写出苹果酸中官能团的名称___________________
(2)写出苹果酸分别与下列物质反应的化学方程式①Na_______________
②Na2CO3______________________________
(3)写出其一分子内酯化成四元环酯的结构简式:_______________。
(II)(4)如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子)按下列要求,回答问题:
①用系统命名法命名________。
②M的一氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
15.写出由G合成乙酸香兰酯的化学方程式_______;
16.回答下列问题
(1)分子中的官能团与有机化合物的性质密切相关。
①下列化合物中与互为同系物的是_______(填字母)。
a. b. c.
②下列化合物中,常温下能使酸性高锰酸钾溶液褪色的是_______(填字母)。
a. b. c.
③下列化合物中,能发生酯化反应的是_______(填字母)。
a. b. c.
(2)化合物X()是一种合成液晶材料的化工原料。
①1mol X在一定条件下最多能与_______发生加成反应。
②X在酸性条件下水解可生成和_______(用结构简式表示)。
③分子中最多有_______个碳原子共平面。
(3)化合物D是一种医药中间体,可通过下列方法合成。
①D中含氧官能团有_______和_______(填名称)。
②C→D的反应中有HCl生成,则M的结构简式为_______。
③E是A的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,能发生银镜反应,能与溶液发生显色反应。E的结构简式为_______(任写一种)。
17.回答下列问题:
(1)乙烯能使酸性高锰酸钾溶液褪色,发生的反应是_______反应(填反应类型)。
(2)乙烯能使溴水褪色,发生的反应是_______反应(填反应类型)。化学方程式:_______。
(3)在一定条件下,乙烯和乙烷都能制得氯乙烷,据此回答问题:
①由乙烷制备氯乙烷的化学方程式:_______,该反应类型属于_______反应。
②由乙烯制备氯乙烷的化学方程式为:_______,该反应类型属于_______反应。
③比较两种方法,第_______种方法较好,其原因是_______。
18.I.糖类是人体基本营养物质,在试管中加入0.5g淀粉和4mL20%的硫酸,加热3min~4min。请回答下列问题:
(1)淀粉完全水解生成的有机物分子式为______
(2)若要检验淀粉已经发生了水解,操作方法及实验现象为______。
(3)在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
过程①是______反应,过程③是______反应(填反应类型);上述物质中,互为同分异构体的是______(填字母代号)。
II.海水是重要的物质资源宝库,海水pH稳定在7.9-8.4之间,可用于烟道气中SO2的吸收。
(1)已知:25℃时,
H2CO3电离平衡常数K1 =4.3×10-7 K2=5. 6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10 -8
海水中含有的HCO可用于吸收SO2,该过程的离子方程式是______。
(2)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是______
②上述方式使处理后海水pH升高的原因是______
(3)科学家还研究了转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为______
19.纤维素是由很多单糖单元构成的,每一个单糖单元有三个醇羟基,因此纤维素能够表现出醇的一些性质,如生成硝酸酯、乙酸酯等。
(1)试写出生成纤维素硝酸酯和纤维素乙酸酯的化学方程式_____。
(2)工业上把酯化比较安全、含氮量高的纤维素硝酸酯叫做火棉,火棉可用来制造无烟火药,试简述可做火药的理由_____。
(3)纤维素乙酸酯俗名醋酸纤维,常用作电影胶片的片基。试分析醋酸纤维和硝酸纤维哪个容易着火,为什么?_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.甲酸的分子式为CH2O2,甲酸甲酯的分子式为C2H4O2,甲酸和甲酸甲酯的分子式不同,不可能互为同分异构体,故A错误;
B.乙酸和甲酸甲酯的分子式相同,都为C2H4O2,结构不同,互为同分异构体,故B正确;
C.乙酸的分子式为C2H4O2,乙酸乙酯的分子式为C4H8O2,乙酸和乙酸乙酯的分子式不同,不可能互为同分异构体,故C错误;
D.甲酸和蚁酸的分子式为CH2O2,甲酸和蚁酸的分子式相同是同种物质,故D错误;
故选B。
2.C
【详解】A.半胱氨酸中氨基连在羧酸的α位上,属于α-氨基酸,故A正确;
B.半胱氨酸含有羧基,具有酸性;含有氨基,具有碱性,故B正确;
C.肽键的形成是氨基酸中的氨基和另一分子中的羧基缩掉一分子水,中不含肽键,故C错误;
D.属于铵盐,铵盐与碱反应生成氨气,故D正确;
故选C。
3.A
【详解】A.燃煤脱硫可以减少煤燃烧时二氧化硫的排放,减少酸雨,与燃烧放出的热量无关,A错误;
B.工厂利用CO还原氧化铁等铁的氧化物从而得到铁单质,涉及氧化还原反应,B正确;
C.推广使用免洗手消毒液,利用了体积分数为75%的酒精,能够使蛋白质变性,杀死细菌, C正确;
D.纯碱溶液即为碳酸钠溶液,碳酸钠电离产生的碳酸根在水溶液中能水解产生氢氧根,油脂在碱性条件下,能发生皂化反应,即水解反应,能清洗餐具上的油脂,D正确;
故选A。
4.B
【详解】A.蛋白质是高分子化合物,A项不符合题意;
B.该物质有羟基,可发生酯化反应;有苯环,可发生加成,加氢还原反应;有机物可发生氧化反应,B项符合题意;
C.分子式应为C18H26N3OCl,C项不符合题意;
D.羟基氯喹分子中苯环上的一氯代物有3种,D项不符合题意;
故正确选项为B
5.B
【详解】A.植物油含有碳碳双键,长期露置在空气中会因发生氧化反应而变质,A正确;
B.酒精能使蛋白质变性,医疗上常用体积分数为75%的医用酒精杀菌消毒,不是质量分数为75%的医用酒精,B错误;
C.聚丙烯是由丙烯通过加聚反应制得,属于人工合成高分子材料,C正确;
D.油脂是高级脂肪酸和甘油形成酯,而生物柴油的主要成分是高级脂肪酸乙酯,故不属于油脂,D正确;
故选B。
6.B
【详解】A.电镀时镀层金属作阳极,待镀器件作阴极,A错误;
B.可在坩埚中进行固体的灼烧,观察现象,B正确;
C.与浓盐酸反应需加热,C错误;
D.会使乙酸乙酯水解,应使用饱和碳酸钠溶液,D错误;
故选B。
7.D
【详解】A.已知苯环上的所有原子共平面,由题干所示有机物结构简式可知,分子中至少有8个碳原子共平面,A正确;
B.手性碳原子是指同时连有四个互不相同的原子或原子团的碳原子,由题干图示信息可知,分子中含1个手性碳原子,如图所示,B正确;
C.由题干图示有机物结构简式可知,该有机物最多能与反应即和苯环加成,C正确;
D.由题干图示有机物结构简式可知,酸性条件下加热水解,产物中不存在碳酸,即不能生成,可以生成氨气,D错误;
故答案为:D。
8.C
【详解】A.乙酸乙酯的水解需要水浴加热,故A不符合题意;
B.由苯制硝基苯在50℃-60℃条件下进行,需用水浴加热,并用温度计控制温度,故B不符合题意;
C.实验室利用浓硫酸的脱水性,以乙醇为原料制取乙烯(C2H4),反应的化学方程式为:CH3CH2OHC2H4↑+H2O,从反应方程式的条件看出,因水浴温度不可能达到170℃,应使用酒精灯直接加热,故C符合题意;
D.乙醛的银镜反应是温水浴加热,故D不符合题意;
故答案为C。
9.A
【详解】A.根据手性碳原子的定义,该有机物中含有手性碳原子位置如图所示 ,该有机物有2个手性碳原子,故A正确;
B.根据结构简式,含氧官能团为酯基、醚键和羟基,有三种含氧官能团,故B错误;
C.该有机物中能与NaOH反应的官能团是酯基,但 ,1mol该酯基消耗2molNaOH,因此1mol该有机物最多消耗3molNaOH,故C错误;
D.四个单键的C原子,其杂化类型为sp3,因此该有机物中sp3杂化的C原子有7个,故D错误;
答案为A。
10.C
【详解】A.O2过量,过量的O2无法除去,会导致引入新的杂质,不能达到除杂目的,A错误;
B.CO2与SO2均能与澄清石灰水反应,不能达到除杂的目的,B错误;
C.BaCl2溶液适量,K2CO3与BaCl2反应产生BaCO3沉淀和KCl,然后过滤除去BaCO3沉淀,就得到纯净KCl溶液,C正确;
D.生石灰能与乙酸反应生成乙酸钙和水,将被提纯的原物质除掉,不符合除杂原则,D错误;
故合理选项是C。
11.C
【详解】A.明矾的化学式为KAl(SO4)212H2O,其水溶液中的Al3+会发生水解,形成Al(OH)3胶体,可以吸附水中悬浮的固体小颗粒,使之形成沉淀而从水中析出,起到净水作用,与水解有关,A不符合题意;
B.纯碱为Na2CO3,在水溶液中显碱性,加热促进水解,溶液碱性增强,而油脂属于酯类,在碱性条件下水解,故纯碱能除油污与水解有关,B不符合题意;
C.波尔多液是胆矾、石灰乳和水按一定的质量比配成,能杀菌的原因是铜离子使蛋白质变性,从而失去活性,和盐类水解无关,C符合题意;
D.氯化铁溶液中的Fe3+会水解生成Fe(OH)3和HCl,加入稀盐酸可以抑制Fe3+的水解,与水解有关,D不符合题意;
故答案为:C。
12.D
【详解】A.乙酸与碳酸钠溶液反应生成乙酸钠、二氧化碳和水,反应的离子方程式为2CH3COOH+= 2CH3COO-+CO2↑+H2O,故A错误;
B.碱性条件下,甲酸溶液与新制氢氧化铜共热反应生成碳酸根离子、氧化亚铜沉淀和水,反应的离子方程式为HCOOH+2Cu(OH)2+2OH-+Cu2O↓+4H2O,故B错误;
C.苯酚钠溶液与少量二氧化碳反应生成苯酚和碳酸氢钠,反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+,故C错误;
D.乙醛溶液与足量的银氨溶液共热发生银镜反应生成醋酸铵、银、氨气和水,反应的离子方程式为CH3CHO+2[Ag(NH3)2]++2OH--CH3COO-++2Ag↓+3NH3↑+H2O,故D正确;
故选D。
13. 2mol 33.6L +NaHCO3→+H2O+CO2↑
【详解】(1)A中含有的酚羟基、羧基能和NaOH反应,因此1mol A与NaOH溶液充分反应,消耗NaOH的物质的量是2mol;
(2)A中含有的酚羟基、羧基、醇羟基均能和Na反应产生氢气,因此1mol A与金属钠在一定条件下充分反应可生成1.5mol氢气,在标准状况下气体的体积为1.5mol×22.4L/mol=33.6L;
(3)A中只有羧基能和NaHCO3溶液反应,反应的化学方程式为+NaHCO3→+H2O+CO2↑。
14. 羟基、羧基 2+6Na→2+3H2↑ +Na2CO3→+H2O+CO2↑ 2,2,4-三甲基戊烷 4 2
【分析】(I)该有机物中含有2个-COOH和1个-OH,可与钠反应生成氢气,与碳酸钠反应生成二氧化碳气体,可发生酯化反应,以此解答该题;
(II)①根据烷烃的系统命名方法命名;
②判断分子中H原子的种类,有几种不同位置的H原子,就有几种一氯取代产物;
③根据烯烃加成反应的特点,判断可能的结构,确定物质种类数目。
【详解】(I)(1)根据物质结构简式可知:该有机物含有的官能团为羟基、羧基;
(2)①有机物中含有2个-COOH和1个-OH,都可与钠反应生成氢气,反应的方程式为:2+6Na→2+3H2↑;
②分子中含有2个羧基,具有酸性,可与碳酸钠反应,反应的方程式为+Na2CO3→+CO2↑+H2O;
(3)分子中含有羧基和羟基,可发生酯化反应生成四元环酯,结构简式为 ;
(II)(4)①根据物质结构简式,选择分子中含有C原子数目最多的碳链为主链,该物质最长碳链上有5个C原子,从左端为起点,给主链上C原子编号,以确定支链的位置,该物质用烷烃的系统命名方法命名为:2,2,4-三甲基戊烷;
②根据物质分子结构可知:分子中含有4种不同位置的H原子,因此若H原子被Cl原子取代,得到的一氯取代产物有4种;
③烯烃与H2发生加成反应时,不饱和的碳碳双键断开,这两个H原子各结合1个H原子变为饱和C原子,若该物质是烯烃加成产物,则相应的烯烃可能的结构有:、, 因此烯烃可能的种类数目是2种。
【点睛】本题考查有机物的结构和性质及烯烃加成反应的特点的分析,注意把握有机物的官能团的性质,为解答该题的关键,侧重考查学生的分析能力。
15.+CH3COCl+HCl
【详解】由有机物的转化关系可知,在氢氧化钠作用下,与CH3COCl发生取代反应生成和氯化氢,反应的化学方程式为+CH3COCl+HCl,故答案为:+CH3COCl+HCl。
16.(1) c b c
(2) 4 (CH3)2CHCOOH 8
(3) 酯基 醚键 或
【解析】(1)
①为苯酚,属于酚,
a. 属于醇,虽然比苯酚多一个CH2,但结构不相似,不互为同系物,a错误;
b. 属于醚,虽然比苯酚多一个CH2,但结构不相似,不互为同系物,b错误;
c. 属于酚,比苯酚多一个CH2,互为同系物,c正确;
答案选c。
②a.为烷烃,性质较稳定,和酸性高锰酸钾溶液不反应,则乙烷不能使酸性高锰酸钾溶液褪色,a错误;
b.为炔烃,含有碳碳三键,所以能被酸性高锰酸钾溶液氧化,则乙炔能使酸性高锰酸钾溶液褪色,b正确;
c.为羧酸,不能使酸性高锰酸钾溶液褪色,c错误;
答案选b。
③能发生酯化反应的有醇和羧酸,
a.为卤代烃,不能发生酯化反应,a错误;
b.为醛,不能发生酯化反应,b错误;
c.为醇,能发生酯化反应,c正确;
答案选c。
(2)
①化合物X()中含有一个苯环和一个酮羰基,1 mol X在一定条件下最多能与4molH2发生加成反应。
②X在酸性条件下水解可生成和2-甲基丙酸,结构简式为(CH3)2CHCOOH。
③根据苯分子中12个原子共面及甲醛分子中4个原子共面可知,分子中最多有8个碳原子共平面。
(3)
①中含氧官能团有酯基和醚键。
②结合、的结构简式,由C→D的反应中有HCl生成,则应该是发生取代反应,M的结构简式为。
③E是的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,则分子高度对称,能发生银镜反应则含有醛基,能与FeCl3溶液发生显色反应则含有酚羟基,故符合条件的E的结构简式为 或。
17.(1)氧化
(2) 加成 CH2= CH2+Br2→CH2BrCH2Br
(3) CH3CH3+Cl2CH3CH2Cl+HCl 取代 CH2= CH2+HClCH3CH2Cl 加成 ② 第②种方法得到的产物较为纯净,而第①种方法会发生多种副反应,生成多种产物的混合物
【解析】(1)
乙烯能使酸性高锰酸钾溶液褪色,发生的反应是氧化反应;
(2)
烯能使溴水褪色,发生加成反应,化学方程式为CH2= CH2+Br2→CH2BrCH2Br;
(3)
①由乙烷制备氯乙烷的化学方程式为CH3CH3+Cl2CH3CH2Cl+HCl,该反应类型属于取代反应。
②由乙烯制备氯乙烷的化学方程式为:CH2= CH2+HClCH3CH2Cl ,该反应类型属于加成反应。
③比较两种方法,第②种方法得到的产物较为纯净,而第①种方法会发生多种副反应,生成多种产物的混合物。
18. 取少量水解后的溶液于试管中,先加足量的NaOH溶液使溶液呈碱性后,再加银氨溶液,水浴加热,若出现银镜现象,说明淀粉已经水解(或取少量水解后的溶液于试管中,先加足量的NaOH溶液使溶液呈碱性后,加新制氢氧化铜悬浊液,加热煮沸,若产生砖红色固体,说明淀粉已经水解) 消去 氧化 AC 与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2
【详解】I.(1)淀粉在稀硫酸催化下加热水解最终生成葡萄糖,葡萄糖的化学式为,故答案为:;
(2)要检验淀粉已经发生了水解,需要检验水解产物葡萄糖,先加碱中和硫酸后,再加银氨溶液,水浴加热观察是否有银镜生成,或者加新制氢氧化铜悬浊液,加热煮沸观察是否有砖红色的固体生成,故答案为:取少量水解后的溶液于试管中,先加足量的NaOH溶液使溶液呈碱性后,再加银氨溶液,水浴加热,若出现银镜现象,说明淀粉已经水解(或取少量水解后的溶液于试管中,先加足量的NaOH溶液使溶液呈碱性后,加新制氢氧化铜悬浊液,加热煮沸,若产生砖红色固体,说明淀粉已经水解)
(3)由代谢过程中的结构简式对比可知①发生的是醇羟基的消去反应,生成碳碳双键,过程②发生碳碳双键加成水的反应重新生成醇羟基,由此可知A与C互为同分异构体,过程③发生醇羟基的氧化生成羰基,过程④发生脱羧反应得到最终物质,故答案为:消去;氧化;AC;
II.(1)25℃时,H2CO3电离平衡常数K1=4.3×10 7 K2=5.6×10 11,H2SO3电离平衡常数K1=1.5×10 2 K2=6.0×10 8,酸性强弱H2SO3>H2CO3>HSO>HCO,海水中含有的HCO可用于吸收SO2,反应生成生成二氧化碳和亚硫酸氢根离子,反应的离子方程式为:,
故答案为:;
(2)①洗涤烟气后的海水呈酸性是亚硫酸氢根离子电离大于其水解,通入O2可将酸性海水中的硫(IV)氧化生成硫酸根离子,反应的离子方程式为:,
故答案为:;
②上述方式使处理后海水pH升高的原因是与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2,
故答案为:与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2;
(3)由电池装置可知,N电极上发生的反应为CO2转化成CO,电解质呈酸性,电极反应为:,故答案为:;
19.(1)+3nHO-NO2+3nH2O、+3nCH3COOH3nH2O+
(2)纤维素具有还原性,而-NO2具有氧化性,在纤维素中引入-NO2后,加热到一定温度时,-NO2可把纤维素氧化,生成CO2和H2O,-NO2自身变成N2。由于反应后,迅速产生大量气体,故火棉可用作炸药,该火药反应后无固体残留,为无烟火药。类似的例子还有2,4,6 三硝基甲苯(TNT)、硝酸甘油酯等
(3)硝酸纤维较醋酸纤维容易着火。因为硝酸纤维中含有氧化性基团硝基,容易发生氧化反应。而醋酸纤维中没有氧化性基团,要发生氧化反应起火,须借助空气中的氧,较难反应
【详解】(1)纤维素和硝酸反应生成纤维素硝酸酯,化学方程式+3nHO-NO2+3nH2O;纤维素和乙酸生成纤维素乙酸酯,化学方程式为+3nCH3COOH3nH2O+;
(2)火棉用来制造无烟火药的理由纤维素具有还原性,而-NO2具有氧化性,在纤维素中引入-NO2后,加热到一定温度时,-NO2可把纤维素氧化,生成CO2和H2O,-NO2自身变成N2。由于反应后,迅速产生大量气体,故火棉可用作炸药,该火药反应后无固体残留,为无烟火药。类似的例子还有2,4,6 三硝基甲苯(TNT)、硝酸甘油酯等;
(3)结合两者结构硝酸纤维较醋酸纤维容易着火。因为硝酸纤维中含有氧化性基团硝基,容易发生氧化反应。而醋酸纤维中没有氧化性基团,要发生氧化反应起火,须借助空气中的氧,较难反应。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列各组有机化合物中,互为同分异构体的是
A.甲酸和甲酸甲酯 B.乙酸和甲酸甲酯
C.乙酸和乙酸乙酯 D.甲酸和蚁酸
2.已知半胱氨酸的结构简式为,则下列说法错误的是
A.半胱氨酸属于-氨基酸
B.半胱氨酸是一种两性化合物
C.两分子半胱氨酸脱水形成的二肽的结构简式为
D. 可与溶液反应放出一种碱性气体
3.劳动创造幸福未来。下列劳动项目与所述的化学知识关联不合理的是
选项 劳动项目 化学知识
A 科学研究:燃煤脱硫 增大煤燃烧放出的热量
B 工厂生产:冶炼钢铁 涉及氧化还原反应
C 社会服务:推广使用免洗手酒精消毒液 酒精消毒液酒精能使蛋白质变性
D 家务劳动:饭后用热的纯碱溶液洗涤餐具 油脂在碱性条件下发生水解
A.A B.B C.C D.D
4.《新型冠状病毒肺炎诊疗方案(试行第七版)》中指出,洛匹那韦(Lopinavir)与氯喹类药物均可用于治疗新冠肺炎。洛匹那韦(Lopinavir)(图1)和羟基氯喹(图2)的结构分别如图所示,对这两种有机化合物描述正确的是
A.洛匹那韦是一种人工合成的蛋白质
B.洛匹那韦能够发生酯化、加成、氧化、还原反应
C.羟基氯喹的分子式为C18H24N3OCl
D.羟基氯喹分子苯环上的一氯代物有5种
5.化学与人类生活、社会可持续发展密切相关,下列说法错误的是
A.植物油长期露置在空气中会因发生氧化反应而变质
B.常用质量分数为75%的医用酒精杀灭新型冠状病毒
C.制作医用口罩使用的聚丙烯属于人工合成高分子材料
D.生物柴油的主要成分是高级脂肪酸乙酯,它不属于油脂
6.利用如图所示装置进行实验,可以达到实验目的的是
A.铁上镀铜 B.加热金属钠观察钠燃烧的现象 C.制取 D.提纯乙酸乙酯
A.A B.B C.C D.D
7.有关的说法不正确的是
A.分子中至少有8个碳原子共平面
B.分子中含1个手性碳原子
C.该有机物最多能与反应
D.酸性条件下加热水解有生成
8.下列实验中,不需要使用水浴控制温度的是
A.乙酸乙酯的水解 B.由苯制硝基苯
C.实验室制乙烯 D.乙醛的银镜反应
9.一种抗血小板聚集的药物X的结构如下图所示。下列说法正确的是
A.1个X含有2个手性碳原子
B.X中存在4种含氧官能团
C.1molX最多能与2molNaOH发生反应
D.1分子X中含有3个sp3杂化的C原子
10.下列物质提纯的方法正确的是
A 除去NO2中的NO 与足量O2混合
B 除去CO2中的SO2 通过足量的澄清石灰水
C 除去KCl溶液中的K2CO3 加入适量BaCl2溶液后过滤
D 除去乙酸中混有的乙醇 加入生石灰后蒸馏
A.A B.B C.C D.D
11.下列事实与盐类水解无关的是
A.明矾常用作净水剂 B.热的纯碱溶液去油污效果好
C.胆矾与石灰乳配成杀虫农药波尔多液 D.配制氯化铁溶液时将氯化铁溶于稀盐酸
12.下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++=CO2↑+H2O
B.甲酸溶液与新制氢氧化铜共热反应:2HCOOH+Cu(OH)2Cu2++2HCOO—+2H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O—+CO2+H2O→2C6H5OH+
D.乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH—CH3COO—++2Ag↓+3NH3↑+H2O
二、填空题
13.某有机物A的结构简式如图。
(1)1mol A与NaOH溶液充分反应,消耗NaOH的物质的量是______。
(2)1mol A与金属钠在一定条件下充分反应可生成标准状况下气体的体积为______。
(3)A与NaHCO3溶液反应的化学方程式是:______。
14.(I)苹果酸()常用于汽水、糖果的添加剂。
(1)写出苹果酸中官能团的名称___________________
(2)写出苹果酸分别与下列物质反应的化学方程式①Na_______________
②Na2CO3______________________________
(3)写出其一分子内酯化成四元环酯的结构简式:_______________。
(II)(4)如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子)按下列要求,回答问题:
①用系统命名法命名________。
②M的一氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
15.写出由G合成乙酸香兰酯的化学方程式_______;
16.回答下列问题
(1)分子中的官能团与有机化合物的性质密切相关。
①下列化合物中与互为同系物的是_______(填字母)。
a. b. c.
②下列化合物中,常温下能使酸性高锰酸钾溶液褪色的是_______(填字母)。
a. b. c.
③下列化合物中,能发生酯化反应的是_______(填字母)。
a. b. c.
(2)化合物X()是一种合成液晶材料的化工原料。
①1mol X在一定条件下最多能与_______发生加成反应。
②X在酸性条件下水解可生成和_______(用结构简式表示)。
③分子中最多有_______个碳原子共平面。
(3)化合物D是一种医药中间体,可通过下列方法合成。
①D中含氧官能团有_______和_______(填名称)。
②C→D的反应中有HCl生成,则M的结构简式为_______。
③E是A的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,能发生银镜反应,能与溶液发生显色反应。E的结构简式为_______(任写一种)。
17.回答下列问题:
(1)乙烯能使酸性高锰酸钾溶液褪色,发生的反应是_______反应(填反应类型)。
(2)乙烯能使溴水褪色,发生的反应是_______反应(填反应类型)。化学方程式:_______。
(3)在一定条件下,乙烯和乙烷都能制得氯乙烷,据此回答问题:
①由乙烷制备氯乙烷的化学方程式:_______,该反应类型属于_______反应。
②由乙烯制备氯乙烷的化学方程式为:_______,该反应类型属于_______反应。
③比较两种方法,第_______种方法较好,其原因是_______。
18.I.糖类是人体基本营养物质,在试管中加入0.5g淀粉和4mL20%的硫酸,加热3min~4min。请回答下列问题:
(1)淀粉完全水解生成的有机物分子式为______
(2)若要检验淀粉已经发生了水解,操作方法及实验现象为______。
(3)在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
过程①是______反应,过程③是______反应(填反应类型);上述物质中,互为同分异构体的是______(填字母代号)。
II.海水是重要的物质资源宝库,海水pH稳定在7.9-8.4之间,可用于烟道气中SO2的吸收。
(1)已知:25℃时,
H2CO3电离平衡常数K1 =4.3×10-7 K2=5. 6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10 -8
海水中含有的HCO可用于吸收SO2,该过程的离子方程式是______。
(2)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是______
②上述方式使处理后海水pH升高的原因是______
(3)科学家还研究了转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为______
19.纤维素是由很多单糖单元构成的,每一个单糖单元有三个醇羟基,因此纤维素能够表现出醇的一些性质,如生成硝酸酯、乙酸酯等。
(1)试写出生成纤维素硝酸酯和纤维素乙酸酯的化学方程式_____。
(2)工业上把酯化比较安全、含氮量高的纤维素硝酸酯叫做火棉,火棉可用来制造无烟火药,试简述可做火药的理由_____。
(3)纤维素乙酸酯俗名醋酸纤维,常用作电影胶片的片基。试分析醋酸纤维和硝酸纤维哪个容易着火,为什么?_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.甲酸的分子式为CH2O2,甲酸甲酯的分子式为C2H4O2,甲酸和甲酸甲酯的分子式不同,不可能互为同分异构体,故A错误;
B.乙酸和甲酸甲酯的分子式相同,都为C2H4O2,结构不同,互为同分异构体,故B正确;
C.乙酸的分子式为C2H4O2,乙酸乙酯的分子式为C4H8O2,乙酸和乙酸乙酯的分子式不同,不可能互为同分异构体,故C错误;
D.甲酸和蚁酸的分子式为CH2O2,甲酸和蚁酸的分子式相同是同种物质,故D错误;
故选B。
2.C
【详解】A.半胱氨酸中氨基连在羧酸的α位上,属于α-氨基酸,故A正确;
B.半胱氨酸含有羧基,具有酸性;含有氨基,具有碱性,故B正确;
C.肽键的形成是氨基酸中的氨基和另一分子中的羧基缩掉一分子水,中不含肽键,故C错误;
D.属于铵盐,铵盐与碱反应生成氨气,故D正确;
故选C。
3.A
【详解】A.燃煤脱硫可以减少煤燃烧时二氧化硫的排放,减少酸雨,与燃烧放出的热量无关,A错误;
B.工厂利用CO还原氧化铁等铁的氧化物从而得到铁单质,涉及氧化还原反应,B正确;
C.推广使用免洗手消毒液,利用了体积分数为75%的酒精,能够使蛋白质变性,杀死细菌, C正确;
D.纯碱溶液即为碳酸钠溶液,碳酸钠电离产生的碳酸根在水溶液中能水解产生氢氧根,油脂在碱性条件下,能发生皂化反应,即水解反应,能清洗餐具上的油脂,D正确;
故选A。
4.B
【详解】A.蛋白质是高分子化合物,A项不符合题意;
B.该物质有羟基,可发生酯化反应;有苯环,可发生加成,加氢还原反应;有机物可发生氧化反应,B项符合题意;
C.分子式应为C18H26N3OCl,C项不符合题意;
D.羟基氯喹分子中苯环上的一氯代物有3种,D项不符合题意;
故正确选项为B
5.B
【详解】A.植物油含有碳碳双键,长期露置在空气中会因发生氧化反应而变质,A正确;
B.酒精能使蛋白质变性,医疗上常用体积分数为75%的医用酒精杀菌消毒,不是质量分数为75%的医用酒精,B错误;
C.聚丙烯是由丙烯通过加聚反应制得,属于人工合成高分子材料,C正确;
D.油脂是高级脂肪酸和甘油形成酯,而生物柴油的主要成分是高级脂肪酸乙酯,故不属于油脂,D正确;
故选B。
6.B
【详解】A.电镀时镀层金属作阳极,待镀器件作阴极,A错误;
B.可在坩埚中进行固体的灼烧,观察现象,B正确;
C.与浓盐酸反应需加热,C错误;
D.会使乙酸乙酯水解,应使用饱和碳酸钠溶液,D错误;
故选B。
7.D
【详解】A.已知苯环上的所有原子共平面,由题干所示有机物结构简式可知,分子中至少有8个碳原子共平面,A正确;
B.手性碳原子是指同时连有四个互不相同的原子或原子团的碳原子,由题干图示信息可知,分子中含1个手性碳原子,如图所示,B正确;
C.由题干图示有机物结构简式可知,该有机物最多能与反应即和苯环加成,C正确;
D.由题干图示有机物结构简式可知,酸性条件下加热水解,产物中不存在碳酸,即不能生成,可以生成氨气,D错误;
故答案为:D。
8.C
【详解】A.乙酸乙酯的水解需要水浴加热,故A不符合题意;
B.由苯制硝基苯在50℃-60℃条件下进行,需用水浴加热,并用温度计控制温度,故B不符合题意;
C.实验室利用浓硫酸的脱水性,以乙醇为原料制取乙烯(C2H4),反应的化学方程式为:CH3CH2OHC2H4↑+H2O,从反应方程式的条件看出,因水浴温度不可能达到170℃,应使用酒精灯直接加热,故C符合题意;
D.乙醛的银镜反应是温水浴加热,故D不符合题意;
故答案为C。
9.A
【详解】A.根据手性碳原子的定义,该有机物中含有手性碳原子位置如图所示 ,该有机物有2个手性碳原子,故A正确;
B.根据结构简式,含氧官能团为酯基、醚键和羟基,有三种含氧官能团,故B错误;
C.该有机物中能与NaOH反应的官能团是酯基,但 ,1mol该酯基消耗2molNaOH,因此1mol该有机物最多消耗3molNaOH,故C错误;
D.四个单键的C原子,其杂化类型为sp3,因此该有机物中sp3杂化的C原子有7个,故D错误;
答案为A。
10.C
【详解】A.O2过量,过量的O2无法除去,会导致引入新的杂质,不能达到除杂目的,A错误;
B.CO2与SO2均能与澄清石灰水反应,不能达到除杂的目的,B错误;
C.BaCl2溶液适量,K2CO3与BaCl2反应产生BaCO3沉淀和KCl,然后过滤除去BaCO3沉淀,就得到纯净KCl溶液,C正确;
D.生石灰能与乙酸反应生成乙酸钙和水,将被提纯的原物质除掉,不符合除杂原则,D错误;
故合理选项是C。
11.C
【详解】A.明矾的化学式为KAl(SO4)212H2O,其水溶液中的Al3+会发生水解,形成Al(OH)3胶体,可以吸附水中悬浮的固体小颗粒,使之形成沉淀而从水中析出,起到净水作用,与水解有关,A不符合题意;
B.纯碱为Na2CO3,在水溶液中显碱性,加热促进水解,溶液碱性增强,而油脂属于酯类,在碱性条件下水解,故纯碱能除油污与水解有关,B不符合题意;
C.波尔多液是胆矾、石灰乳和水按一定的质量比配成,能杀菌的原因是铜离子使蛋白质变性,从而失去活性,和盐类水解无关,C符合题意;
D.氯化铁溶液中的Fe3+会水解生成Fe(OH)3和HCl,加入稀盐酸可以抑制Fe3+的水解,与水解有关,D不符合题意;
故答案为:C。
12.D
【详解】A.乙酸与碳酸钠溶液反应生成乙酸钠、二氧化碳和水,反应的离子方程式为2CH3COOH+= 2CH3COO-+CO2↑+H2O,故A错误;
B.碱性条件下,甲酸溶液与新制氢氧化铜共热反应生成碳酸根离子、氧化亚铜沉淀和水,反应的离子方程式为HCOOH+2Cu(OH)2+2OH-+Cu2O↓+4H2O,故B错误;
C.苯酚钠溶液与少量二氧化碳反应生成苯酚和碳酸氢钠,反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+,故C错误;
D.乙醛溶液与足量的银氨溶液共热发生银镜反应生成醋酸铵、银、氨气和水,反应的离子方程式为CH3CHO+2[Ag(NH3)2]++2OH--CH3COO-++2Ag↓+3NH3↑+H2O,故D正确;
故选D。
13. 2mol 33.6L +NaHCO3→+H2O+CO2↑
【详解】(1)A中含有的酚羟基、羧基能和NaOH反应,因此1mol A与NaOH溶液充分反应,消耗NaOH的物质的量是2mol;
(2)A中含有的酚羟基、羧基、醇羟基均能和Na反应产生氢气,因此1mol A与金属钠在一定条件下充分反应可生成1.5mol氢气,在标准状况下气体的体积为1.5mol×22.4L/mol=33.6L;
(3)A中只有羧基能和NaHCO3溶液反应,反应的化学方程式为+NaHCO3→+H2O+CO2↑。
14. 羟基、羧基 2+6Na→2+3H2↑ +Na2CO3→+H2O+CO2↑ 2,2,4-三甲基戊烷 4 2
【分析】(I)该有机物中含有2个-COOH和1个-OH,可与钠反应生成氢气,与碳酸钠反应生成二氧化碳气体,可发生酯化反应,以此解答该题;
(II)①根据烷烃的系统命名方法命名;
②判断分子中H原子的种类,有几种不同位置的H原子,就有几种一氯取代产物;
③根据烯烃加成反应的特点,判断可能的结构,确定物质种类数目。
【详解】(I)(1)根据物质结构简式可知:该有机物含有的官能团为羟基、羧基;
(2)①有机物中含有2个-COOH和1个-OH,都可与钠反应生成氢气,反应的方程式为:2+6Na→2+3H2↑;
②分子中含有2个羧基,具有酸性,可与碳酸钠反应,反应的方程式为+Na2CO3→+CO2↑+H2O;
(3)分子中含有羧基和羟基,可发生酯化反应生成四元环酯,结构简式为 ;
(II)(4)①根据物质结构简式,选择分子中含有C原子数目最多的碳链为主链,该物质最长碳链上有5个C原子,从左端为起点,给主链上C原子编号,以确定支链的位置,该物质用烷烃的系统命名方法命名为:2,2,4-三甲基戊烷;
②根据物质分子结构可知:分子中含有4种不同位置的H原子,因此若H原子被Cl原子取代,得到的一氯取代产物有4种;
③烯烃与H2发生加成反应时,不饱和的碳碳双键断开,这两个H原子各结合1个H原子变为饱和C原子,若该物质是烯烃加成产物,则相应的烯烃可能的结构有:、, 因此烯烃可能的种类数目是2种。
【点睛】本题考查有机物的结构和性质及烯烃加成反应的特点的分析,注意把握有机物的官能团的性质,为解答该题的关键,侧重考查学生的分析能力。
15.+CH3COCl+HCl
【详解】由有机物的转化关系可知,在氢氧化钠作用下,与CH3COCl发生取代反应生成和氯化氢,反应的化学方程式为+CH3COCl+HCl,故答案为:+CH3COCl+HCl。
16.(1) c b c
(2) 4 (CH3)2CHCOOH 8
(3) 酯基 醚键 或
【解析】(1)
①为苯酚,属于酚,
a. 属于醇,虽然比苯酚多一个CH2,但结构不相似,不互为同系物,a错误;
b. 属于醚,虽然比苯酚多一个CH2,但结构不相似,不互为同系物,b错误;
c. 属于酚,比苯酚多一个CH2,互为同系物,c正确;
答案选c。
②a.为烷烃,性质较稳定,和酸性高锰酸钾溶液不反应,则乙烷不能使酸性高锰酸钾溶液褪色,a错误;
b.为炔烃,含有碳碳三键,所以能被酸性高锰酸钾溶液氧化,则乙炔能使酸性高锰酸钾溶液褪色,b正确;
c.为羧酸,不能使酸性高锰酸钾溶液褪色,c错误;
答案选b。
③能发生酯化反应的有醇和羧酸,
a.为卤代烃,不能发生酯化反应,a错误;
b.为醛,不能发生酯化反应,b错误;
c.为醇,能发生酯化反应,c正确;
答案选c。
(2)
①化合物X()中含有一个苯环和一个酮羰基,1 mol X在一定条件下最多能与4molH2发生加成反应。
②X在酸性条件下水解可生成和2-甲基丙酸,结构简式为(CH3)2CHCOOH。
③根据苯分子中12个原子共面及甲醛分子中4个原子共面可知,分子中最多有8个碳原子共平面。
(3)
①中含氧官能团有酯基和醚键。
②结合、的结构简式,由C→D的反应中有HCl生成,则应该是发生取代反应,M的结构简式为。
③E是的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,则分子高度对称,能发生银镜反应则含有醛基,能与FeCl3溶液发生显色反应则含有酚羟基,故符合条件的E的结构简式为 或。
17.(1)氧化
(2) 加成 CH2= CH2+Br2→CH2BrCH2Br
(3) CH3CH3+Cl2CH3CH2Cl+HCl 取代 CH2= CH2+HClCH3CH2Cl 加成 ② 第②种方法得到的产物较为纯净,而第①种方法会发生多种副反应,生成多种产物的混合物
【解析】(1)
乙烯能使酸性高锰酸钾溶液褪色,发生的反应是氧化反应;
(2)
烯能使溴水褪色,发生加成反应,化学方程式为CH2= CH2+Br2→CH2BrCH2Br;
(3)
①由乙烷制备氯乙烷的化学方程式为CH3CH3+Cl2CH3CH2Cl+HCl,该反应类型属于取代反应。
②由乙烯制备氯乙烷的化学方程式为:CH2= CH2+HClCH3CH2Cl ,该反应类型属于加成反应。
③比较两种方法,第②种方法得到的产物较为纯净,而第①种方法会发生多种副反应,生成多种产物的混合物。
18. 取少量水解后的溶液于试管中,先加足量的NaOH溶液使溶液呈碱性后,再加银氨溶液,水浴加热,若出现银镜现象,说明淀粉已经水解(或取少量水解后的溶液于试管中,先加足量的NaOH溶液使溶液呈碱性后,加新制氢氧化铜悬浊液,加热煮沸,若产生砖红色固体,说明淀粉已经水解) 消去 氧化 AC 与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2
【详解】I.(1)淀粉在稀硫酸催化下加热水解最终生成葡萄糖,葡萄糖的化学式为,故答案为:;
(2)要检验淀粉已经发生了水解,需要检验水解产物葡萄糖,先加碱中和硫酸后,再加银氨溶液,水浴加热观察是否有银镜生成,或者加新制氢氧化铜悬浊液,加热煮沸观察是否有砖红色的固体生成,故答案为:取少量水解后的溶液于试管中,先加足量的NaOH溶液使溶液呈碱性后,再加银氨溶液,水浴加热,若出现银镜现象,说明淀粉已经水解(或取少量水解后的溶液于试管中,先加足量的NaOH溶液使溶液呈碱性后,加新制氢氧化铜悬浊液,加热煮沸,若产生砖红色固体,说明淀粉已经水解)
(3)由代谢过程中的结构简式对比可知①发生的是醇羟基的消去反应,生成碳碳双键,过程②发生碳碳双键加成水的反应重新生成醇羟基,由此可知A与C互为同分异构体,过程③发生醇羟基的氧化生成羰基,过程④发生脱羧反应得到最终物质,故答案为:消去;氧化;AC;
II.(1)25℃时,H2CO3电离平衡常数K1=4.3×10 7 K2=5.6×10 11,H2SO3电离平衡常数K1=1.5×10 2 K2=6.0×10 8,酸性强弱H2SO3>H2CO3>HSO>HCO,海水中含有的HCO可用于吸收SO2,反应生成生成二氧化碳和亚硫酸氢根离子,反应的离子方程式为:,
故答案为:;
(2)①洗涤烟气后的海水呈酸性是亚硫酸氢根离子电离大于其水解,通入O2可将酸性海水中的硫(IV)氧化生成硫酸根离子,反应的离子方程式为:,
故答案为:;
②上述方式使处理后海水pH升高的原因是与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2,
故答案为:与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2;
(3)由电池装置可知,N电极上发生的反应为CO2转化成CO,电解质呈酸性,电极反应为:,故答案为:;
19.(1)+3nHO-NO2+3nH2O、+3nCH3COOH3nH2O+
(2)纤维素具有还原性,而-NO2具有氧化性,在纤维素中引入-NO2后,加热到一定温度时,-NO2可把纤维素氧化,生成CO2和H2O,-NO2自身变成N2。由于反应后,迅速产生大量气体,故火棉可用作炸药,该火药反应后无固体残留,为无烟火药。类似的例子还有2,4,6 三硝基甲苯(TNT)、硝酸甘油酯等
(3)硝酸纤维较醋酸纤维容易着火。因为硝酸纤维中含有氧化性基团硝基,容易发生氧化反应。而醋酸纤维中没有氧化性基团,要发生氧化反应起火,须借助空气中的氧,较难反应
【详解】(1)纤维素和硝酸反应生成纤维素硝酸酯,化学方程式+3nHO-NO2+3nH2O;纤维素和乙酸生成纤维素乙酸酯,化学方程式为+3nCH3COOH3nH2O+;
(2)火棉用来制造无烟火药的理由纤维素具有还原性,而-NO2具有氧化性,在纤维素中引入-NO2后,加热到一定温度时,-NO2可把纤维素氧化,生成CO2和H2O,-NO2自身变成N2。由于反应后,迅速产生大量气体,故火棉可用作炸药,该火药反应后无固体残留,为无烟火药。类似的例子还有2,4,6 三硝基甲苯(TNT)、硝酸甘油酯等;
(3)结合两者结构硝酸纤维较醋酸纤维容易着火。因为硝酸纤维中含有氧化性基团硝基,容易发生氧化反应。而醋酸纤维中没有氧化性基团,要发生氧化反应起火,须借助空气中的氧,较难反应。
答案第1页,共2页
答案第1页,共2页
