第一章:化学反应与能量转化强化基础(含解析)2022-2023学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第一章:化学反应与能量转化强化基础(含解析)2022-2023学年上学期高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 813.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-16 10:24:10 | ||
图片预览



文档简介
第一章:化学反应与能量转化强化基础
一、单选题
1.氢气在氯气中燃烧时发出苍白色火焰,在反应过程中,破坏1 mol氢气中的化学键消耗的能量为a kJ,破坏1 mol氯气中的化学键消耗的能量为b kJ,形成1 mol HCl中的化学键释放的能量为c kJ,下列关系中正确的是 ( )
A.b>c B.a+b>2c
C.a+b2.在298K、100kPa时,已知:H2O(g)=O2(g)+H2(g) △H1
H2(g)+Cl2(g)= 2HCl(g) △H2
2H2O(g)+2Cl2(g)= 4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是( )
A.△H3 =2△H1+2△H2 B.△H3 =2△H1—△H2
C.△H3 =2△H1—2△H2 D.△H3 =2△H1+△H2
3.下列说法不正确的是
A.易腐垃圾富含生物质能
B.氢氧燃料电池放电时化学能全部转化为电能
C.石油的分馏、重油的催化裂化均能得到燃料油
D.从煤的干馏产物中分离出的甲苯可用于生产TNT
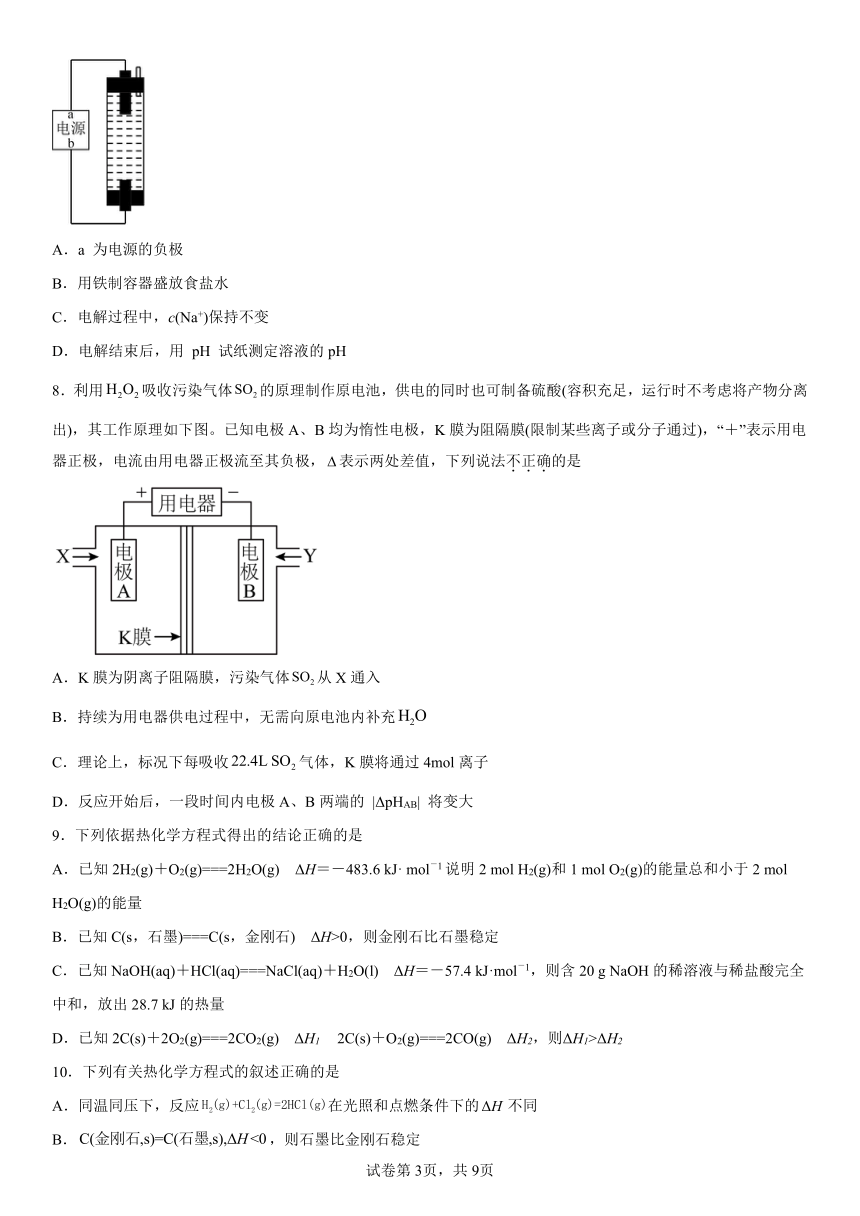
4.下图为镁-次氯酸盐电池的工作原理,下列说法中正确的是
A.a极为电池正极
B.电子由a极流向b极,再经过溶液回到a极
C.电池总反应式为
D.外电路中转移2mol电子,b极消耗2mol
5.我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示:
已知:几种物质中化学键的键能如表所示(假设O=O可表示中的化学键)。
化学键 H—O O=O H—H O—O
键能 467 498 436 138
若反应过程中分解了,则下列说法错误的是A.整个过程实现了光能向化学能的转换
B.总反应为
C.过程II有O—O单键生成并放出能量
D.过程III属于放热反应
6.该装置为锂钒氧化物二次电池,其成本较低,对环境无污染:在下图中用该电池电解含镍酸性废水可得到单质镍(已知:)。下列说法不正确的是
A.该电池充电时,A电极的电极反应式为
B.电解过程中,b中NaCl溶液的物质的量浓度会增大
C.当锂钒氧化物二次电池中有7gLi参与放电时,一定能得到29.35g镍
D.锂钒氧化物二次电池一般用非水溶液作为电解液
7.用石墨作电极电解饱和食盐水可制取 NaClO 消毒液,简易装置如图所示。下列说法正确的是
A.a 为电源的负极
B.用铁制容器盛放食盐水
C.电解过程中,c(Na+)保持不变
D.电解结束后,用 pH 试纸测定溶液的pH
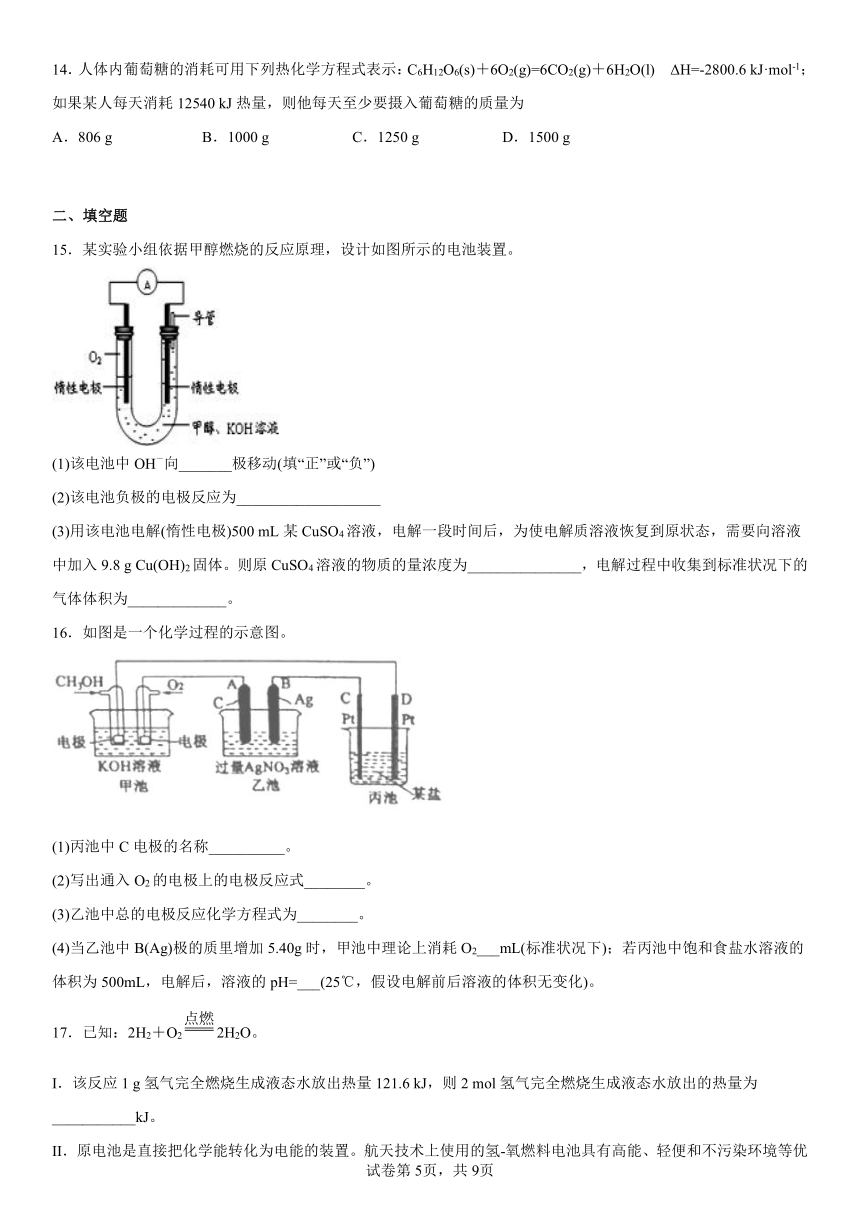
8.利用吸收污染气体的原理制作原电池,供电的同时也可制备硫酸(容积充足,运行时不考虑将产物分离出),其工作原理如下图。已知电极A、B均为惰性电极,K膜为阻隔膜(限制某些离子或分子通过),“+”表示用电器正极,电流由用电器正极流至其负极,表示两处差值,下列说法不正确的是
A.K膜为阴离子阻隔膜,污染气体从X通入
B.持续为用电器供电过程中,无需向原电池内补充
C.理论上,标况下每吸收气体,K膜将通过4mol离子
D.反应开始后,一段时间内电极A、B两端的 |ΔpHAB| 将变大
9.下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1说明2 mol H2(g)和1 mol O2(g)的能量总和小于2 mol H2O(g)的能量
B.已知C(s,石墨)===C(s,金刚石) ΔH>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则含20 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1 2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
10.下列有关热化学方程式的叙述正确的是
A.同温同压下,反应在光照和点燃条件下的不同
B.,则石墨比金刚石稳定
C.由可知,稀醋酸与溶液反应生成液态水时释放的热量
D.,表示甲烷的燃烧热为
11.金属铬常用于制备特种合金。工业上以铬铁矿(主要成分为,含有少量)为原料,电解制备金属铬的流程如图。下列说法正确的是
A.过程①会生成气体
B.过程②需加入过量稀硫酸
C.物质A的化学式为
D.过程③生成金属的电极反应式为
12.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是
A.该电池Zn为负极,ZnO为正极,MnO2为催化剂
B.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
C.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH-
D.电池工作时正极发生氧化反应
13.一次性医用口罩在包装前常采用环氧乙烷灭菌,环氧乙烷(,简称EO,易溶于水)是一种重要的工业原料和消毒剂。由乙烯经间接电解制备EO的原理示意图如下。下列说法正确的是
A.N极与电源正极相连
B.膜X应采用阴离子交换膜
C.从含EO的溶液中分离得到EO,可以采用蒸馏法
D.M极的电极反应式为:
14.人体内葡萄糖的消耗可用下列热化学方程式表示:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800.6 kJ·mol-1;如果某人每天消耗12540 kJ热量,则他每天至少要摄入葡萄糖的质量为
A.806 g B.1000 g C.1250 g D.1500 g
二、填空题
15.某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
(1)该电池中OH-向_______极移动(填“正”或“负”)
(2)该电池负极的电极反应为___________________
(3)用该电池电解(惰性电极)500 mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8 g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为_______________,电解过程中收集到标准状况下的气体体积为_____________。
16.如图是一个化学过程的示意图。
(1)丙池中C电极的名称__________。
(2)写出通入O2的电极上的电极反应式________。
(3)乙池中总的电极反应化学方程式为________。
(4)当乙池中B(Ag)极的质里增加5.40g时,甲池中理论上消耗O2___mL(标准状况下);若丙池中饱和食盐水溶液的体积为500mL,电解后,溶液的pH=___(25℃,假设电解前后溶液的体积无变化)。
17.已知:2H2+O22H2O。
I.该反应1 g氢气完全燃烧生成液态水放出热量121.6 kJ,则2 mol氢气完全燃烧生成液态水放出的热量为___________kJ。
II.原电池是直接把化学能转化为电能的装置。航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。下图是氢-氧燃料电池的装置图。则:
(1)溶液中OH-移向___________电极(填“a”或“b”)。
(2)b电极附近pH___________ (填“增大”“减小”或“不变”)。
(3)该原电池的b极发生___________ (填“氧化”或“还原”)反应,该电极的反应式为___________。
(4)若把上述电解质溶液改为稀硫酸溶液,则正极的电极反应式为___________。
(5)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:产生氢气的体积___________L(标准状况)。
18.将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
①写出电解时阴极的电极反应式_____________。
②电解过程中通过阳离子交换膜的离子主要为________。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向___________极室(填“阴”或者“阳”)加入____________(填化学式)。
19.等质量的碳酸钠、碳酸氢钠粉末分别与足量的盐酸发生反应时,产生CO2较多的是_________(填化学式)。实验过程中,同学们感受到碳酸钠与盐酸的反应是放热反应,而碳酸氢钠与盐酸的反应是吸热反应,下图中代表碳酸钠与盐酸反应的是____________(填字母)。
20.用氧化铁包裹的纳米铁粉(用Fe@Fe2O3表示)能有效还原水溶液中的Cr(Ⅵ)。Fe@Fe2O3还原近中性废水中Cr(Ⅵ)的可能反应机理如图所示。Fe@Fe2O3中Fe还原CrO的过程可描述为___________
。
21.某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如图。
I.KCl作电解质
(1)一定电压下,按图1装置电解,现象:石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。5min后U形管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体。
①石墨电极上的电极反应式是___________________。
②预测图2中的实验现象:________________________
③图2与图1实验现象差异的原因是___________________。
II.KOH作电解质
(2)用图1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液变为淡紫色(FeO),无沉淀产生。
①铁电极上OH-能够放电的原因是____________________。
②阳极生成FeO的总电极反应式是________________________。
22.(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是2H2(g)+O2(g)= 2H2O(l), 请回答下列问题:
①该反应的生成物能量总和________(填“大于”、 “小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量_____(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点_______。
(2) 已知拆开1 mol H—H键,1 mol N—H键,1 mol NN键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________
(3) FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g) = H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g) = 2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________
23.I.下列反应中,属于放热反应的是_______(填序号)
①物质燃烧;②石灰石在高温下的分解反应;③酸碱中和反应;④二氧化碳通过炽热的炭⑤食物因氧化而腐败;⑥Ba(OH)2·8H2O与NH4Cl反应;⑦氧化钙与水反应⑧NaOH溶于水⑨将胆矾加热变为白色粉末
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。
(1)曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
(2)该反应是_______(填“吸热”或“放热”)反应。计算当反应
(3)生成1.5molCH3OH(g)时,能量变化值是_______kJ。
(4)推测反应CH3OH(g) CO(g)+2H2(g)是_______(填“吸热”或“放热”)反应。
III.断开1molH-H键、1molN-H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需_______(填“吸收”或“放出”)能量_______kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是_______。
24.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:
(1)甲池为_______(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的反应式为_______。
(2)乙池中A(石墨)电极的名称为_______(填“正极”“负极”“阴极”或“阳极”),总反应式为_______。
(3)当乙池中B极质量增加21.6g时,甲池中理论上消耗O2的体积为_______L(标准状况下),丙池中D极析出_______g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将_______(填“增大”“减小”或“不变”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】氢气在氯气中燃烧时发出苍白色火焰,该反应为放热反应,因此断键吸收的能量﹤成键放出的能量,即a+b﹤2c,故答案D。
2.A
【详解】设H2O(g)=O2(g)+H2(g)△H1 …① Cl2(g)+H2(g)=2HCl(g )△H2…②
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3…③ 由盖斯定律可知,③=①×2+2×②,因此△H3=2△H1+2△H2,故选A。
3.B
【详解】A.易腐垃圾经过发酵后会转化为热值较高的物质如甲烷等,故易腐垃圾富含生物质能,A正确;
B.氢氧燃料电池放电时化学能部分转化为电能,部分转化为热能,所以不能全部转化为电能,B错误;
C.石油通过分馏可用得到汽油、柴油等燃料油;以石油分馏得到重油为原料,经催化裂化可得到分子中含有C原子数比较少的短链液态烃,从而可提高液态轻质油的产量和质量,因此也能得到燃料油,C正确;
D.煤经干馏得到的煤焦油中含有甲苯,将其分离出来,然后与浓硝酸、浓硫酸混合加热,发生硝化反应产生三硝基甲基,即得到炸药TNT,D正确;
故合理选项是B。
4.C
【详解】A.在b极,ClO-得到电子转化为Cl-,所以b极为原电池的正极,则a为负极,故A错误;
B.电子由负极流向正极,但不经过电解质溶液,故B错误;
C.a为负极,则负极是镁失去电子,生成的Mg2+和溶液中的OH-结合成Mg(OH)2;正极是ClO-得到电子转化为Cl-,所以电池总反应式为 Mg+ClO-+H2O=Mg(OH)2+Cl-,故C正确;
D.1molClO-得到2mol电子转化为Cl-,所以当外电路中转移2mol电子时,b极消耗1mol ClO-,故D错误;
故选C。
5.D
【详解】A.利用太阳光在催化剂表面实现高效分解水生成氢气和氧气,整个过程实现了光能向化学能的转换,故A正确;
B.分解水生成氢气和氧气,总反应为,故B正确;
C.根据图示,过程II有H2O2生成,有O—O单键生成,过程II形成化学键,所以放出能量,故C正确;
D.过程III发生反应,焓变=(467×2+138-436-498)KJ/mol=+138 KJ/mol,属于吸热反应,故D错误;
选D。
6.C
【分析】用该电池电解含镍酸性废水可得到单质镍,则镀镍铁棒作阴极,碳棒作阳极,则A为正极、B为负极。电解过程中,碳棒上氢氧根离子放电生成氧气,则a中钠离子进入b区,镀镍铁棒上Ni2+放电生成Ni,则氯离子进入b区。
【详解】A.根据前面分析A为正极,该电池充电时,A电极为阳极,失电子发生氧化反应,电解反应式为LixV2O5 xe- = V2O5+xLi+,故A正确;
B.电解过程中,碳棒上氢氧根离子放电生成氧气,则a中钠离子进入b区,镀镍铁棒上Ni2+放电生成Ni,则氯离子进入b区,所以导致b区域NaCl浓度增大,故B正确;
C.串联电路中转移电子相等,如果锂钒氧化物二次电池中有7gLi参与放电时,转移电子物质的量= ×1=1mol,当随着电解的进行,c(Ni2+)减小,H+的放电大于Ni2+,则得到Ni的物质的量小于 ×1mol=0.5mol,m(Ni)小于0.5mol×58.7 g mol 1=29.35g,故C错误;
D.Li能和水反应生成LiOH,所以锂钒氧化物二次电池不能用LiCl水溶液作为电解液,故D正确.
综上所述,答案为C。
7.A
【详解】A.电解饱和食盐水,阳极上发生氯离子失去电子生成氯气的反应,阴极上发生水得电子生成氢气和氢氧根离子的反应,为使氯气和氢氧根离子反应生成次氯酸根与氯离子,必须使氯气在装置下部产生,故下面为阳极,b电源为正极,a为电源负极,故A正确;
B.铁在中性食盐水中易发生吸氧腐蚀,铁失去电子变成亚铁离子,故不能用铁制容器盛放食盐水,故B错误;
C.电解过程中,阴极水作为反应物被消耗,溶液体积减小,钠离子物质的量不变,所以c(Na+)减小,故C错误;
D.由于次氯酸钠具有漂白性,会漂白pH 试纸,所以不能用pH 试纸测定溶液的pH,故D错误;
故答案为A。
8.C
【分析】利用吸收污染气体的原理制作原电池,供电的同时也可制备硫酸;由图可知,“+”表示用电器正极,电流由用电器正极流至其负极,B为正极,过氧化氢得到电子发生还原反应,2H++2e- +H2O2=2H2O;A为负极,二氧化硫失去电子发生氧化反应生成硫酸根离子,SO2-2e-+2H2O=+4H+;总反应为SO2+H2O2=+2H+;
【详解】A.由分析可知,氢离子加入右室,K膜可以通过阳离子为阴离子阻隔膜,污染气体从X通入,A正确;
B.总反应为SO2+H2O2=+2H+,故持续为用电器供电过程中,无需向原电池内补充,B正确;
C.理论上,标况下每吸收气体(1mol),K膜将通过2mol氢离子,C错误;
D.反应开始后,一段时间内电极B端不断生成氢离子,溶液酸性增强,导致将变大,D正确;
故选C。
9.C
【详解】A.此反应是放热反应,说明反应物的总能量大于生成物的总能量,故错误;
B.能量越低,物质越稳定,石墨的能量低于金刚石,石墨比金刚石稳定,故错误;
C.20gNaOH参与反应放出热量为20×57.4/40kJ=28.7kJ,故正确;
D.此反应属于放热反应,△H<0,因此△H1<△H2,故错误。
10.B
【详解】A.反应焓变与条件无关,同温同压下,反应在光照和点燃条件下的相同,A错误;
B.,反应放热,石墨的能量更低,石墨比金刚石稳定,B正确;
C.稀醋酸为弱酸,电离时要吸热,稀醋酸与反应生成液态水时释放的能量小于57.3kJ,C错误;
D.燃烧热是1mol可燃物完全燃烧生成指定产物所放出的热量,甲烷完全燃烧的产物中的水应为液态,D错误;
故选B。
11.A
【分析】考查工业流程的分析。工业上以铬铁矿(主要成分为,含有少量)为原料,加入碳酸钠固体处理原料,其中与Na2CO3反应转化为NaAlO2和CO2,Cr2O3与Na2CO3反应转化为Na2CrO4过程中铬元素化合价升高,说明空气中的氧气参与了反应,则FeO也会被氧化得到Fe2O3,但是Fe2O3不能继续与Na2CO3反应;所以物质A是Fe2O3;过程②中Na2CrO4与稀硫酸不反应,NaAlO2与稀硫酸反应得到Al(OH)3;Na2CrO4与浓硫酸反应生成,溶液B为溶液,电解溶液得到Cr。
【详解】A.与Na2CO3反应转化为NaAlO2和CO2,Cr2O3与Na2CO3反应转化为Na2CrO4和CO2,A项正确;
B.过程②加入过量稀硫酸,会溶解Al(OH)3转化为可溶性硫酸铝,不能与Na2CrO4分离,多以不能加过量稀硫酸,B项错误;
C.灼烧过程中,氧化亚铁被氧化得到Fe2O3,故物质A是Fe2O3,C项错误;
D.过程③是电解溶液得到Cr,生成金属的电极反应式为,D项错误;
故答案选A。
12.C
【详解】A.在电池总反应中,Zn失电子发生氧化反应生成ZnO,Zn为负极,MnO2得电子发生还原反应生成MnO(OH),MnO2为正极,A错误;
B.导电时外电路电子由Zn(负极)流向MnO2(正极),电子不流经内电路,内电路中依靠离子的定向移动形成闭合回路,B错误;
C.正极上MnO2得电子发生还原反应生成MnO(OH),电极反应式为MnO2+e-+H2O=MnO(OH)+OH-,C正确;
D.电池工作时,正极发生得电子的还原反应,D错误;
答案选C。
13.C
【分析】Cl-在M极失去电子生成Cl2,M极是阳极,Cl2在溶液中歧化得到HClO,HClO与乙烯发生加成反应得到HOCH2CH2Cl,该溶液与KOH溶液反应后分离得到环氧乙烷(EO);N极是阴极,发生还原反应,KCl溶液是电解质溶液,发生反应:2H2O+2e-=H2↑+2OH-,得到含KOH的溶液a。
【详解】A.据分析,N极是阴极,与电源负极相连,A错误;
B.据分析,N极得到KOH溶液,为防止OH-通过膜X进入M极直接发生反应,膜X应是阳离子交换膜,B错误;
C.由于EO易溶于水,从含EO的溶液中分离得到EO,可以采用蒸馏法,C正确;
D.据分析,M极的电极反应式为:2Cl--2e-=Cl2,之后溶液中发生反应:Cl2+H2OHCl+HClO,,D错误;
故选C。
14.A
【详解】根据葡萄糖热化学方程式可知每天需要摄入葡萄糖的物质的量为:,葡萄糖的质量为×180 g/mol=806 g,综上所述故选A。
15. 负 CH3OH-6e-+8OH-= +6H2O 0.2mol/L 4.48L
【详解】(1)原电池中阴离子移向负极,该电池中OH-向负极移动;
(2)甲醇燃料电池,通入甲醇的一极为负极,发生氧化反应,该电池负极的电极反应为CH3OH-6e-+8OH-= +6H2O;
(3)加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]= =0.1mol,相当于加入0.1molCuO和0.1molH2O,根据Cu原子守恒得n(CuSO4)=n[Cu(OH)2]=0.1mol,则c(CuSO4)==0.2mol/L,根据O原子守恒得n(O2)=n[Cu(OH)2]=0.1mol,根据H原子守恒得n(H2)=n[Cu(OH)2]=0.1mol,则气体在标准状况下的体积=(0.1+0.1)mol×22.4L/mol=4.48L。
16. 阳极 280 13
【分析】燃料电池中,通入燃料的电极为负极,负极电极反应为,通入氧化剂的电极为正极,正极反应为 ,乙池、丙池是电解池,与电源正极相连的是阳极,与电源负极相连的是阴极,则A是阳极、B是阴极,乙池中阳极氢氧根放电产生氧气,阴极银离子放电产生银,丙池中C是阳极,D是阴极,电解质溶液是氯化钠溶液,氢离子在阴极放电,氯离子在阳极放电,据此分析解答。
【详解】(1) C(Pt)电极的名称是阳极,
故答案为:阳极;
(2)通入O2的电极上的电极反应式是,
故答案为:;
(3)乙池中A是阳极、B是阴极,阳极水电离出的氢氧根失电子产生氧气,阴极银离子得电子产生单质银,属于放氧生酸型,电解反应的化学方程式为:,
故答案为:;
(6)当乙池中B(Ag)极的质量增加5.40g时,根据,转移电子为:,根据,甲池中理论上消耗O2的体积是:,丙池中产生氢氧根的物质的量为:0.05mol,,则溶液pH=13,
故答案为:280;13。
17. 486.4 a 增大 还原 O2+2H2O+4e-=4OH- O2+4H++4e-=2H2O 4.48
【详解】I.该反应1 g氢气完全燃烧生成液态水放出热量121.6 kJ,则2 mol氢气即4g,完全燃烧生成液态水放出的热量为121.6 kJ ×4=486.4kJ;故答案为:486.4。
II.(1)根据图中信息,电子向右移动,说明a为负极,b为正极,离子移动方向是“同性相吸”即溶液中OH-移向a;故答案为:a。
(2)b电极为正极,是氧气得到电子变为氢氧根,因此b电极附近pH增大;故答案为:增大。
(3)该原电池的b极是正极,发生还原反应,该电极的反应式为O2+2H2O+4e-=4OH-;故答案为:还原;O2+2H2O+4e-=4OH-。
(4)若把上述电解质溶液改为稀硫酸溶液,则正极的电极反应式为O2+4H++4e-=2H2O;故答案为:O2+4H++4e-=2H2O。
(5)根据题意得到Zn质量减少为60g-47g=13g即物质的量为0.2mol,根据总反应得到关系式Zn~H2↑,则产生氢气的物质的量为0.2mol,标准状况下体积为0.2mol×22.4 L mol 1=4.48L;故答案为:4.48。
18. H+ 阴 PbO
【分析】如图电解池装置中,阳极H2O失去电子发生氧化反应生成氧气,阴极PbCl42-得到电子发生还原反应生成Pb,由此回答。
【详解】(1)电解时阴极PbCl42-得到电子发生还原反应生成Pb,电极方程式为:,故答案为:;
(2)电解时阳极H2O失去电子发生氧化反应:,为了平衡电荷,生成的H+会通过阳离子交换膜移向阴极,故答案为:H+;
(3)电解过程阴极发生反应:,由于溶液中含有Na+和通过阳离子交换膜移向阴极的H+,则阴极溶液中含有溶质HCl和NaCl,则可向阴极室添加PbO生成Na2PbCl4电解液,故答案为:阴;PbO。
19. NaHCO3 a
【详解】根据质量守恒可知C元素的质量分数越大,等质量的碳酸钠、碳酸氢钠粉末产生的二氧化碳越多,碳酸钠中C元素的质量分数为,碳酸氢钠中C元素的质量分数为,所以NaHCO3产生的CO2较多;碳酸钠与盐酸反应放热,说明反应物的总能量高于生成物的总能量,故选a。
20.单质铁发生吸氧腐蚀,3Fe-6e-=3Fe2+,3Fe2++CrO+4H2O+4OH-=Cr(OH)3↓+3Fe(OH)3↓;
【分析】单质铁发生吸氧腐蚀,Fe-2e-=Fe2+,Fe2+再还原CrO生成Cr(OH)3↓。
【详解】还原近中性废水中的Cr(Ⅵ),单质铁发生吸氧腐蚀,电极反应式为:Fe-2e-=Fe2+,Fe2+易被氧化成Fe3+,CrO42-被还原为三价铬,由图可知,根据质量守恒和电子转移守恒写出离子方程式为:3Fe2++CrO+4H2O+4OH-=Cr(OH)3↓+3Fe(OH)3↓。
21. 石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解 盐桥的存在阻碍了OH-向阳极迁移,避免灰绿色固体生成 c(OH-)增大,反应速率加快(更容易放电)
【详解】I.KCl作电解质
(1)①石墨电极上是氢离子放电,产生氢气,电极反应式是,故本题答案为:;
②图2中纯铁做阳极,石墨做阴极,所以石墨电极上迅速产生无色气体,铁电极逐渐溶解,无气体产生, 故本题答案为:石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解;
③图2的装置存在盐桥,阻碍了OH-向阳极迁移,避免灰绿色固体生成,故本题答案为:盐桥的存在阻碍了OH-向阳极迁移,避免灰绿色固体生成;
II.KOH作电解质
(2)①在电解池中,氢氧根向阳极移动,铁电极上c(OH-)增大,反应速率加快(更容易放电),故本题答案为:c(OH-)增大,反应速率加快(更容易放电);
②阳极上铁失电子,生成FeO,电极反应式为,故本题答案为:。
【点睛】本题以铁为阳极发生反应的多样性探究实验考查电解原理的应用,明确电解原理为解题的关键,注意掌握常见元素化合物的性质。
22. 小于 < 不会对环境造成任何污染
【分析】根据反应热计算公式判断能量高低,根据ΔH=反应物键能-生成物键能计算焓变,根据盖斯定律书写热反应方程式。
【详解】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,
①根据反应热可知,该反应的生成物能量总和小于反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,水蒸气的能量大于水的热量,则生成物能量变高,放出的热量< 572 kJ。
③与化石燃料相比,利用氢能源有很多优点,如环保,不会对环境造成任何污染;属于可再生能源等。
(2) 已知拆开1 mol H—H键,1 mol N—H键,1 mol NN键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为。
(3)根据盖斯定律可知,SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是。
23. ①③⑤⑦ 放热 136.5 吸热 放出 30.67 该反应是可逆反应,反应物不可能完全转化为生成物
【详解】I.①物质燃烧放出热量,属于放热反应;②石灰石在高温下的分解反应需要吸收热量,属于吸热反应;③酸碱中和反应放出热量,为放热反应;④二氧化碳通过炽热的炭为吸热反应;⑤食物因氧化而腐败是缓慢氧化的过程,过程中放出热量,属于放热反应;⑥Ba(OH)2·8H2O与NH4Cl反应吸收热量,属于吸热反应;⑦氧化钙与水反应放出大量的热,属于放热反应;⑧NaOH溶于水会放出热量,但过程是物理变化;⑨将胆矾加热变为白色粉末是分解反应,属于吸热反应;综上,属于放热反应的是①③⑤⑦,故答案为:①③⑤⑦。
II.(2)根据图象可知,该反应的生成物的总能量低于反应物的总能量,属于放热反应,故答案为:放热。
(3)每生成1mol CH3OH放出的热量为510 kJ-419 kJ=91 kJ,因此当反应生成1.5mol CH3OH时,能量的变化值为1.5×91 kJ=136.5kJ,故答案为:136.5。
(4)CO(g)+2H2(g) CH3OH(g)为放热反应,则反应CH3OH(g) CO(g)+2H2(g)吸热,故答案为:吸热。
III.已知断开1mol H-H键、1mol N-H键、1mol N≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则生成1mol N-H键能够释放391kJ能量,又3H2(g)+N2(g)2NH3(g),则1mol H2与mol N2反应生成mol NH3时,断键吸收的能量为436kJ+×946kJ=751.33kJ,成键释放能量为×3×391kJ=782kJ,因此1mol H2与足量N2反应生成NH3会放出782kJ-751.33kJ=30.67kJ,但该反应为可逆反应,因此反应的热量总小于理论值,故答案为:放出;30.67;该反应是可逆反应,反应物不可能完全转化为生成物。
24.(1) 原电池 CH3OH 6e-+8OH-=CO+6H2O
(2) 阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3
(3) 1.12 6.4
(4)减小
【分析】甲池中通入甲醇氧气燃料电池,甲醇为燃料,化合价升高,失去电子,作原电池负极,氧气是氧化剂,为正极,乙、丙池为电解池,A、C为电解池的阳极,B、D为电解池的阴极。
【详解】(1)根据前面分析甲池为原电池,通入CH3OH电极的反应式为CH3OH 6e-+8OH-=CO+6H2O;故答案为:原电池;CH3OH 6e-+8OH-=CO+6H2O。
(2)乙池中A(石墨)与原电池正极相连,因此A电极的名称为阳极,阳极是水中氢氧根失去电子变为氧气和水,阴极是银离子得到电子变为银单质即总反应式为4AgNO3+2H2O4Ag+O2↑+4HNO3;故答案为:阳极;4AgNO3+2H2O4Ag+O2↑+4HNO3。
(3)根据关系式4Ag~ O2~2Cu,当乙池中B极质量增加21.6g时(物质的量为0.2mol),甲池中理论上消耗O2物质的量为0.05mol,则标准状况下体积为11.2L,丙池中D极析出0.1mol铜,其质量为6.4g铜;故答案为:11.2;6.4。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中甲醇、氧气、KOH溶液反应生成碳酸钾和水,碱性减弱即甲中溶液的pH将减小;故答案为:减小。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.氢气在氯气中燃烧时发出苍白色火焰,在反应过程中,破坏1 mol氢气中的化学键消耗的能量为a kJ,破坏1 mol氯气中的化学键消耗的能量为b kJ,形成1 mol HCl中的化学键释放的能量为c kJ,下列关系中正确的是 ( )
A.b>c B.a+b>2c
C.a+b
H2(g)+Cl2(g)= 2HCl(g) △H2
2H2O(g)+2Cl2(g)= 4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是( )
A.△H3 =2△H1+2△H2 B.△H3 =2△H1—△H2
C.△H3 =2△H1—2△H2 D.△H3 =2△H1+△H2
3.下列说法不正确的是
A.易腐垃圾富含生物质能
B.氢氧燃料电池放电时化学能全部转化为电能
C.石油的分馏、重油的催化裂化均能得到燃料油
D.从煤的干馏产物中分离出的甲苯可用于生产TNT
4.下图为镁-次氯酸盐电池的工作原理,下列说法中正确的是
A.a极为电池正极
B.电子由a极流向b极,再经过溶液回到a极
C.电池总反应式为
D.外电路中转移2mol电子,b极消耗2mol
5.我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示:
已知:几种物质中化学键的键能如表所示(假设O=O可表示中的化学键)。
化学键 H—O O=O H—H O—O
键能 467 498 436 138
若反应过程中分解了,则下列说法错误的是A.整个过程实现了光能向化学能的转换
B.总反应为
C.过程II有O—O单键生成并放出能量
D.过程III属于放热反应
6.该装置为锂钒氧化物二次电池,其成本较低,对环境无污染:在下图中用该电池电解含镍酸性废水可得到单质镍(已知:)。下列说法不正确的是
A.该电池充电时,A电极的电极反应式为
B.电解过程中,b中NaCl溶液的物质的量浓度会增大
C.当锂钒氧化物二次电池中有7gLi参与放电时,一定能得到29.35g镍
D.锂钒氧化物二次电池一般用非水溶液作为电解液
7.用石墨作电极电解饱和食盐水可制取 NaClO 消毒液,简易装置如图所示。下列说法正确的是
A.a 为电源的负极
B.用铁制容器盛放食盐水
C.电解过程中,c(Na+)保持不变
D.电解结束后,用 pH 试纸测定溶液的pH
8.利用吸收污染气体的原理制作原电池,供电的同时也可制备硫酸(容积充足,运行时不考虑将产物分离出),其工作原理如下图。已知电极A、B均为惰性电极,K膜为阻隔膜(限制某些离子或分子通过),“+”表示用电器正极,电流由用电器正极流至其负极,表示两处差值,下列说法不正确的是
A.K膜为阴离子阻隔膜,污染气体从X通入
B.持续为用电器供电过程中,无需向原电池内补充
C.理论上,标况下每吸收气体,K膜将通过4mol离子
D.反应开始后,一段时间内电极A、B两端的 |ΔpHAB| 将变大
9.下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1说明2 mol H2(g)和1 mol O2(g)的能量总和小于2 mol H2O(g)的能量
B.已知C(s,石墨)===C(s,金刚石) ΔH>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则含20 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1 2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
10.下列有关热化学方程式的叙述正确的是
A.同温同压下,反应在光照和点燃条件下的不同
B.,则石墨比金刚石稳定
C.由可知,稀醋酸与溶液反应生成液态水时释放的热量
D.,表示甲烷的燃烧热为
11.金属铬常用于制备特种合金。工业上以铬铁矿(主要成分为,含有少量)为原料,电解制备金属铬的流程如图。下列说法正确的是
A.过程①会生成气体
B.过程②需加入过量稀硫酸
C.物质A的化学式为
D.过程③生成金属的电极反应式为
12.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是
A.该电池Zn为负极,ZnO为正极,MnO2为催化剂
B.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
C.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH-
D.电池工作时正极发生氧化反应
13.一次性医用口罩在包装前常采用环氧乙烷灭菌,环氧乙烷(,简称EO,易溶于水)是一种重要的工业原料和消毒剂。由乙烯经间接电解制备EO的原理示意图如下。下列说法正确的是
A.N极与电源正极相连
B.膜X应采用阴离子交换膜
C.从含EO的溶液中分离得到EO,可以采用蒸馏法
D.M极的电极反应式为:
14.人体内葡萄糖的消耗可用下列热化学方程式表示:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800.6 kJ·mol-1;如果某人每天消耗12540 kJ热量,则他每天至少要摄入葡萄糖的质量为
A.806 g B.1000 g C.1250 g D.1500 g
二、填空题
15.某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
(1)该电池中OH-向_______极移动(填“正”或“负”)
(2)该电池负极的电极反应为___________________
(3)用该电池电解(惰性电极)500 mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8 g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为_______________,电解过程中收集到标准状况下的气体体积为_____________。
16.如图是一个化学过程的示意图。
(1)丙池中C电极的名称__________。
(2)写出通入O2的电极上的电极反应式________。
(3)乙池中总的电极反应化学方程式为________。
(4)当乙池中B(Ag)极的质里增加5.40g时,甲池中理论上消耗O2___mL(标准状况下);若丙池中饱和食盐水溶液的体积为500mL,电解后,溶液的pH=___(25℃,假设电解前后溶液的体积无变化)。
17.已知:2H2+O22H2O。
I.该反应1 g氢气完全燃烧生成液态水放出热量121.6 kJ,则2 mol氢气完全燃烧生成液态水放出的热量为___________kJ。
II.原电池是直接把化学能转化为电能的装置。航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。下图是氢-氧燃料电池的装置图。则:
(1)溶液中OH-移向___________电极(填“a”或“b”)。
(2)b电极附近pH___________ (填“增大”“减小”或“不变”)。
(3)该原电池的b极发生___________ (填“氧化”或“还原”)反应,该电极的反应式为___________。
(4)若把上述电解质溶液改为稀硫酸溶液,则正极的电极反应式为___________。
(5)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:产生氢气的体积___________L(标准状况)。
18.将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
①写出电解时阴极的电极反应式_____________。
②电解过程中通过阳离子交换膜的离子主要为________。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向___________极室(填“阴”或者“阳”)加入____________(填化学式)。
19.等质量的碳酸钠、碳酸氢钠粉末分别与足量的盐酸发生反应时,产生CO2较多的是_________(填化学式)。实验过程中,同学们感受到碳酸钠与盐酸的反应是放热反应,而碳酸氢钠与盐酸的反应是吸热反应,下图中代表碳酸钠与盐酸反应的是____________(填字母)。
20.用氧化铁包裹的纳米铁粉(用Fe@Fe2O3表示)能有效还原水溶液中的Cr(Ⅵ)。Fe@Fe2O3还原近中性废水中Cr(Ⅵ)的可能反应机理如图所示。Fe@Fe2O3中Fe还原CrO的过程可描述为___________
。
21.某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如图。
I.KCl作电解质
(1)一定电压下,按图1装置电解,现象:石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。5min后U形管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体。
①石墨电极上的电极反应式是___________________。
②预测图2中的实验现象:________________________
③图2与图1实验现象差异的原因是___________________。
II.KOH作电解质
(2)用图1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液变为淡紫色(FeO),无沉淀产生。
①铁电极上OH-能够放电的原因是____________________。
②阳极生成FeO的总电极反应式是________________________。
22.(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是2H2(g)+O2(g)= 2H2O(l), 请回答下列问题:
①该反应的生成物能量总和________(填“大于”、 “小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量_____(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点_______。
(2) 已知拆开1 mol H—H键,1 mol N—H键,1 mol NN键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________
(3) FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g) = H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g) = 2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________
23.I.下列反应中,属于放热反应的是_______(填序号)
①物质燃烧;②石灰石在高温下的分解反应;③酸碱中和反应;④二氧化碳通过炽热的炭⑤食物因氧化而腐败;⑥Ba(OH)2·8H2O与NH4Cl反应;⑦氧化钙与水反应⑧NaOH溶于水⑨将胆矾加热变为白色粉末
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。
(1)曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
(2)该反应是_______(填“吸热”或“放热”)反应。计算当反应
(3)生成1.5molCH3OH(g)时,能量变化值是_______kJ。
(4)推测反应CH3OH(g) CO(g)+2H2(g)是_______(填“吸热”或“放热”)反应。
III.断开1molH-H键、1molN-H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需_______(填“吸收”或“放出”)能量_______kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是_______。
24.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:
(1)甲池为_______(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的反应式为_______。
(2)乙池中A(石墨)电极的名称为_______(填“正极”“负极”“阴极”或“阳极”),总反应式为_______。
(3)当乙池中B极质量增加21.6g时,甲池中理论上消耗O2的体积为_______L(标准状况下),丙池中D极析出_______g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将_______(填“增大”“减小”或“不变”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】氢气在氯气中燃烧时发出苍白色火焰,该反应为放热反应,因此断键吸收的能量﹤成键放出的能量,即a+b﹤2c,故答案D。
2.A
【详解】设H2O(g)=O2(g)+H2(g)△H1 …① Cl2(g)+H2(g)=2HCl(g )△H2…②
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3…③ 由盖斯定律可知,③=①×2+2×②,因此△H3=2△H1+2△H2,故选A。
3.B
【详解】A.易腐垃圾经过发酵后会转化为热值较高的物质如甲烷等,故易腐垃圾富含生物质能,A正确;
B.氢氧燃料电池放电时化学能部分转化为电能,部分转化为热能,所以不能全部转化为电能,B错误;
C.石油通过分馏可用得到汽油、柴油等燃料油;以石油分馏得到重油为原料,经催化裂化可得到分子中含有C原子数比较少的短链液态烃,从而可提高液态轻质油的产量和质量,因此也能得到燃料油,C正确;
D.煤经干馏得到的煤焦油中含有甲苯,将其分离出来,然后与浓硝酸、浓硫酸混合加热,发生硝化反应产生三硝基甲基,即得到炸药TNT,D正确;
故合理选项是B。
4.C
【详解】A.在b极,ClO-得到电子转化为Cl-,所以b极为原电池的正极,则a为负极,故A错误;
B.电子由负极流向正极,但不经过电解质溶液,故B错误;
C.a为负极,则负极是镁失去电子,生成的Mg2+和溶液中的OH-结合成Mg(OH)2;正极是ClO-得到电子转化为Cl-,所以电池总反应式为 Mg+ClO-+H2O=Mg(OH)2+Cl-,故C正确;
D.1molClO-得到2mol电子转化为Cl-,所以当外电路中转移2mol电子时,b极消耗1mol ClO-,故D错误;
故选C。
5.D
【详解】A.利用太阳光在催化剂表面实现高效分解水生成氢气和氧气,整个过程实现了光能向化学能的转换,故A正确;
B.分解水生成氢气和氧气,总反应为,故B正确;
C.根据图示,过程II有H2O2生成,有O—O单键生成,过程II形成化学键,所以放出能量,故C正确;
D.过程III发生反应,焓变=(467×2+138-436-498)KJ/mol=+138 KJ/mol,属于吸热反应,故D错误;
选D。
6.C
【分析】用该电池电解含镍酸性废水可得到单质镍,则镀镍铁棒作阴极,碳棒作阳极,则A为正极、B为负极。电解过程中,碳棒上氢氧根离子放电生成氧气,则a中钠离子进入b区,镀镍铁棒上Ni2+放电生成Ni,则氯离子进入b区。
【详解】A.根据前面分析A为正极,该电池充电时,A电极为阳极,失电子发生氧化反应,电解反应式为LixV2O5 xe- = V2O5+xLi+,故A正确;
B.电解过程中,碳棒上氢氧根离子放电生成氧气,则a中钠离子进入b区,镀镍铁棒上Ni2+放电生成Ni,则氯离子进入b区,所以导致b区域NaCl浓度增大,故B正确;
C.串联电路中转移电子相等,如果锂钒氧化物二次电池中有7gLi参与放电时,转移电子物质的量= ×1=1mol,当随着电解的进行,c(Ni2+)减小,H+的放电大于Ni2+,则得到Ni的物质的量小于 ×1mol=0.5mol,m(Ni)小于0.5mol×58.7 g mol 1=29.35g,故C错误;
D.Li能和水反应生成LiOH,所以锂钒氧化物二次电池不能用LiCl水溶液作为电解液,故D正确.
综上所述,答案为C。
7.A
【详解】A.电解饱和食盐水,阳极上发生氯离子失去电子生成氯气的反应,阴极上发生水得电子生成氢气和氢氧根离子的反应,为使氯气和氢氧根离子反应生成次氯酸根与氯离子,必须使氯气在装置下部产生,故下面为阳极,b电源为正极,a为电源负极,故A正确;
B.铁在中性食盐水中易发生吸氧腐蚀,铁失去电子变成亚铁离子,故不能用铁制容器盛放食盐水,故B错误;
C.电解过程中,阴极水作为反应物被消耗,溶液体积减小,钠离子物质的量不变,所以c(Na+)减小,故C错误;
D.由于次氯酸钠具有漂白性,会漂白pH 试纸,所以不能用pH 试纸测定溶液的pH,故D错误;
故答案为A。
8.C
【分析】利用吸收污染气体的原理制作原电池,供电的同时也可制备硫酸;由图可知,“+”表示用电器正极,电流由用电器正极流至其负极,B为正极,过氧化氢得到电子发生还原反应,2H++2e- +H2O2=2H2O;A为负极,二氧化硫失去电子发生氧化反应生成硫酸根离子,SO2-2e-+2H2O=+4H+;总反应为SO2+H2O2=+2H+;
【详解】A.由分析可知,氢离子加入右室,K膜可以通过阳离子为阴离子阻隔膜,污染气体从X通入,A正确;
B.总反应为SO2+H2O2=+2H+,故持续为用电器供电过程中,无需向原电池内补充,B正确;
C.理论上,标况下每吸收气体(1mol),K膜将通过2mol氢离子,C错误;
D.反应开始后,一段时间内电极B端不断生成氢离子,溶液酸性增强,导致将变大,D正确;
故选C。
9.C
【详解】A.此反应是放热反应,说明反应物的总能量大于生成物的总能量,故错误;
B.能量越低,物质越稳定,石墨的能量低于金刚石,石墨比金刚石稳定,故错误;
C.20gNaOH参与反应放出热量为20×57.4/40kJ=28.7kJ,故正确;
D.此反应属于放热反应,△H<0,因此△H1<△H2,故错误。
10.B
【详解】A.反应焓变与条件无关,同温同压下,反应在光照和点燃条件下的相同,A错误;
B.,反应放热,石墨的能量更低,石墨比金刚石稳定,B正确;
C.稀醋酸为弱酸,电离时要吸热,稀醋酸与反应生成液态水时释放的能量小于57.3kJ,C错误;
D.燃烧热是1mol可燃物完全燃烧生成指定产物所放出的热量,甲烷完全燃烧的产物中的水应为液态,D错误;
故选B。
11.A
【分析】考查工业流程的分析。工业上以铬铁矿(主要成分为,含有少量)为原料,加入碳酸钠固体处理原料,其中与Na2CO3反应转化为NaAlO2和CO2,Cr2O3与Na2CO3反应转化为Na2CrO4过程中铬元素化合价升高,说明空气中的氧气参与了反应,则FeO也会被氧化得到Fe2O3,但是Fe2O3不能继续与Na2CO3反应;所以物质A是Fe2O3;过程②中Na2CrO4与稀硫酸不反应,NaAlO2与稀硫酸反应得到Al(OH)3;Na2CrO4与浓硫酸反应生成,溶液B为溶液,电解溶液得到Cr。
【详解】A.与Na2CO3反应转化为NaAlO2和CO2,Cr2O3与Na2CO3反应转化为Na2CrO4和CO2,A项正确;
B.过程②加入过量稀硫酸,会溶解Al(OH)3转化为可溶性硫酸铝,不能与Na2CrO4分离,多以不能加过量稀硫酸,B项错误;
C.灼烧过程中,氧化亚铁被氧化得到Fe2O3,故物质A是Fe2O3,C项错误;
D.过程③是电解溶液得到Cr,生成金属的电极反应式为,D项错误;
故答案选A。
12.C
【详解】A.在电池总反应中,Zn失电子发生氧化反应生成ZnO,Zn为负极,MnO2得电子发生还原反应生成MnO(OH),MnO2为正极,A错误;
B.导电时外电路电子由Zn(负极)流向MnO2(正极),电子不流经内电路,内电路中依靠离子的定向移动形成闭合回路,B错误;
C.正极上MnO2得电子发生还原反应生成MnO(OH),电极反应式为MnO2+e-+H2O=MnO(OH)+OH-,C正确;
D.电池工作时,正极发生得电子的还原反应,D错误;
答案选C。
13.C
【分析】Cl-在M极失去电子生成Cl2,M极是阳极,Cl2在溶液中歧化得到HClO,HClO与乙烯发生加成反应得到HOCH2CH2Cl,该溶液与KOH溶液反应后分离得到环氧乙烷(EO);N极是阴极,发生还原反应,KCl溶液是电解质溶液,发生反应:2H2O+2e-=H2↑+2OH-,得到含KOH的溶液a。
【详解】A.据分析,N极是阴极,与电源负极相连,A错误;
B.据分析,N极得到KOH溶液,为防止OH-通过膜X进入M极直接发生反应,膜X应是阳离子交换膜,B错误;
C.由于EO易溶于水,从含EO的溶液中分离得到EO,可以采用蒸馏法,C正确;
D.据分析,M极的电极反应式为:2Cl--2e-=Cl2,之后溶液中发生反应:Cl2+H2OHCl+HClO,,D错误;
故选C。
14.A
【详解】根据葡萄糖热化学方程式可知每天需要摄入葡萄糖的物质的量为:,葡萄糖的质量为×180 g/mol=806 g,综上所述故选A。
15. 负 CH3OH-6e-+8OH-= +6H2O 0.2mol/L 4.48L
【详解】(1)原电池中阴离子移向负极,该电池中OH-向负极移动;
(2)甲醇燃料电池,通入甲醇的一极为负极,发生氧化反应,该电池负极的电极反应为CH3OH-6e-+8OH-= +6H2O;
(3)加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]= =0.1mol,相当于加入0.1molCuO和0.1molH2O,根据Cu原子守恒得n(CuSO4)=n[Cu(OH)2]=0.1mol,则c(CuSO4)==0.2mol/L,根据O原子守恒得n(O2)=n[Cu(OH)2]=0.1mol,根据H原子守恒得n(H2)=n[Cu(OH)2]=0.1mol,则气体在标准状况下的体积=(0.1+0.1)mol×22.4L/mol=4.48L。
16. 阳极 280 13
【分析】燃料电池中,通入燃料的电极为负极,负极电极反应为,通入氧化剂的电极为正极,正极反应为 ,乙池、丙池是电解池,与电源正极相连的是阳极,与电源负极相连的是阴极,则A是阳极、B是阴极,乙池中阳极氢氧根放电产生氧气,阴极银离子放电产生银,丙池中C是阳极,D是阴极,电解质溶液是氯化钠溶液,氢离子在阴极放电,氯离子在阳极放电,据此分析解答。
【详解】(1) C(Pt)电极的名称是阳极,
故答案为:阳极;
(2)通入O2的电极上的电极反应式是,
故答案为:;
(3)乙池中A是阳极、B是阴极,阳极水电离出的氢氧根失电子产生氧气,阴极银离子得电子产生单质银,属于放氧生酸型,电解反应的化学方程式为:,
故答案为:;
(6)当乙池中B(Ag)极的质量增加5.40g时,根据,转移电子为:,根据,甲池中理论上消耗O2的体积是:,丙池中产生氢氧根的物质的量为:0.05mol,,则溶液pH=13,
故答案为:280;13。
17. 486.4 a 增大 还原 O2+2H2O+4e-=4OH- O2+4H++4e-=2H2O 4.48
【详解】I.该反应1 g氢气完全燃烧生成液态水放出热量121.6 kJ,则2 mol氢气即4g,完全燃烧生成液态水放出的热量为121.6 kJ ×4=486.4kJ;故答案为:486.4。
II.(1)根据图中信息,电子向右移动,说明a为负极,b为正极,离子移动方向是“同性相吸”即溶液中OH-移向a;故答案为:a。
(2)b电极为正极,是氧气得到电子变为氢氧根,因此b电极附近pH增大;故答案为:增大。
(3)该原电池的b极是正极,发生还原反应,该电极的反应式为O2+2H2O+4e-=4OH-;故答案为:还原;O2+2H2O+4e-=4OH-。
(4)若把上述电解质溶液改为稀硫酸溶液,则正极的电极反应式为O2+4H++4e-=2H2O;故答案为:O2+4H++4e-=2H2O。
(5)根据题意得到Zn质量减少为60g-47g=13g即物质的量为0.2mol,根据总反应得到关系式Zn~H2↑,则产生氢气的物质的量为0.2mol,标准状况下体积为0.2mol×22.4 L mol 1=4.48L;故答案为:4.48。
18. H+ 阴 PbO
【分析】如图电解池装置中,阳极H2O失去电子发生氧化反应生成氧气,阴极PbCl42-得到电子发生还原反应生成Pb,由此回答。
【详解】(1)电解时阴极PbCl42-得到电子发生还原反应生成Pb,电极方程式为:,故答案为:;
(2)电解时阳极H2O失去电子发生氧化反应:,为了平衡电荷,生成的H+会通过阳离子交换膜移向阴极,故答案为:H+;
(3)电解过程阴极发生反应:,由于溶液中含有Na+和通过阳离子交换膜移向阴极的H+,则阴极溶液中含有溶质HCl和NaCl,则可向阴极室添加PbO生成Na2PbCl4电解液,故答案为:阴;PbO。
19. NaHCO3 a
【详解】根据质量守恒可知C元素的质量分数越大,等质量的碳酸钠、碳酸氢钠粉末产生的二氧化碳越多,碳酸钠中C元素的质量分数为,碳酸氢钠中C元素的质量分数为,所以NaHCO3产生的CO2较多;碳酸钠与盐酸反应放热,说明反应物的总能量高于生成物的总能量,故选a。
20.单质铁发生吸氧腐蚀,3Fe-6e-=3Fe2+,3Fe2++CrO+4H2O+4OH-=Cr(OH)3↓+3Fe(OH)3↓;
【分析】单质铁发生吸氧腐蚀,Fe-2e-=Fe2+,Fe2+再还原CrO生成Cr(OH)3↓。
【详解】还原近中性废水中的Cr(Ⅵ),单质铁发生吸氧腐蚀,电极反应式为:Fe-2e-=Fe2+,Fe2+易被氧化成Fe3+,CrO42-被还原为三价铬,由图可知,根据质量守恒和电子转移守恒写出离子方程式为:3Fe2++CrO+4H2O+4OH-=Cr(OH)3↓+3Fe(OH)3↓。
21. 石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解 盐桥的存在阻碍了OH-向阳极迁移,避免灰绿色固体生成 c(OH-)增大,反应速率加快(更容易放电)
【详解】I.KCl作电解质
(1)①石墨电极上是氢离子放电,产生氢气,电极反应式是,故本题答案为:;
②图2中纯铁做阳极,石墨做阴极,所以石墨电极上迅速产生无色气体,铁电极逐渐溶解,无气体产生, 故本题答案为:石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解;
③图2的装置存在盐桥,阻碍了OH-向阳极迁移,避免灰绿色固体生成,故本题答案为:盐桥的存在阻碍了OH-向阳极迁移,避免灰绿色固体生成;
II.KOH作电解质
(2)①在电解池中,氢氧根向阳极移动,铁电极上c(OH-)增大,反应速率加快(更容易放电),故本题答案为:c(OH-)增大,反应速率加快(更容易放电);
②阳极上铁失电子,生成FeO,电极反应式为,故本题答案为:。
【点睛】本题以铁为阳极发生反应的多样性探究实验考查电解原理的应用,明确电解原理为解题的关键,注意掌握常见元素化合物的性质。
22. 小于 < 不会对环境造成任何污染
【分析】根据反应热计算公式判断能量高低,根据ΔH=反应物键能-生成物键能计算焓变,根据盖斯定律书写热反应方程式。
【详解】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,
①根据反应热可知,该反应的生成物能量总和小于反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,水蒸气的能量大于水的热量,则生成物能量变高,放出的热量< 572 kJ。
③与化石燃料相比,利用氢能源有很多优点,如环保,不会对环境造成任何污染;属于可再生能源等。
(2) 已知拆开1 mol H—H键,1 mol N—H键,1 mol NN键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为。
(3)根据盖斯定律可知,SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是。
23. ①③⑤⑦ 放热 136.5 吸热 放出 30.67 该反应是可逆反应,反应物不可能完全转化为生成物
【详解】I.①物质燃烧放出热量,属于放热反应;②石灰石在高温下的分解反应需要吸收热量,属于吸热反应;③酸碱中和反应放出热量,为放热反应;④二氧化碳通过炽热的炭为吸热反应;⑤食物因氧化而腐败是缓慢氧化的过程,过程中放出热量,属于放热反应;⑥Ba(OH)2·8H2O与NH4Cl反应吸收热量,属于吸热反应;⑦氧化钙与水反应放出大量的热,属于放热反应;⑧NaOH溶于水会放出热量,但过程是物理变化;⑨将胆矾加热变为白色粉末是分解反应,属于吸热反应;综上,属于放热反应的是①③⑤⑦,故答案为:①③⑤⑦。
II.(2)根据图象可知,该反应的生成物的总能量低于反应物的总能量,属于放热反应,故答案为:放热。
(3)每生成1mol CH3OH放出的热量为510 kJ-419 kJ=91 kJ,因此当反应生成1.5mol CH3OH时,能量的变化值为1.5×91 kJ=136.5kJ,故答案为:136.5。
(4)CO(g)+2H2(g) CH3OH(g)为放热反应,则反应CH3OH(g) CO(g)+2H2(g)吸热,故答案为:吸热。
III.已知断开1mol H-H键、1mol N-H键、1mol N≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则生成1mol N-H键能够释放391kJ能量,又3H2(g)+N2(g)2NH3(g),则1mol H2与mol N2反应生成mol NH3时,断键吸收的能量为436kJ+×946kJ=751.33kJ,成键释放能量为×3×391kJ=782kJ,因此1mol H2与足量N2反应生成NH3会放出782kJ-751.33kJ=30.67kJ,但该反应为可逆反应,因此反应的热量总小于理论值,故答案为:放出;30.67;该反应是可逆反应,反应物不可能完全转化为生成物。
24.(1) 原电池 CH3OH 6e-+8OH-=CO+6H2O
(2) 阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3
(3) 1.12 6.4
(4)减小
【分析】甲池中通入甲醇氧气燃料电池,甲醇为燃料,化合价升高,失去电子,作原电池负极,氧气是氧化剂,为正极,乙、丙池为电解池,A、C为电解池的阳极,B、D为电解池的阴极。
【详解】(1)根据前面分析甲池为原电池,通入CH3OH电极的反应式为CH3OH 6e-+8OH-=CO+6H2O;故答案为:原电池;CH3OH 6e-+8OH-=CO+6H2O。
(2)乙池中A(石墨)与原电池正极相连,因此A电极的名称为阳极,阳极是水中氢氧根失去电子变为氧气和水,阴极是银离子得到电子变为银单质即总反应式为4AgNO3+2H2O4Ag+O2↑+4HNO3;故答案为:阳极;4AgNO3+2H2O4Ag+O2↑+4HNO3。
(3)根据关系式4Ag~ O2~2Cu,当乙池中B极质量增加21.6g时(物质的量为0.2mol),甲池中理论上消耗O2物质的量为0.05mol,则标准状况下体积为11.2L,丙池中D极析出0.1mol铜,其质量为6.4g铜;故答案为:11.2;6.4。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中甲醇、氧气、KOH溶液反应生成碳酸钾和水,碱性减弱即甲中溶液的pH将减小;故答案为:减小。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
