3.1.2铁盐和亚铁盐 课件(共27张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.2铁盐和亚铁盐 课件(共27张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 30.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-16 10:37:03 | ||
图片预览






文档简介
(共27张PPT)
第一节 铁及其化合物
第三章 铁 金属材料
第二课时铁盐和亚铁盐
目录
CONTENT
第二章海水中的重要元素——钠和氯
一、铁盐和亚铁盐
二、 Fe2+、Fe3+、Fe的相互转化
1.
2.
3.
4.
学习目标
通过实验探究了解铁盐和亚铁盐的性质
掌握Fe、Fe2+、Fe3+相互转化的途径
从化合价角度认识“铁三角”
认识铁的重要化合物的化学性质
同学们都知道人体中含有铁元素,我们也需要从外界补充铁元素
市场上销售的补/加铁食品中的铁元素是Fe2+或Fe3+ 吗?
如何检验?
初中学过含有Fe2+溶液为浅渌色或含Fe3+溶液为黄色,
那我们能通过溶液颜色来判断吗
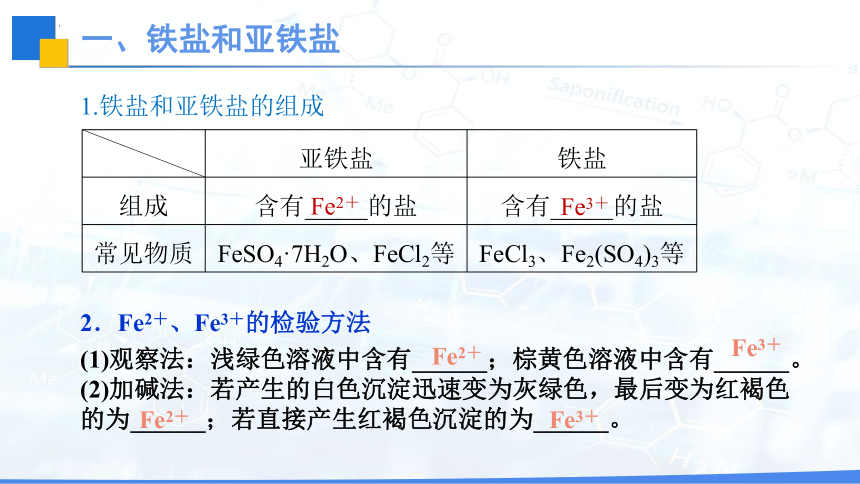
1.铁盐和亚铁盐的组成
亚铁盐 铁盐
组成 含有_____的盐 含有_____的盐
常见物质 FeSO4·7H2O、FeCl2等 FeCl3、Fe2(SO4)3等
Fe2+
Fe3+
一、铁盐和亚铁盐
2.Fe2+、Fe3+的检验方法
(1)观察法:浅绿色溶液中含有______;棕黄色溶液中含有______。
(2)加碱法:若产生的白色沉淀迅速变为灰绿色,最后变为红褐色的为______;若直接产生红褐色沉淀的为______。
Fe2+
Fe3+
Fe2+
Fe3+
一、铁盐和亚铁盐
实验探究一
检验补铁食品中的铁元素
【实验】向补铁溶液中滴入NaOH溶液。
【猜想】若出现红褐色沉淀,则为FeCl3溶液;
若生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,则为FeCl2溶液。(实验时应注意防氧化)
现象为生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色。初步证明补铁食品中的铁元素为Fe2+。
一、铁盐和亚铁盐
Fe2+ Fe3+
溶液的颜色 _____色 ___色
滴加KSCN溶液 无明显现象 溶液变___色
反应原理 不反应 _________________________
结论 利用含有Fe3+的盐溶液遇到KSCN溶液变成___色,检验Fe3+的存在 浅绿
黄
红
Fe3++3SCN-===Fe(SCN)3
红
(3)加KSCN溶液法:
一、铁盐和亚铁盐
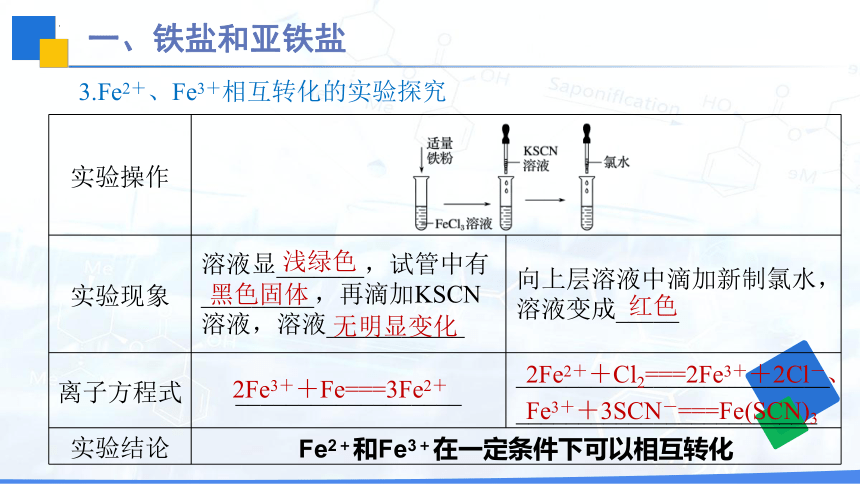
实验操作 实验现象 溶液显_______,试管中有_________,再滴加KSCN溶液,溶液___________ 向上层溶液中滴加新制氯水,溶液变成_____
离子方程式 __________________ _________________________________________________
实验结论 Fe2+和Fe3+在一定条件下可以相互转化 3.Fe2+、Fe3+相互转化的实验探究
浅绿色
黑色固体
无明显变化
红色
2Fe2++Cl2===2Fe3++2Cl-、Fe3++3SCN-===Fe(SCN)3
2Fe3++Fe===3Fe2+
一、铁盐和亚铁盐
归纳总结
1.检验溶液含有Fe2+、不含Fe3+的步骤
2.Fe2+和Fe3+的混合溶液中检验Fe2+的方法
通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪去说明含有Fe2+(注意:Cl-等还原性的离子对Fe2+有干扰)。
一、铁盐和亚铁盐
检验Fe2+的注意事项
(1)只含Fe2+的溶液
检验Fe2+加入试剂的顺序:待测液不变色氧化剂如氯水、H2O2红色(含Fe2+,不含Fe3+)。
①加KSCN溶液前,防止加入氧化性物质[如H2O2、NO(H+)等],使Fe2+被氧化。
②氧化剂不能选用酸性KMnO4溶液。原因:酸性KMnO4溶液本身显紫红色,对Fe(SCN)3的红色有干扰;酸性KMnO4溶液能氧化KSCN,溶液不变红色,不能证明不含Fe2+。
(1)向某溶液中滴加氯水,后滴加KSCN溶液,溶液变红色,则原溶液中有Fe3+( )
(2)向溶液中加入KSCN溶液,溶液变红色,说明溶液中含有Fe3+,不含Fe2+( )
(3)向FeCl3溶液中滴加KSCN溶液,出现红色沉淀( )
×
×
×
(4)证明一个未知溶液中含有Fe2+,而不含有Fe3+的方法是什么?
二、 Fe2+、Fe3+、Fe的相互转化
【思考】Fe、FeSO4和Fe2(SO4)3三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂又可做还原剂
举例写出相应反应的化学方程式,并加以说明。
Fe可做还原剂;
Fe2(SO4)3做氧化剂;
FeSO4既可做氧化剂又可做还原剂
二、 Fe2+、Fe3+、Fe的相互转化
1.Fe只具有_____性。可被弱氧化剂(H+、S等)和Fe3+氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。
举例:Fe+2H+===___________;2Fe+3Cl2 _______。
还原
Fe2++H2↑
2FeCl3
2.Fe2+既有_____性又有_____性。可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+;可被还原剂(CO、C等)还原为Fe。举例:
2Fe2++Cl2===____________;FeO+CO ________。
氧化
还原
2Fe3++2Cl-
Fe+CO2
二、 Fe2+、Fe3+、Fe的相互转化
二、 Fe2+、Fe3+、Fe的相互转化
3.Fe3+只具有_____性,可被弱还原剂(Cu等)和Fe还原为Fe2+,被强还原剂(Al、Zn、CO等)还原为Fe。举例:
2Fe3++Fe===______;Fe2O3+3CO __________。
氧化
3Fe2+
2Fe+3CO2
4.含铁物质的分离与除杂
主要物质 杂质 除杂方法
Fe2+ Fe3+ 加过量铁粉后过滤
FeCl3 FeCl2 加氯水或通入Cl2
Fe2+ Cu2+ 加过量铁粉后过滤
二、 Fe2+、Fe3+、Fe的相互转化
1.如何除去FeCl3溶液中的Fe2+,并写出离子方程式。
深度思考
提示 向溶液中加入适量氯水。2Fe2++Cl2===2Fe3++2Cl-。
2.为什么在配制FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?
提示 Fe2+易被氧化成Fe3+,加入铁粉或铁钉发生反应2Fe3++Fe===3Fe2+。
3.FeCl3溶液蚀刻印刷铜板的原理是怎样的?
【答案】2Fe3++Cu === 2Fe2++Cu2+。
Fe2+、Fe3+的检验方法
(2)利用氢氧化物沉淀的颜色
(3)利用显色反应
(1)直接观察颜色
Fe2+、Fe3+的检验方法
(4)利用Fe2+的还原性
(5)利用Fe3+的氧化性
1.下列关于Fe2+和Fe3+的叙述中,错误的是( )
A.Fe2+的水溶液为浅绿色
B.Fe3+的水溶液为黄色
C.Fe3+具有氧化性,Fe2+具有还原性
D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀
D
2.要证明某溶液中不含Fe3+而可能含Fe2+,有如下实验操作:
①加足量新制氯水 ②加足量酸性KMnO4溶液 ③加少量KSCN溶液,则最佳顺序是( )
A.①③ B.③② C.③① D.①②③
C
3.下列物质之间有如下反应关系:
已知E转化成C的现象是白色沉淀迅速
变为灰绿色,最后变为红褐色。
回答:
(1)写出下列物质的化学式:
A ,B ,D ,甲 ,乙 ,
丙 。
Fe2O3
FeCl3
FeCl2
Cl2(合理即可)
NaOH(或KOH等)
KSCN
(2)写出E→C反应的化学方程式: 。
4Fe(OH)2+O2+2H2O===4Fe(OH)3
4.下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明原溶液中含有Fe2+,不含有Mg2+
C
谢谢
第一节 铁及其化合物
第三章 铁 金属材料
第二课时铁盐和亚铁盐
目录
CONTENT
第二章海水中的重要元素——钠和氯
一、铁盐和亚铁盐
二、 Fe2+、Fe3+、Fe的相互转化
1.
2.
3.
4.
学习目标
通过实验探究了解铁盐和亚铁盐的性质
掌握Fe、Fe2+、Fe3+相互转化的途径
从化合价角度认识“铁三角”
认识铁的重要化合物的化学性质
同学们都知道人体中含有铁元素,我们也需要从外界补充铁元素
市场上销售的补/加铁食品中的铁元素是Fe2+或Fe3+ 吗?
如何检验?
初中学过含有Fe2+溶液为浅渌色或含Fe3+溶液为黄色,
那我们能通过溶液颜色来判断吗
1.铁盐和亚铁盐的组成
亚铁盐 铁盐
组成 含有_____的盐 含有_____的盐
常见物质 FeSO4·7H2O、FeCl2等 FeCl3、Fe2(SO4)3等
Fe2+
Fe3+
一、铁盐和亚铁盐
2.Fe2+、Fe3+的检验方法
(1)观察法:浅绿色溶液中含有______;棕黄色溶液中含有______。
(2)加碱法:若产生的白色沉淀迅速变为灰绿色,最后变为红褐色的为______;若直接产生红褐色沉淀的为______。
Fe2+
Fe3+
Fe2+
Fe3+
一、铁盐和亚铁盐
实验探究一
检验补铁食品中的铁元素
【实验】向补铁溶液中滴入NaOH溶液。
【猜想】若出现红褐色沉淀,则为FeCl3溶液;
若生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,则为FeCl2溶液。(实验时应注意防氧化)
现象为生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色。初步证明补铁食品中的铁元素为Fe2+。
一、铁盐和亚铁盐
Fe2+ Fe3+
溶液的颜色 _____色 ___色
滴加KSCN溶液 无明显现象 溶液变___色
反应原理 不反应 _________________________
结论 利用含有Fe3+的盐溶液遇到KSCN溶液变成___色,检验Fe3+的存在 浅绿
黄
红
Fe3++3SCN-===Fe(SCN)3
红
(3)加KSCN溶液法:
一、铁盐和亚铁盐
实验操作 实验现象 溶液显_______,试管中有_________,再滴加KSCN溶液,溶液___________ 向上层溶液中滴加新制氯水,溶液变成_____
离子方程式 __________________ _________________________________________________
实验结论 Fe2+和Fe3+在一定条件下可以相互转化 3.Fe2+、Fe3+相互转化的实验探究
浅绿色
黑色固体
无明显变化
红色
2Fe2++Cl2===2Fe3++2Cl-、Fe3++3SCN-===Fe(SCN)3
2Fe3++Fe===3Fe2+
一、铁盐和亚铁盐
归纳总结
1.检验溶液含有Fe2+、不含Fe3+的步骤
2.Fe2+和Fe3+的混合溶液中检验Fe2+的方法
通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪去说明含有Fe2+(注意:Cl-等还原性的离子对Fe2+有干扰)。
一、铁盐和亚铁盐
检验Fe2+的注意事项
(1)只含Fe2+的溶液
检验Fe2+加入试剂的顺序:待测液不变色氧化剂如氯水、H2O2红色(含Fe2+,不含Fe3+)。
①加KSCN溶液前,防止加入氧化性物质[如H2O2、NO(H+)等],使Fe2+被氧化。
②氧化剂不能选用酸性KMnO4溶液。原因:酸性KMnO4溶液本身显紫红色,对Fe(SCN)3的红色有干扰;酸性KMnO4溶液能氧化KSCN,溶液不变红色,不能证明不含Fe2+。
(1)向某溶液中滴加氯水,后滴加KSCN溶液,溶液变红色,则原溶液中有Fe3+( )
(2)向溶液中加入KSCN溶液,溶液变红色,说明溶液中含有Fe3+,不含Fe2+( )
(3)向FeCl3溶液中滴加KSCN溶液,出现红色沉淀( )
×
×
×
(4)证明一个未知溶液中含有Fe2+,而不含有Fe3+的方法是什么?
二、 Fe2+、Fe3+、Fe的相互转化
【思考】Fe、FeSO4和Fe2(SO4)3三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂又可做还原剂
举例写出相应反应的化学方程式,并加以说明。
Fe可做还原剂;
Fe2(SO4)3做氧化剂;
FeSO4既可做氧化剂又可做还原剂
二、 Fe2+、Fe3+、Fe的相互转化
1.Fe只具有_____性。可被弱氧化剂(H+、S等)和Fe3+氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。
举例:Fe+2H+===___________;2Fe+3Cl2 _______。
还原
Fe2++H2↑
2FeCl3
2.Fe2+既有_____性又有_____性。可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+;可被还原剂(CO、C等)还原为Fe。举例:
2Fe2++Cl2===____________;FeO+CO ________。
氧化
还原
2Fe3++2Cl-
Fe+CO2
二、 Fe2+、Fe3+、Fe的相互转化
二、 Fe2+、Fe3+、Fe的相互转化
3.Fe3+只具有_____性,可被弱还原剂(Cu等)和Fe还原为Fe2+,被强还原剂(Al、Zn、CO等)还原为Fe。举例:
2Fe3++Fe===______;Fe2O3+3CO __________。
氧化
3Fe2+
2Fe+3CO2
4.含铁物质的分离与除杂
主要物质 杂质 除杂方法
Fe2+ Fe3+ 加过量铁粉后过滤
FeCl3 FeCl2 加氯水或通入Cl2
Fe2+ Cu2+ 加过量铁粉后过滤
二、 Fe2+、Fe3+、Fe的相互转化
1.如何除去FeCl3溶液中的Fe2+,并写出离子方程式。
深度思考
提示 向溶液中加入适量氯水。2Fe2++Cl2===2Fe3++2Cl-。
2.为什么在配制FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?
提示 Fe2+易被氧化成Fe3+,加入铁粉或铁钉发生反应2Fe3++Fe===3Fe2+。
3.FeCl3溶液蚀刻印刷铜板的原理是怎样的?
【答案】2Fe3++Cu === 2Fe2++Cu2+。
Fe2+、Fe3+的检验方法
(2)利用氢氧化物沉淀的颜色
(3)利用显色反应
(1)直接观察颜色
Fe2+、Fe3+的检验方法
(4)利用Fe2+的还原性
(5)利用Fe3+的氧化性
1.下列关于Fe2+和Fe3+的叙述中,错误的是( )
A.Fe2+的水溶液为浅绿色
B.Fe3+的水溶液为黄色
C.Fe3+具有氧化性,Fe2+具有还原性
D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀
D
2.要证明某溶液中不含Fe3+而可能含Fe2+,有如下实验操作:
①加足量新制氯水 ②加足量酸性KMnO4溶液 ③加少量KSCN溶液,则最佳顺序是( )
A.①③ B.③② C.③① D.①②③
C
3.下列物质之间有如下反应关系:
已知E转化成C的现象是白色沉淀迅速
变为灰绿色,最后变为红褐色。
回答:
(1)写出下列物质的化学式:
A ,B ,D ,甲 ,乙 ,
丙 。
Fe2O3
FeCl3
FeCl2
Cl2(合理即可)
NaOH(或KOH等)
KSCN
(2)写出E→C反应的化学方程式: 。
4Fe(OH)2+O2+2H2O===4Fe(OH)3
4.下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明原溶液中含有Fe2+,不含有Mg2+
C
谢谢
