3.2.1常见的合金及应用 课件(共28张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 3.2.1常见的合金及应用 课件(共28张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 30.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-16 00:00:00 | ||
图片预览







文档简介
(共28张PPT)
第二节 金属材料
第三章 铁 金属材料
第1课时 常见的合金及应用
目录
CONTENT
一、铁合金
二、铝和铝合金
三、新型合金
第三章 铁 金属材料
1.
2.
3.
4.
学习目标
认识合金的组成及特性
了解常见铁合金、铝合金、新型合金的组成及用途
能科学、合理的选择和使用金属材料
认识金属铝及氧化铝与酸、碱溶液的反应
在日常生产、生活和科学技术中,金属材料是非常重要的。我们周围的很多物品都中由金属材料制成的。
同学们,下面一起来了解生活中常见的金属材料
1.合金
概念 由两种或两种以上的______(或______________)熔合而成的具有_____特性的物质 性能 硬度 硬度一般_____它的成分金属
熔点 熔点一般_____它的成分金属
与纯金属材料相比,合金具有优良的物理、化学或机械性能 金属
金属和非金属
金属
高于
低于
一、铁合金
铁制品
镍合金门锁
金属材料:包括纯金属和合金
导热性
延展性
导电性
金属特性:
一、铁合金
Cu
Ti
Ag
纯金属
合金
【答案】
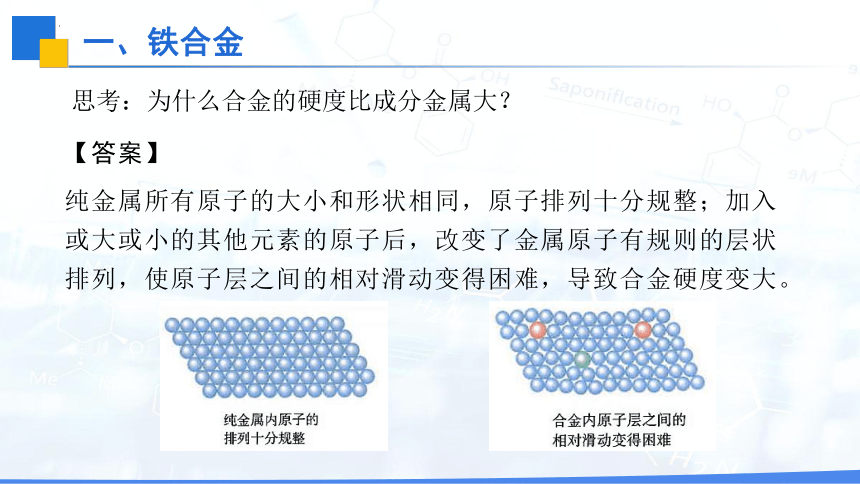
纯金属所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金硬度变大。
思考:为什么合金的硬度比成分金属大?
一、铁合金
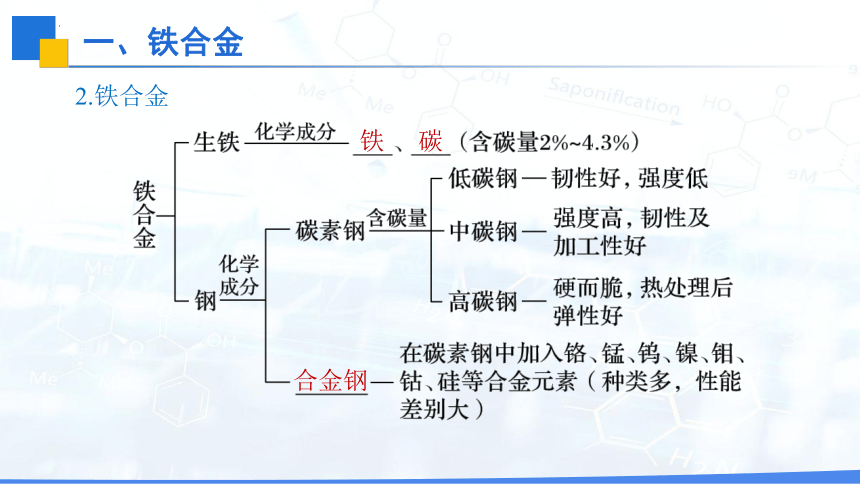
2.铁合金
铁
碳
合金钢
一、铁合金
铁合金 分类 含碳量 性能 用途
生铁 2%~4.3% ________大、抗压,性脆、可铸造成型 制造________和管道等
钢 0.03%~2% 良好的________性,机械性能好,可锻轧和铸造 制造机械和交通工具
硬度
机座
延展
不锈钢是一种重要的合金钢,合金元素主要是___和___,在大气中比较稳定,不易生锈,抗腐蚀能力强,常用于制造医疗器材、厨房用具和餐具,以及地铁列车的车体等。
铬
镍
一、铁合金
各种合金钢的性能和用途
一、铁合金
在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合全钢。这对你有什么启示
合金的结构
合金的性能
合金的用途
研制新材料
对组成元素
定量研究
定性研究
决定
决定
一、铁合金
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)青铜比纯铜的硬度低( )
(4)生铁中的铁与纯铁的化学性质不同( )
(5)地震灾区重建要使用大量钢材,钢材是合金( )
判断正误
×
√
×
√
×
二、铝和铝合金
铝是一种活泼金属,常温下能被空气中的氧气氧化,写出该反应的化学方程式。
4Al+3O2 ===2Al2O3
【思考与交流】铝容易被空气氧化,但为什么人们日常生活中总喜欢使用铝合金制造的物品呢?
在空气中,铝的表面自然形成的氧化膜很薄,耐磨性和抗蚀性还不够强。为了使铝制品适应于不同的用途,常采用化学方法对铝的表面进行处理,如增加膜的厚度,对氧化膜进行着色等。例如,化学氧化 (用铬酸作氧化剂 )可以使氧化膜产生美丽的颜色等。市场上有不少铝制品是经过这种方法处理的。
【实验3-4】
在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
二、铝和铝合金
1.铝、氧化铝的性质
实验 现象 铝片_________,有无色气泡冒出,将点燃的木条放在试管口有_______
逐渐溶解
爆鸣声
化学 方程式 Al2O3+6HCl===2AlCl3+3H2O、2Al+6HCl===2AlCl3+3H2↑
离子 方程式 ______________________________________________________
Al2O3+6H+===2Al3++3H2O、2Al+6H+===2Al3++3H2↑
实验现象 试管①中一开始无气泡产生,一段时间后,铝片______,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有_______
化学方程式 _____________________________________________________________________
离子方程式 _______________________________________________________________
溶解
爆鸣声
Al2O3+2NaOH===2NaAlO2+H2O、2Al+2NaOH+2H2O
===2NaAlO2+3H2↑
【实验3-5】
二、铝和铝合金
实验结论:
①铝既能与稀盐酸反应又能与NaOH溶液反应,都生成___和氢气。
②氧化铝既能与稀盐酸反应又能与NaOH溶液反应,都生成___和水。
(4)两性氧化物、两性氢氧化物的概念
①两性氧化物:既能与酸反应生成_______,又能与碱反应生成________的氧化物,如Al2O3。
②两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,如Al(OH)3。
Al(OH)3溶于盐酸:_____________________________。
Al(OH)3溶于NaOH溶液:________________________________。
二、铝和铝合金
盐和水
盐和水
盐
盐
Al(OH)3+3HCl===AlCl3+3H2O
Al(OH)3+NaOH===NaAlO2+2H2O
2.铝合金
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的___、____、____、___,密度___,强度___,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
Cu
Mg
Mn
Si
小
高
二、铝和铝合金
合金元素 性能 用途
Cu、Mg、Mn、Si __________小、强度高、抗腐蚀能力较强 制造____________、宇宙飞船
密度
飞机
三、新型合金
1.储氢合金:一类能够大量吸收H2,并与H2结合成_____________的材料。如Ti-Fe合金、La-Ni合金,为氢气作为能源的实际应用起到重要的推动作用。
金属氢化物
钛合金
耐热合金
形状记忆合金
2.其他新型合金:_______、_________和_____________等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
要求:储氢量大, 金属氢化物既容易形成,稍稍加热又容易分解,室温下吸、 放氢的速率快。
Ti,V,Fe,Al等,飞机起落架钛合金
钛合金
耐热合金是在高温使用环境条件下,具有组织稳定和优良力学、物理、化学性能的合金。
耐热合金
形状记忆合金是通过热弹性与马氏体相变及其逆变而具有形状记忆效应的由两种以上金属元素所构成的材料。
记忆合金
Ti~Fe, La~Ni一种新型合金,一定条件下能吸收氢气,一定条件能放出氢气。
储氢合金
多孔金属材料兼有功能材料和结构材料的双重作用。
泡沫金属
三、新型合金
3.用途广泛的稀土金属
(1)镧系元素(57~71号元素)及钇和钪,共17种元素为稀土元素。
我国拥有丰富的稀土资源,现已查明的世界稀土资源中,80%分布在我国,并且品种齐全。
(2)稀土金属有着广泛的用途,它既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。
(3)稀土金属可用于制造引火合金、永磁材料、超导材料和发光材料等。稀土金属除广泛应用在冶金、石油化工、材料工业、医药及农业领域外,还逐渐深入到许多现代科技领域。
三、新型合金
1.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述中,不正确的是( )
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
D
2.下列有关厨房铝制品的使用中,你认为合理的是( )
A.盛放食醋 B.烧煮开水
C.用金属丝擦洗表面的污垢 D.用碱水洗涤
B
3.称取两份铝粉,第一份中加入足量的盐酸,第二份中加入足量的NaOH溶液,若同温同压下放出相同体积的气体,则两份铝粉的质量之比为( )
A.2∶3 B.1∶6 C.1∶1 D.3∶2
C
4.在空气中铝制品比铁制品耐腐蚀的原因是( )
A.铝的金属活动性比铁弱
B.铝不与氧气发生化学反应
C.铝在空气中易与氧气反应形成一层致密的氧化膜
D.铝的密度比铁的密度小
C
5.铝制器皿能够盛放的物质是( )
A.KOH溶液 B.浓硫酸
C.NaOH溶液 D.稀硫酸
B
谢谢
第二节 金属材料
第三章 铁 金属材料
第1课时 常见的合金及应用
目录
CONTENT
一、铁合金
二、铝和铝合金
三、新型合金
第三章 铁 金属材料
1.
2.
3.
4.
学习目标
认识合金的组成及特性
了解常见铁合金、铝合金、新型合金的组成及用途
能科学、合理的选择和使用金属材料
认识金属铝及氧化铝与酸、碱溶液的反应
在日常生产、生活和科学技术中,金属材料是非常重要的。我们周围的很多物品都中由金属材料制成的。
同学们,下面一起来了解生活中常见的金属材料
1.合金
概念 由两种或两种以上的______(或______________)熔合而成的具有_____特性的物质 性能 硬度 硬度一般_____它的成分金属
熔点 熔点一般_____它的成分金属
与纯金属材料相比,合金具有优良的物理、化学或机械性能 金属
金属和非金属
金属
高于
低于
一、铁合金
铁制品
镍合金门锁
金属材料:包括纯金属和合金
导热性
延展性
导电性
金属特性:
一、铁合金
Cu
Ti
Ag
纯金属
合金
【答案】
纯金属所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金硬度变大。
思考:为什么合金的硬度比成分金属大?
一、铁合金
2.铁合金
铁
碳
合金钢
一、铁合金
铁合金 分类 含碳量 性能 用途
生铁 2%~4.3% ________大、抗压,性脆、可铸造成型 制造________和管道等
钢 0.03%~2% 良好的________性,机械性能好,可锻轧和铸造 制造机械和交通工具
硬度
机座
延展
不锈钢是一种重要的合金钢,合金元素主要是___和___,在大气中比较稳定,不易生锈,抗腐蚀能力强,常用于制造医疗器材、厨房用具和餐具,以及地铁列车的车体等。
铬
镍
一、铁合金
各种合金钢的性能和用途
一、铁合金
在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合全钢。这对你有什么启示
合金的结构
合金的性能
合金的用途
研制新材料
对组成元素
定量研究
定性研究
决定
决定
一、铁合金
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)青铜比纯铜的硬度低( )
(4)生铁中的铁与纯铁的化学性质不同( )
(5)地震灾区重建要使用大量钢材,钢材是合金( )
判断正误
×
√
×
√
×
二、铝和铝合金
铝是一种活泼金属,常温下能被空气中的氧气氧化,写出该反应的化学方程式。
4Al+3O2 ===2Al2O3
【思考与交流】铝容易被空气氧化,但为什么人们日常生活中总喜欢使用铝合金制造的物品呢?
在空气中,铝的表面自然形成的氧化膜很薄,耐磨性和抗蚀性还不够强。为了使铝制品适应于不同的用途,常采用化学方法对铝的表面进行处理,如增加膜的厚度,对氧化膜进行着色等。例如,化学氧化 (用铬酸作氧化剂 )可以使氧化膜产生美丽的颜色等。市场上有不少铝制品是经过这种方法处理的。
【实验3-4】
在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
二、铝和铝合金
1.铝、氧化铝的性质
实验 现象 铝片_________,有无色气泡冒出,将点燃的木条放在试管口有_______
逐渐溶解
爆鸣声
化学 方程式 Al2O3+6HCl===2AlCl3+3H2O、2Al+6HCl===2AlCl3+3H2↑
离子 方程式 ______________________________________________________
Al2O3+6H+===2Al3++3H2O、2Al+6H+===2Al3++3H2↑
实验现象 试管①中一开始无气泡产生,一段时间后,铝片______,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有_______
化学方程式 _____________________________________________________________________
离子方程式 _______________________________________________________________
溶解
爆鸣声
Al2O3+2NaOH===2NaAlO2+H2O、2Al+2NaOH+2H2O
===2NaAlO2+3H2↑
【实验3-5】
二、铝和铝合金
实验结论:
①铝既能与稀盐酸反应又能与NaOH溶液反应,都生成___和氢气。
②氧化铝既能与稀盐酸反应又能与NaOH溶液反应,都生成___和水。
(4)两性氧化物、两性氢氧化物的概念
①两性氧化物:既能与酸反应生成_______,又能与碱反应生成________的氧化物,如Al2O3。
②两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,如Al(OH)3。
Al(OH)3溶于盐酸:_____________________________。
Al(OH)3溶于NaOH溶液:________________________________。
二、铝和铝合金
盐和水
盐和水
盐
盐
Al(OH)3+3HCl===AlCl3+3H2O
Al(OH)3+NaOH===NaAlO2+2H2O
2.铝合金
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的___、____、____、___,密度___,强度___,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
Cu
Mg
Mn
Si
小
高
二、铝和铝合金
合金元素 性能 用途
Cu、Mg、Mn、Si __________小、强度高、抗腐蚀能力较强 制造____________、宇宙飞船
密度
飞机
三、新型合金
1.储氢合金:一类能够大量吸收H2,并与H2结合成_____________的材料。如Ti-Fe合金、La-Ni合金,为氢气作为能源的实际应用起到重要的推动作用。
金属氢化物
钛合金
耐热合金
形状记忆合金
2.其他新型合金:_______、_________和_____________等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
要求:储氢量大, 金属氢化物既容易形成,稍稍加热又容易分解,室温下吸、 放氢的速率快。
Ti,V,Fe,Al等,飞机起落架钛合金
钛合金
耐热合金是在高温使用环境条件下,具有组织稳定和优良力学、物理、化学性能的合金。
耐热合金
形状记忆合金是通过热弹性与马氏体相变及其逆变而具有形状记忆效应的由两种以上金属元素所构成的材料。
记忆合金
Ti~Fe, La~Ni一种新型合金,一定条件下能吸收氢气,一定条件能放出氢气。
储氢合金
多孔金属材料兼有功能材料和结构材料的双重作用。
泡沫金属
三、新型合金
3.用途广泛的稀土金属
(1)镧系元素(57~71号元素)及钇和钪,共17种元素为稀土元素。
我国拥有丰富的稀土资源,现已查明的世界稀土资源中,80%分布在我国,并且品种齐全。
(2)稀土金属有着广泛的用途,它既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。
(3)稀土金属可用于制造引火合金、永磁材料、超导材料和发光材料等。稀土金属除广泛应用在冶金、石油化工、材料工业、医药及农业领域外,还逐渐深入到许多现代科技领域。
三、新型合金
1.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述中,不正确的是( )
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
D
2.下列有关厨房铝制品的使用中,你认为合理的是( )
A.盛放食醋 B.烧煮开水
C.用金属丝擦洗表面的污垢 D.用碱水洗涤
B
3.称取两份铝粉,第一份中加入足量的盐酸,第二份中加入足量的NaOH溶液,若同温同压下放出相同体积的气体,则两份铝粉的质量之比为( )
A.2∶3 B.1∶6 C.1∶1 D.3∶2
C
4.在空气中铝制品比铁制品耐腐蚀的原因是( )
A.铝的金属活动性比铁弱
B.铝不与氧气发生化学反应
C.铝在空气中易与氧气反应形成一层致密的氧化膜
D.铝的密度比铁的密度小
C
5.铝制器皿能够盛放的物质是( )
A.KOH溶液 B.浓硫酸
C.NaOH溶液 D.稀硫酸
B
谢谢
