黑龙江省哈尔滨市第九中学校2022-2023学年高一下学期6月月考化学试题(含答案)
文档属性
| 名称 | 黑龙江省哈尔滨市第九中学校2022-2023学年高一下学期6月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 438.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-16 19:29:54 | ||
图片预览


文档简介
哈尔滨市第九中学校2022-2023学年高一下学期6月月考
化学试卷
(考试时间:90分钟 满分:100 分)
第Ⅰ卷 选择题
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cu-64 Fe-56
一、单项选择题(本题包括25小题,每题2分,共50分)
1.下列反应属于放热反应的是
A.盐酸与碳酸氢钠反应 B. HCl溶液和NaOH溶液反应
C.灼热的炭与CO2反应 D. Ba(OH)2·8H2O 与NH4Cl反应
2..下列说法正确的是
A.提倡使用-次性筷子、纸杯和塑料袋
B.绿色食品与相关物质的颜色有关.
C.绿色化学的核心是先污染再治理
D.硝酸铵是一种高效氮肥,但受热或经撞击易发生爆炸
3.化学是人类利用自然资源和应对环境问题的重要科学依据,下列说法错误的是
A.煤的综合利用中,煤的气化和煤的液化都属于物理变化
B.石油的裂解可以得到乙烯、丙烯、甲烷等重要的基本化工原料
C.天然气是一种清洁的化石燃料,它作为化工原料主要用于合成氨和生产甲醇等
D.三废是指“废水”,"废气”,“废渣”
4.下列化学用语表述正确的是
A.正丁烷的空间填允模型:
B.氯化铵的电子式:
C.3-甲基戊烷的键线式:
D.中子数为8的氧原子:
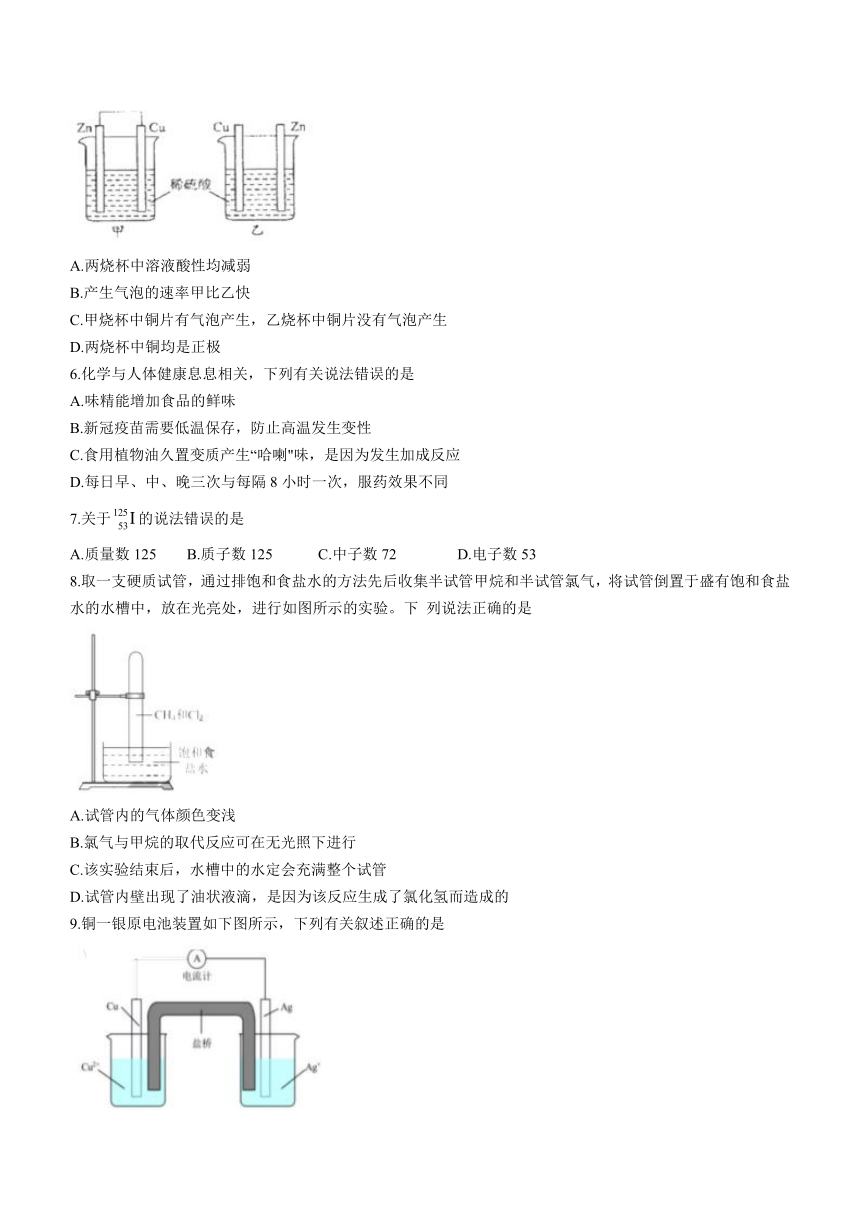
5.将纯锌与纯铜按图所示的方法插入同浓度稀硫酸中,一段时间后,以下叙述错误的是
A.两烧杯中溶液酸性均减弱
B.产生气泡的速率甲比乙快
C.甲烧杯中铜片有气泡产生,乙烧杯中铜片没有气泡产生
D.两烧杯中铜均是正极
6.化学与人体健康息息相关,下列有关说法错误的是
A.味精能增加食品的鲜味
B.新冠疫苗需要低温保存,防止高温发生变性
C.食用植物油久置变质产生“哈喇"味,是因为发生加成反应
D.每日早、中、晚三次与每隔8小时一次,服药效果不同
7.关于的说法错误的是
A.质量数125 B.质子数125 C.中子数72 D.电子数53
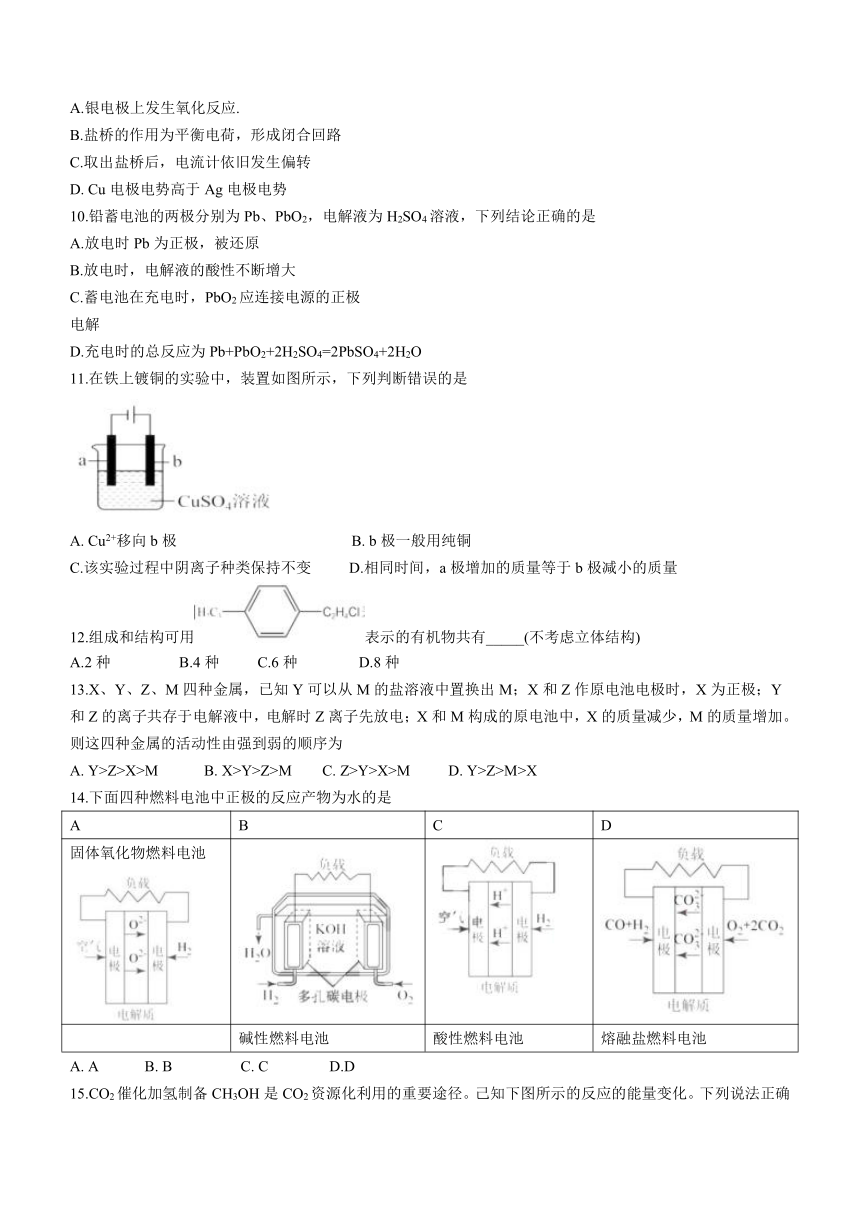
8.取一支硬质试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,将试管倒置于盛有饱和食盐水的水槽中,放在光亮处,进行如图所示的实验。下 列说法正确的是
A.试管内的气体颜色变浅
B.氯气与甲烷的取代反应可在无光照下进行
C.该实验结束后,水槽中的水定会充满整个试管
D.试管内壁出现了油状液滴,是因为该反应生成了氯化氢而造成的
9.铜一银原电池装置如下图所示,下列有关叙述正确的是
A.银电极上发生氧化反应.
B.盐桥的作用为平衡电荷,形成闭合回路
C.取出盐桥后,电流计依旧发生偏转
D. Cu电极电势高于Ag电极电势
10.铅蓄电池的两极分别为Pb、PbO2,电解液为H2SO4溶液,下列结论正确的是
A.放电时Pb为正极,被还原
B.放电时,电解液的酸性不断增大
C.蓄电池在充电时,PbO2应连接电源的正极
电解
D.充电时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O
11.在铁上镀铜的实验中,装置如图所示,下列判断错误的是
A. Cu2+移向b极 B. b极一般用纯铜
C.该实验过程中阴离子种类保持不变 D.相同时间,a极增加的质量等于b极减小的质量
12.组成和结构可用表示的有机物共有_____(不考虑立体结构)
A.2种 B.4种 C.6种 D.8种
13.X、Y、Z、M四种金属,已知Y可以从M的盐溶液中置换出M;X和Z作原电池电极时,X为正极;Y和Z的离子共存于电解液中,电解时Z离子先放电;X和M构成的原电池中,X的质量减少,M的质量增加。则这四种金属的活动性由强到弱的顺序为
A. Y>Z>X>M B. X>Y>Z>M C. Z>Y>X>M D. Y>Z>M>X
14.下面四种燃料电池中正极的反应产物为水的是
A B C D
固体氧化物燃料电池
碱性燃料电池 酸性燃料电池 熔融盐燃料电池
A. A B. B C. C D.D
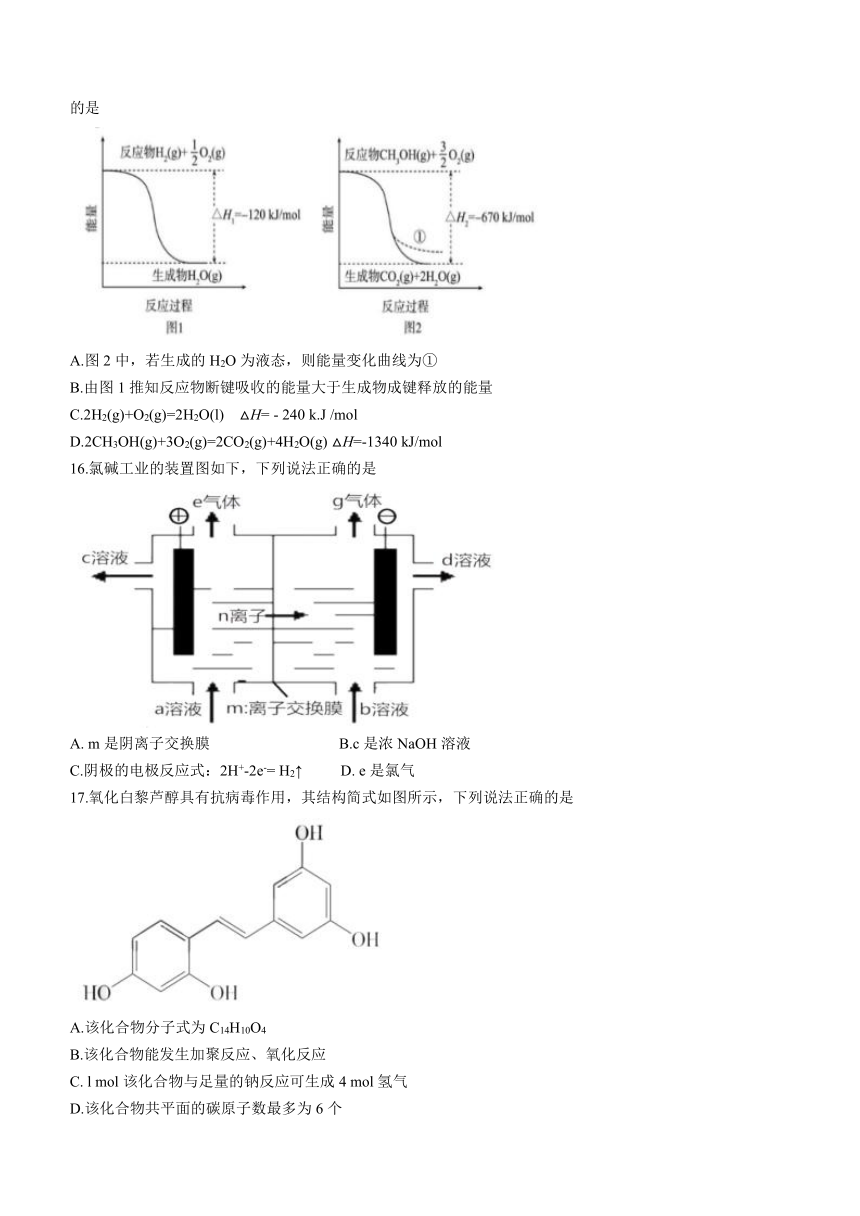
15.CO2催化加氢制备CH3OH是CO2资源化利用的重要途径。己知下图所示的反应的能量变化。下列说法正确的是
A.图2中,若生成的H2O为液态,则能量变化曲线为①
B.由图1推知反应物断键吸收的能量大于生成物成键释放的能量
C.2H2(g)+O2(g)=2H2O(l) △H= - 240 k.J /mol
D.2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1340 kJ/mol
16.氯碱工业的装置图如下,下列说法正确的是
A. m是阴离子交换膜 B.c是浓NaOH溶液
C.阴极的电极反应式:2H+-2e-= H2↑ D. e是氯气
17.氧化白黎芦醇具有抗病毒作用,其结构简式如图所示,下列说法正确的是
A.该化合物分子式为C14H10O4
B.该化合物能发生加聚反应、氧化反应
C. l mol该化合物与足量的钠反应可生成4 mol氢气
D.该化合物共平面的碳原子数最多为6个
18.几种第二、三周期元素的原子半径及主要化合价如表所示,下列叙述错误的是
元素代号 X Y Z W
原子半径/pm 160 143 75 74
主要化合价 +2 +3 +5、-3 -2
A. X、Y的最高价氧化物对应水化物的碱性:X>Y
B.X与Z形成的化合物为共价化合物
C.气态氢化物稳定性:ZD.简单离子的半径:Z>W
19.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。下列说法错误的是
A.图中a极要连接电源的负极 B.C口流出的物质是较浓硫酸
C. a极发生氧化反应 D. 放电的电极反应式为H2O+-2e-=+2H+
20.理想的碳封存技术应该可以产生电能,而不是消耗能量。一种能够捕捉二氧化碳的原电池的工作原理如图所示。下列有关说法错误的是
A.金属铝电极发生反应:Al-3e-=Al3+
B.通入CO2的一极电极反应式为2CO2+2e-=
C.每得到l mol Al2(C2O4)3,电路中转移6 mol电子
D.该电池工作过程中,电子由Al经溶剂到CO2
21.下列关于物质的鉴别或除杂说法错误的是
A.可用溴水来鉴别直馏汽油和裂化汽油
B.除去乙烷中的乙烯可以将混合气体通过溴水洗气
C.可用氢氧化钠来鉴别乙醇和乙酸
D.鉴别丝和棉花可以用灼烧的方法
22. W、X、Y、Z均为短周期元素,原子序数依次增加,Z是地壳中含量最高的元素,M、N是由这些元素组成的二元化合物,M和N转化为R的反应历程与能量关系如图所示。
下列叙述错误的是
A. M的键角为180°
B.①→②放出能量并有非极性键生成
C.上述四种元素只能形成离子化合物.
D.生成R总反应的原子利用率为100%
23.下列说法中正确的是
A.已知:C8H18的燃烧热为11003 kJ/mol,则101kPa时:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(l) △H=-11003 kJ/mol
B.需要加热才能进行的反应一定是吸热反应
C.500°C、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,则热化学方程式为:N2(g)+3H2(g)2NH3(g) △H=- 38.6 kJ/mol
D.已知S(g)+O2(g) = =SO2(g) △H1;S(s)+O2(g) = SO2(g) △H2, 则△H1<△H2
24.下列有关NA的说法正确的是
A.惰性电极电解足量饱和食盐水,当生成2 mol NaOH时,阳极失去的电子数目为2NA
B.电解精炼铜,当阴极生成1 mol Cu时,阳极反应的Cu原子数目为NA
C.氢氧燃料电池,当正极消耗22.4 L (标准状况)氧气时,电路中通过的电子数目为2NA
D.电解足量CuCl2溶液,当电路中转移2mole时,阳极一定生成NA个Cl
25.我国科学家设计二氧化碳熔融盐捕获及电化学装置,其示意图如图所示,下列说法错误的是
A. c为电源的负极
B. a极的电极反应式为2+4e-=4CO2+O2
C.上述装置可能发生反应CO2C+O2
D.①②中,捕获CO2时碳元素的化合价没有变化
第Ⅱ卷 (非选择题)
二、填空题(本题4道小题,共50分)
26. Ⅰ.化学反应伴随能量变化,获取反应能量变化有多条途径。回答下列问题:
(1)理论研究表明,在101 kPa和298K下,HCN(g)=HNC(g)异构化反应过程的能量变化如图所示,HCN与HNC稳定性较弱的是____________。
(2)已知:
化学键种类 C-H N-H C≡N
键能(kJ/mol) a b c
计算可得:HNC(g)=HCN(g) △H=______kJ/mol|(用含 a、b的式子表示)。
(3)神舟系列火箭用偏二甲肼C2H8N2作燃料,N2O4作氧化剂,反应后产物无污染。
已知:反应1:N2(g)+2O2(g)=N2O4(g) △H= x kJmol-
反应2:C2H8N2(1)+4O2(g)=N2(g)+2CO2(g)+4H2O(g) △H2= y kJ :mol 1
写出C2H8N2(1)和N2O4(g)反应生成N2(g)、CO2(g)、H2O(g)的热化学方程式:______________.
Ⅱ.某学生通过测定反应过程中所放出的热量来计算中和反应的反应热。将50 mL0.50 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液加入如图甲所示的装置中,进行中和反应。请回答下列问题:
(4)从实验装置上看,图中缺少的一种玻璃仪器是__________(填仪器名称)。
(5)该同学做实验时有些操作不规范,造成测得中和反应反应热△H偏低,请你分析可能的原因是________。
A.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
B.在量取盐酸时仰视读数
C.测量盐酸的温度后,温度计没有用水冲洗干净
D.用Ba(OH)2溶液和硫酸代替上述试剂
27.已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,它们之间有如图转化关系,请回答下列问题:
(1)有机物A的分子式为___________, 有机物B中官能团的电子式为_____________。
(2)有机物D的最简式为___________, 有机物E中官能团的名称为______________。
(3)写出反应②的化学反应方程式__________________。
反应⑦的反应类型为_____________。
(4)写出符合以下两个要求有机物的结构简式:
①与F互为同系物且含5个碳原子
②该物质的一氯代物只有一种。
28.乙酸乙酯是是一种用途广泛的精细化工产品,是极好的工业溶剂,广泛应用于生产和生活中。
某小组同学欲制取并分离提纯乙酸乙酯,制取实验装置设计如下:
已知:①装置C中盛放的溶液为饱和碳酸钠溶液。
②有关有机物的沸点:
试剂 乙醇 乙酸 乙酸乙酯
沸点/°C 78.5 118 77.1
(1)仪器A的名称是_____________,球形干燥管B的作用是____________。
(2)写出CH3COOH与CH3CH2OH在浓硫酸的作用下,生成乙酸乙酯的化学方程式为_____________,该反应的类型属于____________反应。
(3)装置C中饱和碳酸钠的作用为__________。
A.中和乙酸 B.溶解乙醇
C.降低乙酸乙酯的溶解度 D.吸收水蒸气
(4)在实验过程中,能否用NaOH溶液替代装置C中的饱和碳酸钠溶液_________(填“能”或“否”)
(5)此实验装置中的长导管的作用为_____________。
(6)此实验为什么刚开始加热时要缓慢 ____________。
29. Ⅰ. 如图是某同学设计的一一个简易的原电池装置,请回答下列问题。
(1)如图(1),正极的电极反应式为_____________。
(2)如图(2),电流表的指针也会偏转,则电流流出的一极为____________(填 “Fe”或“Cu”),溶液中的向___极移动(填“Fe”或“Cu”)。
(3)如图(3),负极的电极反应式为_____________。
Ⅱ.用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,其体积均为500 mL,浓度均为2 mol/L。
组别 A槽 B槽
1 CuBr2溶液 NaOH溶液
2 AgNO3溶液 NaCl溶液
3 CuSO4溶液 CuCl2溶液
4 AlCl3溶液 Na2SO4溶液
(4)选择第1组电解液时,当c电极产生标况下22.4 L气体时,a极质量增加_____g。
(5)选择第2组电解液时,当b极生成4 g电解产物时,忽略电解前后电解液的体积变化,此时B槽中的c(OH-)_______mol/L(不考虑OH-与Cl2的反应)。
(6)选择第3组电解液时,当a、c两极电解产物的质量相等时,b极和d极产生的气体体积比为________(同温同压下,忽略气体的溶解)。
(7)选择第4组电解液时,此时该组A池的总反应的化学方程式为___________________。
哈尔滨市第九中学校2022-2023学年高一下学期6月月考
化学试卷答案
第I卷 选择题
一、单项选择题(本题包括25小题,每题2分,共50分)
1-5:BDACD 6-10:CBABC 11-15:ABACD 16-20:DBBCD 21-25:CCDAB
第Ⅱ卷 (非选择题)
二、填空题(本题4道小题,共50分)
26. (10分)
(1) HNC(2分)
(2) b-a (2分)
(3) C2H8N2(I)+2N2O4(g)=3N2(g)+2CO2(g)+4H2O(g) △H=(y-2x) kJ/mol (2分)
(4)玻璃搅拌器(2分)
(5)BD (2分)
27. (13分)
(1)C2H4 (1分)
羟基的电子式(2 分)
(2) CH2O (2分)
酯基(2分)
(3) 2C2H5OH+O2 2CH3CHO+2H2O (2分);加成(2分)
(4) (2分)
28. (13分)
(1)分液漏斗(或滴液漏斗) (1分);防倒吸(2 分)
(2) CH3COOH+C2H5OHCH3COOC2H5+H2O (2分);取代(或酯化) (1分)
(3)ABC (3分)
(4)否(1分)
(5)冷凝(1分)
(6)防止反应物还未来得及反应即被加热蒸馏出来,造成反应物的损失,防副反应的发生。(2分)
29. (14 分)
(1) Fe3-+e-= Fe2+ (2分)
(1)Cu(1分)Fe(1分)
(3) Al-3e-+4OH-=+2H2O (2分)
(4) 64 (2分)
(5)1(2分)
(6)1:2(2分)
(7)2AlCl3+6H2O3Cl2↑+3H2↑+2Al(OH)3↓(2 分)
化学试卷
(考试时间:90分钟 满分:100 分)
第Ⅰ卷 选择题
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cu-64 Fe-56
一、单项选择题(本题包括25小题,每题2分,共50分)
1.下列反应属于放热反应的是
A.盐酸与碳酸氢钠反应 B. HCl溶液和NaOH溶液反应
C.灼热的炭与CO2反应 D. Ba(OH)2·8H2O 与NH4Cl反应
2..下列说法正确的是
A.提倡使用-次性筷子、纸杯和塑料袋
B.绿色食品与相关物质的颜色有关.
C.绿色化学的核心是先污染再治理
D.硝酸铵是一种高效氮肥,但受热或经撞击易发生爆炸
3.化学是人类利用自然资源和应对环境问题的重要科学依据,下列说法错误的是
A.煤的综合利用中,煤的气化和煤的液化都属于物理变化
B.石油的裂解可以得到乙烯、丙烯、甲烷等重要的基本化工原料
C.天然气是一种清洁的化石燃料,它作为化工原料主要用于合成氨和生产甲醇等
D.三废是指“废水”,"废气”,“废渣”
4.下列化学用语表述正确的是
A.正丁烷的空间填允模型:
B.氯化铵的电子式:
C.3-甲基戊烷的键线式:
D.中子数为8的氧原子:
5.将纯锌与纯铜按图所示的方法插入同浓度稀硫酸中,一段时间后,以下叙述错误的是
A.两烧杯中溶液酸性均减弱
B.产生气泡的速率甲比乙快
C.甲烧杯中铜片有气泡产生,乙烧杯中铜片没有气泡产生
D.两烧杯中铜均是正极
6.化学与人体健康息息相关,下列有关说法错误的是
A.味精能增加食品的鲜味
B.新冠疫苗需要低温保存,防止高温发生变性
C.食用植物油久置变质产生“哈喇"味,是因为发生加成反应
D.每日早、中、晚三次与每隔8小时一次,服药效果不同
7.关于的说法错误的是
A.质量数125 B.质子数125 C.中子数72 D.电子数53
8.取一支硬质试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,将试管倒置于盛有饱和食盐水的水槽中,放在光亮处,进行如图所示的实验。下 列说法正确的是
A.试管内的气体颜色变浅
B.氯气与甲烷的取代反应可在无光照下进行
C.该实验结束后,水槽中的水定会充满整个试管
D.试管内壁出现了油状液滴,是因为该反应生成了氯化氢而造成的
9.铜一银原电池装置如下图所示,下列有关叙述正确的是
A.银电极上发生氧化反应.
B.盐桥的作用为平衡电荷,形成闭合回路
C.取出盐桥后,电流计依旧发生偏转
D. Cu电极电势高于Ag电极电势
10.铅蓄电池的两极分别为Pb、PbO2,电解液为H2SO4溶液,下列结论正确的是
A.放电时Pb为正极,被还原
B.放电时,电解液的酸性不断增大
C.蓄电池在充电时,PbO2应连接电源的正极
电解
D.充电时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O
11.在铁上镀铜的实验中,装置如图所示,下列判断错误的是
A. Cu2+移向b极 B. b极一般用纯铜
C.该实验过程中阴离子种类保持不变 D.相同时间,a极增加的质量等于b极减小的质量
12.组成和结构可用表示的有机物共有_____(不考虑立体结构)
A.2种 B.4种 C.6种 D.8种
13.X、Y、Z、M四种金属,已知Y可以从M的盐溶液中置换出M;X和Z作原电池电极时,X为正极;Y和Z的离子共存于电解液中,电解时Z离子先放电;X和M构成的原电池中,X的质量减少,M的质量增加。则这四种金属的活动性由强到弱的顺序为
A. Y>Z>X>M B. X>Y>Z>M C. Z>Y>X>M D. Y>Z>M>X
14.下面四种燃料电池中正极的反应产物为水的是
A B C D
固体氧化物燃料电池
碱性燃料电池 酸性燃料电池 熔融盐燃料电池
A. A B. B C. C D.D
15.CO2催化加氢制备CH3OH是CO2资源化利用的重要途径。己知下图所示的反应的能量变化。下列说法正确的是
A.图2中,若生成的H2O为液态,则能量变化曲线为①
B.由图1推知反应物断键吸收的能量大于生成物成键释放的能量
C.2H2(g)+O2(g)=2H2O(l) △H= - 240 k.J /mol
D.2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1340 kJ/mol
16.氯碱工业的装置图如下,下列说法正确的是
A. m是阴离子交换膜 B.c是浓NaOH溶液
C.阴极的电极反应式:2H+-2e-= H2↑ D. e是氯气
17.氧化白黎芦醇具有抗病毒作用,其结构简式如图所示,下列说法正确的是
A.该化合物分子式为C14H10O4
B.该化合物能发生加聚反应、氧化反应
C. l mol该化合物与足量的钠反应可生成4 mol氢气
D.该化合物共平面的碳原子数最多为6个
18.几种第二、三周期元素的原子半径及主要化合价如表所示,下列叙述错误的是
元素代号 X Y Z W
原子半径/pm 160 143 75 74
主要化合价 +2 +3 +5、-3 -2
A. X、Y的最高价氧化物对应水化物的碱性:X>Y
B.X与Z形成的化合物为共价化合物
C.气态氢化物稳定性:Z
19.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。下列说法错误的是
A.图中a极要连接电源的负极 B.C口流出的物质是较浓硫酸
C. a极发生氧化反应 D. 放电的电极反应式为H2O+-2e-=+2H+
20.理想的碳封存技术应该可以产生电能,而不是消耗能量。一种能够捕捉二氧化碳的原电池的工作原理如图所示。下列有关说法错误的是
A.金属铝电极发生反应:Al-3e-=Al3+
B.通入CO2的一极电极反应式为2CO2+2e-=
C.每得到l mol Al2(C2O4)3,电路中转移6 mol电子
D.该电池工作过程中,电子由Al经溶剂到CO2
21.下列关于物质的鉴别或除杂说法错误的是
A.可用溴水来鉴别直馏汽油和裂化汽油
B.除去乙烷中的乙烯可以将混合气体通过溴水洗气
C.可用氢氧化钠来鉴别乙醇和乙酸
D.鉴别丝和棉花可以用灼烧的方法
22. W、X、Y、Z均为短周期元素,原子序数依次增加,Z是地壳中含量最高的元素,M、N是由这些元素组成的二元化合物,M和N转化为R的反应历程与能量关系如图所示。
下列叙述错误的是
A. M的键角为180°
B.①→②放出能量并有非极性键生成
C.上述四种元素只能形成离子化合物.
D.生成R总反应的原子利用率为100%
23.下列说法中正确的是
A.已知:C8H18的燃烧热为11003 kJ/mol,则101kPa时:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(l) △H=-11003 kJ/mol
B.需要加热才能进行的反应一定是吸热反应
C.500°C、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,则热化学方程式为:N2(g)+3H2(g)2NH3(g) △H=- 38.6 kJ/mol
D.已知S(g)+O2(g) = =SO2(g) △H1;S(s)+O2(g) = SO2(g) △H2, 则△H1<△H2
24.下列有关NA的说法正确的是
A.惰性电极电解足量饱和食盐水,当生成2 mol NaOH时,阳极失去的电子数目为2NA
B.电解精炼铜,当阴极生成1 mol Cu时,阳极反应的Cu原子数目为NA
C.氢氧燃料电池,当正极消耗22.4 L (标准状况)氧气时,电路中通过的电子数目为2NA
D.电解足量CuCl2溶液,当电路中转移2mole时,阳极一定生成NA个Cl
25.我国科学家设计二氧化碳熔融盐捕获及电化学装置,其示意图如图所示,下列说法错误的是
A. c为电源的负极
B. a极的电极反应式为2+4e-=4CO2+O2
C.上述装置可能发生反应CO2C+O2
D.①②中,捕获CO2时碳元素的化合价没有变化
第Ⅱ卷 (非选择题)
二、填空题(本题4道小题,共50分)
26. Ⅰ.化学反应伴随能量变化,获取反应能量变化有多条途径。回答下列问题:
(1)理论研究表明,在101 kPa和298K下,HCN(g)=HNC(g)异构化反应过程的能量变化如图所示,HCN与HNC稳定性较弱的是____________。
(2)已知:
化学键种类 C-H N-H C≡N
键能(kJ/mol) a b c
计算可得:HNC(g)=HCN(g) △H=______kJ/mol|(用含 a、b的式子表示)。
(3)神舟系列火箭用偏二甲肼C2H8N2作燃料,N2O4作氧化剂,反应后产物无污染。
已知:反应1:N2(g)+2O2(g)=N2O4(g) △H= x kJmol-
反应2:C2H8N2(1)+4O2(g)=N2(g)+2CO2(g)+4H2O(g) △H2= y kJ :mol 1
写出C2H8N2(1)和N2O4(g)反应生成N2(g)、CO2(g)、H2O(g)的热化学方程式:______________.
Ⅱ.某学生通过测定反应过程中所放出的热量来计算中和反应的反应热。将50 mL0.50 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液加入如图甲所示的装置中,进行中和反应。请回答下列问题:
(4)从实验装置上看,图中缺少的一种玻璃仪器是__________(填仪器名称)。
(5)该同学做实验时有些操作不规范,造成测得中和反应反应热△H偏低,请你分析可能的原因是________。
A.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
B.在量取盐酸时仰视读数
C.测量盐酸的温度后,温度计没有用水冲洗干净
D.用Ba(OH)2溶液和硫酸代替上述试剂
27.已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,它们之间有如图转化关系,请回答下列问题:
(1)有机物A的分子式为___________, 有机物B中官能团的电子式为_____________。
(2)有机物D的最简式为___________, 有机物E中官能团的名称为______________。
(3)写出反应②的化学反应方程式__________________。
反应⑦的反应类型为_____________。
(4)写出符合以下两个要求有机物的结构简式:
①与F互为同系物且含5个碳原子
②该物质的一氯代物只有一种。
28.乙酸乙酯是是一种用途广泛的精细化工产品,是极好的工业溶剂,广泛应用于生产和生活中。
某小组同学欲制取并分离提纯乙酸乙酯,制取实验装置设计如下:
已知:①装置C中盛放的溶液为饱和碳酸钠溶液。
②有关有机物的沸点:
试剂 乙醇 乙酸 乙酸乙酯
沸点/°C 78.5 118 77.1
(1)仪器A的名称是_____________,球形干燥管B的作用是____________。
(2)写出CH3COOH与CH3CH2OH在浓硫酸的作用下,生成乙酸乙酯的化学方程式为_____________,该反应的类型属于____________反应。
(3)装置C中饱和碳酸钠的作用为__________。
A.中和乙酸 B.溶解乙醇
C.降低乙酸乙酯的溶解度 D.吸收水蒸气
(4)在实验过程中,能否用NaOH溶液替代装置C中的饱和碳酸钠溶液_________(填“能”或“否”)
(5)此实验装置中的长导管的作用为_____________。
(6)此实验为什么刚开始加热时要缓慢 ____________。
29. Ⅰ. 如图是某同学设计的一一个简易的原电池装置,请回答下列问题。
(1)如图(1),正极的电极反应式为_____________。
(2)如图(2),电流表的指针也会偏转,则电流流出的一极为____________(填 “Fe”或“Cu”),溶液中的向___极移动(填“Fe”或“Cu”)。
(3)如图(3),负极的电极反应式为_____________。
Ⅱ.用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,其体积均为500 mL,浓度均为2 mol/L。
组别 A槽 B槽
1 CuBr2溶液 NaOH溶液
2 AgNO3溶液 NaCl溶液
3 CuSO4溶液 CuCl2溶液
4 AlCl3溶液 Na2SO4溶液
(4)选择第1组电解液时,当c电极产生标况下22.4 L气体时,a极质量增加_____g。
(5)选择第2组电解液时,当b极生成4 g电解产物时,忽略电解前后电解液的体积变化,此时B槽中的c(OH-)_______mol/L(不考虑OH-与Cl2的反应)。
(6)选择第3组电解液时,当a、c两极电解产物的质量相等时,b极和d极产生的气体体积比为________(同温同压下,忽略气体的溶解)。
(7)选择第4组电解液时,此时该组A池的总反应的化学方程式为___________________。
哈尔滨市第九中学校2022-2023学年高一下学期6月月考
化学试卷答案
第I卷 选择题
一、单项选择题(本题包括25小题,每题2分,共50分)
1-5:BDACD 6-10:CBABC 11-15:ABACD 16-20:DBBCD 21-25:CCDAB
第Ⅱ卷 (非选择题)
二、填空题(本题4道小题,共50分)
26. (10分)
(1) HNC(2分)
(2) b-a (2分)
(3) C2H8N2(I)+2N2O4(g)=3N2(g)+2CO2(g)+4H2O(g) △H=(y-2x) kJ/mol (2分)
(4)玻璃搅拌器(2分)
(5)BD (2分)
27. (13分)
(1)C2H4 (1分)
羟基的电子式(2 分)
(2) CH2O (2分)
酯基(2分)
(3) 2C2H5OH+O2 2CH3CHO+2H2O (2分);加成(2分)
(4) (2分)
28. (13分)
(1)分液漏斗(或滴液漏斗) (1分);防倒吸(2 分)
(2) CH3COOH+C2H5OHCH3COOC2H5+H2O (2分);取代(或酯化) (1分)
(3)ABC (3分)
(4)否(1分)
(5)冷凝(1分)
(6)防止反应物还未来得及反应即被加热蒸馏出来,造成反应物的损失,防副反应的发生。(2分)
29. (14 分)
(1) Fe3-+e-= Fe2+ (2分)
(1)Cu(1分)Fe(1分)
(3) Al-3e-+4OH-=+2H2O (2分)
(4) 64 (2分)
(5)1(2分)
(6)1:2(2分)
(7)2AlCl3+6H2O3Cl2↑+3H2↑+2Al(OH)3↓(2 分)
同课章节目录
