3.4.1羧酸 课件(共35张ppt)化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.4.1羧酸 课件(共35张ppt)化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-16 21:09:59 | ||
图片预览






文档简介
(共35张PPT)
第三章 烃的衍生物
第四节 羧酸 羧酸衍生物
第一课时 羧酸
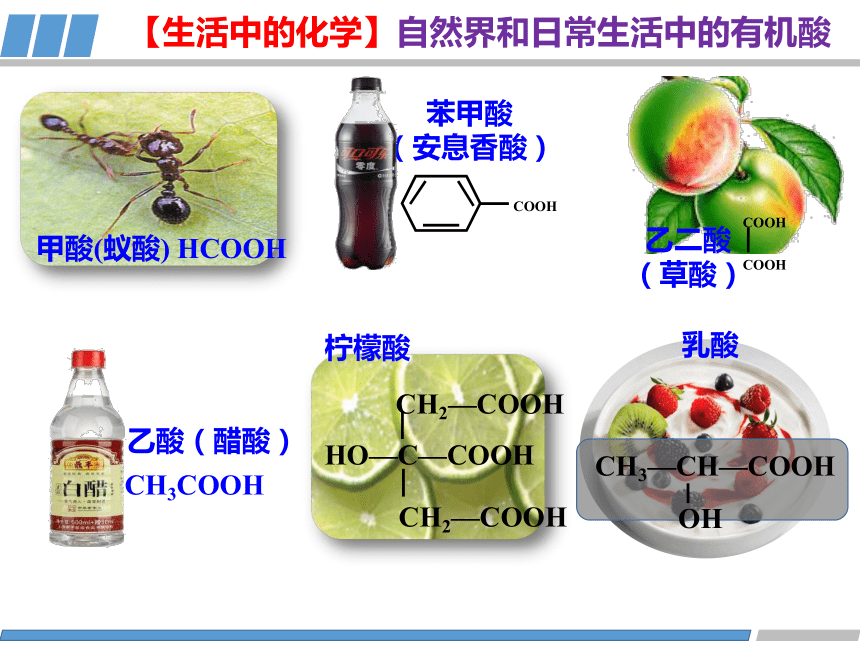
甲酸(蚁酸) HCOOH
柠檬酸
HO—C—COOH
CH2—COOH
CH2—COOH
乙二酸
(草酸)
COOH
COOH
CH3COOH
乙酸(醋酸)
苯甲酸
(安息香酸)
COOH
CH3—CH—COOH
OH
乳酸
【生活中的化学】自然界和日常生活中的有机酸
色态
无色液体
气味
有强烈刺激性气味
沸点
117.9℃ (易挥发)
熔点
16.6℃
溶解性
易溶于水、乙醇
俗名
一、羧酸的代表物质—乙酸
醋酸,它是食醋的主要成分
为什么纯净的乙酸又称:冰醋酸呢?
低于熔点,乙酸凝结成类似于冰一样的晶体
1、乙酸的物理性质
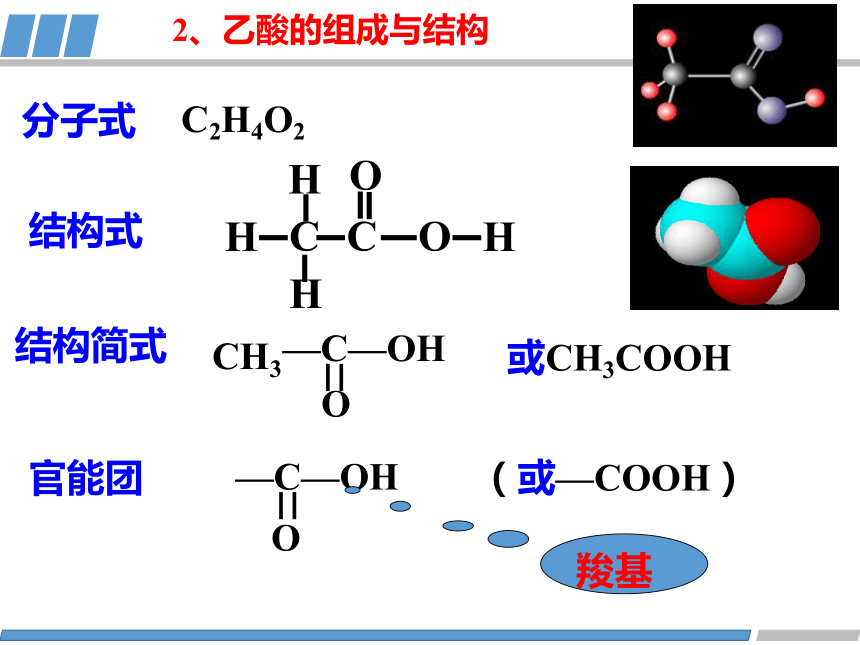
C2H4O2
或CH3COOH
结构简式
分子式
结构式
官能团
O
—C—OH
CH3
O
—C—OH
羧基
2、乙酸的组成与结构
C
H
H
H
H
O
C
O
(或—COOH)
羧基是由羰基和羟基相连构成的,基团间的相互影响使得羧酸的化学性质发生了变化,并不是羟基和羰基具有的化学性质的简单加和。
R
H
O
C
O
使氧氢键的极性增强,更易断裂,电离出H+,表现酸性。
碳氧单键易断裂,发生取代反应。
R
H
O
C
O
使羰基较难发生加成反应,
通过催化加氢的方法很难被还原。
深度思考
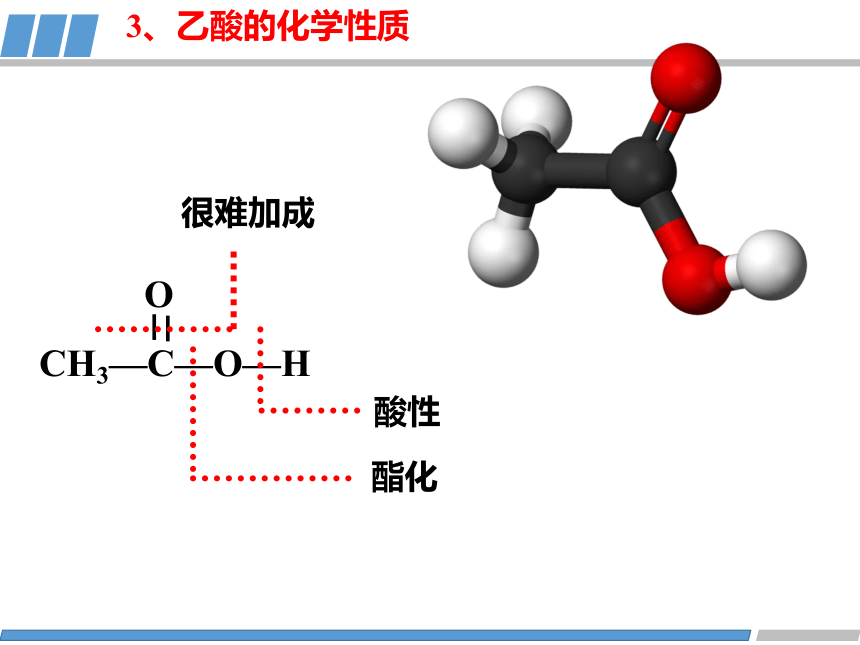
O
CH3—C—O—H
酸性
酯化
3、乙酸的化学性质
很难加成
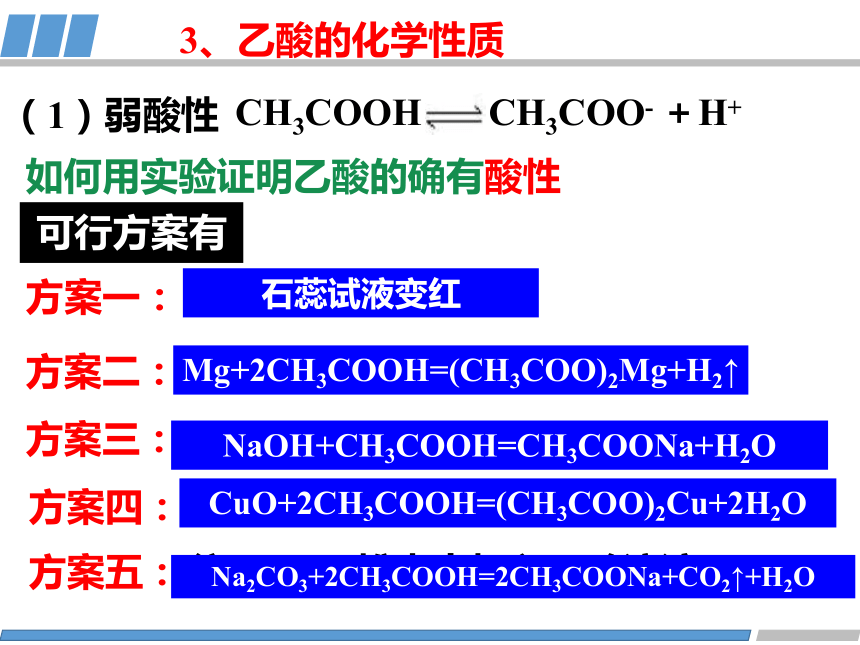
CH3COOH CH3COO- +H+
(1)弱酸性
如何用实验证明乙酸的确有酸性
可行方案有
方案一:
方案二:
方案三:
方案四:
往乙酸溶液中加石蕊
往镁条中加入乙酸溶液
往Na2CO3粉未中加入乙酸溶液
NaOH和酚酞混合溶液中加入乙酸溶液
3、乙酸的化学性质
石蕊试液变红
Mg+2CH3COOH=(CH3COO)2Mg+H2↑
NaOH+CH3COOH=CH3COONa+H2O
Na2CO3+2CH3COOH=2CH3COONa+CO2↑+H2O
方案五:
往CuO粉未中加入乙酸溶液
CuO+2CH3COOH=(CH3COO)2Cu+2H2O
CH3COOH CH3COO- +H+
如何用实验证明乙酸的确有酸性
总结:
方案一:
方案二:
方案三:
方案四:
往乙酸溶液中加石蕊
往镁条中加入乙酸溶液
往Na2CO3粉未中加入乙酸溶液
NaOH和酚酞混合溶液中加入乙酸溶液
与酸碱指示剂反应:
乙二酸(草酸)>甲酸>苯甲酸>乙酸>丙酸
与活泼金属反应
与碱反应
与某些盐反应
方案五:
往CuO粉未中加入乙酸溶液
与碱性氧化物反应
(1)弱酸性
3、乙酸的化学性质
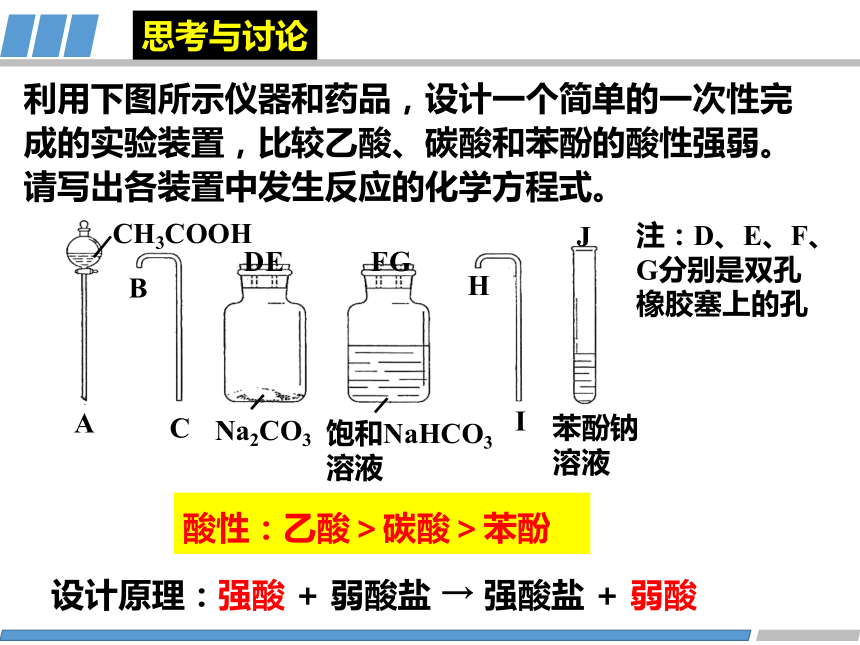
利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,比较乙酸、碳酸和苯酚的酸性强弱。请写出各装置中发生反应的化学方程式。
CH3COOH
A
B
C
Na2CO3
饱和NaHCO3溶液
苯酚钠溶液
D
E
F
G
H
J
注:D、E、F、G分别是双孔橡胶塞上的孔
I
酸性:乙酸>碳酸>苯酚
设计原理:强酸 + 弱酸盐 → 强酸盐 + 弱酸
思考与讨论
2CH3COOH+Na2CO3→
2CH3COONa+CO2↑+H2O
NaHCO3+C6H5OH
CO2+H2O+C6H5ONa→
结论
酸性:CH3COOH>H2CO3>C6H5OH>HCO3-
除去挥发出来的乙酸
CH3COOH+NaHC O3→
CH3COONa+CO2↑+H2O
“酒是陈的香”
为什么呢?
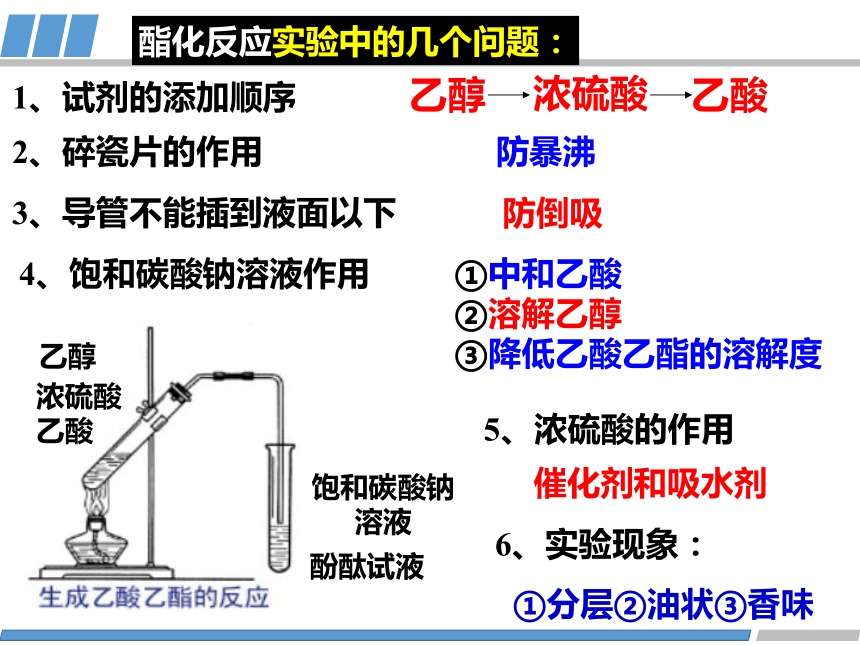
(2)酯化反应
CH3COOH+HOCH2CH3 CH3COOCH2CH3+ H2O
浓H2SO4
△
乙醇
浓硫酸
乙酸
浓硫酸乙酸
乙醇
酚酞试液
饱和碳酸钠溶液
1、试剂的添加顺序
2、碎瓷片的作用
3、导管不能插到液面以下
防暴沸
防倒吸
5、浓硫酸的作用
①中和乙酸
②溶解乙醇
③降低乙酸乙酯的溶解度
4、饱和碳酸钠溶液作用
催化剂和吸水剂
6、实验现象:
①分层②油状③香味
酯化反应实验中的几个问题:
1、酯化反应中断键位置的检验
同位素示踪法
①酯化—使用了浓硫酸吸水;
②使用过量的乙醇;
③先小火加热,再大火加热;从反应物中不断蒸出乙酸乙酯。
CH3COOH+H18OC2H5 CH3CO18OC2H5 + H2O
浓硫酸
酸脱羟基醇脱氢
2、 实验中如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?
根据化学平衡原理,措施有:
CH3COOH+C2H5OH
CH3COOC2H5+H2O
酯化反应的一般规律如下:
2.一元酸与多元醇之间的酯化反应
3.多元酸与一元醇之间的酯化反应
1.一元酸与一元醇之间的酯化反应:
【知识拓展】
4.多元酸与多元醇之间的酯化反应
多元酸与多元醇之间的酯化反应有多种形式,可以得到普通酯、环状酯和高聚酯。
【知识拓展】
5.羟基酸自身的酯化反应
羟基酸自身的酯化反应也有多种形式,可以得到普通酯、环状酯和高聚酯。
【知识拓展】
【知识拓展】
(1)乳酸跟足量金属钠反应的化学方程式:
(2)乳酸跟少量碳酸钠反应的化学方程式:
乳酸最早发现于酸牛奶中,它是人体内糖代谢的中间体,其结构为
CH3-CH-COOH,试写出:
OH
(3)乳酸跟C2H5OH反应的化学方程式:
(4)乳酸跟CH3COOH反应的化学方程式:
(5)乳酸跟浓H2SO4共热可能反应方程式:
课堂检测
结构 简式 羟基 氢的 活泼性 酸性 与钠 反应 与 NaOH 反应 与Na2CO3 反应 与NaHCO3反应
乙醇
苯酚
乙酸
CH3CH2OH
C6H5OH
CH3COOH
增强
中性
弱酸性
能
能
能
能
能
不能
不能
能
能
不生成CO2
醇、酚、羧酸中羟基的比较
知识归纳
弱酸性
不能
不能
能
课堂检测
NaHCO3
Na2CO3或NaOH
Na
1.组成与结构
定义:分子中烃基(或氢原子)和羧基(—COOH)相连的化合物属于羧酸
官能团:羧基
—C—O—H
O
饱和一元羧酸通式:
CnH2n+1COOH[CmH2mO2]
或
—COOH
与比它多一个碳原子的饱和一元醇[Cm+1H2(m+1)+2O]等式量。
柠檬酸
苹果酸
二、羧酸
2、分类
羧酸
烃基不同
脂肪酸
低级脂肪酸
CH3COOH
CH2=CHCOOH
高级脂肪酸
硬脂酸——C17H35COOH
软脂酸——C15H31COOH
油酸——C17H33COOH
芳香酸
COOH
—
羧基数目
一元羧酸
HCOOH、CH2=CHCOOH等
二元羧酸
COOH
COOH
多元羧酸
HO—C—COOH
CH2—COOH
CH2—COOH
(1)选主链:选择含有羧基的最长碳链作为主链,按主链碳原子数称为某酸。
(2)编号位:在选取的主链中,从羧基碳原子开始给主链上的碳原子编号。
(3)定名称:在“某酸”名称之前加上取代基的位次号和名称。
例如:
3、羧酸的系统命名法
4、羧酸的同分异构
练习:写出C5H10O2属于羧酸的同分异构体
(1)种类:
碳架异构、官能团异构
注意:羧基只能位于链端,羧酸无官能团位置异构
(2)官能团异构:
羧酸 (-COOH) 与 酯 (-COO-)
① 羧酸:先写碳架,链端变羧基
② 酯:先写碳架,后插入酯基(正、反)
注意:对称结构无需考虑反向插入
写出同时符合下列条件的 B( )的所有同分异构体有 种:
①能和 NaHCO3 溶液反应生成 CO2;
②能使 FeCl3 溶液发生显色反应;
③能发生银镜反应;
10
【夯实基础】
思考交流
阅读表3-4,总结羧酸的物理性质及其递变规律。
名称 结构简式 熔点/℃ 沸点/℃
甲酸 HCOOH 8 101
乙酸 CH3COOH 17 118
丙酸 CH3CH2COOH -21 141
正丁酸 CH3CH2CH2COOH -5 166
十八酸(硬脂酸) CH3(CH2)16COOH 70 383
苯甲酸 —COOH 122 249
相对分子质量相当的不同有机物的沸点数据
名称 甲酸 乙醛 乙醇 乙酸 丙醛 正丙醇 丙酸 丁醛 正丁醇
结构简式 HCOOH CH3CHO CH3CH2OH CH3COOH CH3CH2CHO CH3CH2CH2OH CH3CH2COOH CH3(CH2)2CHO CH3(CH2)2CH2OH
相对分子质量 46 44 46 60 58 60 74 72 74
沸点/℃ 101 21 78.4 118 49 97.2 141 76 117.8
注:以上数据来自《有机化学基础》(作者:邢其毅)。
与相对分子质量相当的其他有机物的沸点相比:
R
H
O
C
O
这与分子间可以形成氢键有关。
R
H
O
C
O
…
氢键
R
H
O
C
O
R
H
O
C
O
…
氢键
羧酸的沸点较高
由于羧酸分子形成氢键的机会比相对分子质量相近的醇的多,羧酸的沸点比相应的醇的高。
5、羧酸的物理性质
水溶性:①甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。
②随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。
③高级脂肪酸是不溶于水的蜡状固体。
熔沸点:①随着分子中碳原子数的增加,熔沸点逐渐升高。
②羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
甲酸(蚁酸) HCOOH
柠檬酸
HO—C—COOH
CH2—COOH
CH2—COOH
乙二酸
(草酸)
COOH
COOH
CH3COOH
乙酸(醋酸)
苯甲酸
(安息香酸)
COOH
CH3—CH—COOH
OH
乳酸
6、常见的羧酸
结构特点:既有羧基又有醛基
化学性质
醛基
羧基
氧化反应(如银镜反应)
酸性,酯化反应
O
H—C—O—H
蚁酸(甲酸)
HCOOH
具有醛和羧酸的性质
甲酸是一种无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶。
羧基
醛基
具有还原性
用途:工业上作还原剂,也是合成医药、农药和染料等的原料
甲酸
苯甲酸——俗称安息香酸
苯甲酸是一种无色晶体,易升华,微溶于水,易溶于乙醇,酸性比乙酸强,比甲酸弱。苯甲酸可以用于合成香料、药物等,它的钠盐或钾盐是常用的食品防腐剂。
COOH
乙二酸是二元羧酸,无色透明晶体,可溶于水和乙醇。通常以结晶水合物形式
存在((COOH)2 2H2O),加热至100℃时失水成无水草酸。常用于化学分析的还原剂。也是重要的化工原料。草酸钙(CaC2O4)难溶于水,是人体膀胱结石和肾结石的主要成分。
乙二酸——俗称草酸
COOH
COOH
HOOC-COOH
【化学性质】草酸是最简单的饱和二元羧酸,是二元羧酸中酸性最强的,它具有一些特殊的化学性质。能使酸性高锰酸钾溶液褪色、可作漂白剂。
北京奥运会期间对大量盆栽鲜花施用了S 诱抗素制剂,以保证鲜花盛开。S 诱抗素的分子结构如图,下列关于该物质的说法正确的是
A.其分子式为C15H22O4
B.1mol该物质与足量NaOH溶液反应,最多消耗 2mol NaOH
C.既能发生加聚反应,又能发生缩聚反应
D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
C
【夯实基础】
写出同时符合下列条件的 B( )的所有同分异构体有 种:
①能和 NaHCO3 溶液反应生成 CO2;
②能使 FeCl3 溶液发生显色反应;
③能发生银镜反应;
10
【夯实基础】
第三章 烃的衍生物
第四节 羧酸 羧酸衍生物
第一课时 羧酸
甲酸(蚁酸) HCOOH
柠檬酸
HO—C—COOH
CH2—COOH
CH2—COOH
乙二酸
(草酸)
COOH
COOH
CH3COOH
乙酸(醋酸)
苯甲酸
(安息香酸)
COOH
CH3—CH—COOH
OH
乳酸
【生活中的化学】自然界和日常生活中的有机酸
色态
无色液体
气味
有强烈刺激性气味
沸点
117.9℃ (易挥发)
熔点
16.6℃
溶解性
易溶于水、乙醇
俗名
一、羧酸的代表物质—乙酸
醋酸,它是食醋的主要成分
为什么纯净的乙酸又称:冰醋酸呢?
低于熔点,乙酸凝结成类似于冰一样的晶体
1、乙酸的物理性质
C2H4O2
或CH3COOH
结构简式
分子式
结构式
官能团
O
—C—OH
CH3
O
—C—OH
羧基
2、乙酸的组成与结构
C
H
H
H
H
O
C
O
(或—COOH)
羧基是由羰基和羟基相连构成的,基团间的相互影响使得羧酸的化学性质发生了变化,并不是羟基和羰基具有的化学性质的简单加和。
R
H
O
C
O
使氧氢键的极性增强,更易断裂,电离出H+,表现酸性。
碳氧单键易断裂,发生取代反应。
R
H
O
C
O
使羰基较难发生加成反应,
通过催化加氢的方法很难被还原。
深度思考
O
CH3—C—O—H
酸性
酯化
3、乙酸的化学性质
很难加成
CH3COOH CH3COO- +H+
(1)弱酸性
如何用实验证明乙酸的确有酸性
可行方案有
方案一:
方案二:
方案三:
方案四:
往乙酸溶液中加石蕊
往镁条中加入乙酸溶液
往Na2CO3粉未中加入乙酸溶液
NaOH和酚酞混合溶液中加入乙酸溶液
3、乙酸的化学性质
石蕊试液变红
Mg+2CH3COOH=(CH3COO)2Mg+H2↑
NaOH+CH3COOH=CH3COONa+H2O
Na2CO3+2CH3COOH=2CH3COONa+CO2↑+H2O
方案五:
往CuO粉未中加入乙酸溶液
CuO+2CH3COOH=(CH3COO)2Cu+2H2O
CH3COOH CH3COO- +H+
如何用实验证明乙酸的确有酸性
总结:
方案一:
方案二:
方案三:
方案四:
往乙酸溶液中加石蕊
往镁条中加入乙酸溶液
往Na2CO3粉未中加入乙酸溶液
NaOH和酚酞混合溶液中加入乙酸溶液
与酸碱指示剂反应:
乙二酸(草酸)>甲酸>苯甲酸>乙酸>丙酸
与活泼金属反应
与碱反应
与某些盐反应
方案五:
往CuO粉未中加入乙酸溶液
与碱性氧化物反应
(1)弱酸性
3、乙酸的化学性质
利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,比较乙酸、碳酸和苯酚的酸性强弱。请写出各装置中发生反应的化学方程式。
CH3COOH
A
B
C
Na2CO3
饱和NaHCO3溶液
苯酚钠溶液
D
E
F
G
H
J
注:D、E、F、G分别是双孔橡胶塞上的孔
I
酸性:乙酸>碳酸>苯酚
设计原理:强酸 + 弱酸盐 → 强酸盐 + 弱酸
思考与讨论
2CH3COOH+Na2CO3→
2CH3COONa+CO2↑+H2O
NaHCO3+C6H5OH
CO2+H2O+C6H5ONa→
结论
酸性:CH3COOH>H2CO3>C6H5OH>HCO3-
除去挥发出来的乙酸
CH3COOH+NaHC O3→
CH3COONa+CO2↑+H2O
“酒是陈的香”
为什么呢?
(2)酯化反应
CH3COOH+HOCH2CH3 CH3COOCH2CH3+ H2O
浓H2SO4
△
乙醇
浓硫酸
乙酸
浓硫酸乙酸
乙醇
酚酞试液
饱和碳酸钠溶液
1、试剂的添加顺序
2、碎瓷片的作用
3、导管不能插到液面以下
防暴沸
防倒吸
5、浓硫酸的作用
①中和乙酸
②溶解乙醇
③降低乙酸乙酯的溶解度
4、饱和碳酸钠溶液作用
催化剂和吸水剂
6、实验现象:
①分层②油状③香味
酯化反应实验中的几个问题:
1、酯化反应中断键位置的检验
同位素示踪法
①酯化—使用了浓硫酸吸水;
②使用过量的乙醇;
③先小火加热,再大火加热;从反应物中不断蒸出乙酸乙酯。
CH3COOH+H18OC2H5 CH3CO18OC2H5 + H2O
浓硫酸
酸脱羟基醇脱氢
2、 实验中如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?
根据化学平衡原理,措施有:
CH3COOH+C2H5OH
CH3COOC2H5+H2O
酯化反应的一般规律如下:
2.一元酸与多元醇之间的酯化反应
3.多元酸与一元醇之间的酯化反应
1.一元酸与一元醇之间的酯化反应:
【知识拓展】
4.多元酸与多元醇之间的酯化反应
多元酸与多元醇之间的酯化反应有多种形式,可以得到普通酯、环状酯和高聚酯。
【知识拓展】
5.羟基酸自身的酯化反应
羟基酸自身的酯化反应也有多种形式,可以得到普通酯、环状酯和高聚酯。
【知识拓展】
【知识拓展】
(1)乳酸跟足量金属钠反应的化学方程式:
(2)乳酸跟少量碳酸钠反应的化学方程式:
乳酸最早发现于酸牛奶中,它是人体内糖代谢的中间体,其结构为
CH3-CH-COOH,试写出:
OH
(3)乳酸跟C2H5OH反应的化学方程式:
(4)乳酸跟CH3COOH反应的化学方程式:
(5)乳酸跟浓H2SO4共热可能反应方程式:
课堂检测
结构 简式 羟基 氢的 活泼性 酸性 与钠 反应 与 NaOH 反应 与Na2CO3 反应 与NaHCO3反应
乙醇
苯酚
乙酸
CH3CH2OH
C6H5OH
CH3COOH
增强
中性
弱酸性
能
能
能
能
能
不能
不能
能
能
不生成CO2
醇、酚、羧酸中羟基的比较
知识归纳
弱酸性
不能
不能
能
课堂检测
NaHCO3
Na2CO3或NaOH
Na
1.组成与结构
定义:分子中烃基(或氢原子)和羧基(—COOH)相连的化合物属于羧酸
官能团:羧基
—C—O—H
O
饱和一元羧酸通式:
CnH2n+1COOH[CmH2mO2]
或
—COOH
与比它多一个碳原子的饱和一元醇[Cm+1H2(m+1)+2O]等式量。
柠檬酸
苹果酸
二、羧酸
2、分类
羧酸
烃基不同
脂肪酸
低级脂肪酸
CH3COOH
CH2=CHCOOH
高级脂肪酸
硬脂酸——C17H35COOH
软脂酸——C15H31COOH
油酸——C17H33COOH
芳香酸
COOH
—
羧基数目
一元羧酸
HCOOH、CH2=CHCOOH等
二元羧酸
COOH
COOH
多元羧酸
HO—C—COOH
CH2—COOH
CH2—COOH
(1)选主链:选择含有羧基的最长碳链作为主链,按主链碳原子数称为某酸。
(2)编号位:在选取的主链中,从羧基碳原子开始给主链上的碳原子编号。
(3)定名称:在“某酸”名称之前加上取代基的位次号和名称。
例如:
3、羧酸的系统命名法
4、羧酸的同分异构
练习:写出C5H10O2属于羧酸的同分异构体
(1)种类:
碳架异构、官能团异构
注意:羧基只能位于链端,羧酸无官能团位置异构
(2)官能团异构:
羧酸 (-COOH) 与 酯 (-COO-)
① 羧酸:先写碳架,链端变羧基
② 酯:先写碳架,后插入酯基(正、反)
注意:对称结构无需考虑反向插入
写出同时符合下列条件的 B( )的所有同分异构体有 种:
①能和 NaHCO3 溶液反应生成 CO2;
②能使 FeCl3 溶液发生显色反应;
③能发生银镜反应;
10
【夯实基础】
思考交流
阅读表3-4,总结羧酸的物理性质及其递变规律。
名称 结构简式 熔点/℃ 沸点/℃
甲酸 HCOOH 8 101
乙酸 CH3COOH 17 118
丙酸 CH3CH2COOH -21 141
正丁酸 CH3CH2CH2COOH -5 166
十八酸(硬脂酸) CH3(CH2)16COOH 70 383
苯甲酸 —COOH 122 249
相对分子质量相当的不同有机物的沸点数据
名称 甲酸 乙醛 乙醇 乙酸 丙醛 正丙醇 丙酸 丁醛 正丁醇
结构简式 HCOOH CH3CHO CH3CH2OH CH3COOH CH3CH2CHO CH3CH2CH2OH CH3CH2COOH CH3(CH2)2CHO CH3(CH2)2CH2OH
相对分子质量 46 44 46 60 58 60 74 72 74
沸点/℃ 101 21 78.4 118 49 97.2 141 76 117.8
注:以上数据来自《有机化学基础》(作者:邢其毅)。
与相对分子质量相当的其他有机物的沸点相比:
R
H
O
C
O
这与分子间可以形成氢键有关。
R
H
O
C
O
…
氢键
R
H
O
C
O
R
H
O
C
O
…
氢键
羧酸的沸点较高
由于羧酸分子形成氢键的机会比相对分子质量相近的醇的多,羧酸的沸点比相应的醇的高。
5、羧酸的物理性质
水溶性:①甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。
②随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。
③高级脂肪酸是不溶于水的蜡状固体。
熔沸点:①随着分子中碳原子数的增加,熔沸点逐渐升高。
②羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
甲酸(蚁酸) HCOOH
柠檬酸
HO—C—COOH
CH2—COOH
CH2—COOH
乙二酸
(草酸)
COOH
COOH
CH3COOH
乙酸(醋酸)
苯甲酸
(安息香酸)
COOH
CH3—CH—COOH
OH
乳酸
6、常见的羧酸
结构特点:既有羧基又有醛基
化学性质
醛基
羧基
氧化反应(如银镜反应)
酸性,酯化反应
O
H—C—O—H
蚁酸(甲酸)
HCOOH
具有醛和羧酸的性质
甲酸是一种无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶。
羧基
醛基
具有还原性
用途:工业上作还原剂,也是合成医药、农药和染料等的原料
甲酸
苯甲酸——俗称安息香酸
苯甲酸是一种无色晶体,易升华,微溶于水,易溶于乙醇,酸性比乙酸强,比甲酸弱。苯甲酸可以用于合成香料、药物等,它的钠盐或钾盐是常用的食品防腐剂。
COOH
乙二酸是二元羧酸,无色透明晶体,可溶于水和乙醇。通常以结晶水合物形式
存在((COOH)2 2H2O),加热至100℃时失水成无水草酸。常用于化学分析的还原剂。也是重要的化工原料。草酸钙(CaC2O4)难溶于水,是人体膀胱结石和肾结石的主要成分。
乙二酸——俗称草酸
COOH
COOH
HOOC-COOH
【化学性质】草酸是最简单的饱和二元羧酸,是二元羧酸中酸性最强的,它具有一些特殊的化学性质。能使酸性高锰酸钾溶液褪色、可作漂白剂。
北京奥运会期间对大量盆栽鲜花施用了S 诱抗素制剂,以保证鲜花盛开。S 诱抗素的分子结构如图,下列关于该物质的说法正确的是
A.其分子式为C15H22O4
B.1mol该物质与足量NaOH溶液反应,最多消耗 2mol NaOH
C.既能发生加聚反应,又能发生缩聚反应
D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
C
【夯实基础】
写出同时符合下列条件的 B( )的所有同分异构体有 种:
①能和 NaHCO3 溶液反应生成 CO2;
②能使 FeCl3 溶液发生显色反应;
③能发生银镜反应;
10
【夯实基础】
