1.3.3元素周期表的应用 课件 (共23张PPT)2022-2023学年鲁科版(2019年)高中化学必修二
文档属性
| 名称 | 1.3.3元素周期表的应用 课件 (共23张PPT)2022-2023学年鲁科版(2019年)高中化学必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 45.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-17 21:57:58 | ||
图片预览



文档简介
(共23张PPT)
预测元素及其化合物的性质
能借助元素周期表,梳理元素及其化合物的性质
通过预测元素的性质,将元素化合物从“价-类”二维认知模型发展到元素周期表三维认知模型
目标1
目标2
学习目标
发展宏观辨识与微观探析
发展证据推理与模型认知
发展科学态度与社会责任
目标3
通过学习领会元素周期表在生产实践中的指导意义
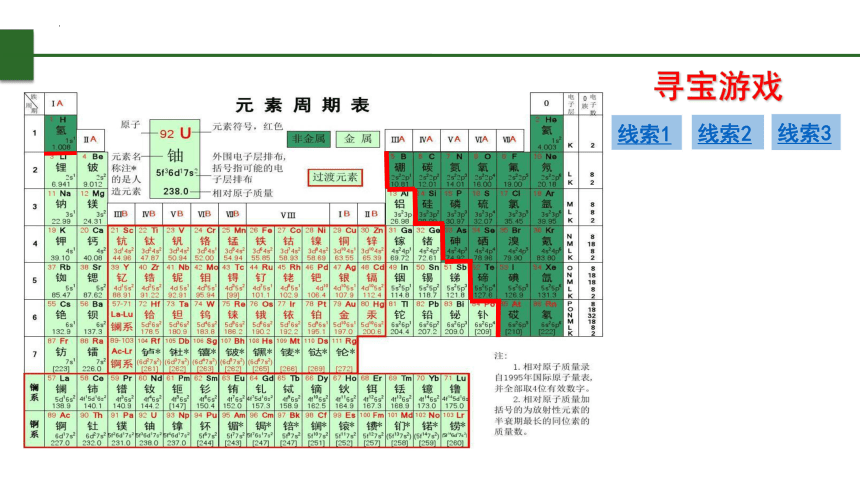
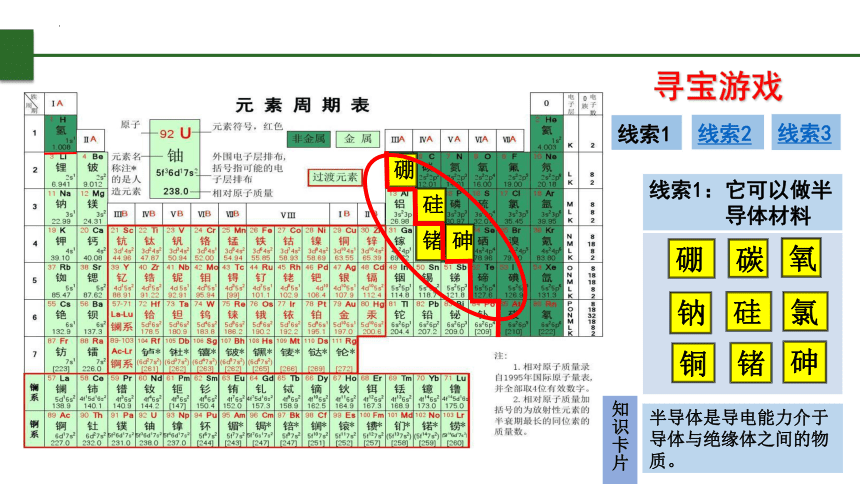
寻宝游戏
线索1
线索2
线索3
硅
砷
硼
锗
线索1:它可以做半
导体材料
硅
砷
硼
碳
锗
钠
氯
氧
铜
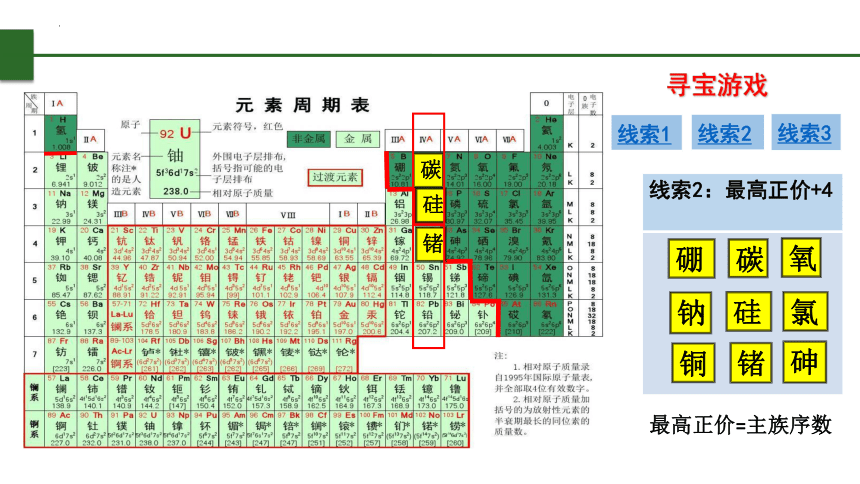
寻宝游戏
线索1
线索2
线索3
半导体是导电能力介于导体与绝缘体之间的物质。
知识卡片
寻宝游戏
线索1
线索2
线索3
线索2:最高正价+4
硅
砷
硼
碳
锗
钠
氯
氧
铜
硅
碳
锗
最高正价=主族序数
硅
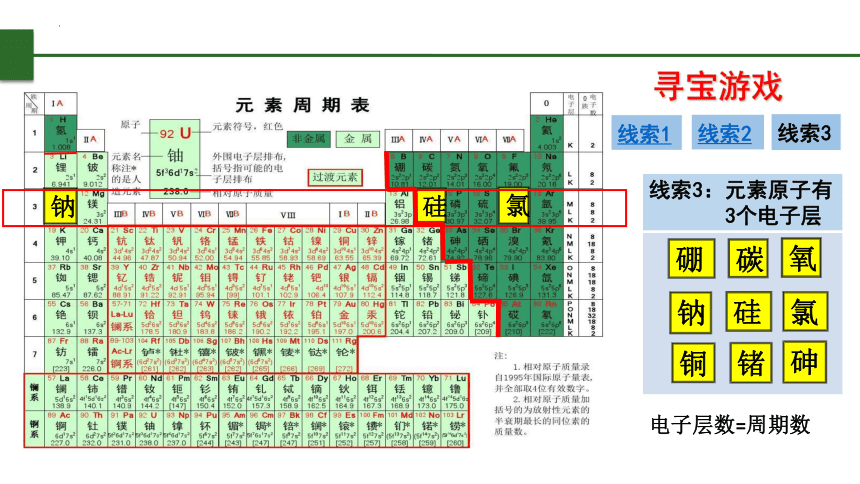
线索3:元素原子有
3个电子层
硅
砷
硼
碳
锗
钠
氯
氧
铜
寻宝游戏
线索1
线索2
线索3
钠
氯
电子层数=周期数
硅
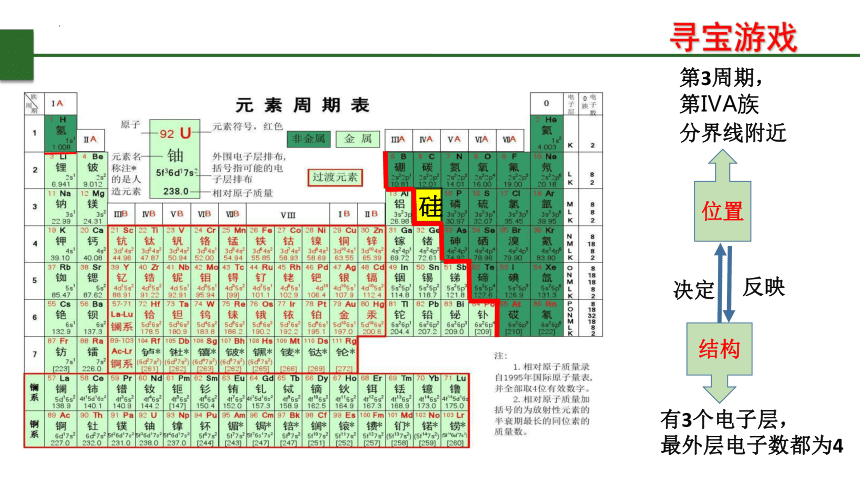
寻宝游戏
有3个电子层,
最外层电子数都为4
结构
位置
分界线附近
决定
反映
第3周期,
第ⅣA族
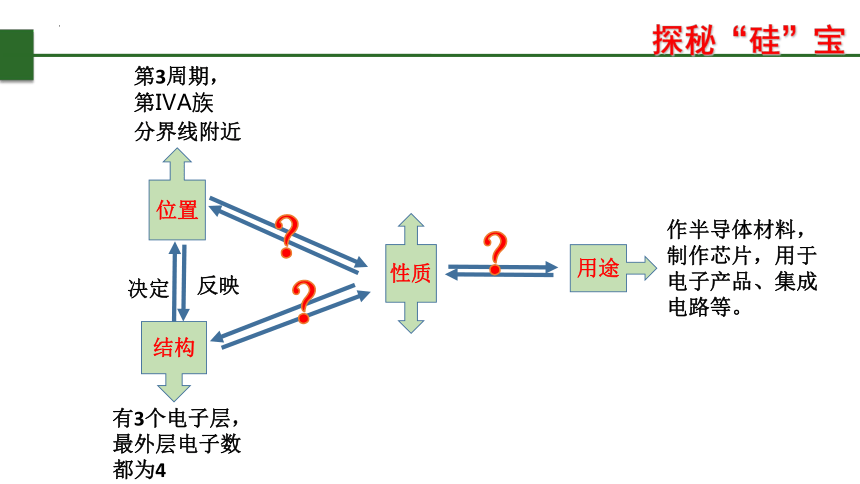
探秘“硅”宝
作半导体材料,制作芯片,用于电子产品、集成电路等。
性质
有3个电子层,最外层电子数都为4
结构
位置
分界线附近
决定
反映
用途
第3周期,
第ⅣA族
探秘“硅”宝
?
?
?
活动1:结合元素周期表和原子结构信息,预测硅元素有哪些性质。
任务一 预测硅元素的性质
活动2:比较Si 与C 、P元素性质强弱,说明比较依据。
活动要求:个人完成学案,小组互查互议
活动3:总结硅元素适合做半导体材料原因。
任务一 预测硅元素的性质
元素性质 碳 硅 磷
主要化合价
原子半径 C Si Si P
得电子能力 C Si Si P
非金属性 C Si Si P
比较依据
元素周周表应用
利用“位-构-性”关系预测硅元素的性质
利用元素周期表“同主族相似性、递变性、同周期递变性”比较元素的性质
同 主族 元素具有 相似 性质、同时具 递变 性
同 周期 元素具有 递变 性
准金属
非金属
金属
半导体材料
金属与非金属分界线处
最外层电子数为4
构结
任务三 应用元素周期表解决问题
置位
不易得电子,也不易失电子;即表现出一定的金属性,也表现出一定的非金属性,但非金属性较弱;有导电能力,但比金属导电能力弱。
质性
活动3:总结硅元素适合做半导体材料原因。
材料特异性质 元素定位区域
半导体材料 金属与非金属分界线
催化剂和耐高温、耐腐蚀的合金材料 过渡金属
农药含As、F、Cl、S、P等元素 非金属元素
任务一 硅元素的性质
位置相近
结构相似
性质相似
元素周周表应用---利用位置相近性质相似规律研究物质结构、发现新元
素、合成新物质、寻找新材料。
材料
第一代半导体 锗晶体(Ge)
硅单晶
第二代半导体 砷化镓(GaAs
磷化铟
第三代半导体 氮化镓(GaN)
碳化硅(SiC)
半导体产业发展
元素性质相似
单质和某些同类化合物表现出相似性
元素性质差异
单质和某些同类化合物表现出差异性
准金属
非金属
金属
硅
锗
砷
磷
碳
镓
铟
任务二 预测硅及其化合物的性质
活动1:写出较常见含硅元素的物质
活动要求:小组讨论合作完成(10分钟)
活动2:预测硅单质及硅酸的化学性质,说明预测依据
活动3:比较性质强弱(与C、P元素对应的同类物质),说明比较依据
任务二 预测硅及其化合物的性质
硅晶体灰黑色 、硬而脆有金属光泽的固体。熔沸点高,硬度大。
硅酸为玻璃状无色透明的无定形颗粒,难溶于水,在水中为胶状物。
沙子、石英、水晶的主要成分是二氧化硅。 熔沸点高,硬度大。
水晶
任务二 预测硅及其化合物的性质
物质 化学性质 与C、P元素对应的物质比较性质强弱
Si 单质氧化性 碳 硅 硅 磷
单质还原性 碳 硅 硅 磷
H2SiO3 最高价含氧酸酸性 H2CO3 H2SiO3 H2CO3 H3PO4
元素周周表应用---利用“同主族相似性、递变性,同周期递变性”预测物质性质及
比较性质强弱
同 主族 元素原子结构 相似 性质与 递变 性
同周期 元素结构 递变 性
请同学们总结可以从哪些视角预测物质性
?
比较
依据
决定
单质和某些同类化合物表现出相似性、与递变性。
单质和某些同类化合物表现出递变性
决定
氧化性
0
+4
-4
还原性
物质
类别
元素
价态
元素周期表
物质
通性 /特性
相似性/递变性
思维模型--认识物质性质角度由二维视角发展到三维视角
任务二 预测硅及其化合物的性质
实验目的 验证酸性H2CO3强于H2SiO3
实验步骤 打开Na2SiO3溶液瓶塞,
快速拧开矿泉水瓶盖,迅速将Na2SiO3溶液一次性全部倒入矿泉水瓶(充满CO2)中,迅速拧紧瓶盖。
大力摇动矿泉水瓶 。
实验现象
实验结论
活动5:分组实验,验证H2CO3酸性强于H2SiO3
瓶子变瘪,溶液浑浊
H2CO3酸性强于H2SiO3
活动4:设计实验,证明H2CO3酸性强于H2SiO3
Na2SiO3+CO2+H2O = Na2CO3+ H2SiO3 ↓
成功关键
“快”
本节课的收获
原子
结构
元素
性质
决定
反映
元素
位置
决定
反映
反映
反映
原子序数
族
周期
化合价
原子半径
得失电子能力
最外层电子数
电子层数
核电荷数
物质组成
结构分类
物质
性质
决定
反映
物质
用途
决定
反映
决定
反映
化学性质
元素周期表应用
预测元素性质
预测物质性质
位-构-性
周期表
物质类
化合价
作业1:梳理本节课硅单质及硅酸的性质
作业2:请同学们从物质类别、化合价、元素周期表三维角度预测SiO2 的性质
作业3:你有用哪些方法可以比较C和P的非金属?
制造中国芯 助力中国梦
谢谢指导
预测元素及其化合物的性质
能借助元素周期表,梳理元素及其化合物的性质
通过预测元素的性质,将元素化合物从“价-类”二维认知模型发展到元素周期表三维认知模型
目标1
目标2
学习目标
发展宏观辨识与微观探析
发展证据推理与模型认知
发展科学态度与社会责任
目标3
通过学习领会元素周期表在生产实践中的指导意义
寻宝游戏
线索1
线索2
线索3
硅
砷
硼
锗
线索1:它可以做半
导体材料
硅
砷
硼
碳
锗
钠
氯
氧
铜
寻宝游戏
线索1
线索2
线索3
半导体是导电能力介于导体与绝缘体之间的物质。
知识卡片
寻宝游戏
线索1
线索2
线索3
线索2:最高正价+4
硅
砷
硼
碳
锗
钠
氯
氧
铜
硅
碳
锗
最高正价=主族序数
硅
线索3:元素原子有
3个电子层
硅
砷
硼
碳
锗
钠
氯
氧
铜
寻宝游戏
线索1
线索2
线索3
钠
氯
电子层数=周期数
硅
寻宝游戏
有3个电子层,
最外层电子数都为4
结构
位置
分界线附近
决定
反映
第3周期,
第ⅣA族
探秘“硅”宝
作半导体材料,制作芯片,用于电子产品、集成电路等。
性质
有3个电子层,最外层电子数都为4
结构
位置
分界线附近
决定
反映
用途
第3周期,
第ⅣA族
探秘“硅”宝
?
?
?
活动1:结合元素周期表和原子结构信息,预测硅元素有哪些性质。
任务一 预测硅元素的性质
活动2:比较Si 与C 、P元素性质强弱,说明比较依据。
活动要求:个人完成学案,小组互查互议
活动3:总结硅元素适合做半导体材料原因。
任务一 预测硅元素的性质
元素性质 碳 硅 磷
主要化合价
原子半径 C Si Si P
得电子能力 C Si Si P
非金属性 C Si Si P
比较依据
元素周周表应用
利用“位-构-性”关系预测硅元素的性质
利用元素周期表“同主族相似性、递变性、同周期递变性”比较元素的性质
同 主族 元素具有 相似 性质、同时具 递变 性
同 周期 元素具有 递变 性
准金属
非金属
金属
半导体材料
金属与非金属分界线处
最外层电子数为4
构结
任务三 应用元素周期表解决问题
置位
不易得电子,也不易失电子;即表现出一定的金属性,也表现出一定的非金属性,但非金属性较弱;有导电能力,但比金属导电能力弱。
质性
活动3:总结硅元素适合做半导体材料原因。
材料特异性质 元素定位区域
半导体材料 金属与非金属分界线
催化剂和耐高温、耐腐蚀的合金材料 过渡金属
农药含As、F、Cl、S、P等元素 非金属元素
任务一 硅元素的性质
位置相近
结构相似
性质相似
元素周周表应用---利用位置相近性质相似规律研究物质结构、发现新元
素、合成新物质、寻找新材料。
材料
第一代半导体 锗晶体(Ge)
硅单晶
第二代半导体 砷化镓(GaAs
磷化铟
第三代半导体 氮化镓(GaN)
碳化硅(SiC)
半导体产业发展
元素性质相似
单质和某些同类化合物表现出相似性
元素性质差异
单质和某些同类化合物表现出差异性
准金属
非金属
金属
硅
锗
砷
磷
碳
镓
铟
任务二 预测硅及其化合物的性质
活动1:写出较常见含硅元素的物质
活动要求:小组讨论合作完成(10分钟)
活动2:预测硅单质及硅酸的化学性质,说明预测依据
活动3:比较性质强弱(与C、P元素对应的同类物质),说明比较依据
任务二 预测硅及其化合物的性质
硅晶体灰黑色 、硬而脆有金属光泽的固体。熔沸点高,硬度大。
硅酸为玻璃状无色透明的无定形颗粒,难溶于水,在水中为胶状物。
沙子、石英、水晶的主要成分是二氧化硅。 熔沸点高,硬度大。
水晶
任务二 预测硅及其化合物的性质
物质 化学性质 与C、P元素对应的物质比较性质强弱
Si 单质氧化性 碳 硅 硅 磷
单质还原性 碳 硅 硅 磷
H2SiO3 最高价含氧酸酸性 H2CO3 H2SiO3 H2CO3 H3PO4
元素周周表应用---利用“同主族相似性、递变性,同周期递变性”预测物质性质及
比较性质强弱
同 主族 元素原子结构 相似 性质与 递变 性
同周期 元素结构 递变 性
请同学们总结可以从哪些视角预测物质性
?
比较
依据
决定
单质和某些同类化合物表现出相似性、与递变性。
单质和某些同类化合物表现出递变性
决定
氧化性
0
+4
-4
还原性
物质
类别
元素
价态
元素周期表
物质
通性 /特性
相似性/递变性
思维模型--认识物质性质角度由二维视角发展到三维视角
任务二 预测硅及其化合物的性质
实验目的 验证酸性H2CO3强于H2SiO3
实验步骤 打开Na2SiO3溶液瓶塞,
快速拧开矿泉水瓶盖,迅速将Na2SiO3溶液一次性全部倒入矿泉水瓶(充满CO2)中,迅速拧紧瓶盖。
大力摇动矿泉水瓶 。
实验现象
实验结论
活动5:分组实验,验证H2CO3酸性强于H2SiO3
瓶子变瘪,溶液浑浊
H2CO3酸性强于H2SiO3
活动4:设计实验,证明H2CO3酸性强于H2SiO3
Na2SiO3+CO2+H2O = Na2CO3+ H2SiO3 ↓
成功关键
“快”
本节课的收获
原子
结构
元素
性质
决定
反映
元素
位置
决定
反映
反映
反映
原子序数
族
周期
化合价
原子半径
得失电子能力
最外层电子数
电子层数
核电荷数
物质组成
结构分类
物质
性质
决定
反映
物质
用途
决定
反映
决定
反映
化学性质
元素周期表应用
预测元素性质
预测物质性质
位-构-性
周期表
物质类
化合价
作业1:梳理本节课硅单质及硅酸的性质
作业2:请同学们从物质类别、化合价、元素周期表三维角度预测SiO2 的性质
作业3:你有用哪些方法可以比较C和P的非金属?
制造中国芯 助力中国梦
谢谢指导
