1.1.2分散系和胶体 课件(共38张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.2分散系和胶体 课件(共38张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-17 00:00:00 | ||
图片预览











文档简介
(共38张PPT)
第一节 物质的分类及转化
第2课时:分散系和胶体
第一章 物质及其变化
分散系及其分类
01
胶体的制备及性质
02
学习目标
1.通过阅读教材、讨论交流,熟知溶液、浊液、胶体三种分散系的本质区别,了解胶体的性质及其应用,会鉴别胶体和溶液,培养“宏观辨识与微观探析”的化学素养。
2.通过动手实验、现象观察、原理分析,掌握Fe(OH)3胶体的制备方法,理解胶体的丁达尔效应及其应用,初步了解实验研究的方法和步骤,培养“科学态度与科学探究”的化学素养。
请同学们欣赏自然界的“光束”,思考它们形成的原因是什么呢
美丽的大自然成就了我们多彩的生活!
分散系及其分类
分散系及其分类
活动一、认识分散系及分类
任务一、阅读教材P8第一自然段,回答分散系的定义是什么?并举例
说明生活中有哪些常见的分散系?
牛奶
硫酸铜溶液
油水混合物
泥水
上述这些物质有何相同点和不同点
分散系及其分类
硫酸铜溶液
油水混合物
泥水
一种或几种物质分散到另一种物质里,形成___________的混合物—溶液。
均一、稳定
____________悬浮于液体里形成的混合物—
悬浊液。
固体小颗粒
________分散到液体里形成的混合物—乳浊液。
小液滴
【相同点】一种或几种物质分散到另一种物质里,形成的混合物。
分散系及其分类
分散系定义
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。分散系中被分散的物质称作分散质,起容纳分散质作用的物质称为分散剂。
常见分散系
溶液(硫酸铜溶液等)、浊液(悬浊液—泥水、乳浊液—油水混合物)、胶体(牛奶)。
分散系
分散系及其分类
任务二、讨论交流:结合物质的分类方法,思考如何对分散系进行交
叉分类和树状分类?举例说明。
①按照分散质与分散剂的不同状态分
气
液
固
气
液
固
分散剂为气体有:空气、云、灰尘、烟等。
分散剂为液体有:牛奶、酒精的水溶液、泥水、豆浆等。
分散剂为固体有:有色玻璃、珍珠、合金、泡沫塑料等。
分散质 分散剂 实例
雾
烟
牛奶
分散系及其分类
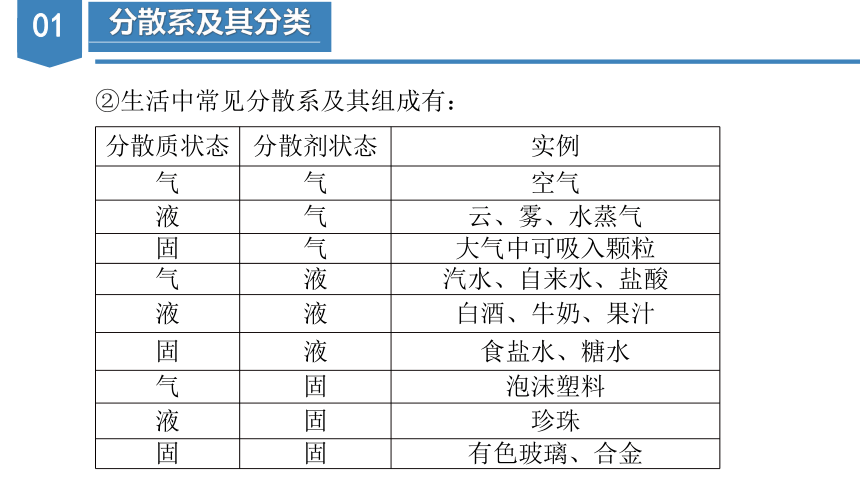
②生活中常见分散系及其组成有:
分散质状态 分散剂状态 实例
气 气 空气
液 气 云、雾、水蒸气
固 气 大气中可吸入颗粒
气 液 汽水、自来水、盐酸
液 液 白酒、牛奶、果汁
固 液 食盐水、糖水
气 固 泡沫塑料
液 固 珍珠
固 固 有色玻璃、合金
分散系及其分类
③按分散质粒子的大小不同分
溶液<1nm 胶体 1nm~100nm 浊液>100nm
对应训练
【典例1】根据气象台报道,近年来每到春季,沿海一些城市经常出
现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的
( ) A.溶液 B.悬浊液 C.乳浊液 D.胶体
【解析】雾是由悬浮在大气中的小液滴构成的,小液滴的直径在1~100 nm之间,所以雾属于胶体。
D
分散系及其分类
【典例2】我国在国际上首次实现从一氧化碳到蛋白质的合成。已经形
成万吨级的工业生产能力,获得首个饲料和饲料添加剂新产品证书。
蛋白质是高分子有机化合物,其分子直径在2nm 20nm。
下列分散质粒子直径在1nm-100nm之间的是( )
A.稀硫酸 B.硫酸铜溶液 C.有色玻璃 D.酒精溶液
【解析】稀硫酸、硫酸铜溶液、酒精溶液均属于溶液,分散质粒子直径小于1nm, 有色玻璃为胶体,分散质粒子直径在1nm 100nm之间,故选C项;故选C。
C
分散系及其分类
活动二、探究分散系的本质及性质
任务一、阅读教材P8第二自然段,比较溶液、浊液和胶体三种分散系
性质,完成下表内容,由此说明三种分散系的本质区别是什么?
分散系 溶液 胶体 浊液
外观
分散质微粒组成
微粒直径
均一、稳定、透明
均一、稳定、透明
不均一、不稳定、不透明
分子、离子
大分子、离子的集合体
固体颗粒、液体小液滴
<1nm
1~100nm
>100nm
【过渡】分散系中,有一位新成员—胶体,在生活中随处可见,那么,胶体有哪些本质特征呢?
分散系及其分类
②本质区别:分散质粒子直径大小不同。如图:
③分散系都是混合物而不是纯净物。
溶液
(<1nm)
胶体
(1-100nm)
浊液
(>100nm)
1nm=10-9m
分散系及其分类
任务二、阅读教材P8第三自然段,思考胶体的定义、本质特征及分类,并举例说明。
胶体
定义
分类
鉴别
常见
胶体是分散质粒子直径在1~100 nm之间的分散系。本质特征是分散质粒子直径在1~100 nm之间。
按分散剂所处的状态分:气溶胶(烟、云、雾等)、液溶胶(Fe(OH)3胶体等)和固溶胶(有色玻璃等)。
利用丁达尔效应区分溶液和胶体
牛奶、豆浆、空气、血液、墨水、土壤、蛋白质溶液、淀粉溶液等。
分散系及其分类
任务三、问题探究:Fe(OH)3胶体的胶粒数与Fe(OH)3分子数相等吗?
①胶粒的组成:胶体微粒一般是离子、分子或难溶物的聚集体,但有些高分子化合物,如淀粉、蛋白质,因其分子非常大,其相对分子质量通常为几万、几十万甚至上百万、千万,因此一个分子就是一个胶体微粒,它们的溶液是胶体。
②在Fe(OH)3胶体中,Fe(OH)3胶体粒子的数目要远远小于原FeCl3溶液中Fe3+的数目。
对应训练
【典例1】在物质分类中,前者包括后者的是( )
A.氧化物、化合物 B.溶液、胶体
C.分散系、溶液 D.酸性氧化物、化合物
【解析】A中化合物不一定是氧化物,故A错,B中胶体和溶液是两个对立的概念,互相之间谁都不包含誰,故B错,D中化合物不一定是氧化物,更加不会是酸性氧化物,故D错。
C
对应训练
【典例2】FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,
下列叙述中错误的是( ) A.Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在
10-9~10-7 m B.分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 C.三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性 D.三种分散系均属于混合物
【解析】A项胶体区别于溶液或浊液的本质特征是胶体粒子直径在10-9~10-7m,正确;B项胶体能发生丁达尔效应,溶液和浊液不会产生丁达尔效应,正确;C项只有胶体具有吸附性,FeCl3溶液和Fe(OH)3浊液没有吸附性,FeCl3溶液为棕黄色,而Fe(OH)3胶体和Fe(OH)3浊液都为红褐色,错误;D项溶液、胶体、浊液均属于混合物,正确。
C
胶体的制备及性质
胶体的制备及性质
活动一、胶体的制备
任务一、制备Fe(OH)3胶体:结合教材P9页【实验1-1】完成实验。
步骤 实验内容 现象 原理及装置
步骤1 取100mL小烧杯,加入40ml的蒸馏水加热至沸腾。
步骤2 向沸水中滴加5-6滴饱和FeCl3溶液 步骤3 继续煮沸至液体呈红褐色,停止加热。 沸腾,产生气泡。
溶液由无色
变成浅黄色。
浅黄色溶液变成红褐色液体。
FeCl3+3H2O
Fe(OH)3(胶体)+3HCl
红褐色液体,透明
胶体的制备及性质
任务二:讨论结论:结合上述实验讨论交流Fe(OH)3胶体的制备要注意
哪些问题?
★Fe(OH)3胶体的制备注意事项!
①必须选用氯化铁饱和溶液而不能用氯化铁稀溶液。因溶液浓度过低,不利于氢氧化铁胶体的形成。
②向沸水中滴加FeCl3饱和溶液,而不是直接加热FeCl3饱和溶液,否则会因溶液浓度过大直接生成Fe(OH)3沉淀。
③实验中必须用蒸馏水,而不能用自来水。原因是自来水中含较多的杂质,易使制备的胶体发生聚沉。
④往沸水中滴加氯化铁饱和溶液后,可稍微加热煮沸,但不宜长时间加热。原因是长时间加热将导致氢氧化铁胶体聚沉。
⑤要边加热边摇动烧杯,但不能用玻璃棒搅拌,否则会使Fe(OH)3胶粒碰撞成大颗粒形成沉淀。
对应训练
【典例1】下列关于氢氧化铁胶体制备的说法正确的是( ) A.将氯化铁稀溶液慢慢滴入沸腾的自来水中,继续加热煮沸 B.将氯化铁饱和溶液慢慢滴入沸腾的蒸馏水中,并用玻璃棒搅拌 C.将氢氧化钠溶液慢慢滴入饱和的氯化铁溶液中 D.在沸腾的蒸馏水中慢慢滴入氯化铁饱和溶液,继续煮沸至溶液呈
红褐色
D
【解析】制备氢氧化铁胶体时,若选用自来水、氢氧化钠溶液,或用玻璃棒搅拌、长时间加热等,都会容易产生氢氧化铁沉淀,而不能得到氢氧化铁胶体。
对应训练
【典例2】用下列方法制备胶体:①0.5 mol/L的BaCl2溶液和等体积2
mol/L的硫酸混合振荡;②把1 mol/L饱和的FeCl3溶液逐滴加入20 mL沸
水中,边加边振荡;③1 mol/L NaOH溶液滴到1 mol/L FeCl3溶液中,可
行的是( )
A.①② B.①③ C.② D.①②③
【解析】胶体制备时对溶液浓度、反应时的操作、滴加试剂的顺序都有严格的要求。①中H2SO4溶液浓度太大,只会生成BaSO4沉淀,得不到BaSO4胶体。②中是制备Fe(OH)3胶体的正确方法,可行。③中NaOH与FeCl3浓度都太大,生成Fe(OH)3的量太多,得到Fe(OH)3沉淀。故选C。
C
胶体的制备及性质
活动二、探究胶体的性质及应用
任务一、实验探究:将上述Fe(OH)3胶体、CuSO4溶液、泥水做如下实
验,观察现象,并填写表中内容。
实验 实验内容 现象 结论
实验1 将三种液体静置片刻,观察现象。并用胶头滴管取2 3mLFe(OH)3胶体于试管中继续加热煮沸一段时间,观察现象。
Fe(OH)3胶体和CuSO4溶液都处于均一、稳定状态,而泥水分层,有泥沙沉淀生成。Fe(OH)3胶体加热煮沸有红褐色沉淀生成。
溶液稳定,胶体较稳定,浊液不稳定。
胶体的制备及性质
实验 实验内容 现象 结论
实验2 用胶头滴管取2 3mL Fe(OH)3胶体于试管中,逐滴加入盐酸溶液,观察现象。
实验3 用胶头滴管取4 5mL Fe(OH)3胶体,并按过滤操作对Fe(OH)3胶体进行过滤,观察现象。
Fe(OH)3透过了滤纸,滤液仍然呈红褐色。
先生成红褐色沉淀,后沉淀逐渐溶解。
胶体加入酸可发生聚沉,生成沉淀。
胶体可
以透过
滤纸
胶体的制备及性质
实验 实验内容 现象 结论
实验4 把盛有Fe(OH)3胶体、CuSO4溶液、泥水的三个烧杯置于暗处,分别勇激光笔照射液体,在与光线垂直方向观察现象。
实验5 ★在Fe(OH)3胶体插入两个碳棒做电极,接通直流电源,观察现象。
有一条光亮的“通路”
无通路
CuSO4溶液
Fe(OH)3胶体
泥水(浊液)也无通路
胶体能发生丁达尔效应,而溶液和浊液不能。
阳极颜色变浅,阴极颜色变深。
Fe(OH)3胶体的胶粒带正电荷
胶体的制备及性质
任务二、问题探究:通过上面实验探究说明胶体具有什么特殊性质?
结合教材P10“资料卡片”,回答何为丁达尔效应?
1.丁达尔效应:当光束通过胶体时,可以看到一条光亮的“通路”,这是由于胶体粒子对光线散射形成的,是物理现象,鉴别溶液和胶体。
散射微弱
发生散射
发生反射
胶体的制备及性质
2.胶体粒子的直径大小介于溶液和浊液之间。因此胶体能够透过滤纸,◆不能透过半透膜—渗析法。
分离、提纯胶体
胶体的制备及性质
任务三、归纳总结:胶体主要性质。
胶体的主要性质
①介稳性:稳定性介于溶液和浊液之间,属于介稳体系。
②丁达尔效应:当光束通过胶体时,可以看到一条光亮的“通路”,
③能够透过滤纸,
◆不能透过半透膜。
④电泳:胶体呈电中性,但具有电泳现象。
◆⑤聚沉:加入某些酸、碱、盐或加热或加胶粒带相反电荷的胶体可以发生电性中和而聚沉。
胶体的制备及性质
任务四、应用探究:生活中有哪些现象体现了胶体的什么性质?
胶体的应用
①农业生产:土壤的保肥作用;土壤里许多物质如土,腐殖质等常以胶体形式存在。
②日常生活:制豆腐(胶体的聚沉);明矾(KAl(SO4)2·12H2O)净水(在水中自然形成胶体,吸附力很强。
③医疗卫生:血液透析;血清在纸上电泳;利用电泳分离各种氨基酸和蛋白质。
④自然地理:江河入海口处形成三角洲的原理是海水中的电解质使江河泥沙所形成的胶体发生聚沉。
⑤工业生产:制有色玻璃(固溶胶);冶金工业利用电泳原理选矿;原油脱水等。
对应训练
【典例1】下列性质既可能是胶体所具有的,也可能是溶液所具有的是
( )
A.光线照射时,从侧面可观察到一条光亮的通路
B.加入少量稀硫酸立即产生沉淀
C.分散质粒子直径小于1 nm
D.装入半透膜袋中并将其浸入盛水的烧杯中一段时间,袋内外均含分散
质粒子
B
【解析】 溶液不具有丁达尔效应,不是溶液的性质,A错误;稀硫酸可以使胶体发生聚沉,也可以和钡盐溶液反应生成BaSO4沉淀,B正确;胶体的分散质粒子直径在1~100 nm,C错误;胶体的分散质粒子不能通过半透膜,D错误。
胶体的制备及性质
【典例2】下列现象与胶体知识无关的是 ( ) A.夏日的傍晚常常看到万丈霞光穿云而过美不胜收 B.过滤除去氯化钠溶液中的泥沙 C.食品加工厂利用豆浆中加入盐卤做豆腐 D.化工厂利用静电除尘技术去除废气中的固体悬浮物
【解析】 A项,“万丈霞光”是丁达尔效应,是胶体的特性;C项,“卤水点豆腐”是胶体的聚沉;D项,“静电除尘”是胶体的电泳;B项,氯化钠溶液、泥沙均不是胶体,故选B。
B
1.在物质分类中,前者包括后者的是( )
A.溶液、浊液 B.胶体、分散系
C.化合物、氧化物 D.纯净物、电解质溶液
C
【解析】当分散剂是水时,根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm)。溶液、浊液是并列关系,不存在包含关系,故A不选;分散系包含胶体、溶液、浊液,后者包括前者,故B不选;氧化物是由两种元素组成的纯净物,其中一种元素是氧元素;化合物是由两种或两种以上的元素组成的纯净物,所以,氧化物属于化合物,前者包括后者,故C选; 电解质是指在水溶液中或熔融状态下能导电的化合物,所以,电解质属于化合物,也属于纯净物,但电解质溶液属于混合物,不存在包含关系,故D不选;故选C。
2.用饱和的氯化铁溶液制取氢氧化铁胶体,正确的操作是 ( )
A.将饱和氯化铁溶液滴入蒸馏水中即可
B.将饱和氯化铁溶液滴入热水中,生成棕黄色液体即可
C.将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色液体
即可
D.将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色沉淀
即可
C
【解析】 Fe(OH)3胶体的制备中,是将饱和FeCl3溶液滴入沸水中,并继续煮沸至呈红褐色。
3.下列事实与胶体性质无关的是( )
A.土壤中离子的吸附和交换过程,有保肥作用
B.将植物油倒入水中用力搅拌形成油水混合物
C.一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的
通路
D.可用半透膜除去淀粉溶液中的少量NaCl
B
【解析】胶体的性质包括丁达尔效应、布朗运动、电泳、胶体的聚沉。A选项土壤
中的胶体对离子有吸附和交换作用,可起到保肥的效果;B中的植物油倒入水中用
力搅拌形成的油水混合物属于乳浊液,长时间后分层,油层在水层的上面,可以用
分液的方法分离;蛋白质溶液属于胶体,有丁达尔效应;利用分散质微粒直径的大
小用半透膜除去淀粉胶体中的少量NaCl。
4.下列说法错误的是( )
A.利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液
B.某物质经科学测定只含有一种元素,则可以断定该物质是一
种纯净物
C.用过滤法无法除去Fe(OH)3胶体中的FeCl3
D.向豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质
B
【解析】由同一种元素构成的不同单质组成的物质属于混合物,如O2与O3组成的物质。
1、分散系
定义:把一种(或多种)物质分散在另一种(或多种)物质
中所得到的体系。
分类:按照分散质与分散剂的不同状态分,可分为9种
分散系。
2、胶体
制备
Fe(OH)3胶体
方法:饱和饱和FeCl3溶液滴加到煮沸的蒸
馏水中,继续加热至红褐色。
原理:FeCl3+3H2O Fe(OH)3(胶体)+3HCl。
性质
丁达尔效应—鉴别溶液和胶体。
渗析—分离和提纯胶体、血液透析等。
电泳与聚沉—静电除尘、净水和制豆腐等。
第一节 物质的分类及转化
第2课时:分散系和胶体
第一章 物质及其变化
分散系及其分类
01
胶体的制备及性质
02
学习目标
1.通过阅读教材、讨论交流,熟知溶液、浊液、胶体三种分散系的本质区别,了解胶体的性质及其应用,会鉴别胶体和溶液,培养“宏观辨识与微观探析”的化学素养。
2.通过动手实验、现象观察、原理分析,掌握Fe(OH)3胶体的制备方法,理解胶体的丁达尔效应及其应用,初步了解实验研究的方法和步骤,培养“科学态度与科学探究”的化学素养。
请同学们欣赏自然界的“光束”,思考它们形成的原因是什么呢
美丽的大自然成就了我们多彩的生活!
分散系及其分类
分散系及其分类
活动一、认识分散系及分类
任务一、阅读教材P8第一自然段,回答分散系的定义是什么?并举例
说明生活中有哪些常见的分散系?
牛奶
硫酸铜溶液
油水混合物
泥水
上述这些物质有何相同点和不同点
分散系及其分类
硫酸铜溶液
油水混合物
泥水
一种或几种物质分散到另一种物质里,形成___________的混合物—溶液。
均一、稳定
____________悬浮于液体里形成的混合物—
悬浊液。
固体小颗粒
________分散到液体里形成的混合物—乳浊液。
小液滴
【相同点】一种或几种物质分散到另一种物质里,形成的混合物。
分散系及其分类
分散系定义
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。分散系中被分散的物质称作分散质,起容纳分散质作用的物质称为分散剂。
常见分散系
溶液(硫酸铜溶液等)、浊液(悬浊液—泥水、乳浊液—油水混合物)、胶体(牛奶)。
分散系
分散系及其分类
任务二、讨论交流:结合物质的分类方法,思考如何对分散系进行交
叉分类和树状分类?举例说明。
①按照分散质与分散剂的不同状态分
气
液
固
气
液
固
分散剂为气体有:空气、云、灰尘、烟等。
分散剂为液体有:牛奶、酒精的水溶液、泥水、豆浆等。
分散剂为固体有:有色玻璃、珍珠、合金、泡沫塑料等。
分散质 分散剂 实例
雾
烟
牛奶
分散系及其分类
②生活中常见分散系及其组成有:
分散质状态 分散剂状态 实例
气 气 空气
液 气 云、雾、水蒸气
固 气 大气中可吸入颗粒
气 液 汽水、自来水、盐酸
液 液 白酒、牛奶、果汁
固 液 食盐水、糖水
气 固 泡沫塑料
液 固 珍珠
固 固 有色玻璃、合金
分散系及其分类
③按分散质粒子的大小不同分
溶液<1nm 胶体 1nm~100nm 浊液>100nm
对应训练
【典例1】根据气象台报道,近年来每到春季,沿海一些城市经常出
现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的
( ) A.溶液 B.悬浊液 C.乳浊液 D.胶体
【解析】雾是由悬浮在大气中的小液滴构成的,小液滴的直径在1~100 nm之间,所以雾属于胶体。
D
分散系及其分类
【典例2】我国在国际上首次实现从一氧化碳到蛋白质的合成。已经形
成万吨级的工业生产能力,获得首个饲料和饲料添加剂新产品证书。
蛋白质是高分子有机化合物,其分子直径在2nm 20nm。
下列分散质粒子直径在1nm-100nm之间的是( )
A.稀硫酸 B.硫酸铜溶液 C.有色玻璃 D.酒精溶液
【解析】稀硫酸、硫酸铜溶液、酒精溶液均属于溶液,分散质粒子直径小于1nm, 有色玻璃为胶体,分散质粒子直径在1nm 100nm之间,故选C项;故选C。
C
分散系及其分类
活动二、探究分散系的本质及性质
任务一、阅读教材P8第二自然段,比较溶液、浊液和胶体三种分散系
性质,完成下表内容,由此说明三种分散系的本质区别是什么?
分散系 溶液 胶体 浊液
外观
分散质微粒组成
微粒直径
均一、稳定、透明
均一、稳定、透明
不均一、不稳定、不透明
分子、离子
大分子、离子的集合体
固体颗粒、液体小液滴
<1nm
1~100nm
>100nm
【过渡】分散系中,有一位新成员—胶体,在生活中随处可见,那么,胶体有哪些本质特征呢?
分散系及其分类
②本质区别:分散质粒子直径大小不同。如图:
③分散系都是混合物而不是纯净物。
溶液
(<1nm)
胶体
(1-100nm)
浊液
(>100nm)
1nm=10-9m
分散系及其分类
任务二、阅读教材P8第三自然段,思考胶体的定义、本质特征及分类,并举例说明。
胶体
定义
分类
鉴别
常见
胶体是分散质粒子直径在1~100 nm之间的分散系。本质特征是分散质粒子直径在1~100 nm之间。
按分散剂所处的状态分:气溶胶(烟、云、雾等)、液溶胶(Fe(OH)3胶体等)和固溶胶(有色玻璃等)。
利用丁达尔效应区分溶液和胶体
牛奶、豆浆、空气、血液、墨水、土壤、蛋白质溶液、淀粉溶液等。
分散系及其分类
任务三、问题探究:Fe(OH)3胶体的胶粒数与Fe(OH)3分子数相等吗?
①胶粒的组成:胶体微粒一般是离子、分子或难溶物的聚集体,但有些高分子化合物,如淀粉、蛋白质,因其分子非常大,其相对分子质量通常为几万、几十万甚至上百万、千万,因此一个分子就是一个胶体微粒,它们的溶液是胶体。
②在Fe(OH)3胶体中,Fe(OH)3胶体粒子的数目要远远小于原FeCl3溶液中Fe3+的数目。
对应训练
【典例1】在物质分类中,前者包括后者的是( )
A.氧化物、化合物 B.溶液、胶体
C.分散系、溶液 D.酸性氧化物、化合物
【解析】A中化合物不一定是氧化物,故A错,B中胶体和溶液是两个对立的概念,互相之间谁都不包含誰,故B错,D中化合物不一定是氧化物,更加不会是酸性氧化物,故D错。
C
对应训练
【典例2】FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,
下列叙述中错误的是( ) A.Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在
10-9~10-7 m B.分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 C.三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性 D.三种分散系均属于混合物
【解析】A项胶体区别于溶液或浊液的本质特征是胶体粒子直径在10-9~10-7m,正确;B项胶体能发生丁达尔效应,溶液和浊液不会产生丁达尔效应,正确;C项只有胶体具有吸附性,FeCl3溶液和Fe(OH)3浊液没有吸附性,FeCl3溶液为棕黄色,而Fe(OH)3胶体和Fe(OH)3浊液都为红褐色,错误;D项溶液、胶体、浊液均属于混合物,正确。
C
胶体的制备及性质
胶体的制备及性质
活动一、胶体的制备
任务一、制备Fe(OH)3胶体:结合教材P9页【实验1-1】完成实验。
步骤 实验内容 现象 原理及装置
步骤1 取100mL小烧杯,加入40ml的蒸馏水加热至沸腾。
步骤2 向沸水中滴加5-6滴饱和FeCl3溶液 步骤3 继续煮沸至液体呈红褐色,停止加热。 沸腾,产生气泡。
溶液由无色
变成浅黄色。
浅黄色溶液变成红褐色液体。
FeCl3+3H2O
Fe(OH)3(胶体)+3HCl
红褐色液体,透明
胶体的制备及性质
任务二:讨论结论:结合上述实验讨论交流Fe(OH)3胶体的制备要注意
哪些问题?
★Fe(OH)3胶体的制备注意事项!
①必须选用氯化铁饱和溶液而不能用氯化铁稀溶液。因溶液浓度过低,不利于氢氧化铁胶体的形成。
②向沸水中滴加FeCl3饱和溶液,而不是直接加热FeCl3饱和溶液,否则会因溶液浓度过大直接生成Fe(OH)3沉淀。
③实验中必须用蒸馏水,而不能用自来水。原因是自来水中含较多的杂质,易使制备的胶体发生聚沉。
④往沸水中滴加氯化铁饱和溶液后,可稍微加热煮沸,但不宜长时间加热。原因是长时间加热将导致氢氧化铁胶体聚沉。
⑤要边加热边摇动烧杯,但不能用玻璃棒搅拌,否则会使Fe(OH)3胶粒碰撞成大颗粒形成沉淀。
对应训练
【典例1】下列关于氢氧化铁胶体制备的说法正确的是( ) A.将氯化铁稀溶液慢慢滴入沸腾的自来水中,继续加热煮沸 B.将氯化铁饱和溶液慢慢滴入沸腾的蒸馏水中,并用玻璃棒搅拌 C.将氢氧化钠溶液慢慢滴入饱和的氯化铁溶液中 D.在沸腾的蒸馏水中慢慢滴入氯化铁饱和溶液,继续煮沸至溶液呈
红褐色
D
【解析】制备氢氧化铁胶体时,若选用自来水、氢氧化钠溶液,或用玻璃棒搅拌、长时间加热等,都会容易产生氢氧化铁沉淀,而不能得到氢氧化铁胶体。
对应训练
【典例2】用下列方法制备胶体:①0.5 mol/L的BaCl2溶液和等体积2
mol/L的硫酸混合振荡;②把1 mol/L饱和的FeCl3溶液逐滴加入20 mL沸
水中,边加边振荡;③1 mol/L NaOH溶液滴到1 mol/L FeCl3溶液中,可
行的是( )
A.①② B.①③ C.② D.①②③
【解析】胶体制备时对溶液浓度、反应时的操作、滴加试剂的顺序都有严格的要求。①中H2SO4溶液浓度太大,只会生成BaSO4沉淀,得不到BaSO4胶体。②中是制备Fe(OH)3胶体的正确方法,可行。③中NaOH与FeCl3浓度都太大,生成Fe(OH)3的量太多,得到Fe(OH)3沉淀。故选C。
C
胶体的制备及性质
活动二、探究胶体的性质及应用
任务一、实验探究:将上述Fe(OH)3胶体、CuSO4溶液、泥水做如下实
验,观察现象,并填写表中内容。
实验 实验内容 现象 结论
实验1 将三种液体静置片刻,观察现象。并用胶头滴管取2 3mLFe(OH)3胶体于试管中继续加热煮沸一段时间,观察现象。
Fe(OH)3胶体和CuSO4溶液都处于均一、稳定状态,而泥水分层,有泥沙沉淀生成。Fe(OH)3胶体加热煮沸有红褐色沉淀生成。
溶液稳定,胶体较稳定,浊液不稳定。
胶体的制备及性质
实验 实验内容 现象 结论
实验2 用胶头滴管取2 3mL Fe(OH)3胶体于试管中,逐滴加入盐酸溶液,观察现象。
实验3 用胶头滴管取4 5mL Fe(OH)3胶体,并按过滤操作对Fe(OH)3胶体进行过滤,观察现象。
Fe(OH)3透过了滤纸,滤液仍然呈红褐色。
先生成红褐色沉淀,后沉淀逐渐溶解。
胶体加入酸可发生聚沉,生成沉淀。
胶体可
以透过
滤纸
胶体的制备及性质
实验 实验内容 现象 结论
实验4 把盛有Fe(OH)3胶体、CuSO4溶液、泥水的三个烧杯置于暗处,分别勇激光笔照射液体,在与光线垂直方向观察现象。
实验5 ★在Fe(OH)3胶体插入两个碳棒做电极,接通直流电源,观察现象。
有一条光亮的“通路”
无通路
CuSO4溶液
Fe(OH)3胶体
泥水(浊液)也无通路
胶体能发生丁达尔效应,而溶液和浊液不能。
阳极颜色变浅,阴极颜色变深。
Fe(OH)3胶体的胶粒带正电荷
胶体的制备及性质
任务二、问题探究:通过上面实验探究说明胶体具有什么特殊性质?
结合教材P10“资料卡片”,回答何为丁达尔效应?
1.丁达尔效应:当光束通过胶体时,可以看到一条光亮的“通路”,这是由于胶体粒子对光线散射形成的,是物理现象,鉴别溶液和胶体。
散射微弱
发生散射
发生反射
胶体的制备及性质
2.胶体粒子的直径大小介于溶液和浊液之间。因此胶体能够透过滤纸,◆不能透过半透膜—渗析法。
分离、提纯胶体
胶体的制备及性质
任务三、归纳总结:胶体主要性质。
胶体的主要性质
①介稳性:稳定性介于溶液和浊液之间,属于介稳体系。
②丁达尔效应:当光束通过胶体时,可以看到一条光亮的“通路”,
③能够透过滤纸,
◆不能透过半透膜。
④电泳:胶体呈电中性,但具有电泳现象。
◆⑤聚沉:加入某些酸、碱、盐或加热或加胶粒带相反电荷的胶体可以发生电性中和而聚沉。
胶体的制备及性质
任务四、应用探究:生活中有哪些现象体现了胶体的什么性质?
胶体的应用
①农业生产:土壤的保肥作用;土壤里许多物质如土,腐殖质等常以胶体形式存在。
②日常生活:制豆腐(胶体的聚沉);明矾(KAl(SO4)2·12H2O)净水(在水中自然形成胶体,吸附力很强。
③医疗卫生:血液透析;血清在纸上电泳;利用电泳分离各种氨基酸和蛋白质。
④自然地理:江河入海口处形成三角洲的原理是海水中的电解质使江河泥沙所形成的胶体发生聚沉。
⑤工业生产:制有色玻璃(固溶胶);冶金工业利用电泳原理选矿;原油脱水等。
对应训练
【典例1】下列性质既可能是胶体所具有的,也可能是溶液所具有的是
( )
A.光线照射时,从侧面可观察到一条光亮的通路
B.加入少量稀硫酸立即产生沉淀
C.分散质粒子直径小于1 nm
D.装入半透膜袋中并将其浸入盛水的烧杯中一段时间,袋内外均含分散
质粒子
B
【解析】 溶液不具有丁达尔效应,不是溶液的性质,A错误;稀硫酸可以使胶体发生聚沉,也可以和钡盐溶液反应生成BaSO4沉淀,B正确;胶体的分散质粒子直径在1~100 nm,C错误;胶体的分散质粒子不能通过半透膜,D错误。
胶体的制备及性质
【典例2】下列现象与胶体知识无关的是 ( ) A.夏日的傍晚常常看到万丈霞光穿云而过美不胜收 B.过滤除去氯化钠溶液中的泥沙 C.食品加工厂利用豆浆中加入盐卤做豆腐 D.化工厂利用静电除尘技术去除废气中的固体悬浮物
【解析】 A项,“万丈霞光”是丁达尔效应,是胶体的特性;C项,“卤水点豆腐”是胶体的聚沉;D项,“静电除尘”是胶体的电泳;B项,氯化钠溶液、泥沙均不是胶体,故选B。
B
1.在物质分类中,前者包括后者的是( )
A.溶液、浊液 B.胶体、分散系
C.化合物、氧化物 D.纯净物、电解质溶液
C
【解析】当分散剂是水时,根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm)。溶液、浊液是并列关系,不存在包含关系,故A不选;分散系包含胶体、溶液、浊液,后者包括前者,故B不选;氧化物是由两种元素组成的纯净物,其中一种元素是氧元素;化合物是由两种或两种以上的元素组成的纯净物,所以,氧化物属于化合物,前者包括后者,故C选; 电解质是指在水溶液中或熔融状态下能导电的化合物,所以,电解质属于化合物,也属于纯净物,但电解质溶液属于混合物,不存在包含关系,故D不选;故选C。
2.用饱和的氯化铁溶液制取氢氧化铁胶体,正确的操作是 ( )
A.将饱和氯化铁溶液滴入蒸馏水中即可
B.将饱和氯化铁溶液滴入热水中,生成棕黄色液体即可
C.将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色液体
即可
D.将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色沉淀
即可
C
【解析】 Fe(OH)3胶体的制备中,是将饱和FeCl3溶液滴入沸水中,并继续煮沸至呈红褐色。
3.下列事实与胶体性质无关的是( )
A.土壤中离子的吸附和交换过程,有保肥作用
B.将植物油倒入水中用力搅拌形成油水混合物
C.一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的
通路
D.可用半透膜除去淀粉溶液中的少量NaCl
B
【解析】胶体的性质包括丁达尔效应、布朗运动、电泳、胶体的聚沉。A选项土壤
中的胶体对离子有吸附和交换作用,可起到保肥的效果;B中的植物油倒入水中用
力搅拌形成的油水混合物属于乳浊液,长时间后分层,油层在水层的上面,可以用
分液的方法分离;蛋白质溶液属于胶体,有丁达尔效应;利用分散质微粒直径的大
小用半透膜除去淀粉胶体中的少量NaCl。
4.下列说法错误的是( )
A.利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液
B.某物质经科学测定只含有一种元素,则可以断定该物质是一
种纯净物
C.用过滤法无法除去Fe(OH)3胶体中的FeCl3
D.向豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质
B
【解析】由同一种元素构成的不同单质组成的物质属于混合物,如O2与O3组成的物质。
1、分散系
定义:把一种(或多种)物质分散在另一种(或多种)物质
中所得到的体系。
分类:按照分散质与分散剂的不同状态分,可分为9种
分散系。
2、胶体
制备
Fe(OH)3胶体
方法:饱和饱和FeCl3溶液滴加到煮沸的蒸
馏水中,继续加热至红褐色。
原理:FeCl3+3H2O Fe(OH)3(胶体)+3HCl。
性质
丁达尔效应—鉴别溶液和胶体。
渗析—分离和提纯胶体、血液透析等。
电泳与聚沉—静电除尘、净水和制豆腐等。
