2.2.2化学平衡常数 课件(共38张ppt)化学人教版(2019)选择性必修第一册
文档属性
| 名称 | 2.2.2化学平衡常数 课件(共38张ppt)化学人教版(2019)选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-17 00:00:00 | ||
图片预览





文档简介
(共38张PPT)
第二节 化学平衡
第2课时
第二章
化学反应速率与化学反应平衡
化学平衡常数的应用
2
化学平衡常数
1
本节重点
本节难点
在一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?
示例分析
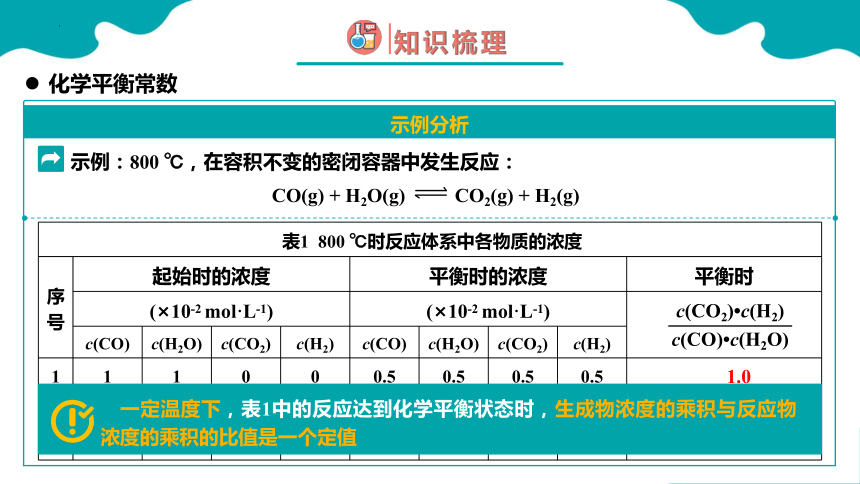
表1 800 ℃时反应体系中各物质的浓度 序号 起始时的浓度 平衡时的浓度 平衡时
(×10-2 mol·L-1) (×10-2 mol·L-1)
c(CO) c(H2O) c(CO2) c(H2) c(CO) c(H2O) c(CO2) c(H2) 1 1 1 0 0 0.5 0.5 0.5 0.5
2 1 3 0 0 0.25 2.25 0.75 0.75
3 0.25 3 0.75 0.75 0.21 2.96 0.79 0.79
1.0
1.0
1.0
化学平衡常数
CO(g) + H2O(g) CO2(g) + H2(g)
示例:800 ℃,在容积不变的密闭容器中发生反应:
c(CO) c(H2O)
c(CO2) c(H2)
一定温度下,表1中的反应达到化学平衡状态时,生成物浓度的乘积与反应物浓度的乘积的比值是一个定值
该结论适用于其他可逆反应吗?
化学平衡常数
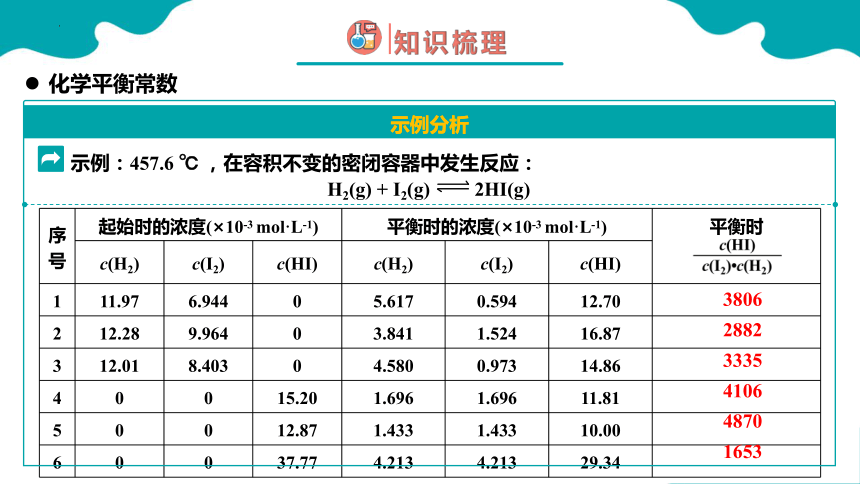
序号 起始时的浓度(×10-3 mol·L-1) 平衡时的浓度(×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
示例分析
H2(g) + I2(g) 2HI(g)
示例分析
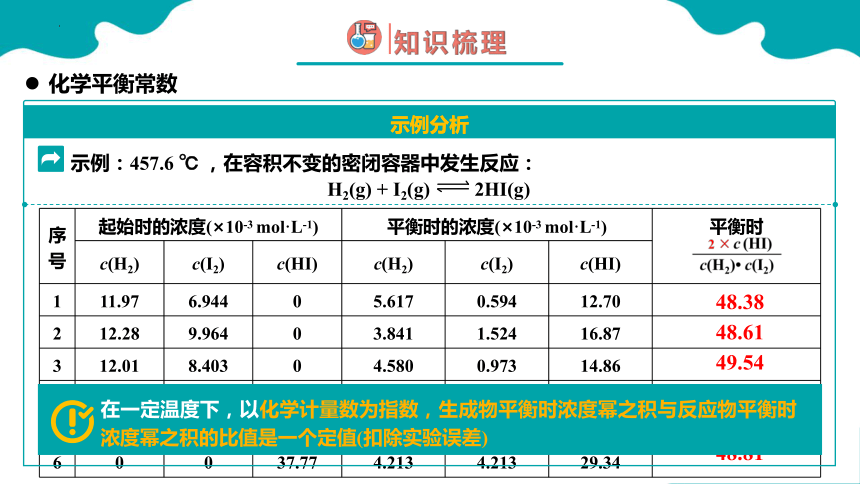
示例:457.6 ℃ ,在容积不变的密闭容器中发生反应:
3806
2882
3335
4106
4870
1653
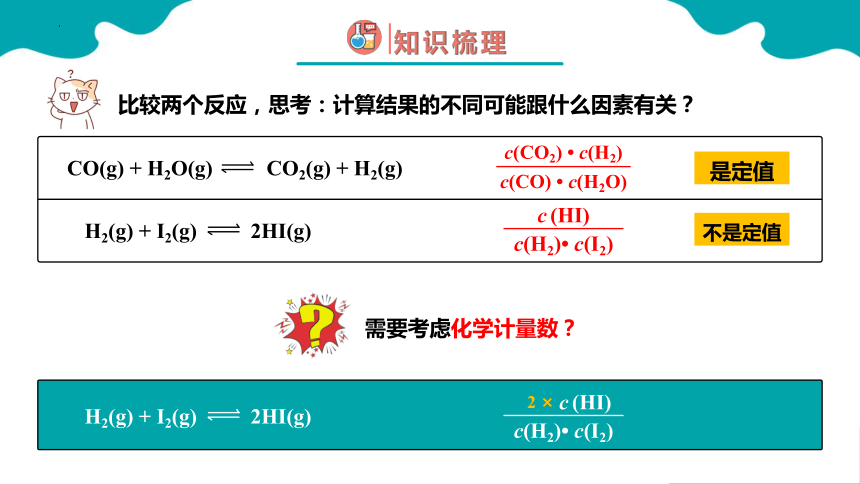
是定值
c(CO2) c(H2)
c(CO) c(H2O)
不是定值
CO(g) + H2O(g) CO2(g) + H2(g)
H2(g) + I2(g) 2HI(g)
c (HI)
c(H2) c(I2)
比较两个反应,思考:计算结果的不同可能跟什么因素有关?
需要考虑化学计量数?
H2(g) + I2(g) 2HI(g)
c (HI)
c(H2) c(I2)
2 ×
化学平衡常数
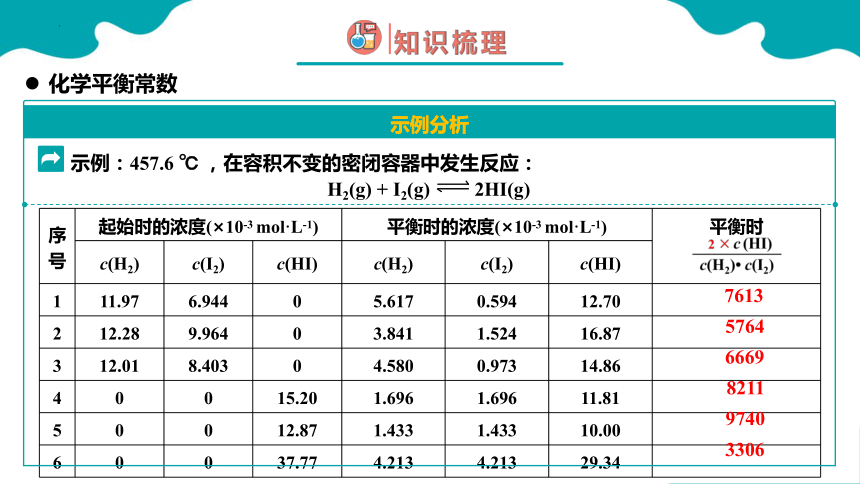
序号 起始时的浓度(×10-3 mol·L-1) 平衡时的浓度(×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
示例分析
H2(g) + I2(g) 2HI(g)
示例分析
示例:457.6 ℃ ,在容积不变的密闭容器中发生反应:
7613
5764
6669
8211
9740
3306
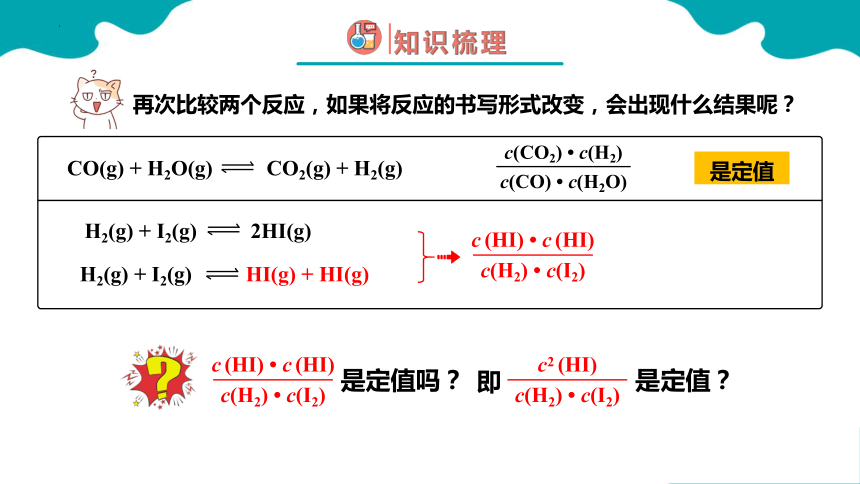
再次比较两个反应,如果将反应的书写形式改变,会出现什么结果呢?
是定值
c(CO2) c(H2)
c(CO) c(H2O)
CO(g) + H2O(g) CO2(g) + H2(g)
H2(g) + I2(g) 2HI(g)
H2(g) + I2(g) HI(g) + HI(g)
c (HI) c (HI)
c(H2) c(I2)
是定值吗?
c (HI) c (HI)
c(H2) c(I2)
是定值?
即
c2 (HI)
c(H2) c(I2)
化学平衡常数
序号 起始时的浓度(×10-3 mol·L-1) 平衡时的浓度(×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
示例分析
H2(g) + I2(g) 2HI(g)
示例分析
示例:457.6 ℃ ,在容积不变的密闭容器中发生反应:
48.38
48.61
49.54
48.48
48.71
48.81
在一定温度下,以化学计量数为指数,生成物平衡时浓度幂之积与反应物平衡时浓度幂之积的比值是一个定值(扣除实验误差)
该结论适用于其他可逆反应吗?
我又来了。。。
化学平衡常数
示例验证
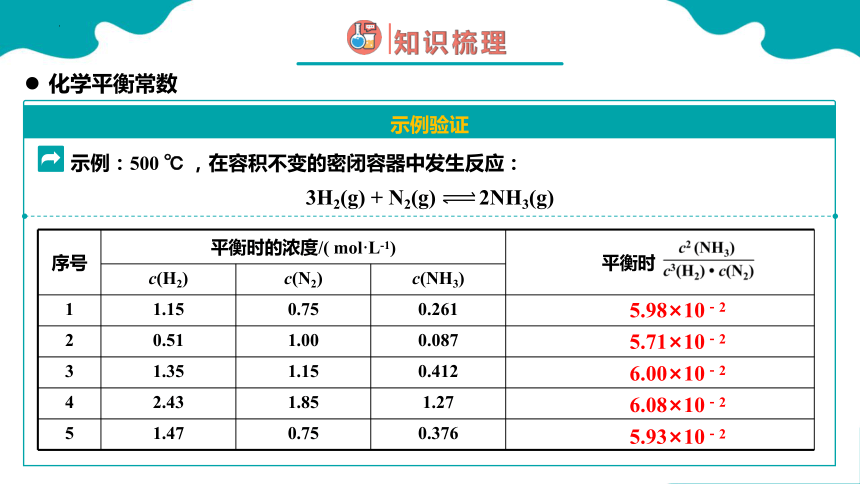
示例:500 ℃ ,在容积不变的密闭容器中发生反应:
3H2(g) + N2(g) 2NH3(g)
序号 平衡时的浓度/( mol·L-1) 平衡时
c(H2) c(N2) c(NH3) 1 1.15 0.75 0.261
2 0.51 1.00 0.087
3 1.35 1.15 0.412
4 2.43 1.85 1.27
5 1.47 0.75 0.376
6.00×10-2
5.98×10-2
5.71×10-2
5.93×10-2
6.08×10-2
科学家们通过大量数据验证,证明了上述结论成立,计算得出的定值称为化学平衡常数,用K来表示。
化学平衡常数
K 为常数,称为化学平衡常数,简称平衡常数
K =
cp(C) cq(D)
cm(A) cn(B)
对于一般的可逆反应
m A(g) + n B(g) p C(g) + q D(g)
在一定温度下达到化学平衡时,各物质的浓度满足的数学关系式为:
化学平衡常数
【例1】写出下列可逆反应的平衡常数表达式。
c2(NH3)
K1=
c(N2) c3(H2)
N2(g) + 3H2(g) 2NH3(g)
2NH3(g) N2(g) + 3H2(g)
反应01
反应02
N2(g) + H2(g) NH3(g)
1
2
3
2
反应03
c2(NH3)
K2=
c(N2) c3(H2)
c(NH3)
K3=
c1/2(N2) c3/2(H2)
反应04
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
高温
c(N2) c3(H2)
c2(NH3)
K1=
c2(NH3)
K2=
c(N2) c3(H2)
c1/2(N2) c3/2(H2)
c(NH3)
K3=
以上所求的平衡常数K1 和K2、K3之间存在什么关系呢?
c2(NH3)
c(N2) c3(H2)
c2(NH3)
×
c(N2) c3(H2)
K1 K2=
=1
(K3)2=
c(NH3)
c1/2(N2) c3/2(H2)
2
=K1
K1 =
K2
1
= K32
【例1】写出下列可逆反应的平衡常数表达式。
c2(NH3)
K1=
c(N2) c3(H2)
N2(g) + 3H2(g) 2NH3(g)
2NH3(g) N2(g) + 3H2(g)
反应01
反应02
N2(g) + H2(g) NH3(g)
1
2
3
2
反应03
c2(NH3)
K2=
c(N2) c3(H2)
c(NH3)
K3=
c1/2(N2) c3/2(H2)
反应04
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
高温
K=
c4(H2O)
c4(H2)
书写平衡常数表达式的注意事项
化学平衡常数
(注意:若化学反应为离子反应,书写其化学平衡常数时应先改写成离子方程式再进行书写)
表达式中的各物质的浓度必须为平衡浓度
平衡常数表达式与化学方程式的书写一一对应
(注意:非水溶液中发生的反应,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数的表达式中)
固体、液体纯物质的浓度视为常数,在表达式中不出现
有气体参与的反应,也可以用平衡分压(总压乘以各物质的物质的量分数)表示平衡常数
平衡常数受哪些因素影响?
我又双叒叕来了。。。
化学平衡常数
数据分析
H2(g) + I2(g) 2HI(g)
示例:在容积不变的密闭容器中发生反应:
序号 起始浓度(×10-2 mol·L-1) 不同温度下的平衡常数(K ) c(H2) c(I2) c(HI) 457.6 ℃ 425.6 ℃ 25 ℃
1 1.197 0.694 0 48.38 54.51 867
2 1.228 0.996 0 48.61 54.62 867
3 1.201 0.840 0 49.54 54.21 867
4 0 0 1.520 48.48 54.10 867
5 0 0 1.287 48.71 54.42 867
判断可逆反应热效应
化学平衡常数
数据分析
结论:
平衡常数不受浓度的影响,受温度影响
升高温度,吸热反应的平衡常数增大,放热反应的平衡常数减小
降低温度,吸热反应的平衡常数减小,放热反应的平衡常数增大
化学平衡常数
数据分析
结论:
平衡常数不受浓度的影响,受温度影响
体系压强改变会影响平衡常数吗?
压强改变可能会影响体系中物质的浓度,而浓度的改变不影响平衡常数。因此压强不影响平衡常数的大小
化学平衡常数
数据分析
H2(g) + X2(g) 2HX(g)
示例:25 ℃ 时,生成卤化氢反应的平衡常数
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
平衡常数的大小,与反应中物质的性质有关
影响化学平衡常数的因素
化学平衡常数
反应中物质的性质
内因
对于同一可逆反应,化学平衡常数只与温度有关
外因
化学平衡常数的应用
化学平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)
K =
cp(C) cq(D)
cm(A) cn(B)
m A(g) + n B(g) p C(g) + q D(g)
结合平衡常数的表达式思考,K 的大小表示什么含义?
K值越大,表示反应进行得越完全,平衡时反应物的转化率越大。一般来说,对于同类型的化学反应,K≥105时可认为该反应进行得基本完全了
K值越小,表示反应进行得越不完全,平衡时反应物的转化率越小。可以说,化学平衡常数是在一定温度下一个反应本身固有性质的定量体现
化学平衡常数的大小反映的是反应进行的程度大小,并不涉及反应时间和化学反应速率。也就是说,某个化学反应的平衡常数很大,可能化学反应速率却很小
【例1】将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。(1)求该反应的平衡常数及平衡时CO的转化率。
【解】依题意可知:起始时 c(CO) = c(H2O) = 0.01 mol·L-1,平衡时 c(CO) = 0.005 mol·L-1,变化量 c(CO) = 0.005 mol·L-1
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005
平衡浓度/(mol·L-1 ) 0.005
0.005 0.005 0.005
0.005 0.005 0.005
K= = =1
c(CO2) c(H2)
c(CO) c(H2O)
0.005 × 0.005
0.005 × 0.005
CO的转化率为:
× 100%
= 50%
0.005 mol·L-1
0.01 mol·L-1
起始浓度/(mol·L-1 ) 0.01 0.03 0 0
变化浓度/(mol·L-1 ) x
平衡浓度/(mol·L-1 ) 0.01-x
【例1】将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。(2)在上述温度下,CO的量不变,将气态H2O的投料改为0.3 mol,达到平衡时, CO的浓度为多少?CO的转化率为多少?
【解】依题意可知:起始时 c(CO) = 0.01 mol·L-1 ,c(H2O) = 0.03 mol·L-1
CO(g) + H2O(g) CO2(g) + H2(g)
x x x
设达到平衡状态时CO浓度的变化量为x mol·L-1
0.03- x x x
K = =
c(CO2) c(H2)
c(CO) c(H2O)
= 1
x2
(0.01 x) (0.03 x)
x = 0.0075
(平衡常数只与温度有关)
CO的转化率为:
=75%
× 100%
0.0075 mol·L-1
0.01 mol·L-1
【例1】将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。(2)在上述温度下,CO的量不变,将气态H2O的投料改为0.3 mol,达到平衡时, CO的浓度为多少?CO的转化率为多少?
投料浓度不影响化学反应的平衡常数,改变投料浓度后,平衡时物质的转化率会改变
序号 起始浓度/(mol·L-1) 平衡时CO的转化率
CO(g) H2O(g) 1 0.01 0.01 50%
2 0.01 0.03 75%
根据平衡常数计算平衡时各物质的浓度及反应物的转化率
化学平衡常数应用
同一温度下,同一反应
投料方式1
投料方式2
投料方式3
转化率可能不同,平衡常数(K )相同
化学平衡1
化学平衡2
化学平衡3
【例1】将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。 (3)在该温度下, CO的量不变,将气态H2O的投料改为0.375 mol ,反应一段时间后测得体系中CO的浓度为0.0025 mol·L-1 ,此时反应是否达到平衡状态?
起始浓度/(mol·L-1 ) 0.01 0.0375 0 0
变化浓度/(mol·L-1 ) 0.0075 0.0075 0.0075 0.0075
某时刻浓度/(mol·L-1 ) 0.0025 0.03 0.0075 0.0075
【解】依题意可知:起始时 c(CO) = 0.01 mol·L-1, c(H2O) =0.0375 mol·L-1,某时刻 c(CO) = 0.0025 mol·L-1,减少了0.0075 mol·L-1
CO(g) + H2O(g) CO2(g) + H2(g)
K= = =0.75
c(CO2) c(H2)
c(CO) c(H2O)
0.0075 × 0.0075
0.0025 × 0.03
< 1
此时不是化学平衡状态,反应在向正反应方向进行之中
利用平衡常数判断化学反应进行的方向
化学平衡常数应用
m A(g) + n B(g) p C(g) + q D(g)
对于可逆反应:
=Q
任意时刻,反应中各物质的浓度幂之积的比值
cp(C) cq(D)
cm(A) cn(B)
浓度商
达到化学平衡状态时浓度商等于该温度下的K
同一温度下:
是否平衡或平衡移动的方向,可用该时刻浓度商Q与K比较大小来判断
Q = K ,处于化学平衡状态
Q < K ,向正反应方向进行
Q > K ,向逆反应方向进行
师承拉瓦锡
拿破仑的科学顾问,化学伯爵
西元1798年,拿破仑远征埃及,聘任社会声望佳与科学成就卓越的贝托莱,成为其科学顾问。在埃及期间,贝托莱偶然发现,碳酸钠竟沉积在盐湖周围!基于对科学灵敏的认知,他觉察到这应该是高浓度的盐在水体中缓慢蒸发造成的结果(Na2CO3+CaCl2→CaCO3+2NaCl)。于是西元1803年,贝托莱在其著作中,提出了『有些化学反应式不只有单向反应,也可以进行逆向反应』的观点,这也是现今我们所称之「可逆反应」的先驱。
可逆反应的先驱
1.下列关于化学平衡常数的叙述正确的是( )
A.化学平衡常数表示反应进行的程度,与温度无关
B.两种物质反应,不管怎样书写化学方程式,平衡常数均不变
C.化学平衡常数等于某一时刻生成物浓度幂之积与反应物浓度幂之积的比值
D.温度一定,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D
2.下列关于化学平衡常数的说法正确的是( )
A.在任何条件下,化学平衡常数不变
B.当改变反应物的浓度时,化学平衡常数会发生改变
C.化学平衡常数K与温度、反应物浓度、体系的压强有关
D.由化学平衡常数K可以推断一个可逆反应进行的程度
D
编号 反应 平衡常数 反应热
反应① A(g) B(g)+C(g) K1 ΔH1
反应② B(g)+C(g) D(g) K2 ΔH2
反应③ A(g) D(g) K3 ΔH3
3.对于下列反应,其反应过程的能量变化示意图如下:
下列说法正确的是( )
A.K3=K1+K2
B.ΔH3=ΔH1+ΔH2
C.加催化剂,反应①的反应热降低,反应速率加快
D.增大压强,K1减小,K2增大,K3不变
B
4.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K值分别是
①H2+F2 2HF K=1047;
②H2+Cl2 2HCl K=1017;
③H2+Br2 2HBr K=109;
④H2+I2 2HI K=1。
比较K值大小,可知各反应的正反应进行的程度由大到小的顺序是( )
A.①②③④ B.④②③①
C.①④③② D.无法确定
A
5.某恒定温度下,在一个2 L的密闭容器中充入气体A、气体B,其浓度分别为2 mol·L-1、1 mol·L-1,且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)。反应一段时间后达到平衡状态,测得生成1.6 mol C,且反应前后气体的压强比为5∶4,回答下列问题:
(1)该反应的平衡常数表达式为_______________________________________。
(2)B的转化率为________。
(3)增加C的量,A、B的转化率________(填“变大”“变小”或“不变”)。
40%
不变
K=
c2(D)
c3(A) c2(B)
第二节
化学平衡
第2课时
化学平衡常数
化学平衡常数的应用
概念
判断可逆反应是否达到平衡
表达式
比较可逆反应限度
意义
影响因素
判断可逆反应热效应
用于计算平衡浓度、物质的量分数、转化率等
THANKS
谢谢聆听
第二节 化学平衡
第2课时
第二章
化学反应速率与化学反应平衡
化学平衡常数的应用
2
化学平衡常数
1
本节重点
本节难点
在一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?
示例分析
表1 800 ℃时反应体系中各物质的浓度 序号 起始时的浓度 平衡时的浓度 平衡时
(×10-2 mol·L-1) (×10-2 mol·L-1)
c(CO) c(H2O) c(CO2) c(H2) c(CO) c(H2O) c(CO2) c(H2) 1 1 1 0 0 0.5 0.5 0.5 0.5
2 1 3 0 0 0.25 2.25 0.75 0.75
3 0.25 3 0.75 0.75 0.21 2.96 0.79 0.79
1.0
1.0
1.0
化学平衡常数
CO(g) + H2O(g) CO2(g) + H2(g)
示例:800 ℃,在容积不变的密闭容器中发生反应:
c(CO) c(H2O)
c(CO2) c(H2)
一定温度下,表1中的反应达到化学平衡状态时,生成物浓度的乘积与反应物浓度的乘积的比值是一个定值
该结论适用于其他可逆反应吗?
化学平衡常数
序号 起始时的浓度(×10-3 mol·L-1) 平衡时的浓度(×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
示例分析
H2(g) + I2(g) 2HI(g)
示例分析
示例:457.6 ℃ ,在容积不变的密闭容器中发生反应:
3806
2882
3335
4106
4870
1653
是定值
c(CO2) c(H2)
c(CO) c(H2O)
不是定值
CO(g) + H2O(g) CO2(g) + H2(g)
H2(g) + I2(g) 2HI(g)
c (HI)
c(H2) c(I2)
比较两个反应,思考:计算结果的不同可能跟什么因素有关?
需要考虑化学计量数?
H2(g) + I2(g) 2HI(g)
c (HI)
c(H2) c(I2)
2 ×
化学平衡常数
序号 起始时的浓度(×10-3 mol·L-1) 平衡时的浓度(×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
示例分析
H2(g) + I2(g) 2HI(g)
示例分析
示例:457.6 ℃ ,在容积不变的密闭容器中发生反应:
7613
5764
6669
8211
9740
3306
再次比较两个反应,如果将反应的书写形式改变,会出现什么结果呢?
是定值
c(CO2) c(H2)
c(CO) c(H2O)
CO(g) + H2O(g) CO2(g) + H2(g)
H2(g) + I2(g) 2HI(g)
H2(g) + I2(g) HI(g) + HI(g)
c (HI) c (HI)
c(H2) c(I2)
是定值吗?
c (HI) c (HI)
c(H2) c(I2)
是定值?
即
c2 (HI)
c(H2) c(I2)
化学平衡常数
序号 起始时的浓度(×10-3 mol·L-1) 平衡时的浓度(×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
示例分析
H2(g) + I2(g) 2HI(g)
示例分析
示例:457.6 ℃ ,在容积不变的密闭容器中发生反应:
48.38
48.61
49.54
48.48
48.71
48.81
在一定温度下,以化学计量数为指数,生成物平衡时浓度幂之积与反应物平衡时浓度幂之积的比值是一个定值(扣除实验误差)
该结论适用于其他可逆反应吗?
我又来了。。。
化学平衡常数
示例验证
示例:500 ℃ ,在容积不变的密闭容器中发生反应:
3H2(g) + N2(g) 2NH3(g)
序号 平衡时的浓度/( mol·L-1) 平衡时
c(H2) c(N2) c(NH3) 1 1.15 0.75 0.261
2 0.51 1.00 0.087
3 1.35 1.15 0.412
4 2.43 1.85 1.27
5 1.47 0.75 0.376
6.00×10-2
5.98×10-2
5.71×10-2
5.93×10-2
6.08×10-2
科学家们通过大量数据验证,证明了上述结论成立,计算得出的定值称为化学平衡常数,用K来表示。
化学平衡常数
K 为常数,称为化学平衡常数,简称平衡常数
K =
cp(C) cq(D)
cm(A) cn(B)
对于一般的可逆反应
m A(g) + n B(g) p C(g) + q D(g)
在一定温度下达到化学平衡时,各物质的浓度满足的数学关系式为:
化学平衡常数
【例1】写出下列可逆反应的平衡常数表达式。
c2(NH3)
K1=
c(N2) c3(H2)
N2(g) + 3H2(g) 2NH3(g)
2NH3(g) N2(g) + 3H2(g)
反应01
反应02
N2(g) + H2(g) NH3(g)
1
2
3
2
反应03
c2(NH3)
K2=
c(N2) c3(H2)
c(NH3)
K3=
c1/2(N2) c3/2(H2)
反应04
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
高温
c(N2) c3(H2)
c2(NH3)
K1=
c2(NH3)
K2=
c(N2) c3(H2)
c1/2(N2) c3/2(H2)
c(NH3)
K3=
以上所求的平衡常数K1 和K2、K3之间存在什么关系呢?
c2(NH3)
c(N2) c3(H2)
c2(NH3)
×
c(N2) c3(H2)
K1 K2=
=1
(K3)2=
c(NH3)
c1/2(N2) c3/2(H2)
2
=K1
K1 =
K2
1
= K32
【例1】写出下列可逆反应的平衡常数表达式。
c2(NH3)
K1=
c(N2) c3(H2)
N2(g) + 3H2(g) 2NH3(g)
2NH3(g) N2(g) + 3H2(g)
反应01
反应02
N2(g) + H2(g) NH3(g)
1
2
3
2
反应03
c2(NH3)
K2=
c(N2) c3(H2)
c(NH3)
K3=
c1/2(N2) c3/2(H2)
反应04
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
高温
K=
c4(H2O)
c4(H2)
书写平衡常数表达式的注意事项
化学平衡常数
(注意:若化学反应为离子反应,书写其化学平衡常数时应先改写成离子方程式再进行书写)
表达式中的各物质的浓度必须为平衡浓度
平衡常数表达式与化学方程式的书写一一对应
(注意:非水溶液中发生的反应,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数的表达式中)
固体、液体纯物质的浓度视为常数,在表达式中不出现
有气体参与的反应,也可以用平衡分压(总压乘以各物质的物质的量分数)表示平衡常数
平衡常数受哪些因素影响?
我又双叒叕来了。。。
化学平衡常数
数据分析
H2(g) + I2(g) 2HI(g)
示例:在容积不变的密闭容器中发生反应:
序号 起始浓度(×10-2 mol·L-1) 不同温度下的平衡常数(K ) c(H2) c(I2) c(HI) 457.6 ℃ 425.6 ℃ 25 ℃
1 1.197 0.694 0 48.38 54.51 867
2 1.228 0.996 0 48.61 54.62 867
3 1.201 0.840 0 49.54 54.21 867
4 0 0 1.520 48.48 54.10 867
5 0 0 1.287 48.71 54.42 867
判断可逆反应热效应
化学平衡常数
数据分析
结论:
平衡常数不受浓度的影响,受温度影响
升高温度,吸热反应的平衡常数增大,放热反应的平衡常数减小
降低温度,吸热反应的平衡常数减小,放热反应的平衡常数增大
化学平衡常数
数据分析
结论:
平衡常数不受浓度的影响,受温度影响
体系压强改变会影响平衡常数吗?
压强改变可能会影响体系中物质的浓度,而浓度的改变不影响平衡常数。因此压强不影响平衡常数的大小
化学平衡常数
数据分析
H2(g) + X2(g) 2HX(g)
示例:25 ℃ 时,生成卤化氢反应的平衡常数
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
平衡常数的大小,与反应中物质的性质有关
影响化学平衡常数的因素
化学平衡常数
反应中物质的性质
内因
对于同一可逆反应,化学平衡常数只与温度有关
外因
化学平衡常数的应用
化学平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)
K =
cp(C) cq(D)
cm(A) cn(B)
m A(g) + n B(g) p C(g) + q D(g)
结合平衡常数的表达式思考,K 的大小表示什么含义?
K值越大,表示反应进行得越完全,平衡时反应物的转化率越大。一般来说,对于同类型的化学反应,K≥105时可认为该反应进行得基本完全了
K值越小,表示反应进行得越不完全,平衡时反应物的转化率越小。可以说,化学平衡常数是在一定温度下一个反应本身固有性质的定量体现
化学平衡常数的大小反映的是反应进行的程度大小,并不涉及反应时间和化学反应速率。也就是说,某个化学反应的平衡常数很大,可能化学反应速率却很小
【例1】将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。(1)求该反应的平衡常数及平衡时CO的转化率。
【解】依题意可知:起始时 c(CO) = c(H2O) = 0.01 mol·L-1,平衡时 c(CO) = 0.005 mol·L-1,变化量 c(CO) = 0.005 mol·L-1
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005
平衡浓度/(mol·L-1 ) 0.005
0.005 0.005 0.005
0.005 0.005 0.005
K= = =1
c(CO2) c(H2)
c(CO) c(H2O)
0.005 × 0.005
0.005 × 0.005
CO的转化率为:
× 100%
= 50%
0.005 mol·L-1
0.01 mol·L-1
起始浓度/(mol·L-1 ) 0.01 0.03 0 0
变化浓度/(mol·L-1 ) x
平衡浓度/(mol·L-1 ) 0.01-x
【例1】将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。(2)在上述温度下,CO的量不变,将气态H2O的投料改为0.3 mol,达到平衡时, CO的浓度为多少?CO的转化率为多少?
【解】依题意可知:起始时 c(CO) = 0.01 mol·L-1 ,c(H2O) = 0.03 mol·L-1
CO(g) + H2O(g) CO2(g) + H2(g)
x x x
设达到平衡状态时CO浓度的变化量为x mol·L-1
0.03- x x x
K = =
c(CO2) c(H2)
c(CO) c(H2O)
= 1
x2
(0.01 x) (0.03 x)
x = 0.0075
(平衡常数只与温度有关)
CO的转化率为:
=75%
× 100%
0.0075 mol·L-1
0.01 mol·L-1
【例1】将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。(2)在上述温度下,CO的量不变,将气态H2O的投料改为0.3 mol,达到平衡时, CO的浓度为多少?CO的转化率为多少?
投料浓度不影响化学反应的平衡常数,改变投料浓度后,平衡时物质的转化率会改变
序号 起始浓度/(mol·L-1) 平衡时CO的转化率
CO(g) H2O(g) 1 0.01 0.01 50%
2 0.01 0.03 75%
根据平衡常数计算平衡时各物质的浓度及反应物的转化率
化学平衡常数应用
同一温度下,同一反应
投料方式1
投料方式2
投料方式3
转化率可能不同,平衡常数(K )相同
化学平衡1
化学平衡2
化学平衡3
【例1】将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。 (3)在该温度下, CO的量不变,将气态H2O的投料改为0.375 mol ,反应一段时间后测得体系中CO的浓度为0.0025 mol·L-1 ,此时反应是否达到平衡状态?
起始浓度/(mol·L-1 ) 0.01 0.0375 0 0
变化浓度/(mol·L-1 ) 0.0075 0.0075 0.0075 0.0075
某时刻浓度/(mol·L-1 ) 0.0025 0.03 0.0075 0.0075
【解】依题意可知:起始时 c(CO) = 0.01 mol·L-1, c(H2O) =0.0375 mol·L-1,某时刻 c(CO) = 0.0025 mol·L-1,减少了0.0075 mol·L-1
CO(g) + H2O(g) CO2(g) + H2(g)
K= = =0.75
c(CO2) c(H2)
c(CO) c(H2O)
0.0075 × 0.0075
0.0025 × 0.03
< 1
此时不是化学平衡状态,反应在向正反应方向进行之中
利用平衡常数判断化学反应进行的方向
化学平衡常数应用
m A(g) + n B(g) p C(g) + q D(g)
对于可逆反应:
=Q
任意时刻,反应中各物质的浓度幂之积的比值
cp(C) cq(D)
cm(A) cn(B)
浓度商
达到化学平衡状态时浓度商等于该温度下的K
同一温度下:
是否平衡或平衡移动的方向,可用该时刻浓度商Q与K比较大小来判断
Q = K ,处于化学平衡状态
Q < K ,向正反应方向进行
Q > K ,向逆反应方向进行
师承拉瓦锡
拿破仑的科学顾问,化学伯爵
西元1798年,拿破仑远征埃及,聘任社会声望佳与科学成就卓越的贝托莱,成为其科学顾问。在埃及期间,贝托莱偶然发现,碳酸钠竟沉积在盐湖周围!基于对科学灵敏的认知,他觉察到这应该是高浓度的盐在水体中缓慢蒸发造成的结果(Na2CO3+CaCl2→CaCO3+2NaCl)。于是西元1803年,贝托莱在其著作中,提出了『有些化学反应式不只有单向反应,也可以进行逆向反应』的观点,这也是现今我们所称之「可逆反应」的先驱。
可逆反应的先驱
1.下列关于化学平衡常数的叙述正确的是( )
A.化学平衡常数表示反应进行的程度,与温度无关
B.两种物质反应,不管怎样书写化学方程式,平衡常数均不变
C.化学平衡常数等于某一时刻生成物浓度幂之积与反应物浓度幂之积的比值
D.温度一定,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D
2.下列关于化学平衡常数的说法正确的是( )
A.在任何条件下,化学平衡常数不变
B.当改变反应物的浓度时,化学平衡常数会发生改变
C.化学平衡常数K与温度、反应物浓度、体系的压强有关
D.由化学平衡常数K可以推断一个可逆反应进行的程度
D
编号 反应 平衡常数 反应热
反应① A(g) B(g)+C(g) K1 ΔH1
反应② B(g)+C(g) D(g) K2 ΔH2
反应③ A(g) D(g) K3 ΔH3
3.对于下列反应,其反应过程的能量变化示意图如下:
下列说法正确的是( )
A.K3=K1+K2
B.ΔH3=ΔH1+ΔH2
C.加催化剂,反应①的反应热降低,反应速率加快
D.增大压强,K1减小,K2增大,K3不变
B
4.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K值分别是
①H2+F2 2HF K=1047;
②H2+Cl2 2HCl K=1017;
③H2+Br2 2HBr K=109;
④H2+I2 2HI K=1。
比较K值大小,可知各反应的正反应进行的程度由大到小的顺序是( )
A.①②③④ B.④②③①
C.①④③② D.无法确定
A
5.某恒定温度下,在一个2 L的密闭容器中充入气体A、气体B,其浓度分别为2 mol·L-1、1 mol·L-1,且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)。反应一段时间后达到平衡状态,测得生成1.6 mol C,且反应前后气体的压强比为5∶4,回答下列问题:
(1)该反应的平衡常数表达式为_______________________________________。
(2)B的转化率为________。
(3)增加C的量,A、B的转化率________(填“变大”“变小”或“不变”)。
40%
不变
K=
c2(D)
c3(A) c2(B)
第二节
化学平衡
第2课时
化学平衡常数
化学平衡常数的应用
概念
判断可逆反应是否达到平衡
表达式
比较可逆反应限度
意义
影响因素
判断可逆反应热效应
用于计算平衡浓度、物质的量分数、转化率等
THANKS
谢谢聆听
