1.1 有机化合物的分离与提纯 学案(含答案)人教版(2019)选择性必修三
文档属性
| 名称 | 1.1 有机化合物的分离与提纯 学案(含答案)人教版(2019)选择性必修三 | 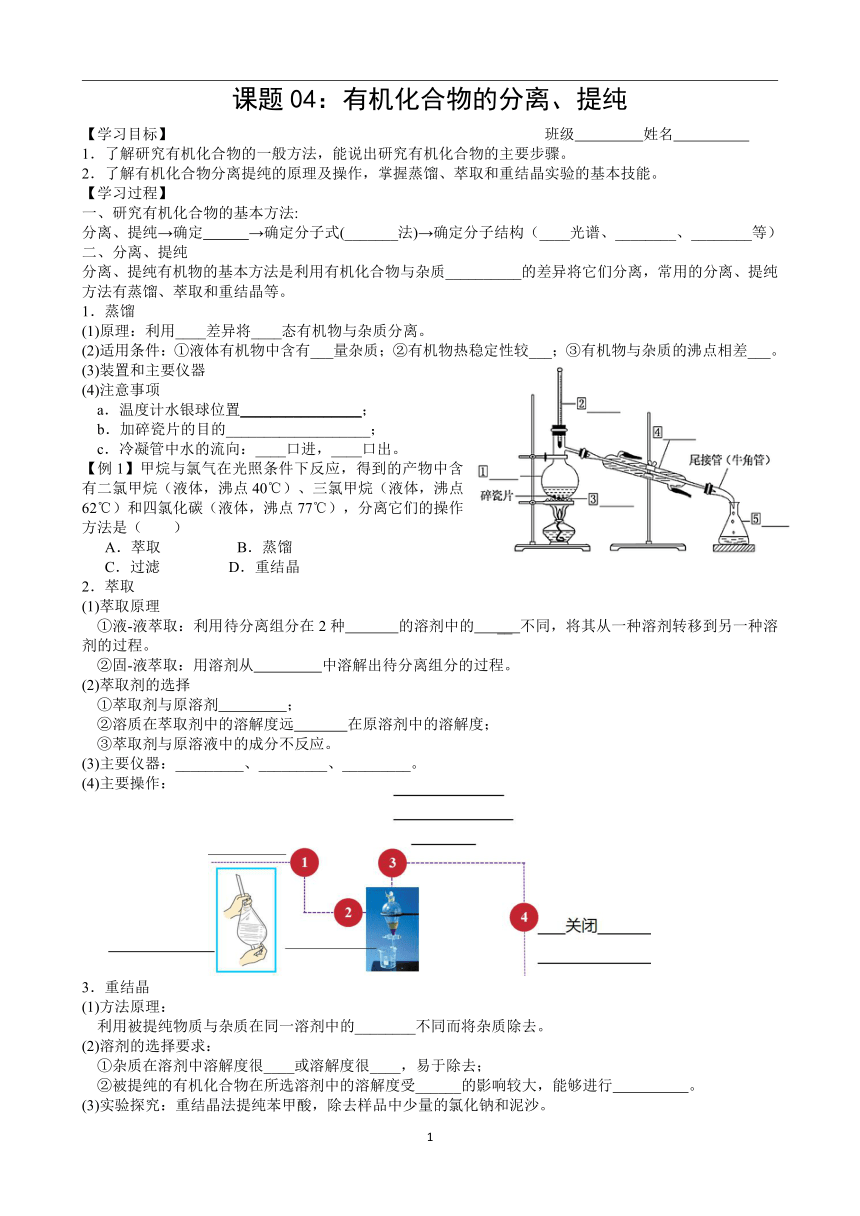 | |
| 格式 | docx | ||
| 文件大小 | 334.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 16:35:33 | ||
图片预览


文档简介
课题04:有机化合物的分离、提纯
【学习目标】 班级 姓名
1.了解研究有机化合物的一般方法,能说出研究有机化合物的主要步骤。
2.了解有机化合物分离提纯的原理及操作,掌握蒸馏、萃取和重结晶实验的基本技能。
【学习过程】
一、研究有机化合物的基本方法:
分离、提纯→确定 →确定分子式(_______法)→确定分子结构(____光谱、________、________等)
二、分离、提纯
分离、提纯有机物的基本方法是利用有机化合物与杂质__________的差异将它们分离,常用的分离、提纯方法有蒸馏、萃取和重结晶等。
1.蒸馏
(1)原理:利用____差异将____态有机物与杂质分离。
(2)适用条件:①液体有机物中含有___量杂质;②有机物热稳定性较___;③有机物与杂质的沸点相差___。
(3)装置和主要仪器
(4)注意事项
a.温度计水银球位置________________;
b.加碎瓷片的目的___________________;
c.冷凝管中水的流向:____口进,____口出。
【例1】甲烷与氯气在光照条件下反应,得到的产物中含有二氯甲烷(液体,沸点40℃)、三氯甲烷(液体,沸点62℃)和四氯化碳(液体,沸点77℃),分离它们的操作方法是( )
A.萃取 B.蒸馏
C.过滤 D.重结晶
2.萃取
(1)萃取原理
①液-液萃取:利用待分离组分在2种 的溶剂中的 __ 不同,将其从一种溶剂转移到另一种溶剂的过程。
②固-液萃取:用溶剂从 中溶解出待分离组分的过程。
(2)萃取剂的选择
①萃取剂与原溶剂 ;
②溶质在萃取剂中的溶解度远 在原溶剂中的溶解度;
③萃取剂与原溶液中的成分不反应。
(3)主要仪器:_________、_________、_________。
(4)主要操作:
3.重结晶
(1)方法原理:
利用被提纯物质与杂质在同一溶剂中的________不同而将杂质除去。
(2)溶剂的选择要求:
①杂质在溶剂中溶解度很____或溶解度很____,易于除去;
②被提纯的有机化合物在所选溶剂中的溶解度受______的影响较大,能够进行 。
(3)实验探究:重结晶法提纯苯甲酸,除去样品中少量的氯化钠和泥沙。
1、选择_____作溶剂,原因___________________________________________
2、补全步骤:加热溶解→趁热过滤→冷却结晶→_______→_______→________→________等。
3、【讨论】
①重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
_______________________________________________________________________________
_______________________________________________________________________________
②溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
加热:________________;趁热过滤:_____________________________________________________
③实验操作中多次使用了玻璃棒,分别起到了哪些作用?
_____________________________、__________________、______________________________
④如何检验提纯后的苯甲酸中氯化钠已经被除净?
_______________________________________________________________________________________
_____________________________________________________________________________
【例2】乙酰苯胺是一种具有解热镇痛的白色晶体,20℃时在乙醇中的溶解度为36.9g,在水中的溶解度如下表:
温度/℃ 25 50 80 100
溶解度/g 0.56 0.84 3.5 5.5
某种乙酰苯胺样品中混入了少量氯化钠杂质,下列提纯乙酰苯胺的方法正确的是( )
(注:氯化钠可分散在乙醇中形成胶体。)
A.用水溶解后分液 B.用乙醇溶解后过滤
C.用水作溶剂进行重结晶 D.用乙醇作溶剂进行重结晶
4.色谱法:当样品随着流动相经过固定相时,因样品中不同组分在两相间的分配不同而实现分离,这样的一类分离分析方法被称为色谱法。
【课堂反馈】
1、正误判断
(1)能用分液的方法分离植物油和水的混合物( )
(2)Br2、I2在水中的溶解度较小,但易溶于有机溶剂,故可用酒精萃取溴水中的Br2或碘水中的I2( )
(3)利用蒸馏法分离液态有机物时,温度计可以插入液面以下( )
(4)在蒸馏实验中,发现忘记加沸石,应立即停止实验,马上加入( )
(5)重结晶要求杂质的溶解度比被提纯的物质小才能进行分离( )
2、下列关于实验操作的叙述正确的是( )
A.分液操作时,分液漏斗中的下层液体从下口放出,上层液体也从下口流出
B.从碘水中萃取碘,应选择有机萃取剂,且萃取剂的密度必须比水大
C.萃取操作时,分液漏斗使用前必须检查是否漏水
D.萃取分液即得纯净的产品,不需再提纯
3、按要求回答问题
(1)如图是一套蒸馏装置图,图中存在的错误:
___________________________;
___________________________;
____________________________。
(2)若用蒸馏的方法分离甘油(沸点为290 ℃)和水的混合物,被蒸馏出来的物质是________。
(3)若用蒸馏的方法分离出CCl4(沸点为76.8 ℃)中含有的CH3CH2OCH2CH3
(沸点为45 ℃),应控制的适宜温度为________。
4、选择下列实验方法分离、提纯物质,将分离、提纯方法的字母填在横线上。
A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气
(1)分离水和汽油的混合物: ________。
(2)分离四氯化碳 (沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:________。
(3)提取碘水中的碘:________。
(4)除去混在乙烷中的乙烯:________。
(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:________。
【课后限时训练】
1.我国明代《本草纲目》中收载药物1 892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.萃取 B.渗析 C.蒸馏 D.过滤
2.现有一瓶A和B的混合液,已知A和B的某些性质如下,由此推知分离A和B的最佳方法是
物质 分子式 熔点/℃ 沸点/℃ 密度/(g·cm-3) 水溶性
A C3H6O2 -24 141 0.99 可溶
B C4H8O2 -84 77 0.90 可溶
A.萃取 B.结晶 C.蒸馏 D.分液
3.现有3组混合物:①乙酸乙酯和乙酸钠溶液、②乙醇和丁醇、③溴化钠和单质溴的水溶液。分离以上各组混合物的正确方法依次是
A.分液法、萃取法、蒸馏法 B.萃取法、蒸馏法、分液法
C.分液法、蒸馏法、萃取法 D.蒸馏法、萃取法、分液法
4.以下关于萃取操作的叙述中,正确的是
A.把混合液体转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.分液时,需先将上口的玻璃塞打开,再打开活塞
5.下列实验中,所采取的分离方法与对应原理都正确的是
选项 目的 分离方法 原理
A 分离溶于水的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去苯甲酸固体中混杂的NaCl 重结晶 苯甲酸在水中的溶解度很小
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
6.下列有关苯甲酸重结晶实验的说法错误的是
A.溶解粗苯甲酸过程中,加热、玻璃棒搅拌均能提高苯甲酸的溶解度
B.苯甲酸溶解时,若加水加热后仍有不溶物,说明该不溶物是不溶性杂质
C.过滤时,趁热过滤可防止苯甲酸晶体提前析出
D.冷却结晶时,温度过低杂质将析出,故此时温度不是越低越好
7.下列有关实验的说法错误的是
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和二氯甲烷的混合物
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶液中的溶解度受温度影响应该很大
8.已知乙醛(CH3CHO)是易溶于水、沸点为20.8 ℃的液体,将乙醛和乙酸分离的正确方法是
A.加热蒸馏
B.加入Na2CO3后,通过萃取的方法分离
C.先加入NaOH溶液后蒸出乙醛,再加入H2SO4,蒸出乙酸
D.与钠反应后分离
9.下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛有饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①② B.②④ C.③④ D.②③
10.欲用96%的工业酒精制取无水乙醇时,可选用的方法是
A.加入无水CuSO4,再过滤 B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇 D.将96%的乙醇溶液直接加热蒸馏
11.现拟分离乙酸乙酯、乙酸和乙醇的混合物,下图是分离操作步骤流程图。已知各物质的沸点:
乙酸乙酯 77.1 ℃、乙醇 78.5 ℃、乙酸 118 ℃。
请回答下列问题:
(1)试剂(a)为__________,试剂(b)为__________。
(2)图中的分离方法分别是:①__________;②__________;③__________。
(3)写出下列有机物的化学式:
A__________;B__________;C__________;D__________;E__________。
12.我国科学家屠呦呦因青蒿素研究获得诺贝尔奖,青蒿素是从传统药材中发现的能治疗疟疾的有机化合物。现某实验小组拟提取青蒿素。青蒿素为无色针状晶体,熔点为156~157℃,易溶于丙酮、氯仿和乙醚,在水中几乎不溶。
I.实验室流程如图所示:
(1)在操作I前要对青蒿进行粉碎,其目的是_________________________,操作II的名称是_______。
(2)操作III进行的是重结晶,其操作步骤为加热溶解→_______→_______→过滤、洗涤、干燥。
II.已知青蒿素是一种仅含有C、H、O三种元素的化合物,为进一步确定其化学式,进行了如图实验:
实验步骤:①连接装置,检查装置气密性;
②称量E、F中仪器及药品的质量;
③取14. 10g青蒿素放入C的硬质玻璃管中,点燃C、D中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(3)装置E、F应分别装入的药品为_____________、_____________。
(4)通过质谱法测得青蒿素的相对分子质量为282,结合上图数据,得出青蒿素的分子式为_______。
(5)若使用上述方法会产生较大实验误差,你的改进方法是__________________________________。
课题04:有机化合物的分离、提纯 答案
一、实验式 质谱 红外 核磁共振氢谱 X射线衍射
二、物理性质
1.沸点 液 少 强 较大
蒸馏烧瓶 温度计 石棉网 冷凝管 锥形瓶
蒸馏烧瓶动支管口 防止暴沸 下 上
【例1】B
2.互不相溶 溶解性 固体物质 不反应,不互溶 大于
分液漏斗 烧杯 铁架台(带铁圈)
3.溶解度 小 大 温度 冷却结晶
水
NaCl在水中易溶 泥沙在水中难溶 苯甲酸在水中溶解度小,但随温度变化比较大,能进行冷却结晶
过滤→洗涤→干燥→称量
讨论:
1、杂质泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。通过重结晶可以使它与杂质分离。主要操作步骤:①加热溶解;②趁热过滤;③冷却结晶;④过滤、洗涤;⑤干燥;⑥称重。
2、加热:使苯甲酸溶解。趁热过滤:除去不溶性杂质,并防止苯甲酸晶体低温析出。
3、玻璃棒的作用:①溶解时搅拌,加快溶解速度;②过滤、洗涤时引流; ③干燥时用于转移晶体。
4、用适量蒸馏水洗涤过滤器中的苯甲酸晶体,取一烧杯收集最后一次洗涤后的滤液,滴加几滴AgNO3溶液,观察是否有沉淀产生。若无,则氯化钠被除尽。
【例2】C
【课堂反馈】
1、(1)√ (2)× (3)× (4)× (5)× 2、C
3、(1)温度计位置错误,冷凝管进出水方向不对,没有加碎瓷片 (2)水 (3)45 ℃
4、(1)C (2)D (3)A (4)F (5)B
【课后限时训练】
1.C 2.C 3.C 4.D 5.D 6.A 7.D 8.C 9.B 10.B
11.(1)饱和Na2CO3溶液 硫酸 (2)分液 蒸馏 蒸馏 (3)CH3COOCH2CH3 CH3CH2OH、CH3COONa CH3COONa CH3COOH CH3CH2OH
12.(1)增大青蒿与乙醚的接触面积,提高浸取率 蒸馏
(2)趁热过滤 冷却结晶
(3)无水氯化钙(或五氧化二磷) 碱石灰
(4)C15H22O5
(5)在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置
5
【学习目标】 班级 姓名
1.了解研究有机化合物的一般方法,能说出研究有机化合物的主要步骤。
2.了解有机化合物分离提纯的原理及操作,掌握蒸馏、萃取和重结晶实验的基本技能。
【学习过程】
一、研究有机化合物的基本方法:
分离、提纯→确定 →确定分子式(_______法)→确定分子结构(____光谱、________、________等)
二、分离、提纯
分离、提纯有机物的基本方法是利用有机化合物与杂质__________的差异将它们分离,常用的分离、提纯方法有蒸馏、萃取和重结晶等。
1.蒸馏
(1)原理:利用____差异将____态有机物与杂质分离。
(2)适用条件:①液体有机物中含有___量杂质;②有机物热稳定性较___;③有机物与杂质的沸点相差___。
(3)装置和主要仪器
(4)注意事项
a.温度计水银球位置________________;
b.加碎瓷片的目的___________________;
c.冷凝管中水的流向:____口进,____口出。
【例1】甲烷与氯气在光照条件下反应,得到的产物中含有二氯甲烷(液体,沸点40℃)、三氯甲烷(液体,沸点62℃)和四氯化碳(液体,沸点77℃),分离它们的操作方法是( )
A.萃取 B.蒸馏
C.过滤 D.重结晶
2.萃取
(1)萃取原理
①液-液萃取:利用待分离组分在2种 的溶剂中的 __ 不同,将其从一种溶剂转移到另一种溶剂的过程。
②固-液萃取:用溶剂从 中溶解出待分离组分的过程。
(2)萃取剂的选择
①萃取剂与原溶剂 ;
②溶质在萃取剂中的溶解度远 在原溶剂中的溶解度;
③萃取剂与原溶液中的成分不反应。
(3)主要仪器:_________、_________、_________。
(4)主要操作:
3.重结晶
(1)方法原理:
利用被提纯物质与杂质在同一溶剂中的________不同而将杂质除去。
(2)溶剂的选择要求:
①杂质在溶剂中溶解度很____或溶解度很____,易于除去;
②被提纯的有机化合物在所选溶剂中的溶解度受______的影响较大,能够进行 。
(3)实验探究:重结晶法提纯苯甲酸,除去样品中少量的氯化钠和泥沙。
1、选择_____作溶剂,原因___________________________________________
2、补全步骤:加热溶解→趁热过滤→冷却结晶→_______→_______→________→________等。
3、【讨论】
①重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
_______________________________________________________________________________
_______________________________________________________________________________
②溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
加热:________________;趁热过滤:_____________________________________________________
③实验操作中多次使用了玻璃棒,分别起到了哪些作用?
_____________________________、__________________、______________________________
④如何检验提纯后的苯甲酸中氯化钠已经被除净?
_______________________________________________________________________________________
_____________________________________________________________________________
【例2】乙酰苯胺是一种具有解热镇痛的白色晶体,20℃时在乙醇中的溶解度为36.9g,在水中的溶解度如下表:
温度/℃ 25 50 80 100
溶解度/g 0.56 0.84 3.5 5.5
某种乙酰苯胺样品中混入了少量氯化钠杂质,下列提纯乙酰苯胺的方法正确的是( )
(注:氯化钠可分散在乙醇中形成胶体。)
A.用水溶解后分液 B.用乙醇溶解后过滤
C.用水作溶剂进行重结晶 D.用乙醇作溶剂进行重结晶
4.色谱法:当样品随着流动相经过固定相时,因样品中不同组分在两相间的分配不同而实现分离,这样的一类分离分析方法被称为色谱法。
【课堂反馈】
1、正误判断
(1)能用分液的方法分离植物油和水的混合物( )
(2)Br2、I2在水中的溶解度较小,但易溶于有机溶剂,故可用酒精萃取溴水中的Br2或碘水中的I2( )
(3)利用蒸馏法分离液态有机物时,温度计可以插入液面以下( )
(4)在蒸馏实验中,发现忘记加沸石,应立即停止实验,马上加入( )
(5)重结晶要求杂质的溶解度比被提纯的物质小才能进行分离( )
2、下列关于实验操作的叙述正确的是( )
A.分液操作时,分液漏斗中的下层液体从下口放出,上层液体也从下口流出
B.从碘水中萃取碘,应选择有机萃取剂,且萃取剂的密度必须比水大
C.萃取操作时,分液漏斗使用前必须检查是否漏水
D.萃取分液即得纯净的产品,不需再提纯
3、按要求回答问题
(1)如图是一套蒸馏装置图,图中存在的错误:
___________________________;
___________________________;
____________________________。
(2)若用蒸馏的方法分离甘油(沸点为290 ℃)和水的混合物,被蒸馏出来的物质是________。
(3)若用蒸馏的方法分离出CCl4(沸点为76.8 ℃)中含有的CH3CH2OCH2CH3
(沸点为45 ℃),应控制的适宜温度为________。
4、选择下列实验方法分离、提纯物质,将分离、提纯方法的字母填在横线上。
A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气
(1)分离水和汽油的混合物: ________。
(2)分离四氯化碳 (沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:________。
(3)提取碘水中的碘:________。
(4)除去混在乙烷中的乙烯:________。
(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:________。
【课后限时训练】
1.我国明代《本草纲目》中收载药物1 892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.萃取 B.渗析 C.蒸馏 D.过滤
2.现有一瓶A和B的混合液,已知A和B的某些性质如下,由此推知分离A和B的最佳方法是
物质 分子式 熔点/℃ 沸点/℃ 密度/(g·cm-3) 水溶性
A C3H6O2 -24 141 0.99 可溶
B C4H8O2 -84 77 0.90 可溶
A.萃取 B.结晶 C.蒸馏 D.分液
3.现有3组混合物:①乙酸乙酯和乙酸钠溶液、②乙醇和丁醇、③溴化钠和单质溴的水溶液。分离以上各组混合物的正确方法依次是
A.分液法、萃取法、蒸馏法 B.萃取法、蒸馏法、分液法
C.分液法、蒸馏法、萃取法 D.蒸馏法、萃取法、分液法
4.以下关于萃取操作的叙述中,正确的是
A.把混合液体转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.分液时,需先将上口的玻璃塞打开,再打开活塞
5.下列实验中,所采取的分离方法与对应原理都正确的是
选项 目的 分离方法 原理
A 分离溶于水的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去苯甲酸固体中混杂的NaCl 重结晶 苯甲酸在水中的溶解度很小
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
6.下列有关苯甲酸重结晶实验的说法错误的是
A.溶解粗苯甲酸过程中,加热、玻璃棒搅拌均能提高苯甲酸的溶解度
B.苯甲酸溶解时,若加水加热后仍有不溶物,说明该不溶物是不溶性杂质
C.过滤时,趁热过滤可防止苯甲酸晶体提前析出
D.冷却结晶时,温度过低杂质将析出,故此时温度不是越低越好
7.下列有关实验的说法错误的是
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和二氯甲烷的混合物
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶液中的溶解度受温度影响应该很大
8.已知乙醛(CH3CHO)是易溶于水、沸点为20.8 ℃的液体,将乙醛和乙酸分离的正确方法是
A.加热蒸馏
B.加入Na2CO3后,通过萃取的方法分离
C.先加入NaOH溶液后蒸出乙醛,再加入H2SO4,蒸出乙酸
D.与钠反应后分离
9.下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛有饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①② B.②④ C.③④ D.②③
10.欲用96%的工业酒精制取无水乙醇时,可选用的方法是
A.加入无水CuSO4,再过滤 B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇 D.将96%的乙醇溶液直接加热蒸馏
11.现拟分离乙酸乙酯、乙酸和乙醇的混合物,下图是分离操作步骤流程图。已知各物质的沸点:
乙酸乙酯 77.1 ℃、乙醇 78.5 ℃、乙酸 118 ℃。
请回答下列问题:
(1)试剂(a)为__________,试剂(b)为__________。
(2)图中的分离方法分别是:①__________;②__________;③__________。
(3)写出下列有机物的化学式:
A__________;B__________;C__________;D__________;E__________。
12.我国科学家屠呦呦因青蒿素研究获得诺贝尔奖,青蒿素是从传统药材中发现的能治疗疟疾的有机化合物。现某实验小组拟提取青蒿素。青蒿素为无色针状晶体,熔点为156~157℃,易溶于丙酮、氯仿和乙醚,在水中几乎不溶。
I.实验室流程如图所示:
(1)在操作I前要对青蒿进行粉碎,其目的是_________________________,操作II的名称是_______。
(2)操作III进行的是重结晶,其操作步骤为加热溶解→_______→_______→过滤、洗涤、干燥。
II.已知青蒿素是一种仅含有C、H、O三种元素的化合物,为进一步确定其化学式,进行了如图实验:
实验步骤:①连接装置,检查装置气密性;
②称量E、F中仪器及药品的质量;
③取14. 10g青蒿素放入C的硬质玻璃管中,点燃C、D中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(3)装置E、F应分别装入的药品为_____________、_____________。
(4)通过质谱法测得青蒿素的相对分子质量为282,结合上图数据,得出青蒿素的分子式为_______。
(5)若使用上述方法会产生较大实验误差,你的改进方法是__________________________________。
课题04:有机化合物的分离、提纯 答案
一、实验式 质谱 红外 核磁共振氢谱 X射线衍射
二、物理性质
1.沸点 液 少 强 较大
蒸馏烧瓶 温度计 石棉网 冷凝管 锥形瓶
蒸馏烧瓶动支管口 防止暴沸 下 上
【例1】B
2.互不相溶 溶解性 固体物质 不反应,不互溶 大于
分液漏斗 烧杯 铁架台(带铁圈)
3.溶解度 小 大 温度 冷却结晶
水
NaCl在水中易溶 泥沙在水中难溶 苯甲酸在水中溶解度小,但随温度变化比较大,能进行冷却结晶
过滤→洗涤→干燥→称量
讨论:
1、杂质泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。通过重结晶可以使它与杂质分离。主要操作步骤:①加热溶解;②趁热过滤;③冷却结晶;④过滤、洗涤;⑤干燥;⑥称重。
2、加热:使苯甲酸溶解。趁热过滤:除去不溶性杂质,并防止苯甲酸晶体低温析出。
3、玻璃棒的作用:①溶解时搅拌,加快溶解速度;②过滤、洗涤时引流; ③干燥时用于转移晶体。
4、用适量蒸馏水洗涤过滤器中的苯甲酸晶体,取一烧杯收集最后一次洗涤后的滤液,滴加几滴AgNO3溶液,观察是否有沉淀产生。若无,则氯化钠被除尽。
【例2】C
【课堂反馈】
1、(1)√ (2)× (3)× (4)× (5)× 2、C
3、(1)温度计位置错误,冷凝管进出水方向不对,没有加碎瓷片 (2)水 (3)45 ℃
4、(1)C (2)D (3)A (4)F (5)B
【课后限时训练】
1.C 2.C 3.C 4.D 5.D 6.A 7.D 8.C 9.B 10.B
11.(1)饱和Na2CO3溶液 硫酸 (2)分液 蒸馏 蒸馏 (3)CH3COOCH2CH3 CH3CH2OH、CH3COONa CH3COONa CH3COOH CH3CH2OH
12.(1)增大青蒿与乙醚的接触面积,提高浸取率 蒸馏
(2)趁热过滤 冷却结晶
(3)无水氯化钙(或五氧化二磷) 碱石灰
(4)C15H22O5
(5)在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置
5
