2023浙教版科学七升八暑假培优训练(五):物质的溶解(2)【含解析】
文档属性
| 名称 | 2023浙教版科学七升八暑假培优训练(五):物质的溶解(2)【含解析】 |

|
|
| 格式 | doc | ||
| 文件大小 | 640.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-07-18 00:00:00 | ||
图片预览


文档简介
物质的溶解(2)
1.在10℃时,A物质的溶解度为5g/100g水,则此温度下,A物质的饱和溶液里,下列质量比关系正确的是( )
A.m溶液:m溶质=1:20 B.m溶质:m溶液=1:20
C.m溶液:m溶剂=21:20 D.m溶剂:m溶质=19:1
2.20℃时,某物质溶解于水的实验数据如表.则下列叙述正确的是( )
实验序号 水的质量(g) 加入该物质的质量(g) 剩余未溶解固体的质量(g)
① 10 2 0
② 10 3 0
③ 10 4 0.4
④ 10 5 1.4
A.溶液质量由大到小的顺序为:④>③>②>①
B.20℃时10g饱和溶液溶有3.6g该物质
C.20℃时10g水最多溶解3.6g该物质
D.①所得溶液的溶质质量分数为20%
3.20C时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分到溶解,实验过程如图所示。下列分析正确的是( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大温地破
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
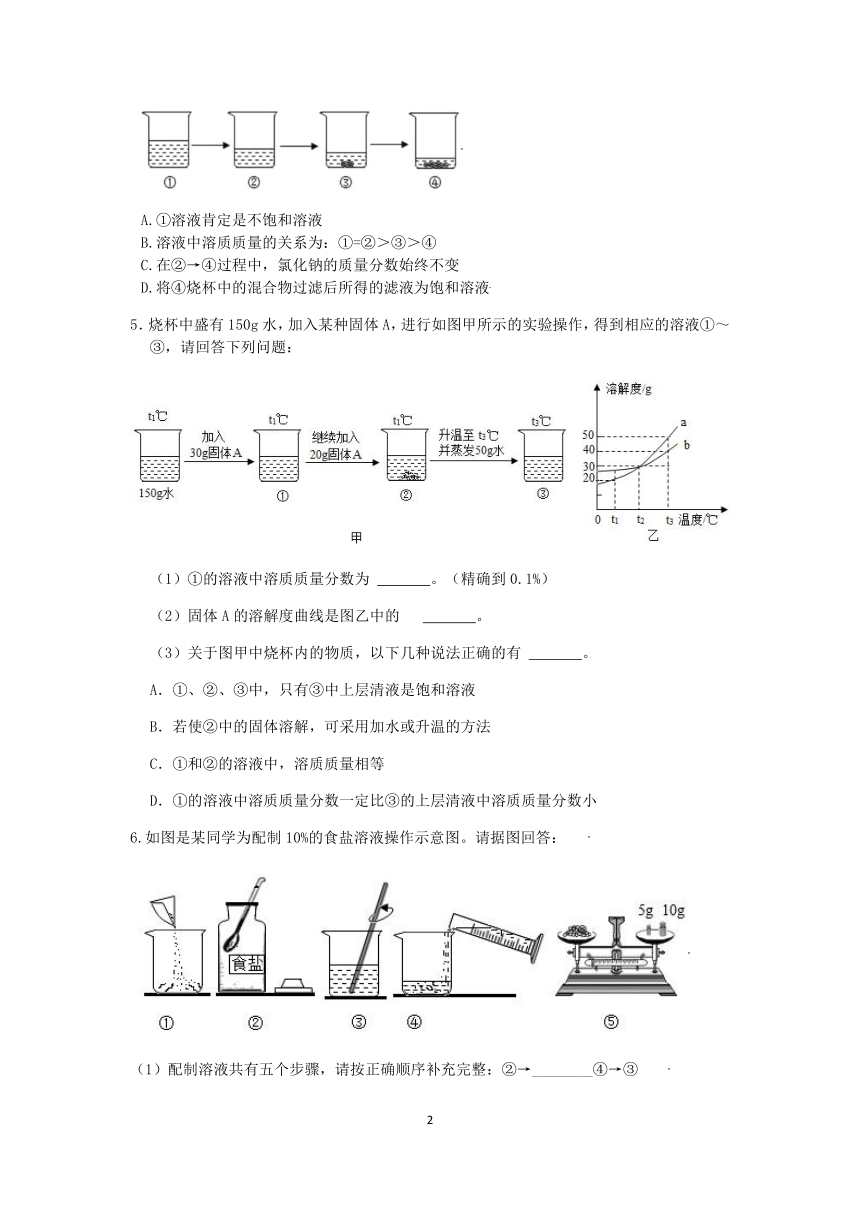
4.如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,下列说法错误的是( )
A.①溶液肯定是不饱和溶液
B.溶液中溶质质量的关系为:①=②>③>④
C.在②→④过程中,氯化钠的质量分数始终不变
D.将④烧杯中的混合物过滤后所得的滤液为饱和溶液
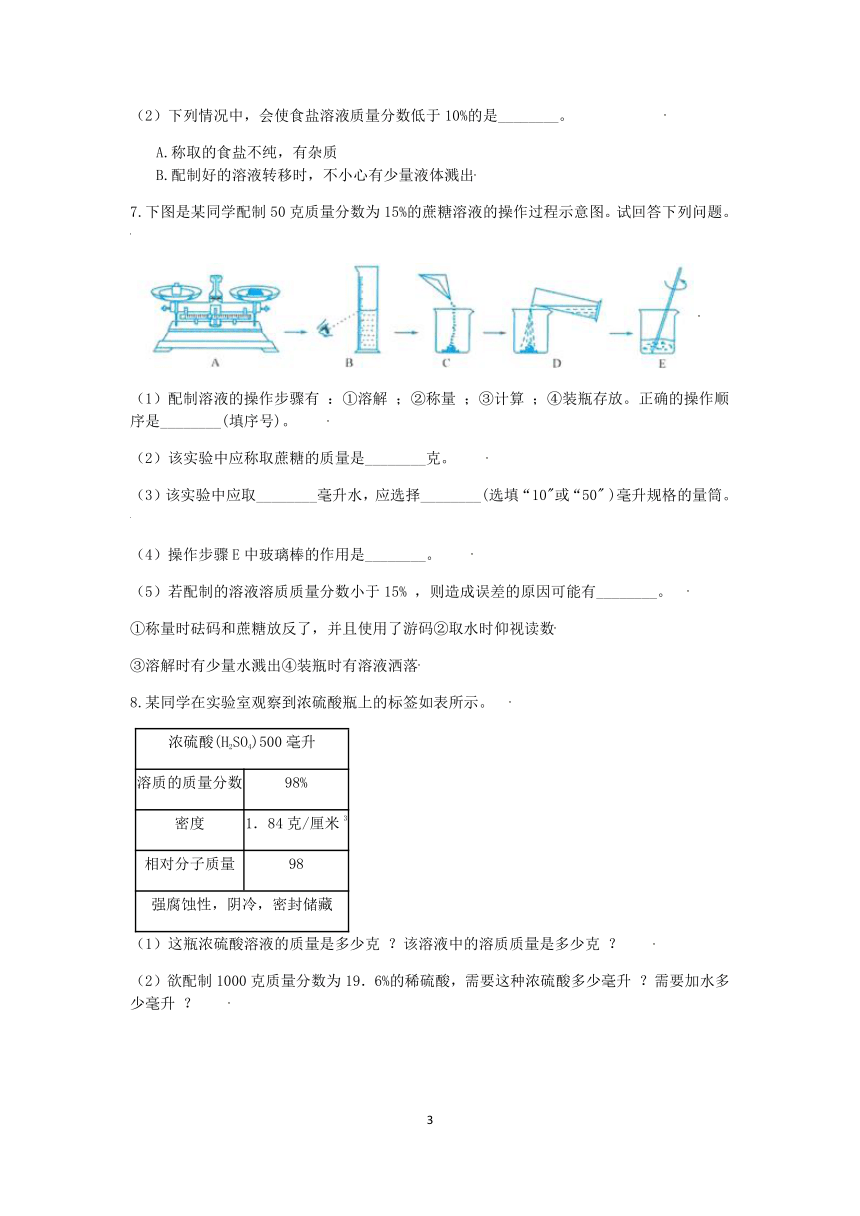
5.烧杯中盛有150g水,加入某种固体A,进行如图甲所示的实验操作,得到相应的溶液①~③,请回答下列问题:
(1)①的溶液中溶质质量分数为 。(精确到0.1%)
(2)固体A的溶解度曲线是图乙中的 。
(3)关于图甲中烧杯内的物质,以下几种说法正确的有 。
A.①、②、③中,只有③中上层清液是饱和溶液
B.若使②中的固体溶解,可采用加水或升温的方法
C.①和②的溶液中,溶质质量相等
D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小
6.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)配制溶液共有五个步骤,请按正确顺序补充完整:②→________④→③
(2)下列情况中,会使食盐溶液质量分数低于10%的是________。
A.称取的食盐不纯,有杂质
B.配制好的溶液转移时,不小心有少量液体溅出
7.下图是某同学配制50克质量分数为15%的蔗糖溶液的操作过程示意图。试回答下列问题。
(1)配制溶液的操作步骤有 :①溶解 ;②称量 ;③计算 ;④装瓶存放。正确的操作顺序是________(填序号)。
(2)该实验中应称取蔗糖的质量是________克。
(3)该实验中应取________毫升水,应选择________(选填“10"或“50" )毫升规格的量筒。
(4)操作步骤E中玻璃棒的作用是________。
(5)若配制的溶液溶质质量分数小于15% ,则造成误差的原因可能有________。
①称量时砝码和蔗糖放反了,并且使用了游码②取水时仰视读数
③溶解时有少量水溅出④装瓶时有溶液洒落
8.某同学在实验室观察到浓硫酸瓶上的标签如表所示。
浓硫酸(H2SO4)500毫升
溶质的质量分数 98%
密度 1.84克/厘米3
相对分子质量 98
强腐蚀性,阴冷,密封储藏
(1)这瓶浓硫酸溶液的质量是多少克 ?该溶液中的溶质质量是多少克 ?
(2)欲配制1000克质量分数为19.6%的稀硫酸,需要这种浓硫酸多少毫升 ?需要加水多少毫升 ?
9.20℃时,氯化钠在水中溶解度为36克。现将10克氯化钠溶于40克水中,求:
(1)所得溶液中溶质的质量分数是多少?
(2)若欲使原溶液的溶质质量分数减少一半,需加水多少克?
(3)若欲使原溶液恰好形成该温度下的饱和溶液,可恒温蒸发多少克水?(结果保留一位小数)
10.为了有效防控疫情,最有效的预防方法之一就是用消毒液对空气消毒。二氧化氯消毒液,是国际上公认的新一代强力、广谱、安全、高效的消毒剂,学校曾用此消毒液对全校教室、寝室全面消毒。小民观察到瓶上的标签如下表所示:
溶质的质重分数。 80%
密度 1.2g/cm2
相对分子质里 67.5
强腐蚀性,阴冷,密封储藏
(1)1000 毫升该二氧化氯消毒液的质量是多少克?
(2)1000 毫升该二氧化氯消毒液中含溶质多少克?
(3)实验室欲用该消毒液来配制350 千克质量分数为 20%的稀二氧化氯消毒液用来消毒,需要加水多少毫升?
11.舟山海鲜闻名全国,但是有一些不法商贩为了获取暴利,会用福尔马林浸泡海鲜,以延长其保鲜时间,这对食用者的健康有很大损害。查阅资料发现福尔马林是浓度为35%-40%的甲醛溶液。在医学上,常用来浸泡病理切片及生物标本,请根据要求回答下列问题:
(1)实验室中,如果要配制100g质量分数为40%的福尔马林溶液,需要甲醛的质量为多少?
(2)如果将该溶液稀释为35%的溶液,需要加入多少毫升的水?(结果保留一位小数)
答案及解析
1.C
解:在10℃时,A物质的溶解度为5g/100g水,含义是10℃时,100g水中最多能溶解A物质5g,溶液达到饱和状态,形成饱和溶液105g。
A、该温度下A物质的饱和溶液中溶液质量:溶质质量=105g:5g=21:1,故选项说法错误。
B、该温度下A物质的饱和溶液中溶质质量:溶液质量=5g:105g=1:21,故选项说法错误。
C、该温度下A物质的饱和溶液中溶液质量:溶剂质量=105g:100g=21:20,故选项说法正确。
D、该温度下A物质的饱和溶液中溶剂质量:溶质质量=100g:5g=20:1,故选项说法错误。
故选:C。
2.C
解:A、对比②③可见,20℃时,10g水中达到饱和,最多可以溶解3.6g该物质,所以③④都是饱和溶液,二者的质量相等,所以溶液质量由大到小的顺序为:④=③>②>①,故A错误;
B、根据实验③所得数据,20℃时10g水溶解13.6g﹣10g=3.6g该物质时溶液为饱和溶液,即20℃时10g饱和溶液溶有3.6g该物质的叙述是错误的;故B错误;
C、③、④溶液中同为10g水中溶解了3.6g某物质,所以20℃时10g水最多洛解3.6g该物质,故C正确;
D、①所得溶液是10g水中溶解了2g氯化钠制得,所得溶液的溶质质量分数为100%=16.7%.故D错误;
故选:C。
3.B
【解析】根据有固体未溶解的溶液一定是饱和溶液,向杯底有固体剩余的溶液中加水,溶质质量分数可能不变分析。
A、 甲烧杯中,硝酸钾未完全溶解,是饱和溶液 ,不符合题意;
B、丁烧杯中为丙烧杯中溶液再加25克水形成,一定是硝酸钾的不饱和溶液 ,符合题意;
C、乙→丙过程中,若固体刚好溶解,即丙是饱和溶液时,硝酸钾溶液的溶质质量分数不变,不符合题意;
D、丙→丁过程中,硝酸钾溶液的溶质质量分数变小,不符合题意;
4.C
【解析】(1)②为饱和溶液,将①和②的溶剂质量比较大小即可;
(2)析出的晶体越多,溶质的质量越少;
(3)饱和溶液的溶质质量分数与溶解度有关;
(4)如果溶液中有晶体出现,那么它肯定是饱和溶液。
【解答】A.①蒸发溶剂得到②,即①中溶剂的质量肯定大于②的溶剂质量。因为②为饱和溶液,那么①肯定为不饱和溶液,故A正确不合题意;
B.①和②中都没有溶质析出,那么它们的溶质质量相等,即①=②;③中析出氯化钠的质量小于④,那么③中溶质的质量大于④,因此溶质质量大小关系:①=②>③>④,故B正确不合题意;
C.②③④都是饱和溶液,②和③的温度相同,那么氯化钠的溶解度相同,则溶质质量分数相同;④的温度高,氯化钠的溶解度改变,则溶质质量分数改变,故C错误符合题意;
D.④中有氯化钠晶体析出,肯定为饱和溶液,故D正确不合题意。
5.解:(1)①的溶液中溶质质量分数为100%≈16.7%;
(2)在t3℃时,50gA全部溶解,所以固体A的溶解度曲线是图乙中的a;
(3)t1℃时,A物质的溶解度是20g,①中溶质30g,溶剂150g,②中溶剂150g,溶质30g;t3℃时,A物质的溶解度是50g,③中溶质50g,溶剂100g。
A、①、②、③中,②的烧杯底部有固体剩余,所以②③中上层清液都是饱和溶液,故A错误;
B、A物质的溶解度随温度的升高而增大,所以若使②中的固体溶解,可采用加水或升温的方法,故B正确;
C、①和②的溶液中,溶质质量相等,故C正确;
D、③中溶质质量分数100%≈33.3%,所以①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小,故D正确。
故选:BCD。
故答案为:(1)16.7%;(2)a;(3)BCD。
6.(1)⑤→① (2)A
【解析】(1)根据配制一定浓度的溶液的实验过程分析;
(2)根据溶质质量分数=可知,溶质质量偏小,要么是溶质质量偏小,要么是溶剂质量偏大,据此分析判断。
【解答】(1)配制10%的氯化钠溶液的步骤为:②取出食盐;⑤称量食盐;①将食盐倒入烧杯;④量筒量取水倒入烧杯;③用玻璃棒搅拌,直到完全溶解。
则正确的顺序为:②→⑤→①→④→③。
(2)A.称取的食盐不纯,有杂质,那么溶质的质量偏小,故A符合题意;
B.配制好的溶液转移时,不小心有少量液体溅出。由于溶液均一稳定,因此不会影响溶液的溶质质量分数,故B不合题意。
7.(1)③②①④(2)7.5(3)42.5;50(4)搅拌,加速蔗精溶解(5)①②
【解析】(1)根据配制溶液的操作步骤分析;
(2)根据溶质质量=溶液质量×溶质质量分数分析;
(3)根据溶液质量=溶质质量+溶剂质量分析;
(4)根据溶解时玻璃棒的搅拌作用分析;
(5)根据溶质质量分数偏小可能是溶质偏小或溶剂偏多分析。
【解答】(1)配制溶液的操作步骤为计算、称量、溶解、装瓶,即顺序为③②①④;
(2)该实验中应称取蔗糖的质量是50克×15%=7.5g;
(3)该实验中应取用水的质量为50g-7.5g=42.5g,体积为42.5毫升,应选择50毫升规格的量筒;
(4)E为溶解,玻璃棒的作用是搅拌,加速蔗精溶解 ;
(5)①称量时砝码和蔗糖放反了,并且使用了游码,会使溶质质量偏小,使溶质质量分数偏小,正确;②取水时仰视读数,会使水的实际体积偏大,溶质质量分数偏小,正确;③溶解时有少量水溅出,会使溶质质量分数因溶剂偏小而偏大,错误;④装瓶时有溶液洒落不影响溶质质量分数大小,错误;
8.(1)这瓶浓硫酸溶液的质量为500毫升× 1.84克/厘米3 =920克,
该溶液中的溶质质量是920克 ×98%=901.6克;
(2)设需浓硫酸质量为x
1000克×19.6% =98%x
x=2000克,
则体积为200克 1.84克/厘米3 =108.7毫升,
需水的质量为1000克-200克=800克,体积为800毫升。
【解析】(1)根据溶质质量=溶液质量×溶质质量分数,溶液质量=溶液体积×密度分析;
(2)根据溶液稀释前后溶质质量不变及所加水的质量即为稀溶液质量-浓溶液质量分析。
9.(1)设40g水中最多溶解氯化钠的质量为x,
;
解得:x=14.4g;
因为10g<14.4g,所以得到氯化钠的不饱和溶液。
溶质质量分数为:.
(2)若欲使原溶液的溶质质量分数减少一半,需加水的质量为y,
;解得:y=50g。
(3)20℃时,10g氯化钠配制成饱和溶液时需要水的质量为z,
;解得:z≈27.8g;
则需要蒸发水的质量为:40g-27.8g=12.2g。
【解析】(1)根据溶解度计算出40g水中最多溶解氯化钠的质量,从而确定溶液是否包含,再计算溶质质量分数。
(2)根据溶质质量分数=列方程计算即可;
(3)根据溶解度计算出10g氯化钠配制成饱和溶液时需要水的质量,然后前后两个水的质量相减即可。
10.(1)1200g;(2)960g;(3)。
【解析】
(1)1000 毫升该二氧化氯消毒液的质量:m=ρV=1.2g/cm3×1000cm3=1200g;
(2)其中所含溶质的质量:1200g×80%=960g;
(3)设需要80%的消毒液的质量为x, 80%x=350kg×20%;x=87.5kg;
需要加水的质量:350kg-87.5kg=262.5kg;
需要加水的体积:。
11.(1)需要甲醛的质量为:100g×40%=40g。
(2)稀释为35%的溶液的质量为:,需要加入水的质量为:114.3g-100g=14.3g,需要加入水的体积为:。
1.在10℃时,A物质的溶解度为5g/100g水,则此温度下,A物质的饱和溶液里,下列质量比关系正确的是( )
A.m溶液:m溶质=1:20 B.m溶质:m溶液=1:20
C.m溶液:m溶剂=21:20 D.m溶剂:m溶质=19:1
2.20℃时,某物质溶解于水的实验数据如表.则下列叙述正确的是( )
实验序号 水的质量(g) 加入该物质的质量(g) 剩余未溶解固体的质量(g)
① 10 2 0
② 10 3 0
③ 10 4 0.4
④ 10 5 1.4
A.溶液质量由大到小的顺序为:④>③>②>①
B.20℃时10g饱和溶液溶有3.6g该物质
C.20℃时10g水最多溶解3.6g该物质
D.①所得溶液的溶质质量分数为20%
3.20C时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分到溶解,实验过程如图所示。下列分析正确的是( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大温地破
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
4.如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,下列说法错误的是( )
A.①溶液肯定是不饱和溶液
B.溶液中溶质质量的关系为:①=②>③>④
C.在②→④过程中,氯化钠的质量分数始终不变
D.将④烧杯中的混合物过滤后所得的滤液为饱和溶液
5.烧杯中盛有150g水,加入某种固体A,进行如图甲所示的实验操作,得到相应的溶液①~③,请回答下列问题:
(1)①的溶液中溶质质量分数为 。(精确到0.1%)
(2)固体A的溶解度曲线是图乙中的 。
(3)关于图甲中烧杯内的物质,以下几种说法正确的有 。
A.①、②、③中,只有③中上层清液是饱和溶液
B.若使②中的固体溶解,可采用加水或升温的方法
C.①和②的溶液中,溶质质量相等
D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小
6.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)配制溶液共有五个步骤,请按正确顺序补充完整:②→________④→③
(2)下列情况中,会使食盐溶液质量分数低于10%的是________。
A.称取的食盐不纯,有杂质
B.配制好的溶液转移时,不小心有少量液体溅出
7.下图是某同学配制50克质量分数为15%的蔗糖溶液的操作过程示意图。试回答下列问题。
(1)配制溶液的操作步骤有 :①溶解 ;②称量 ;③计算 ;④装瓶存放。正确的操作顺序是________(填序号)。
(2)该实验中应称取蔗糖的质量是________克。
(3)该实验中应取________毫升水,应选择________(选填“10"或“50" )毫升规格的量筒。
(4)操作步骤E中玻璃棒的作用是________。
(5)若配制的溶液溶质质量分数小于15% ,则造成误差的原因可能有________。
①称量时砝码和蔗糖放反了,并且使用了游码②取水时仰视读数
③溶解时有少量水溅出④装瓶时有溶液洒落
8.某同学在实验室观察到浓硫酸瓶上的标签如表所示。
浓硫酸(H2SO4)500毫升
溶质的质量分数 98%
密度 1.84克/厘米3
相对分子质量 98
强腐蚀性,阴冷,密封储藏
(1)这瓶浓硫酸溶液的质量是多少克 ?该溶液中的溶质质量是多少克 ?
(2)欲配制1000克质量分数为19.6%的稀硫酸,需要这种浓硫酸多少毫升 ?需要加水多少毫升 ?
9.20℃时,氯化钠在水中溶解度为36克。现将10克氯化钠溶于40克水中,求:
(1)所得溶液中溶质的质量分数是多少?
(2)若欲使原溶液的溶质质量分数减少一半,需加水多少克?
(3)若欲使原溶液恰好形成该温度下的饱和溶液,可恒温蒸发多少克水?(结果保留一位小数)
10.为了有效防控疫情,最有效的预防方法之一就是用消毒液对空气消毒。二氧化氯消毒液,是国际上公认的新一代强力、广谱、安全、高效的消毒剂,学校曾用此消毒液对全校教室、寝室全面消毒。小民观察到瓶上的标签如下表所示:
溶质的质重分数。 80%
密度 1.2g/cm2
相对分子质里 67.5
强腐蚀性,阴冷,密封储藏
(1)1000 毫升该二氧化氯消毒液的质量是多少克?
(2)1000 毫升该二氧化氯消毒液中含溶质多少克?
(3)实验室欲用该消毒液来配制350 千克质量分数为 20%的稀二氧化氯消毒液用来消毒,需要加水多少毫升?
11.舟山海鲜闻名全国,但是有一些不法商贩为了获取暴利,会用福尔马林浸泡海鲜,以延长其保鲜时间,这对食用者的健康有很大损害。查阅资料发现福尔马林是浓度为35%-40%的甲醛溶液。在医学上,常用来浸泡病理切片及生物标本,请根据要求回答下列问题:
(1)实验室中,如果要配制100g质量分数为40%的福尔马林溶液,需要甲醛的质量为多少?
(2)如果将该溶液稀释为35%的溶液,需要加入多少毫升的水?(结果保留一位小数)
答案及解析
1.C
解:在10℃时,A物质的溶解度为5g/100g水,含义是10℃时,100g水中最多能溶解A物质5g,溶液达到饱和状态,形成饱和溶液105g。
A、该温度下A物质的饱和溶液中溶液质量:溶质质量=105g:5g=21:1,故选项说法错误。
B、该温度下A物质的饱和溶液中溶质质量:溶液质量=5g:105g=1:21,故选项说法错误。
C、该温度下A物质的饱和溶液中溶液质量:溶剂质量=105g:100g=21:20,故选项说法正确。
D、该温度下A物质的饱和溶液中溶剂质量:溶质质量=100g:5g=20:1,故选项说法错误。
故选:C。
2.C
解:A、对比②③可见,20℃时,10g水中达到饱和,最多可以溶解3.6g该物质,所以③④都是饱和溶液,二者的质量相等,所以溶液质量由大到小的顺序为:④=③>②>①,故A错误;
B、根据实验③所得数据,20℃时10g水溶解13.6g﹣10g=3.6g该物质时溶液为饱和溶液,即20℃时10g饱和溶液溶有3.6g该物质的叙述是错误的;故B错误;
C、③、④溶液中同为10g水中溶解了3.6g某物质,所以20℃时10g水最多洛解3.6g该物质,故C正确;
D、①所得溶液是10g水中溶解了2g氯化钠制得,所得溶液的溶质质量分数为100%=16.7%.故D错误;
故选:C。
3.B
【解析】根据有固体未溶解的溶液一定是饱和溶液,向杯底有固体剩余的溶液中加水,溶质质量分数可能不变分析。
A、 甲烧杯中,硝酸钾未完全溶解,是饱和溶液 ,不符合题意;
B、丁烧杯中为丙烧杯中溶液再加25克水形成,一定是硝酸钾的不饱和溶液 ,符合题意;
C、乙→丙过程中,若固体刚好溶解,即丙是饱和溶液时,硝酸钾溶液的溶质质量分数不变,不符合题意;
D、丙→丁过程中,硝酸钾溶液的溶质质量分数变小,不符合题意;
4.C
【解析】(1)②为饱和溶液,将①和②的溶剂质量比较大小即可;
(2)析出的晶体越多,溶质的质量越少;
(3)饱和溶液的溶质质量分数与溶解度有关;
(4)如果溶液中有晶体出现,那么它肯定是饱和溶液。
【解答】A.①蒸发溶剂得到②,即①中溶剂的质量肯定大于②的溶剂质量。因为②为饱和溶液,那么①肯定为不饱和溶液,故A正确不合题意;
B.①和②中都没有溶质析出,那么它们的溶质质量相等,即①=②;③中析出氯化钠的质量小于④,那么③中溶质的质量大于④,因此溶质质量大小关系:①=②>③>④,故B正确不合题意;
C.②③④都是饱和溶液,②和③的温度相同,那么氯化钠的溶解度相同,则溶质质量分数相同;④的温度高,氯化钠的溶解度改变,则溶质质量分数改变,故C错误符合题意;
D.④中有氯化钠晶体析出,肯定为饱和溶液,故D正确不合题意。
5.解:(1)①的溶液中溶质质量分数为100%≈16.7%;
(2)在t3℃时,50gA全部溶解,所以固体A的溶解度曲线是图乙中的a;
(3)t1℃时,A物质的溶解度是20g,①中溶质30g,溶剂150g,②中溶剂150g,溶质30g;t3℃时,A物质的溶解度是50g,③中溶质50g,溶剂100g。
A、①、②、③中,②的烧杯底部有固体剩余,所以②③中上层清液都是饱和溶液,故A错误;
B、A物质的溶解度随温度的升高而增大,所以若使②中的固体溶解,可采用加水或升温的方法,故B正确;
C、①和②的溶液中,溶质质量相等,故C正确;
D、③中溶质质量分数100%≈33.3%,所以①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小,故D正确。
故选:BCD。
故答案为:(1)16.7%;(2)a;(3)BCD。
6.(1)⑤→① (2)A
【解析】(1)根据配制一定浓度的溶液的实验过程分析;
(2)根据溶质质量分数=可知,溶质质量偏小,要么是溶质质量偏小,要么是溶剂质量偏大,据此分析判断。
【解答】(1)配制10%的氯化钠溶液的步骤为:②取出食盐;⑤称量食盐;①将食盐倒入烧杯;④量筒量取水倒入烧杯;③用玻璃棒搅拌,直到完全溶解。
则正确的顺序为:②→⑤→①→④→③。
(2)A.称取的食盐不纯,有杂质,那么溶质的质量偏小,故A符合题意;
B.配制好的溶液转移时,不小心有少量液体溅出。由于溶液均一稳定,因此不会影响溶液的溶质质量分数,故B不合题意。
7.(1)③②①④(2)7.5(3)42.5;50(4)搅拌,加速蔗精溶解(5)①②
【解析】(1)根据配制溶液的操作步骤分析;
(2)根据溶质质量=溶液质量×溶质质量分数分析;
(3)根据溶液质量=溶质质量+溶剂质量分析;
(4)根据溶解时玻璃棒的搅拌作用分析;
(5)根据溶质质量分数偏小可能是溶质偏小或溶剂偏多分析。
【解答】(1)配制溶液的操作步骤为计算、称量、溶解、装瓶,即顺序为③②①④;
(2)该实验中应称取蔗糖的质量是50克×15%=7.5g;
(3)该实验中应取用水的质量为50g-7.5g=42.5g,体积为42.5毫升,应选择50毫升规格的量筒;
(4)E为溶解,玻璃棒的作用是搅拌,加速蔗精溶解 ;
(5)①称量时砝码和蔗糖放反了,并且使用了游码,会使溶质质量偏小,使溶质质量分数偏小,正确;②取水时仰视读数,会使水的实际体积偏大,溶质质量分数偏小,正确;③溶解时有少量水溅出,会使溶质质量分数因溶剂偏小而偏大,错误;④装瓶时有溶液洒落不影响溶质质量分数大小,错误;
8.(1)这瓶浓硫酸溶液的质量为500毫升× 1.84克/厘米3 =920克,
该溶液中的溶质质量是920克 ×98%=901.6克;
(2)设需浓硫酸质量为x
1000克×19.6% =98%x
x=2000克,
则体积为200克 1.84克/厘米3 =108.7毫升,
需水的质量为1000克-200克=800克,体积为800毫升。
【解析】(1)根据溶质质量=溶液质量×溶质质量分数,溶液质量=溶液体积×密度分析;
(2)根据溶液稀释前后溶质质量不变及所加水的质量即为稀溶液质量-浓溶液质量分析。
9.(1)设40g水中最多溶解氯化钠的质量为x,
;
解得:x=14.4g;
因为10g<14.4g,所以得到氯化钠的不饱和溶液。
溶质质量分数为:.
(2)若欲使原溶液的溶质质量分数减少一半,需加水的质量为y,
;解得:y=50g。
(3)20℃时,10g氯化钠配制成饱和溶液时需要水的质量为z,
;解得:z≈27.8g;
则需要蒸发水的质量为:40g-27.8g=12.2g。
【解析】(1)根据溶解度计算出40g水中最多溶解氯化钠的质量,从而确定溶液是否包含,再计算溶质质量分数。
(2)根据溶质质量分数=列方程计算即可;
(3)根据溶解度计算出10g氯化钠配制成饱和溶液时需要水的质量,然后前后两个水的质量相减即可。
10.(1)1200g;(2)960g;(3)。
【解析】
(1)1000 毫升该二氧化氯消毒液的质量:m=ρV=1.2g/cm3×1000cm3=1200g;
(2)其中所含溶质的质量:1200g×80%=960g;
(3)设需要80%的消毒液的质量为x, 80%x=350kg×20%;x=87.5kg;
需要加水的质量:350kg-87.5kg=262.5kg;
需要加水的体积:。
11.(1)需要甲醛的质量为:100g×40%=40g。
(2)稀释为35%的溶液的质量为:,需要加入水的质量为:114.3g-100g=14.3g,需要加入水的体积为:。
同课章节目录
