2.2.1化学平衡状态 课件(共38张ppt)化学人教版(2019)选择性必修第一册
文档属性
| 名称 | 2.2.1化学平衡状态 课件(共38张ppt)化学人教版(2019)选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 00:00:00 | ||
图片预览







文档简介
(共38张PPT)
第二节 化学平衡
第1课时
第二章
化学反应速率与化学反应平衡
化学平衡状态的判定
2
化学平衡的状态
1
本节重点
本节难点
合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,原理如下:
如何提高生产效率呢?只要尽力提高化学反应速率生产效率就一定高吗?
2NH3
N2 + 3H2
催化剂
高温、高压
化学平衡状态
示例分析
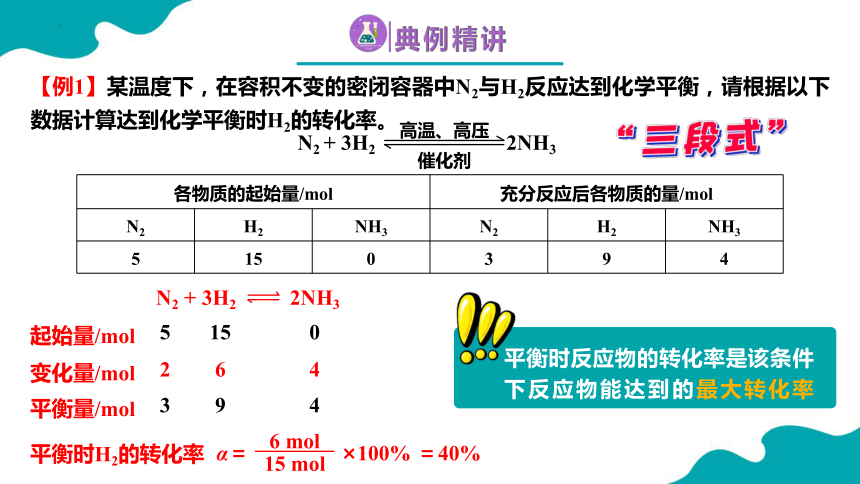
各物质的起始量/mol 充分反应后各物质的量/mol N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
某温度下,在容积不变的密闭容器中N2与H2反应足够长时间后各物质的量不再改变,数据如下:
2NH3
N2 + 3H2
催化剂
高温、高压
合成氨反应有限度,原料无法完全转化
只考虑化学反应速率不够,还需考虑如何尽可能多地将原料转化为产品
化学平衡状态
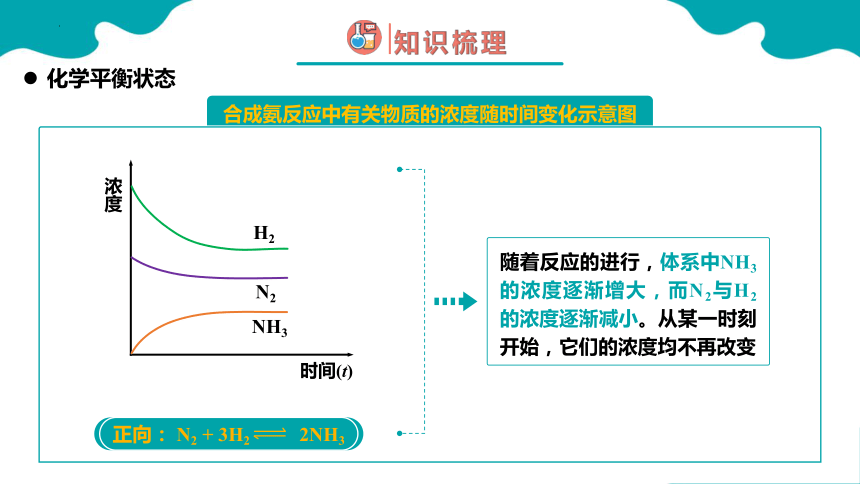
合成氨反应中有关物质的浓度随时间变化示意图
浓度
时间(t)
NH3
N2
H2
正向: N2 + 3H2 2NH3
随着反应的进行,体系中NH3的浓度逐渐增大,而N2与H2的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变
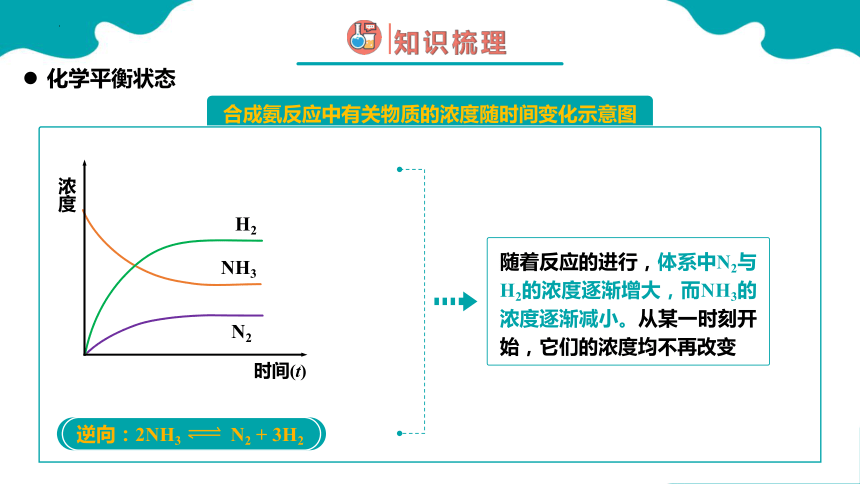
化学平衡状态
合成氨反应中有关物质的浓度随时间变化示意图
逆向:2NH3 N2 + 3H2
NH3
N2
H2
浓度
时间(t)
随着反应的进行,体系中N2与H2的浓度逐渐增大,而NH3的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变
任何可逆反应在一定条件下都存在反应的限度。达到限度时,反应就停止了吗?
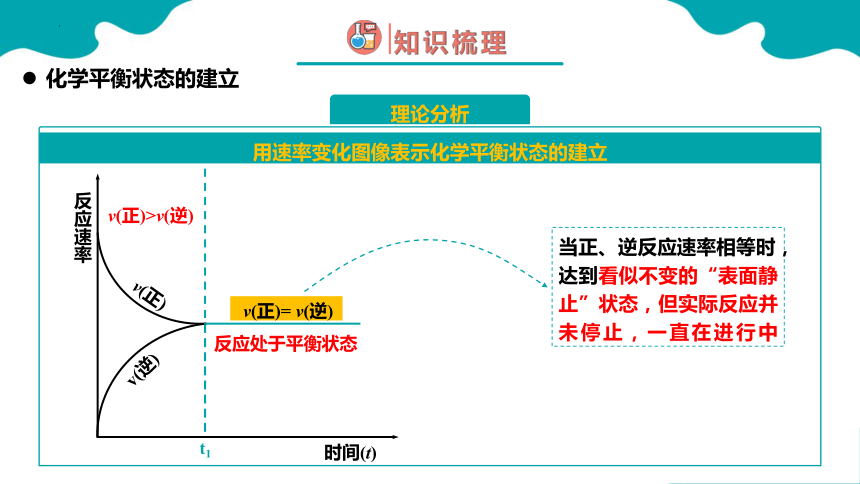
v(正)>v(逆)
化学平衡状态的建立
用速率变化图像表示化学平衡状态的建立
理论分析
v(正)
v(逆)
反应速率
时间(t)
反应处于平衡状态
t1
v(正)= v(逆)
当正、逆反应速率相等时,达到看似不变的“表面静止”状态,但实际反应并未停止,一直在进行中
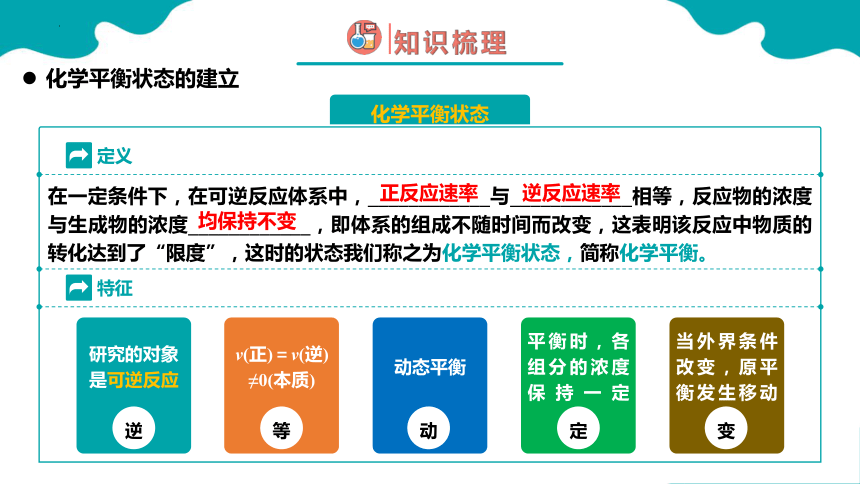
化学平衡状态
定义
在一定条件下,在可逆反应体系中,____________与____________相等,反应物的浓度与生成物的浓度____________,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。
正反应速率
逆反应速率
均保持不变
化学平衡状态的建立
特征
动态平衡
平衡时,各组分的浓度保持一定
当外界条件改变,原平衡发生移动
研究的对象是可逆反应
逆
v(正)=v(逆) ≠0(本质)
等
动
定
变
化学平衡状态是可逆反应的一种特殊状态,是在给定条件下化学反应所能达到或完成的最大程度。
转化率
(α)
=
转化的量
起始的量
×100%
量: 质量、物质的量、体积、物质的量浓度等
化学反应的限度
化学反应的限度决定了反应物在该条件下的最大转化率
同一可逆反应,改变条件可以在一定程度上改变一个化学反应的限度
各物质的起始量/mol 充分反应后各物质的量/mol N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
【例1】某温度下,在容积不变的密闭容器中N2与H2反应达到化学平衡,请根据以下数据计算达到化学平衡时H2的转化率。
2NH3
N2 + 3H2
催化剂
高温、高压
N2 + 3H2 2NH3
起始量/mol
变化量/mol
平衡量/mol
5
15
0
2
6
4
3
9
4
平衡时H2的转化率
α= ×100% =40%
6 mol
15 mol
平衡时反应物的转化率是该条件下反应物能达到的最大转化率
如何判断一个可逆的化学反应是否达到了化学平衡状态?
反应达到化学平衡的标志
a.同一物质的生成速率等于其消耗速率
直接标志——“正逆反应速率相等”
v正=v逆 > 0
c.在化学方程式同一边的不同物质,一种物质的生成速率与另一种物质的消耗速率之比等于化学计量数之比
b.在化学方程式两边的不同物质的生成(或消耗)速率之比等化学计量数之比
各组分的浓度保持一定
a.各组分的浓度不随时间的改变而改变
b.各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变
速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一物质的消耗速率和生成速率相等
3v(N2)=v(H2) ( )
状态01
2v正(N2) = v逆(NH3) ( )
状02
消耗 1 mol N2的同时,生成2 mol NH3 ( )
状态03
1 mol H-H键断裂的同时,2molN-H键断裂 ( )
状态04
单位时间内消耗的N2量是NH3量的两倍 ( )
状态05
【例1】 ,请根据所学:判断下列描述的反应状态是否达到平衡。
N2 + 3H2 2NH3
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
随反应进行一定改变的量有______________________当这些量不再变化时,反应达平衡。
浓度
(反应物\生成物)
物质的量
(反应物\生成物)
质量
(固体/液体)
颜色
(有色物质)
转化率
(α反)
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体的p总、V总、n总
(pV=nRT)
左=右:_____________
看气体
左右系数和
左≠右:_____________
例如:N2 + 3H2 2NH3
4
3
>
变量
定量
例如:反应2HI H2+I2
2
2
=
气体的n总不变时
恒温恒容 密闭容器,p总不变时
恒温恒压 密闭容器,V总不变时
【例1】判断下列描述的反应状态是否达到平衡。
A(g) + B(g) C(g)
左=右
左≠右
A(s) + B(g) C(g)
变量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体体积分数/物质的量分数
(pV=nRT)
φ(B) =
nB
n总
φ(B)不变时
A(g) + B(g) 2C(g)
φ(B) =
nB
n总
φ(B) =
1
2
定量
变量
定量
A(s) B(g) + C(g)
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
反应式 M(平均)不变时
NH2COONH4(s) 2NH3(g) + CO2(g)
2
3
1
3
M=
×17+ ×44
2
3
1
3
定量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
反应式 M(平均)不变时
2SO2(g)+O2(g) 2SO3(g)
M=
m总
n总
变量
定量
左≠右:_____________
n总为变量
变量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
反应式 M(平均)不变时
M=
m总
n总
变量
定量
左=右:_____________
n总为定量
变量
2A(g)+ B(s) 2C(g)
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
反应式 M(平均)不变时
H2(g)+I2(g) 2HI(g)
M=
m总
n总
定量
定量
定量
左=右:_____________
n总为定量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
看系数
看状态
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体密度
ρ=
m总
V
看系数
看状态
反应式 恒温 恒容 密闭容器,ρ不变时
2SO2(g)+O2(g) 2SO3(g)
ρ=
m总
V
定量
恒容时,不用考虑系数
定量
定量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体密度
ρ=
m总
V
看系数
看状态
反应式 恒温 恒容 密闭容器,ρ不变时
ρ=
m总
V
定量
变量
变量
Ni(s) + 4CO(g) Ni(CO)4(g)
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体密度
ρ=
m总
V
看系数
看状态
反应式 恒温 恒压 密闭容器,ρ不变时
2SO2(g)+O2(g) 2SO3(g)
pV=nRT
pM=ρRT
M∝ρ
ρ=
m总
V
M=
m总
n总
变量
定量
变量
左≠右:_____________
n总为变量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体密度
ρ=
m总
V
看系数
看状态
反应式 恒温 恒压 密闭容器,ρ不变时
Ni(s) + 4CO(g) Ni(CO)4(g)
M=
m总
n总
变量
变量
变量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
归纳总结
φ(B) =
nB
n总
ρ=
m总
V
M=
m总
n总
看系数
看状态
恒压
恒容→m总
pV=nRT
反应达到化学平衡的标志
其他条件
示例:判断下列描述的应状态是否达到平衡。
,当n(SO2):n(O2):n(SO3)=2:1:2时( )
2SO2(g)+O2(g) 2SO3(g)
状态01
绝热体系下, ,体系温度不变时( )
2SO2(g)+O2(g) 2SO3(g)
状态02
不和外界发生热量交换
变温
变量
变量不变,反应达到平衡
【例1】可逆反应2NO2(g) 2NO(g)+O2(g)在恒容密闭容器中进行:
①单位时间内生成n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
可说明该反应达到化学平衡状态的是__________。
①④⑥⑦
合成氨工业之父——卡尔·博施
1874年,卡尔·博施生于德国科隆。24岁时毕业于莱比锡大学,获有机化学博士学位。1908年~1913年,卡尔·博施改进哈伯首创的高压合成氨催化方法,利用氧化铁型催化剂,使合成氨生产工业化,化学上称为"哈伯——博施法"。1940年,因找到合适的催化剂,使合成氨反应成为工业化,也因此获得诺贝尔化学奖。
1.下列关于化学平衡的说法中,不正确的是( )
A.当可逆反应达到平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡破坏
D.当可逆反应达到平衡时,尽管正、逆反应都还在进行,但各物质的浓度保持不变
A
2.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A(g)+3B(g) 2C(g)。若维持温度和压强不变,当达到平衡时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是( )
①原混合气体的体积为1.2V L
②原混合气体的体积为1.1V L
③反应达到平衡时气体A消耗掉0.05V L
④反应达到平衡时气体B消耗掉0.05V L
A.②③ B.②④C.①③ D.①④
A
3.在一定温度下的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2∶1∶1
⑤单位时间内生成n mol C,同时生成n mol D
⑥单位时间内生成n mol D,同时生成2n mol A
A.①②⑤ B.②③⑤
C.②③⑥ D.①③⑥
C
4.在一个绝热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g) pC(g)+qD(s),当m、n、p、q为任意整数时,一定可以作为反应达到平衡状态的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③体系的密度不再变化
④各组分质量分数不再改变
A.①②③
B.①②③④
C.②③④
D.③④
C
5.在698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g) 2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
(1)V=__________ L。
(2)该反应达到最大限度的时间是________,
该时间内平均反应速率v(HI)=________________。
(3)该反应达到平衡状态时,________(填“吸收”或“放出”)的热量为__________。
2
5 s
0.316 mol·L-1·s-1
放出
41.87 kJ
直接标志——“正逆反应速率相等”
间接标志——“变量不变”
第二节
化学平衡
第1课时
化学平衡的状态
化学平衡状态的判定
定义
特征
THANKS
谢谢聆听
第二节 化学平衡
第1课时
第二章
化学反应速率与化学反应平衡
化学平衡状态的判定
2
化学平衡的状态
1
本节重点
本节难点
合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,原理如下:
如何提高生产效率呢?只要尽力提高化学反应速率生产效率就一定高吗?
2NH3
N2 + 3H2
催化剂
高温、高压
化学平衡状态
示例分析
各物质的起始量/mol 充分反应后各物质的量/mol N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
某温度下,在容积不变的密闭容器中N2与H2反应足够长时间后各物质的量不再改变,数据如下:
2NH3
N2 + 3H2
催化剂
高温、高压
合成氨反应有限度,原料无法完全转化
只考虑化学反应速率不够,还需考虑如何尽可能多地将原料转化为产品
化学平衡状态
合成氨反应中有关物质的浓度随时间变化示意图
浓度
时间(t)
NH3
N2
H2
正向: N2 + 3H2 2NH3
随着反应的进行,体系中NH3的浓度逐渐增大,而N2与H2的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变
化学平衡状态
合成氨反应中有关物质的浓度随时间变化示意图
逆向:2NH3 N2 + 3H2
NH3
N2
H2
浓度
时间(t)
随着反应的进行,体系中N2与H2的浓度逐渐增大,而NH3的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变
任何可逆反应在一定条件下都存在反应的限度。达到限度时,反应就停止了吗?
v(正)>v(逆)
化学平衡状态的建立
用速率变化图像表示化学平衡状态的建立
理论分析
v(正)
v(逆)
反应速率
时间(t)
反应处于平衡状态
t1
v(正)= v(逆)
当正、逆反应速率相等时,达到看似不变的“表面静止”状态,但实际反应并未停止,一直在进行中
化学平衡状态
定义
在一定条件下,在可逆反应体系中,____________与____________相等,反应物的浓度与生成物的浓度____________,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。
正反应速率
逆反应速率
均保持不变
化学平衡状态的建立
特征
动态平衡
平衡时,各组分的浓度保持一定
当外界条件改变,原平衡发生移动
研究的对象是可逆反应
逆
v(正)=v(逆) ≠0(本质)
等
动
定
变
化学平衡状态是可逆反应的一种特殊状态,是在给定条件下化学反应所能达到或完成的最大程度。
转化率
(α)
=
转化的量
起始的量
×100%
量: 质量、物质的量、体积、物质的量浓度等
化学反应的限度
化学反应的限度决定了反应物在该条件下的最大转化率
同一可逆反应,改变条件可以在一定程度上改变一个化学反应的限度
各物质的起始量/mol 充分反应后各物质的量/mol N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
【例1】某温度下,在容积不变的密闭容器中N2与H2反应达到化学平衡,请根据以下数据计算达到化学平衡时H2的转化率。
2NH3
N2 + 3H2
催化剂
高温、高压
N2 + 3H2 2NH3
起始量/mol
变化量/mol
平衡量/mol
5
15
0
2
6
4
3
9
4
平衡时H2的转化率
α= ×100% =40%
6 mol
15 mol
平衡时反应物的转化率是该条件下反应物能达到的最大转化率
如何判断一个可逆的化学反应是否达到了化学平衡状态?
反应达到化学平衡的标志
a.同一物质的生成速率等于其消耗速率
直接标志——“正逆反应速率相等”
v正=v逆 > 0
c.在化学方程式同一边的不同物质,一种物质的生成速率与另一种物质的消耗速率之比等于化学计量数之比
b.在化学方程式两边的不同物质的生成(或消耗)速率之比等化学计量数之比
各组分的浓度保持一定
a.各组分的浓度不随时间的改变而改变
b.各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变
速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一物质的消耗速率和生成速率相等
3v(N2)=v(H2) ( )
状态01
2v正(N2) = v逆(NH3) ( )
状02
消耗 1 mol N2的同时,生成2 mol NH3 ( )
状态03
1 mol H-H键断裂的同时,2molN-H键断裂 ( )
状态04
单位时间内消耗的N2量是NH3量的两倍 ( )
状态05
【例1】 ,请根据所学:判断下列描述的反应状态是否达到平衡。
N2 + 3H2 2NH3
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
随反应进行一定改变的量有______________________当这些量不再变化时,反应达平衡。
浓度
(反应物\生成物)
物质的量
(反应物\生成物)
质量
(固体/液体)
颜色
(有色物质)
转化率
(α反)
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体的p总、V总、n总
(pV=nRT)
左=右:_____________
看气体
左右系数和
左≠右:_____________
例如:N2 + 3H2 2NH3
4
3
>
变量
定量
例如:反应2HI H2+I2
2
2
=
气体的n总不变时
恒温恒容 密闭容器,p总不变时
恒温恒压 密闭容器,V总不变时
【例1】判断下列描述的反应状态是否达到平衡。
A(g) + B(g) C(g)
左=右
左≠右
A(s) + B(g) C(g)
变量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体体积分数/物质的量分数
(pV=nRT)
φ(B) =
nB
n总
φ(B)不变时
A(g) + B(g) 2C(g)
φ(B) =
nB
n总
φ(B) =
1
2
定量
变量
定量
A(s) B(g) + C(g)
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
反应式 M(平均)不变时
NH2COONH4(s) 2NH3(g) + CO2(g)
2
3
1
3
M=
×17+ ×44
2
3
1
3
定量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
反应式 M(平均)不变时
2SO2(g)+O2(g) 2SO3(g)
M=
m总
n总
变量
定量
左≠右:_____________
n总为变量
变量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
反应式 M(平均)不变时
M=
m总
n总
变量
定量
左=右:_____________
n总为定量
变量
2A(g)+ B(s) 2C(g)
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
反应式 M(平均)不变时
H2(g)+I2(g) 2HI(g)
M=
m总
n总
定量
定量
定量
左=右:_____________
n总为定量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体平均相对分子质量
M=
m总
n总
看系数
看状态
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体密度
ρ=
m总
V
看系数
看状态
反应式 恒温 恒容 密闭容器,ρ不变时
2SO2(g)+O2(g) 2SO3(g)
ρ=
m总
V
定量
恒容时,不用考虑系数
定量
定量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体密度
ρ=
m总
V
看系数
看状态
反应式 恒温 恒容 密闭容器,ρ不变时
ρ=
m总
V
定量
变量
变量
Ni(s) + 4CO(g) Ni(CO)4(g)
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体密度
ρ=
m总
V
看系数
看状态
反应式 恒温 恒压 密闭容器,ρ不变时
2SO2(g)+O2(g) 2SO3(g)
pV=nRT
pM=ρRT
M∝ρ
ρ=
m总
V
M=
m总
n总
变量
定量
变量
左≠右:_____________
n总为变量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
气体密度
ρ=
m总
V
看系数
看状态
反应式 恒温 恒压 密闭容器,ρ不变时
Ni(s) + 4CO(g) Ni(CO)4(g)
M=
m总
n总
变量
变量
变量
反应达到化学平衡的标志
间接标志——“变量不变”
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据
归纳总结
φ(B) =
nB
n总
ρ=
m总
V
M=
m总
n总
看系数
看状态
恒压
恒容→m总
pV=nRT
反应达到化学平衡的标志
其他条件
示例:判断下列描述的应状态是否达到平衡。
,当n(SO2):n(O2):n(SO3)=2:1:2时( )
2SO2(g)+O2(g) 2SO3(g)
状态01
绝热体系下, ,体系温度不变时( )
2SO2(g)+O2(g) 2SO3(g)
状态02
不和外界发生热量交换
变温
变量
变量不变,反应达到平衡
【例1】可逆反应2NO2(g) 2NO(g)+O2(g)在恒容密闭容器中进行:
①单位时间内生成n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
可说明该反应达到化学平衡状态的是__________。
①④⑥⑦
合成氨工业之父——卡尔·博施
1874年,卡尔·博施生于德国科隆。24岁时毕业于莱比锡大学,获有机化学博士学位。1908年~1913年,卡尔·博施改进哈伯首创的高压合成氨催化方法,利用氧化铁型催化剂,使合成氨生产工业化,化学上称为"哈伯——博施法"。1940年,因找到合适的催化剂,使合成氨反应成为工业化,也因此获得诺贝尔化学奖。
1.下列关于化学平衡的说法中,不正确的是( )
A.当可逆反应达到平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡破坏
D.当可逆反应达到平衡时,尽管正、逆反应都还在进行,但各物质的浓度保持不变
A
2.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A(g)+3B(g) 2C(g)。若维持温度和压强不变,当达到平衡时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是( )
①原混合气体的体积为1.2V L
②原混合气体的体积为1.1V L
③反应达到平衡时气体A消耗掉0.05V L
④反应达到平衡时气体B消耗掉0.05V L
A.②③ B.②④C.①③ D.①④
A
3.在一定温度下的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2∶1∶1
⑤单位时间内生成n mol C,同时生成n mol D
⑥单位时间内生成n mol D,同时生成2n mol A
A.①②⑤ B.②③⑤
C.②③⑥ D.①③⑥
C
4.在一个绝热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g) pC(g)+qD(s),当m、n、p、q为任意整数时,一定可以作为反应达到平衡状态的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③体系的密度不再变化
④各组分质量分数不再改变
A.①②③
B.①②③④
C.②③④
D.③④
C
5.在698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g) 2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
(1)V=__________ L。
(2)该反应达到最大限度的时间是________,
该时间内平均反应速率v(HI)=________________。
(3)该反应达到平衡状态时,________(填“吸收”或“放出”)的热量为__________。
2
5 s
0.316 mol·L-1·s-1
放出
41.87 kJ
直接标志——“正逆反应速率相等”
间接标志——“变量不变”
第二节
化学平衡
第1课时
化学平衡的状态
化学平衡状态的判定
定义
特征
THANKS
谢谢聆听
