2.2.4影响化学平衡因素 课件(共34张ppt)化学人教版(2019)选择性必修第一册
文档属性
| 名称 | 2.2.4影响化学平衡因素 课件(共34张ppt)化学人教版(2019)选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 00:00:00 | ||
图片预览











文档简介
(共34张PPT)
第二节 化学平衡
第4课时
第二章
化学反应速率与化学反应平衡
化学平衡的图像
2
影响化学平衡的因素(温度、催化剂)
1
本节重点
本节难点
温度如何影响化学平衡呢?
实验 浸泡在热水中 浸泡在冰水中
现象 颜色加深 颜色变浅
移动方向
结论
影响化学平衡的因素
探究四 研究温度对化学平衡的影响
实验现象
向逆反应方向移动
向正反应方向移动
H =-56.9 kJ/mol
2NO2(g) N2O4(g)
其他条件不变时,升高温度,化学平衡向吸热反应方向移动
其他条件不变时,降低温度,化学平衡向放热反应方向移动
请思考:当温度变化时,此时正、逆反应速率如何变化?
温度
改变
图像
速率
变化
升高温度
热效应
正反应放热
正反应放热
正反应吸热
正反应吸热
降低温度
升高温度
降低温度
v(正)、v(逆)均增大, 且v'(逆)> v'(正)
v(正)、v(逆)均增大,且v'(正) > v'(逆)
v(正)、v(逆)均减小,且v'(正) > v'(逆)
v(正)、v(逆)均减小,且v'(逆) > v'(正)
v(正)
v(逆)
v
t
v'(正)
v'(逆)
v(正)
v(逆)
v
t
v'(逆)
v'(正)
v(正)
v(逆)
v
t
v(正)
v(逆)
v
t
v'(逆)
v'(正)
v'(正)
v'(逆)
影响化学平衡的因素
归纳总结
改变的外界条件(其他条件不变) 化学平衡移动的方向
浓度 增大反应物浓度或减小生成物浓度 向正反应方向移动
减小反应物浓度或增大生成物浓度 向逆反应方向移动
压强 (有气体参加的反应) 反应前后气 体体积改变 增大压强(减小容器的容积) 向气体分子总数减小的方向移动
减小压强(增大容器的容积) 向气体分子总数增大的方向移动
反应前后气体体积不变 改变压强 平衡不移动
温度 升高温度 向吸热反应方向移动
降低温度 向放热反应方向移动
催化剂 同等程度地改变v正、v逆,平衡不移动 催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间。
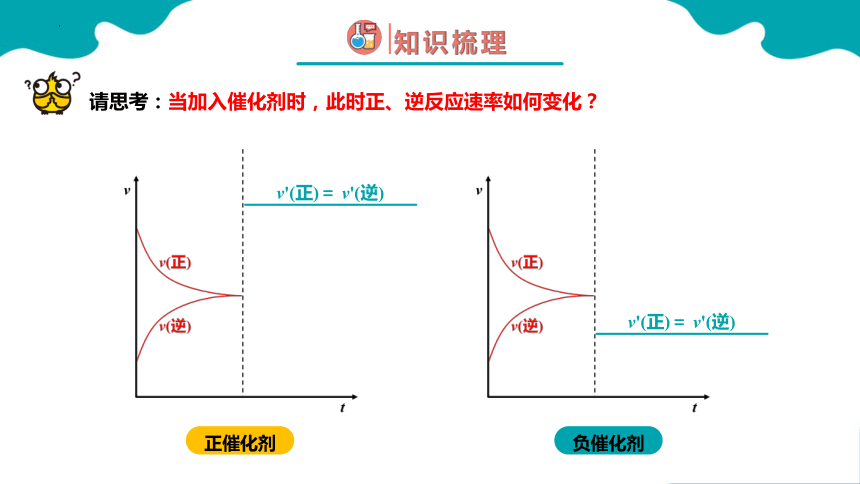
加入催化剂会使化学平衡发生移动吗?
请思考:当加入催化剂时,此时正、逆反应速率如何变化?
v'(正)= v'(逆)
v'(正)= v'(逆)
正催化剂
负催化剂
综上所述,改变浓度、压强、温度等因素可以提高反应产率或者抑制反应进行的程度。法国化学家勒夏特列( H.-L. Le Chatelier, 1850—1936)曾就此总结出一条经验规律:
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方向移动
(化学平衡移动原理)
勒夏特列原理
【例1】下列事实不能用勒夏特列原理解释的是( )
A.溴水中有化学平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.工业合成氨反应为放热反应,为提高氨的产率,理论上应采取降低温度的措施
C.恒容密闭容器中,发生反应CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达到平衡后,缩小容器容积可使体系颜色变深
D
化学平衡的图像
解题方法
联想外界条件的改变对化学反应速率和化学平衡的影响规律
找规律
根据图像中表现的关系与所学规律,作出符合题目要求的判断
作判断
一看面(即纵坐标与横坐标的意义)
二看线(即线的走向和变化趋势)
三看点(即起点、折点、交点、终点)
四看辅助线(如等温线、等压线、平衡线等)
五看量的变化(如浓度变化、温度变化等)
看图像
化学平衡的图像
化学平衡图像的类型
速率—时间图像(v-t图像)
v(正)
v(逆)
v
t
v'(正)
v'(逆)
Ⅰ
v(正)
v(逆)
v
t
v'(逆)
v'(正)
Ⅱ
v(正)
v(逆)
v
t
v'(正)= v'(逆)
Ⅲ
请思考:上述正、逆反应速率的变化是什么因素影响的?
v'正突变
化学平衡的图像
化学平衡图像的类型
速率—时间图像(v-t图像)
v(正)
v(逆)
v
t
v'(正)
v'(逆)
Ⅰ
v'逆渐变
说明影响因素是增大了反应物的浓度,使v'正突变,v'正>v'逆,则平衡正向移动
化学平衡的图像
化学平衡图像的类型
速率—时间图像(v-t图像)
v(正)
v(逆)
v
t
v'(逆)
v'(正)
Ⅱ
v'正突变
v'逆突变
说明影响因素是降低压强或降低温度, v'正、v'逆都是突然减小且v'正>v'逆,说明平衡正向移动
该反应的正反应可能是放热反应或气体总体积增大的反应
化学平衡的图像
化学平衡图像的类型
速率—时间图像(v-t图像)
v(正)
v(逆)
v
t
v'(正)= v'(逆)
Ⅲ
v'正、v'逆突然增大且增大程度相同,化学平衡没有发生移动
说明影响因素是可能是使用催化剂,也可能是反应前后气体总体积不发生变化的反应压缩体积(增大压强)所致
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
t
Ⅰ
t
Ⅱ
t
Ⅲ
生成物的百分含量
反应物的转化率
生成物的百分含量
T1
T2
p1
p2
a
b
观察上图,你能得到哪些信息?
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
t
生成物的百分含量
T1
T2
t
Ⅱ
反应物的转化率
p1
p2
t
Ⅲ
生成物的百分含量
a
b
Ⅰ
化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较
高(如图Ⅰ中T2>T1)、压强较大(如图Ⅱ中p2>p1)或使用了催化剂(如图Ⅲ中a可能使用了催化剂)
(T2>T1)
(p2>p1)
(a可能使用催化剂)
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
Ⅰ
t
生成物的百分含量
T1
T2
t
Ⅱ
反应物的转化率
p1
p2
t
Ⅲ
生成物的百分含量
a
b
(T2>T1)
(p2>p1)
(a可能使用催化剂)
先拐先平数值大
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
Ⅰ
t
生成物的百分含量
T1
T2
(T2>T1)
升温对应生成物的百分含量降低
说明:正反应是放热反应,升高温度,平衡逆向移动
加压对应反应物的转化率减小
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
t
Ⅱ
反应物的转化率
p1
p2
(p2>p1)
说明:正反应是气体总体积增大的反应,增大压强,平衡逆向移动
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
t
Ⅲ
生成物的百分含量
a
b
生成物C的百分含量不变
说明:平衡不发生移动,但反应速率a>b,故可能是a使用了催化剂;也可能该反应是反应前后气体总体积不变的可逆反应,a增大了压强(减小容器的容积)
化学平衡的图像
化学平衡图像的类型
百分含量—压强—温度图像
Ⅰ
T
生成物的百分含量
107 Pa
105 Pa
Ⅱ
p
生成物的百分含量
400 ℃
500 ℃
化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个变量,分析方法是确定其中一个变量,讨论另外两个变量之间的关系
(定一议二)
等温线
化学平衡的图像
化学平衡图像的类型
百分含量—压强—温度图像
Ⅰ
T
生成物的百分含量
107 Pa
105 Pa
若确定压强为105 Pa或107 Pa,则生成物C的百分含量随温度T的升高而逐渐减小,说明正反应是放热反应
若确定温度T不变,作横坐标的垂线,与两个压强曲线出现交点,分析生成物C的百分含量随压强p的变化可以发现,增大压强,生成物C的百分含量增大,说明正反应是气体总体积减小的反应
等压线
化学平衡的图像
化学平衡图像的类型
百分含量—压强—温度图像
Ⅱ
p
生成物的百分含量
400 ℃
500 ℃
等压线
等温线
若确定温度为400 ℃或500 ℃,则生成物的百分含量随压强p的增大而逐渐减小,说明正反应是气体总体积增大的反应
若确定压强p不变,作横坐标的垂线,与两个温度曲线出现交点,分析生成物C的百分含量随压强p的变化可以发现,升高温度,生成物的百分含量降低,说明正反应是放热反应
【例1】硝酸厂常用催化还原法处理尾气,CH4在催化剂作用下可以将NO2还原为N2,反应原理为CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(l) ΔH<0,NO2(g)的平衡转化率[α(NO2)]随温度、压强变化如图所示(X、Y代表温度或压强)。下列说法错误的是( )
A. X代表压强
B.Y1C. 平衡常数:Ka>Kc
D. 适当降低温度,NO2的平衡转化率增大
A
该反应是气体总体积减小的放热反应,升高温度,平衡逆向移动,NO2的平衡转化率减小;增大压强,平衡正向移动,NO2的平衡转化率增大。由图可知,X增大,NO2的平衡转化率减小,则X代表温度、Y代表压强,A错误;
在温度相同时,NO2的平衡转化率Y1该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故平衡常数Ka>Kc,C正确;
该反应为放热反应,降低温度,平衡正向移动,NO2的平衡转化率增大,D正确。
热力学第一定律是涉及热现象领域内的能量守恒和转化定律,反映了不同形式的能量在传递与转换过程中守恒。表述为:物体内能的增加等于物体吸收的热量和对物体所作的功的总和。即热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。其推广和本质就是著名的能量守恒定律。
热力学第一定律
尤利乌斯·罗伯特·迈尔
詹姆斯·普雷斯科特·焦耳
1.已知:A(g)+3B(g) 2C(g) ΔH<0。该反应在恒容密闭容器中进行,达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.容器中混合气体的平均相对分子质量减小
B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.正反应速率和逆反应速率都减小,C的质量分数增加
D.混合气体密度的变化情况可以作为判断反应是否再次达平衡的依据
C
2.在某密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),反应体系在平衡状态时SO3的质量分数与温度的关系如图所示。下列说法正确的是( )
A.D点:v正B.反应2SO2(g)+O2(g) 2SO3(g)的ΔH>0
C.若B、C点的平衡常数分别为KB、KC,则KB=KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
D
3.已知反应:2NO2(g) N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡皮管,把A烧瓶放入热水里,把B烧瓶放入冰水里,如图所示(省略夹持装置)。与常温时烧瓶内气体的颜色进行对比,发现A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是( )
A.把A烧瓶放入热水中,A烧瓶内正、逆反应速率均加快
B.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C.上述过程中,A、B烧瓶内气体密度均保持不变
D.2NO2(g) N2O4(g)的逆反应为放热反应
D
4.下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.2SO2(g)+O2(g) 2SO3(g),高压比常压有利于合成SO3
C.工业制取金属钾:Na(l)+KCl(l) NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
D.加入催化剂有利于氨的合成
D
5.丙烷氧化脱氢法制备丙烯的主要反应如下:
C3H8(g)+O2(g) C3H6(g)+H2O(g) ΔH=-118 kJ·mol-1。
在催化剂作用下,丙烷氧化脱氢除生成丙烯外,还生成CO、CO2等物质。丙烷的转化率和丙烯的产率随温度变化关系如图所示。
(1)图中丙烷的转化率随温度升高而增大的原因可能是 。
(2)575 ℃时,丙烯的选择性为 。(丙烯的选择性=×100%)
(3)基于本研究结果,能提高丙烯选择性的措施是 。
选择相对较低的温度
温度升高,反应速率加快(或催化剂的活性增强)
51.5%
第二节
化学平衡
第4课时
化学平衡的图像
影响化学平衡的因素
解题方法
温度
化学平衡图像的类型
催化剂
1.其他条件不变时,升高温度,化学平衡向吸热反应方向移动
2.其他条件不变时,降低温度,化学平衡向放热反应方向移动
催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间
THANKS
谢谢聆听
第二节 化学平衡
第4课时
第二章
化学反应速率与化学反应平衡
化学平衡的图像
2
影响化学平衡的因素(温度、催化剂)
1
本节重点
本节难点
温度如何影响化学平衡呢?
实验 浸泡在热水中 浸泡在冰水中
现象 颜色加深 颜色变浅
移动方向
结论
影响化学平衡的因素
探究四 研究温度对化学平衡的影响
实验现象
向逆反应方向移动
向正反应方向移动
H =-56.9 kJ/mol
2NO2(g) N2O4(g)
其他条件不变时,升高温度,化学平衡向吸热反应方向移动
其他条件不变时,降低温度,化学平衡向放热反应方向移动
请思考:当温度变化时,此时正、逆反应速率如何变化?
温度
改变
图像
速率
变化
升高温度
热效应
正反应放热
正反应放热
正反应吸热
正反应吸热
降低温度
升高温度
降低温度
v(正)、v(逆)均增大, 且v'(逆)> v'(正)
v(正)、v(逆)均增大,且v'(正) > v'(逆)
v(正)、v(逆)均减小,且v'(正) > v'(逆)
v(正)、v(逆)均减小,且v'(逆) > v'(正)
v(正)
v(逆)
v
t
v'(正)
v'(逆)
v(正)
v(逆)
v
t
v'(逆)
v'(正)
v(正)
v(逆)
v
t
v(正)
v(逆)
v
t
v'(逆)
v'(正)
v'(正)
v'(逆)
影响化学平衡的因素
归纳总结
改变的外界条件(其他条件不变) 化学平衡移动的方向
浓度 增大反应物浓度或减小生成物浓度 向正反应方向移动
减小反应物浓度或增大生成物浓度 向逆反应方向移动
压强 (有气体参加的反应) 反应前后气 体体积改变 增大压强(减小容器的容积) 向气体分子总数减小的方向移动
减小压强(增大容器的容积) 向气体分子总数增大的方向移动
反应前后气体体积不变 改变压强 平衡不移动
温度 升高温度 向吸热反应方向移动
降低温度 向放热反应方向移动
催化剂 同等程度地改变v正、v逆,平衡不移动 催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间。
加入催化剂会使化学平衡发生移动吗?
请思考:当加入催化剂时,此时正、逆反应速率如何变化?
v'(正)= v'(逆)
v'(正)= v'(逆)
正催化剂
负催化剂
综上所述,改变浓度、压强、温度等因素可以提高反应产率或者抑制反应进行的程度。法国化学家勒夏特列( H.-L. Le Chatelier, 1850—1936)曾就此总结出一条经验规律:
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方向移动
(化学平衡移动原理)
勒夏特列原理
【例1】下列事实不能用勒夏特列原理解释的是( )
A.溴水中有化学平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.工业合成氨反应为放热反应,为提高氨的产率,理论上应采取降低温度的措施
C.恒容密闭容器中,发生反应CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达到平衡后,缩小容器容积可使体系颜色变深
D
化学平衡的图像
解题方法
联想外界条件的改变对化学反应速率和化学平衡的影响规律
找规律
根据图像中表现的关系与所学规律,作出符合题目要求的判断
作判断
一看面(即纵坐标与横坐标的意义)
二看线(即线的走向和变化趋势)
三看点(即起点、折点、交点、终点)
四看辅助线(如等温线、等压线、平衡线等)
五看量的变化(如浓度变化、温度变化等)
看图像
化学平衡的图像
化学平衡图像的类型
速率—时间图像(v-t图像)
v(正)
v(逆)
v
t
v'(正)
v'(逆)
Ⅰ
v(正)
v(逆)
v
t
v'(逆)
v'(正)
Ⅱ
v(正)
v(逆)
v
t
v'(正)= v'(逆)
Ⅲ
请思考:上述正、逆反应速率的变化是什么因素影响的?
v'正突变
化学平衡的图像
化学平衡图像的类型
速率—时间图像(v-t图像)
v(正)
v(逆)
v
t
v'(正)
v'(逆)
Ⅰ
v'逆渐变
说明影响因素是增大了反应物的浓度,使v'正突变,v'正>v'逆,则平衡正向移动
化学平衡的图像
化学平衡图像的类型
速率—时间图像(v-t图像)
v(正)
v(逆)
v
t
v'(逆)
v'(正)
Ⅱ
v'正突变
v'逆突变
说明影响因素是降低压强或降低温度, v'正、v'逆都是突然减小且v'正>v'逆,说明平衡正向移动
该反应的正反应可能是放热反应或气体总体积增大的反应
化学平衡的图像
化学平衡图像的类型
速率—时间图像(v-t图像)
v(正)
v(逆)
v
t
v'(正)= v'(逆)
Ⅲ
v'正、v'逆突然增大且增大程度相同,化学平衡没有发生移动
说明影响因素是可能是使用催化剂,也可能是反应前后气体总体积不发生变化的反应压缩体积(增大压强)所致
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
t
Ⅰ
t
Ⅱ
t
Ⅲ
生成物的百分含量
反应物的转化率
生成物的百分含量
T1
T2
p1
p2
a
b
观察上图,你能得到哪些信息?
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
t
生成物的百分含量
T1
T2
t
Ⅱ
反应物的转化率
p1
p2
t
Ⅲ
生成物的百分含量
a
b
Ⅰ
化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较
高(如图Ⅰ中T2>T1)、压强较大(如图Ⅱ中p2>p1)或使用了催化剂(如图Ⅲ中a可能使用了催化剂)
(T2>T1)
(p2>p1)
(a可能使用催化剂)
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
Ⅰ
t
生成物的百分含量
T1
T2
t
Ⅱ
反应物的转化率
p1
p2
t
Ⅲ
生成物的百分含量
a
b
(T2>T1)
(p2>p1)
(a可能使用催化剂)
先拐先平数值大
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
Ⅰ
t
生成物的百分含量
T1
T2
(T2>T1)
升温对应生成物的百分含量降低
说明:正反应是放热反应,升高温度,平衡逆向移动
加压对应反应物的转化率减小
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
t
Ⅱ
反应物的转化率
p1
p2
(p2>p1)
说明:正反应是气体总体积增大的反应,增大压强,平衡逆向移动
化学平衡的图像
化学平衡图像的类型
·
百分含量(或转化率)—时间—温度(或压强)图像
t
Ⅲ
生成物的百分含量
a
b
生成物C的百分含量不变
说明:平衡不发生移动,但反应速率a>b,故可能是a使用了催化剂;也可能该反应是反应前后气体总体积不变的可逆反应,a增大了压强(减小容器的容积)
化学平衡的图像
化学平衡图像的类型
百分含量—压强—温度图像
Ⅰ
T
生成物的百分含量
107 Pa
105 Pa
Ⅱ
p
生成物的百分含量
400 ℃
500 ℃
化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个变量,分析方法是确定其中一个变量,讨论另外两个变量之间的关系
(定一议二)
等温线
化学平衡的图像
化学平衡图像的类型
百分含量—压强—温度图像
Ⅰ
T
生成物的百分含量
107 Pa
105 Pa
若确定压强为105 Pa或107 Pa,则生成物C的百分含量随温度T的升高而逐渐减小,说明正反应是放热反应
若确定温度T不变,作横坐标的垂线,与两个压强曲线出现交点,分析生成物C的百分含量随压强p的变化可以发现,增大压强,生成物C的百分含量增大,说明正反应是气体总体积减小的反应
等压线
化学平衡的图像
化学平衡图像的类型
百分含量—压强—温度图像
Ⅱ
p
生成物的百分含量
400 ℃
500 ℃
等压线
等温线
若确定温度为400 ℃或500 ℃,则生成物的百分含量随压强p的增大而逐渐减小,说明正反应是气体总体积增大的反应
若确定压强p不变,作横坐标的垂线,与两个温度曲线出现交点,分析生成物C的百分含量随压强p的变化可以发现,升高温度,生成物的百分含量降低,说明正反应是放热反应
【例1】硝酸厂常用催化还原法处理尾气,CH4在催化剂作用下可以将NO2还原为N2,反应原理为CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(l) ΔH<0,NO2(g)的平衡转化率[α(NO2)]随温度、压强变化如图所示(X、Y代表温度或压强)。下列说法错误的是( )
A. X代表压强
B.Y1
D. 适当降低温度,NO2的平衡转化率增大
A
该反应是气体总体积减小的放热反应,升高温度,平衡逆向移动,NO2的平衡转化率减小;增大压强,平衡正向移动,NO2的平衡转化率增大。由图可知,X增大,NO2的平衡转化率减小,则X代表温度、Y代表压强,A错误;
在温度相同时,NO2的平衡转化率Y1
该反应为放热反应,降低温度,平衡正向移动,NO2的平衡转化率增大,D正确。
热力学第一定律是涉及热现象领域内的能量守恒和转化定律,反映了不同形式的能量在传递与转换过程中守恒。表述为:物体内能的增加等于物体吸收的热量和对物体所作的功的总和。即热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。其推广和本质就是著名的能量守恒定律。
热力学第一定律
尤利乌斯·罗伯特·迈尔
詹姆斯·普雷斯科特·焦耳
1.已知:A(g)+3B(g) 2C(g) ΔH<0。该反应在恒容密闭容器中进行,达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.容器中混合气体的平均相对分子质量减小
B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.正反应速率和逆反应速率都减小,C的质量分数增加
D.混合气体密度的变化情况可以作为判断反应是否再次达平衡的依据
C
2.在某密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),反应体系在平衡状态时SO3的质量分数与温度的关系如图所示。下列说法正确的是( )
A.D点:v正
C.若B、C点的平衡常数分别为KB、KC,则KB=KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
D
3.已知反应:2NO2(g) N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡皮管,把A烧瓶放入热水里,把B烧瓶放入冰水里,如图所示(省略夹持装置)。与常温时烧瓶内气体的颜色进行对比,发现A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是( )
A.把A烧瓶放入热水中,A烧瓶内正、逆反应速率均加快
B.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C.上述过程中,A、B烧瓶内气体密度均保持不变
D.2NO2(g) N2O4(g)的逆反应为放热反应
D
4.下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.2SO2(g)+O2(g) 2SO3(g),高压比常压有利于合成SO3
C.工业制取金属钾:Na(l)+KCl(l) NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
D.加入催化剂有利于氨的合成
D
5.丙烷氧化脱氢法制备丙烯的主要反应如下:
C3H8(g)+O2(g) C3H6(g)+H2O(g) ΔH=-118 kJ·mol-1。
在催化剂作用下,丙烷氧化脱氢除生成丙烯外,还生成CO、CO2等物质。丙烷的转化率和丙烯的产率随温度变化关系如图所示。
(1)图中丙烷的转化率随温度升高而增大的原因可能是 。
(2)575 ℃时,丙烯的选择性为 。(丙烯的选择性=×100%)
(3)基于本研究结果,能提高丙烯选择性的措施是 。
选择相对较低的温度
温度升高,反应速率加快(或催化剂的活性增强)
51.5%
第二节
化学平衡
第4课时
化学平衡的图像
影响化学平衡的因素
解题方法
温度
化学平衡图像的类型
催化剂
1.其他条件不变时,升高温度,化学平衡向吸热反应方向移动
2.其他条件不变时,降低温度,化学平衡向放热反应方向移动
催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间
THANKS
谢谢聆听
