1.2.2离子反应及其发生的条件 课件(共41张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.2离子反应及其发生的条件 课件(共41张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 33.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 16:42:18 | ||
图片预览











文档简介
(共41张PPT)
第一章 物质及其变化
第2课时 离子反应及其发生的条件
离子反应
第二节
【学习目标】
1.理解离子反应的概念。
2.掌握复分解反应型离子反应发生的条件。
3.掌握离子方程式的书写。
电解质溶于水后,可电离成为离子,所以电解质在溶液中所起的反应,实质上是离子间的反应,这样的反应属于离子反应
那么,电解质溶液中离子是如何反应的?反应之后发生什么实质性的变化?我们先来看几个实验:
实验1:
CuSO4溶液
+ NaCl溶液
无明显现象
[理论分析]
Cu2+ + SO42-
Na+ + Cl-
+
×
[结 论]
无化学变化,只是Cu2+、SO42-、Na+、Cl-的简单混合
实验2:
CuSO4溶液
+ NaCl溶液
有白色沉淀生成
静置,上层清液为蓝色
BaCl2溶液
[理论分析]
Cu2+ + SO42-
Ba2+ + 2Cl-
+
BaSO4↓
含Cu2+
Cl-呢?如何证明Cl-的存在?
实验3:
取实验2的上层清液
+ AgNO3溶液
有白色沉淀生成
+ 稀HNO3
白色沉淀不溶解
结 论:
Cl-仍在滤液中
即,实验2中Cu2+、Cl-均未参加实际的反应。
实验2的反应实质是:
Ba2+ + SO42-
BaSO4
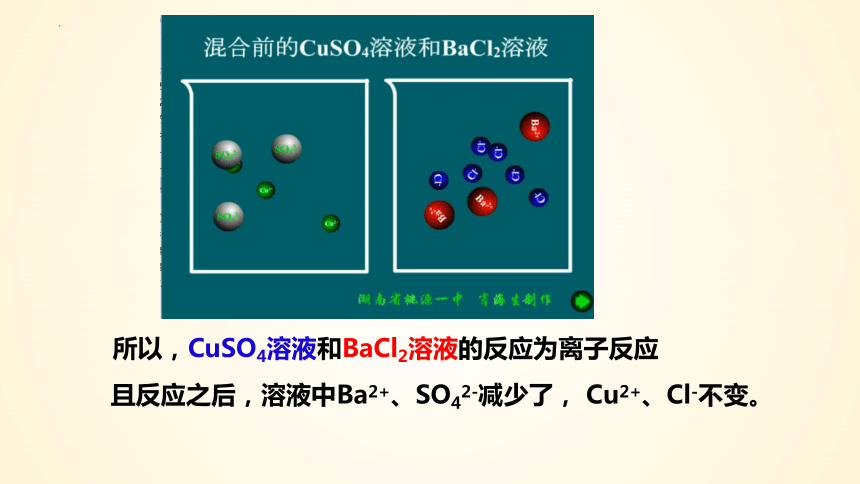
所以,CuSO4溶液和BaCl2溶液的反应为离子反应
且反应之后,溶液中Ba2+、SO42-减少了, Cu2+、Cl-不变。
一、离子反应
1.定义:
2.离子反应的特点:
向着降低某些离子数目的方向进行。
3.离子方程式:
用实际参加反应的离子符号来表示离子反应的式子
如:上述实验2
Ba2+ + SO42-
BaSO4
CuSO4溶液和BaCl2溶液的反应
追问:上述实验3的离子方程式呢?
实验3:
取实验2的上层清液
+ AgNO3溶液
Cl- + Ag+ = AgCl↓
有离子参加或生成的反应。
4.离子方程式的书写方法:
(课本P17)
①“写”:
写出正确、符合客观事实的化学方程式
②“拆”:
易溶于水且易电离的物质写成离子形式,其余一律写化学式。
即在水中主要以离子形式存在的强电解质
强酸、强碱、大部分可溶性盐
③“删”:
CuSO4 + BaCl2
= BaSO4↓+ CuCl2
Cu2++SO42-
+ Ba2+ + 2Cl-
= BaSO4↓
+ Cu2+ + 2Cl-
删去方程式两边不参加反应的离子并将系数化为最简比
即删去两边相同的离子(注:离子数目也删一样多)
Fe2+
Fe3+
Na
Na+
不可删
4Cl-
Cl2+
2Cl-
2Cl-
2H+ + 2OH- = 2H2O
H++OH- =H2O
一、离子反应
4.离子方程式的书写方法:
(课本P17)
①“写”:
写出正确、符合客观事实的化学方程式
②“拆”:
易溶于水且易电离的物质写成离子形式,其余一律写化学式。
即在水中主要以离子形式存在的强电解质
强酸、强碱、大部分可溶性盐
③“删”:
CuSO4 + BaCl2
= BaSO4↓+ CuCl2
Cu2++SO42-
+ Ba2+ + 2Cl-
= BaSO4↓
+ Cu2+ + 2Cl-
删去方程式两边不参加反应的离子并将系数化为最简比
即删去两边相同的离子(注:离子数目也删一样多)
一、离子反应
SO42- + Ba2+
= BaSO4↓
④“查”:
查“原子守恒” 和“电荷守恒”
写、拆、删、查
关键
可拆物质(易溶易电离的强电解质)
强酸: HCl、H2SO4、HNO3
强碱:NaOH、KOH、Ba(OH)2
可溶性的盐:钾、钠、铵盐;硝酸盐等。
溶解性口诀:
钾钠铵盐均易溶
硝酸盐见水影无踪
硫酸盐不溶铅和钡
盐酸盐不溶银、亚汞
可溶性的盐:钾、钠、铵盐;硝酸盐等。
BaSO4↓
PbSO4↓
AgCl↓
HgCl↓
CO32-盐:
除Na2CO3
、K2CO3
、(NH4)2CO3
其余均难溶
CaCO3、BaCO3 、AgCO3 、ZnCO3 、FeCO3 、CuCO3等
SO32-盐(同上)
碱:
除NaOH
、KOH
、Ba(OH)2 、NH3·H2O等易溶
Ca(OH)2
微溶
大多碱难溶:
Mg(OH)2 、Al(OH)3 、AgOH、Zn(OH)2、
Fe(OH)2、Fe(OH)3 、Cu(OH)2等
若为澄清溶液:
若为悬浊液或固体:
微溶物
作生成物
作反应物
如Ca(OH)2
若为澄清石灰水:
若为石灰乳或悬浊液:
四个微溶物的处理
Ca(OH)2
CaSO4
MgCO3
Ag2SO4
作反应物
:一律视为沉淀,不可拆
“拆”
“不拆”
拆成 Ca2+ + 2OH-
不拆,写化学式Ca(OH)2
单质:Fe、Zn、Cl2等
弱酸:H2S、CH3COOH、H2SO3等
弱碱:Cu(OH)2、Mg(OH)2 、NH3·H2O等
难溶性盐:AgCl 、 CaCO3、BaSO4等
不可拆的物质
氧化物:H2O、CO2、CaO等
气体:NH3等
气体、难溶、难电离,以化学式表示。
Zn+2H+=Zn2++H2
Ca2++2OH-+CO2 =CaCO3 +H2O
CuO+2H+=Cu2++H2O
CaCO3+2H+=Ca2++CO2 +H2O
⑷向澄清石灰水中通入少量CO2气体
⑶ CuO溶于稀H2SO4
⑵ CaCO3跟稀HCl反应
⑴ Zn跟稀H2SO4反应
[思考与练习]
写出下列反应的离子方程式:
[思考与练习]
写出下列反应的离子方程式:
CaCO3 + 2CH3COOH = 2CH3COO- + Ca2++CO2 +H2O
(6)碳酸钙与CH3COOH溶液的反应
(5) NaOH溶液与CH3COOH溶液的反应
OH- + CH3COOH = CH3COO- + H2O
(7)铜与硝酸银溶液的反应
= Cu2+ + 2Ag
Cu + 2Ag+
(9) Ba(OH)2溶液与CuSO4溶液的反应
Ba2+ + 2OH— + 2H+ + SO42— = BaSO4↓+ 2H2O
(8) Ba(OH)2溶液与H2SO4溶液的反应
Ba2+ + 2OH— + Cu2+ + SO42— = BaSO4↓+ Cu(OH)2↓
两种电解质溶液混合,至少电离出两种阴离子和两种阳离子
这四种(或更多种)之间都能两两结合,发生离子反应,称为多重反应。
写多重反应离子方程式时注意不要遗漏其中的某组反应。
(10)Ba(OH)2溶液与(NH4)2SO4溶液混合
[思考与练习]
写出下列反应的离子方程式:
Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3·H2O
(11) 向NaHSO4溶液中加入NaOH
(12)向NaHCO3溶液中加入稀H2SO4
(13) 向NaHCO3溶液中加入NaOH
H++OH- =H2O
HCO3— + H+ = H2O + CO2↑
HCO3— + OH- = H2O + CO32—
HCO3—与H+ 、 OH-均可以反应
注意:水溶液中HSO4—一定要拆
[思考与练习]
写出下列反应的离子方程式:
完成下列反应的离子方程式,由此你能得出什么结论吗?
⑴HCl+NaOH ⑵H2SO4+NaOH
⑶H2SO4+KOH ⑷HNO3+Ba(OH)2
[思考与交流]
⑴H++OH- =H2O ⑵H++OH- =H2O
⑶H++OH- =H2O ⑷H++OH- =H2O
⑴中和反应的实质:由酸电离出来的H+和由碱电离出来的OH-结合生成了水。
⑵离子方程式不仅可表示某一个具体的化学反应, 而且可表示同一类型的离子反应。
结 论:
H++OH- = H2O
5、离子反应方程式的意义P18:
①表示某一个具体的化学反应;
②表示同一类型的离子反应。
问:
Ba(OH)2与H2SO4溶液反应、 CH3COOH与NaOH溶液反应,
可以用H++OH- =H2O 来表示吗?
不能
注意:
H++OH- =H2O仅表示
强酸+强碱 可溶性盐+水
(例:Ba2+ + SO42- = BaSO4↓)
(例:H+ + OH- = H2O)
一、离子反应
练习1:下列各反应中,能用离子方程式 H++OH-=H2O表示的是( )
A、 NaHSO4溶液和KOH溶液反应
B、 稀HCl和氨水反应
C、稀H2SO4和Ba(OH)2溶液反应
D、CH3COOH溶液和KOH溶液反应
A
教材P19 7题
练习2:
一个离子方程式,往往对应着多个化学反应。
已知阳离子,阴离子找NO3-、Cl-、SO42-等
已知阴离子,阳离子找K+、Na+等
离子方程式的正误判断:
(1)铁与稀硫酸反应
2 Fe + 6 H+ = 2 Fe3+ + 3H2↑
(2)稀硫酸滴在铜片上
Cu+ 2 H+ = Cu2+ + H2↑
不符合客观事实
(3)碳酸钡与硝酸反应
CO32-+2H+ = H2O + CO2↑
(4)碳酸钠与稀硫酸反应
CO32-+2H+ = H2O + CO2↑
(5)CH3COOH溶液和KOH溶液中和
OH +H+=H2O
(6)醋酸与氨水反应
H++OH- = H2O
(7)氧化铜溶于盐酸 O2- + 2H+ = H2O
看“拆”是否正确
√
(8)稀硫酸与氢氧化钡溶液反应
H+ + SO42- + Ba2+ + OH- = BaSO4↓+ H2O
(不符合原子配比关系)
(9)硫酸铜溶液与氢氧化钡溶液反应
Ba 2 + + SO42- = BaSO4↓
(漏了离子反应:2OH—+ Cu2+ =Cu(OH)2↓)
(10) Na+2 H2O = Na+ +2 OH-+ H2↑
(11) 铝片插入AgNO3溶液中:Al + Ag+ = Al3++ Ag
(电荷不守恒)
(电荷不守恒)
2
2
(12)石灰乳与稀HCl反应:Ca(OH)2+ 2H+= Ca2++2H2O
√
(13)向澄清的石灰水中通入过量的CO2
CO2 + OH- = HCO3-
√
2
2
2
3
3
离子方程式的正误判断:
归纳总结:
离子方程式的正误判断:
“一看”:是否符合客观事实
“二看” :“拆”是否正确
“三看”:是否符合电荷守恒
“五看”:是否符合阴、阳离子配比关系
“四看”:是否漏掉离子反应。
(1)将Na2SO4溶液和KCl溶液混合能发生化学反应吗?
(2)离子反应的发生应具备什么条件?
二、离子反应发生的条件
总结:离子反应发生的条件(P18)
1.复分解反应型离子反应
2.离子参加的置换反应(氧化还原反应)
如:(1)锌和稀硫酸的反应可用离子方程式表示为 。
(2)铜和硝酸银溶液反应的离子方程式为 。
三. 离子大量共存问题
1.所谓几种离子在同一溶液中能大量共存,就是指离子之间 ;若离子之间能 ,则不能大量共存。
不发生任何反应
发生反应
2.若离子间能生成沉淀、气体、弱电解质(水、弱酸、弱碱),
则一定不能大量共存。
如:Cu2+、SO42-、Na+、Cl- (能共存)
Cu2+、SO42-、 Ba2+ 、Cl- (不能大量共存)
BaSO4↓
离子大量共存问题关键在:“大量”两个字
说明:
如,任何水溶液中都有H+和OH—
,它们的量不多
而我们讲H+和OH—是不能大量共存的
H+ + OH—
= H2O
1.下列各组离子在水溶液中能大量共存的是( )
A.Na+、Ba2+、Cl 、SO42-
B. Ca2+、OH 、Cl 、H+
C.Mg2+、Na+、NO3 、Cl
D. H+ 、Cl 、Na+ 、CO32
[思考与练习]
小结1.看离子间能否满足复分解反应发生的条件
C
[离子大量共存]
2.在强酸性溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3- 、MnO4-
B.K+、Na+、Cl-、CO32-
C.K+、NH4十、 Cl-、Mg2+
D.Na十、Ba2+、OH-、NO3-
小结2. 看题干中是否有一些隐含条件。
比如:溶液的酸碱性,有无颜色等。
常见有色的离子:Cu2+(蓝色或绿色)、Fe3+(棕黄色)、
C
[离子大量共存]
H+
H+
H+
Fe2+(浅绿色)、MnO4-(紫色)
H+
[思考与练习]
3.在无色透明强酸性溶液中能大量共存的离子组是( )
A、K+、Cu2+、NO3-、SO42- B、Na+、Cl-、HCO3-、SO42-
C、Ca2+、Ba2+、Cl-、NO3- D、Mg2+、NH4+、OH-、NO3-
C
与 H+不共存的:
OH- ;弱酸酸根,如:CO32-(HCO3-)、
SO32-(HSO3-)、CH3COO-、S2—、SiO32-等
与 OH-不共存的:
H+ ;
弱碱阳离子(Cu2+、NH4+ 、Al3+、Mg2+、Fe3+等)
多元弱酸酸式根,如:HCO3-、HSO3 -等
H+
H+
HCO3— + H+ = H2O + CO2↑
HCO3— + OH- = H2O + CO32—
多元弱酸酸式根离子(如HCO3—、HSO3—、HS—、H2PO4—等) 与OH—、H+均不能大量共存
4、在某无色透明的碱性溶液中,能共存的离子组是
A.Na+ 、K+、SO42-、HCO3
B.Cu2+、K+、SO42-、NO3
C.Na+、 K+、Cl 、 NO3
D.Fe3+、K+、SO42-、Cl
5、已知某溶液中存在较多的OH-、SO42-、CO32-,则该溶液中还可以大量存在的离子组是
A、Al3+、CH3COO-、Cl-
B、Mg2+、Ba2+、Br-
C、K+、I-、Cl-
D、Na+、NH4+、Cl-
C
C
6.用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂及有关反应的离子方程式。
(1)FeSO4溶液(CuSO4):试剂___________,
离子方程式__________________________;
(2) Cu(Mg):试剂____________________,
离子方程式__________________________;
(3) CO(CO2):试剂___________________,
离子方程式__________________________。
铁粉
Fe+Cu2+ = Cu+Fe2+
稀盐酸
Mg+2H+ = Mg2++H2↑
NaOH溶液
CO2+2OH- = CO32-+H2O
(4)CO2(HCl)试剂 ;
离子方程式: 。
饱和碳酸氢钠溶液
HCO3— + H+ = H2O + CO2↑
7、某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl 、OH 、NO3 六种离子。
⑴甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子 、 、 。 ⑵乙厂的废水中含的另外三种离子是 、 、 。如果在该厂废水中加一定量 选填:活性炭或铁粉),则可以回收其中的金属 (填写金属元素符号)。写出回收该金属的离子方程式: 。
⑶有一种设想:将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式: ; 。
经过滤后的废水主要含 ,可用来浇灌农田。
OH
K+
Cl
Ag+
Fe3+
NO3
铁粉
Ag
2Ag+ + Fe = 2Ag + Fe2+
Fe3+ + 3OH- = Fe(OH)3
Ag+ + Cl- = AgCl
K+ 、 NO3
归纳总结:
(1)离子间若发生下列反应之一,就不能大量共存
(记住溶解性口诀和溶解性表)
如Ca2+与CO32-、Ba2+与SO42-、Ag+与Cl-、Mg2+与OH-等
①离子间能生成难溶或微溶物质
Ag+与 SO42-,Ca2+与SO42-、OH-,Mg2+与CO32-等。
②离子间反应生成气体。
如H+与CO32-、HCO3-、SO32-、HSO3-等
③离子间能生成弱电解质。
如HCO3-与OH-、NH4+与OH-、CH3COO-与H+、H+与OH-等
④多元弱酸酸式根离子(如HCO3—、HSO3—、HS—、H2PO4—等)
与OH—、H+均不能大量共存
(2)注意附加的隐含条件
①无色透明的溶液中,不存在有色离子。如Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO 4- (紫红色)等。
[注:澄清透明溶液指“不浑浊”,可以 “有色”]
②强酸性溶液
不存在与H+起反应的离子。
PH < 7的溶液
使石蕊试纸变红的溶液
③强碱性溶液
PH > 7的溶液
使酚酞试纸变红的溶液
不存在与OH-起反应的离子
归纳总结:
1.离子反应:有离子参加或生成的反应。
2.离子反应的特点:
向着降低某些离子数目的方向进行。
4.复分解型离子反应发生的条件:
产生难溶性的物质、易挥发性的物质、难电离的物质
沉 淀
气 体
弱电解质
课 堂小 结
3.离子方程式:
(1)离子方程式的书写步骤:写,拆,删,查
(2)离子方程式的意义:
用实际参加反应的离子符号来表示离子反应的式子
①表示某一个具体的化学反应;
②表示同一类型的离子反应。
5. 离子大量共存问题
【拓展延伸】
②过量CO2:
①少量CO2:
(1)CO2气体通入氢氧化钠溶液。
与量有关的离子方程式的书写
CO2+2OH- = CO32-+H2O
CO2+OH- = HCO3-
问:CO2气体通入Ca(OH)2溶液中呢
②过量CO2:
①少量CO2:
Ca2++2OH-+CO2 =CaCO3 +H2O
CO2+OH- = HCO3-
(1)Ca(HCO3)2溶液与NaOH溶液反应
①NaOH不足: ;
这里涉及两个连续的离子反应
解析:
1 : 1
+ OH—
HCO3—
CO32—+H2O
①
CO32—+Ca2+
= CaCO3↓
②
解题技巧:
“少定多变”法
少定
:量少的反应物按化学式配比将量定为“1”
多变
:过量的反应物其离子数目按反应需要的量确定,不受化学式离子比例的制约
若NaOH不足,则NaOH定为“1”
1份OH—需要1份HCO3—
+ OH—
HCO3—
CO32—+H2O
反应中生成1份CO32— ,需要1份Ca2+与之反应:
CO32—+Ca2+
= CaCO3↓
总:
OH-+
HCO3—
CO32—+H2O
+Ca2+
Ca
↓
少量定1
多变
(2)酸式盐与碱的反应:
②NaOH过量: ;
(1)Ca(HCO3)2溶液与NaOH溶液反应
若NaOH过量,则Ca(HCO3)2定为“1”
2份HCO3—需要2份OH—
+ OH—
HCO3—
CO32—+ H2O
反应中生成2份CO32— ,但只有1份Ca2+与之反应:
CO32—+Ca2+
= CaCO3↓
其中含1份Ca2+和2份HCO3—
2 2 2 2
Ca2++2HCO3— +2OH-=CO32—+2H2O+CaCO3↓
总:
因此CO32—多余一份没有形成沉淀
Ca2++2HCO3—
少量定1
+2OH-
CO32—+ 2H2O
2
+ CaCO3↓
多变
这里涉及两个连续的离子反应
解析:
1 : 1
+ OH—
HCO3—
CO32—+H2O
①
CO32—+Ca2+
= CaCO3↓
②
(2)酸式盐与碱的反应:
Ca2++2OH-+2HCO3—===CO32—+2H2O+CaCO3↓
①NaHCO3不足:
;
②NaHCO3过量:
。
少量定1
少量定1
多变
多变
2)NaHCO3溶液与Ca(OH)2溶液反应
换Ba(OH)2呢?
思考: Ca(HCO3)2溶液与Ca(OH)2溶液反应呢?
Ca2++ OH-+ HCO3— === CaCO3↓+ H2O
(2)酸式盐与碱的反应:
Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
常设量少的物质为1,据此调整过量物质的比例
【拓展延伸】
与量有关的离子方程式的书写
(3)Ba(OH)2与NaHSO4溶液混合。
①NaHSO4溶液不足时:
②NaHSO4溶液过量时:
Ba2++OH-+H++SO42- = BaSO4↓+H2O
“少定多变”
①溶液呈中性:
②溶液呈碱性:
。
Ba(OH)2 :NaHSO4
Ba(OH)2溶液与NaHSO4溶液的反应
1 : 2
Ba2++2OH-+2H++SO42—== BaSO4↓+2H2O
Ba(OH)2过量
,NaHSO4定为1
H++SO42—+OH-+Ba2+===BaSO4↓+H2O
③ Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+恰好完全沉淀
1 : 1
Ba2++SO42—+OH-+ H+===BaSO4↓+H2O
==
[思考与练习]
写出下列反应的离子方程式:
第一章 物质及其变化
第2课时 离子反应及其发生的条件
离子反应
第二节
【学习目标】
1.理解离子反应的概念。
2.掌握复分解反应型离子反应发生的条件。
3.掌握离子方程式的书写。
电解质溶于水后,可电离成为离子,所以电解质在溶液中所起的反应,实质上是离子间的反应,这样的反应属于离子反应
那么,电解质溶液中离子是如何反应的?反应之后发生什么实质性的变化?我们先来看几个实验:
实验1:
CuSO4溶液
+ NaCl溶液
无明显现象
[理论分析]
Cu2+ + SO42-
Na+ + Cl-
+
×
[结 论]
无化学变化,只是Cu2+、SO42-、Na+、Cl-的简单混合
实验2:
CuSO4溶液
+ NaCl溶液
有白色沉淀生成
静置,上层清液为蓝色
BaCl2溶液
[理论分析]
Cu2+ + SO42-
Ba2+ + 2Cl-
+
BaSO4↓
含Cu2+
Cl-呢?如何证明Cl-的存在?
实验3:
取实验2的上层清液
+ AgNO3溶液
有白色沉淀生成
+ 稀HNO3
白色沉淀不溶解
结 论:
Cl-仍在滤液中
即,实验2中Cu2+、Cl-均未参加实际的反应。
实验2的反应实质是:
Ba2+ + SO42-
BaSO4
所以,CuSO4溶液和BaCl2溶液的反应为离子反应
且反应之后,溶液中Ba2+、SO42-减少了, Cu2+、Cl-不变。
一、离子反应
1.定义:
2.离子反应的特点:
向着降低某些离子数目的方向进行。
3.离子方程式:
用实际参加反应的离子符号来表示离子反应的式子
如:上述实验2
Ba2+ + SO42-
BaSO4
CuSO4溶液和BaCl2溶液的反应
追问:上述实验3的离子方程式呢?
实验3:
取实验2的上层清液
+ AgNO3溶液
Cl- + Ag+ = AgCl↓
有离子参加或生成的反应。
4.离子方程式的书写方法:
(课本P17)
①“写”:
写出正确、符合客观事实的化学方程式
②“拆”:
易溶于水且易电离的物质写成离子形式,其余一律写化学式。
即在水中主要以离子形式存在的强电解质
强酸、强碱、大部分可溶性盐
③“删”:
CuSO4 + BaCl2
= BaSO4↓+ CuCl2
Cu2++SO42-
+ Ba2+ + 2Cl-
= BaSO4↓
+ Cu2+ + 2Cl-
删去方程式两边不参加反应的离子并将系数化为最简比
即删去两边相同的离子(注:离子数目也删一样多)
Fe2+
Fe3+
Na
Na+
不可删
4Cl-
Cl2+
2Cl-
2Cl-
2H+ + 2OH- = 2H2O
H++OH- =H2O
一、离子反应
4.离子方程式的书写方法:
(课本P17)
①“写”:
写出正确、符合客观事实的化学方程式
②“拆”:
易溶于水且易电离的物质写成离子形式,其余一律写化学式。
即在水中主要以离子形式存在的强电解质
强酸、强碱、大部分可溶性盐
③“删”:
CuSO4 + BaCl2
= BaSO4↓+ CuCl2
Cu2++SO42-
+ Ba2+ + 2Cl-
= BaSO4↓
+ Cu2+ + 2Cl-
删去方程式两边不参加反应的离子并将系数化为最简比
即删去两边相同的离子(注:离子数目也删一样多)
一、离子反应
SO42- + Ba2+
= BaSO4↓
④“查”:
查“原子守恒” 和“电荷守恒”
写、拆、删、查
关键
可拆物质(易溶易电离的强电解质)
强酸: HCl、H2SO4、HNO3
强碱:NaOH、KOH、Ba(OH)2
可溶性的盐:钾、钠、铵盐;硝酸盐等。
溶解性口诀:
钾钠铵盐均易溶
硝酸盐见水影无踪
硫酸盐不溶铅和钡
盐酸盐不溶银、亚汞
可溶性的盐:钾、钠、铵盐;硝酸盐等。
BaSO4↓
PbSO4↓
AgCl↓
HgCl↓
CO32-盐:
除Na2CO3
、K2CO3
、(NH4)2CO3
其余均难溶
CaCO3、BaCO3 、AgCO3 、ZnCO3 、FeCO3 、CuCO3等
SO32-盐(同上)
碱:
除NaOH
、KOH
、Ba(OH)2 、NH3·H2O等易溶
Ca(OH)2
微溶
大多碱难溶:
Mg(OH)2 、Al(OH)3 、AgOH、Zn(OH)2、
Fe(OH)2、Fe(OH)3 、Cu(OH)2等
若为澄清溶液:
若为悬浊液或固体:
微溶物
作生成物
作反应物
如Ca(OH)2
若为澄清石灰水:
若为石灰乳或悬浊液:
四个微溶物的处理
Ca(OH)2
CaSO4
MgCO3
Ag2SO4
作反应物
:一律视为沉淀,不可拆
“拆”
“不拆”
拆成 Ca2+ + 2OH-
不拆,写化学式Ca(OH)2
单质:Fe、Zn、Cl2等
弱酸:H2S、CH3COOH、H2SO3等
弱碱:Cu(OH)2、Mg(OH)2 、NH3·H2O等
难溶性盐:AgCl 、 CaCO3、BaSO4等
不可拆的物质
氧化物:H2O、CO2、CaO等
气体:NH3等
气体、难溶、难电离,以化学式表示。
Zn+2H+=Zn2++H2
Ca2++2OH-+CO2 =CaCO3 +H2O
CuO+2H+=Cu2++H2O
CaCO3+2H+=Ca2++CO2 +H2O
⑷向澄清石灰水中通入少量CO2气体
⑶ CuO溶于稀H2SO4
⑵ CaCO3跟稀HCl反应
⑴ Zn跟稀H2SO4反应
[思考与练习]
写出下列反应的离子方程式:
[思考与练习]
写出下列反应的离子方程式:
CaCO3 + 2CH3COOH = 2CH3COO- + Ca2++CO2 +H2O
(6)碳酸钙与CH3COOH溶液的反应
(5) NaOH溶液与CH3COOH溶液的反应
OH- + CH3COOH = CH3COO- + H2O
(7)铜与硝酸银溶液的反应
= Cu2+ + 2Ag
Cu + 2Ag+
(9) Ba(OH)2溶液与CuSO4溶液的反应
Ba2+ + 2OH— + 2H+ + SO42— = BaSO4↓+ 2H2O
(8) Ba(OH)2溶液与H2SO4溶液的反应
Ba2+ + 2OH— + Cu2+ + SO42— = BaSO4↓+ Cu(OH)2↓
两种电解质溶液混合,至少电离出两种阴离子和两种阳离子
这四种(或更多种)之间都能两两结合,发生离子反应,称为多重反应。
写多重反应离子方程式时注意不要遗漏其中的某组反应。
(10)Ba(OH)2溶液与(NH4)2SO4溶液混合
[思考与练习]
写出下列反应的离子方程式:
Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3·H2O
(11) 向NaHSO4溶液中加入NaOH
(12)向NaHCO3溶液中加入稀H2SO4
(13) 向NaHCO3溶液中加入NaOH
H++OH- =H2O
HCO3— + H+ = H2O + CO2↑
HCO3— + OH- = H2O + CO32—
HCO3—与H+ 、 OH-均可以反应
注意:水溶液中HSO4—一定要拆
[思考与练习]
写出下列反应的离子方程式:
完成下列反应的离子方程式,由此你能得出什么结论吗?
⑴HCl+NaOH ⑵H2SO4+NaOH
⑶H2SO4+KOH ⑷HNO3+Ba(OH)2
[思考与交流]
⑴H++OH- =H2O ⑵H++OH- =H2O
⑶H++OH- =H2O ⑷H++OH- =H2O
⑴中和反应的实质:由酸电离出来的H+和由碱电离出来的OH-结合生成了水。
⑵离子方程式不仅可表示某一个具体的化学反应, 而且可表示同一类型的离子反应。
结 论:
H++OH- = H2O
5、离子反应方程式的意义P18:
①表示某一个具体的化学反应;
②表示同一类型的离子反应。
问:
Ba(OH)2与H2SO4溶液反应、 CH3COOH与NaOH溶液反应,
可以用H++OH- =H2O 来表示吗?
不能
注意:
H++OH- =H2O仅表示
强酸+强碱 可溶性盐+水
(例:Ba2+ + SO42- = BaSO4↓)
(例:H+ + OH- = H2O)
一、离子反应
练习1:下列各反应中,能用离子方程式 H++OH-=H2O表示的是( )
A、 NaHSO4溶液和KOH溶液反应
B、 稀HCl和氨水反应
C、稀H2SO4和Ba(OH)2溶液反应
D、CH3COOH溶液和KOH溶液反应
A
教材P19 7题
练习2:
一个离子方程式,往往对应着多个化学反应。
已知阳离子,阴离子找NO3-、Cl-、SO42-等
已知阴离子,阳离子找K+、Na+等
离子方程式的正误判断:
(1)铁与稀硫酸反应
2 Fe + 6 H+ = 2 Fe3+ + 3H2↑
(2)稀硫酸滴在铜片上
Cu+ 2 H+ = Cu2+ + H2↑
不符合客观事实
(3)碳酸钡与硝酸反应
CO32-+2H+ = H2O + CO2↑
(4)碳酸钠与稀硫酸反应
CO32-+2H+ = H2O + CO2↑
(5)CH3COOH溶液和KOH溶液中和
OH +H+=H2O
(6)醋酸与氨水反应
H++OH- = H2O
(7)氧化铜溶于盐酸 O2- + 2H+ = H2O
看“拆”是否正确
√
(8)稀硫酸与氢氧化钡溶液反应
H+ + SO42- + Ba2+ + OH- = BaSO4↓+ H2O
(不符合原子配比关系)
(9)硫酸铜溶液与氢氧化钡溶液反应
Ba 2 + + SO42- = BaSO4↓
(漏了离子反应:2OH—+ Cu2+ =Cu(OH)2↓)
(10) Na+2 H2O = Na+ +2 OH-+ H2↑
(11) 铝片插入AgNO3溶液中:Al + Ag+ = Al3++ Ag
(电荷不守恒)
(电荷不守恒)
2
2
(12)石灰乳与稀HCl反应:Ca(OH)2+ 2H+= Ca2++2H2O
√
(13)向澄清的石灰水中通入过量的CO2
CO2 + OH- = HCO3-
√
2
2
2
3
3
离子方程式的正误判断:
归纳总结:
离子方程式的正误判断:
“一看”:是否符合客观事实
“二看” :“拆”是否正确
“三看”:是否符合电荷守恒
“五看”:是否符合阴、阳离子配比关系
“四看”:是否漏掉离子反应。
(1)将Na2SO4溶液和KCl溶液混合能发生化学反应吗?
(2)离子反应的发生应具备什么条件?
二、离子反应发生的条件
总结:离子反应发生的条件(P18)
1.复分解反应型离子反应
2.离子参加的置换反应(氧化还原反应)
如:(1)锌和稀硫酸的反应可用离子方程式表示为 。
(2)铜和硝酸银溶液反应的离子方程式为 。
三. 离子大量共存问题
1.所谓几种离子在同一溶液中能大量共存,就是指离子之间 ;若离子之间能 ,则不能大量共存。
不发生任何反应
发生反应
2.若离子间能生成沉淀、气体、弱电解质(水、弱酸、弱碱),
则一定不能大量共存。
如:Cu2+、SO42-、Na+、Cl- (能共存)
Cu2+、SO42-、 Ba2+ 、Cl- (不能大量共存)
BaSO4↓
离子大量共存问题关键在:“大量”两个字
说明:
如,任何水溶液中都有H+和OH—
,它们的量不多
而我们讲H+和OH—是不能大量共存的
H+ + OH—
= H2O
1.下列各组离子在水溶液中能大量共存的是( )
A.Na+、Ba2+、Cl 、SO42-
B. Ca2+、OH 、Cl 、H+
C.Mg2+、Na+、NO3 、Cl
D. H+ 、Cl 、Na+ 、CO32
[思考与练习]
小结1.看离子间能否满足复分解反应发生的条件
C
[离子大量共存]
2.在强酸性溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3- 、MnO4-
B.K+、Na+、Cl-、CO32-
C.K+、NH4十、 Cl-、Mg2+
D.Na十、Ba2+、OH-、NO3-
小结2. 看题干中是否有一些隐含条件。
比如:溶液的酸碱性,有无颜色等。
常见有色的离子:Cu2+(蓝色或绿色)、Fe3+(棕黄色)、
C
[离子大量共存]
H+
H+
H+
Fe2+(浅绿色)、MnO4-(紫色)
H+
[思考与练习]
3.在无色透明强酸性溶液中能大量共存的离子组是( )
A、K+、Cu2+、NO3-、SO42- B、Na+、Cl-、HCO3-、SO42-
C、Ca2+、Ba2+、Cl-、NO3- D、Mg2+、NH4+、OH-、NO3-
C
与 H+不共存的:
OH- ;弱酸酸根,如:CO32-(HCO3-)、
SO32-(HSO3-)、CH3COO-、S2—、SiO32-等
与 OH-不共存的:
H+ ;
弱碱阳离子(Cu2+、NH4+ 、Al3+、Mg2+、Fe3+等)
多元弱酸酸式根,如:HCO3-、HSO3 -等
H+
H+
HCO3— + H+ = H2O + CO2↑
HCO3— + OH- = H2O + CO32—
多元弱酸酸式根离子(如HCO3—、HSO3—、HS—、H2PO4—等) 与OH—、H+均不能大量共存
4、在某无色透明的碱性溶液中,能共存的离子组是
A.Na+ 、K+、SO42-、HCO3
B.Cu2+、K+、SO42-、NO3
C.Na+、 K+、Cl 、 NO3
D.Fe3+、K+、SO42-、Cl
5、已知某溶液中存在较多的OH-、SO42-、CO32-,则该溶液中还可以大量存在的离子组是
A、Al3+、CH3COO-、Cl-
B、Mg2+、Ba2+、Br-
C、K+、I-、Cl-
D、Na+、NH4+、Cl-
C
C
6.用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂及有关反应的离子方程式。
(1)FeSO4溶液(CuSO4):试剂___________,
离子方程式__________________________;
(2) Cu(Mg):试剂____________________,
离子方程式__________________________;
(3) CO(CO2):试剂___________________,
离子方程式__________________________。
铁粉
Fe+Cu2+ = Cu+Fe2+
稀盐酸
Mg+2H+ = Mg2++H2↑
NaOH溶液
CO2+2OH- = CO32-+H2O
(4)CO2(HCl)试剂 ;
离子方程式: 。
饱和碳酸氢钠溶液
HCO3— + H+ = H2O + CO2↑
7、某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl 、OH 、NO3 六种离子。
⑴甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子 、 、 。 ⑵乙厂的废水中含的另外三种离子是 、 、 。如果在该厂废水中加一定量 选填:活性炭或铁粉),则可以回收其中的金属 (填写金属元素符号)。写出回收该金属的离子方程式: 。
⑶有一种设想:将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式: ; 。
经过滤后的废水主要含 ,可用来浇灌农田。
OH
K+
Cl
Ag+
Fe3+
NO3
铁粉
Ag
2Ag+ + Fe = 2Ag + Fe2+
Fe3+ + 3OH- = Fe(OH)3
Ag+ + Cl- = AgCl
K+ 、 NO3
归纳总结:
(1)离子间若发生下列反应之一,就不能大量共存
(记住溶解性口诀和溶解性表)
如Ca2+与CO32-、Ba2+与SO42-、Ag+与Cl-、Mg2+与OH-等
①离子间能生成难溶或微溶物质
Ag+与 SO42-,Ca2+与SO42-、OH-,Mg2+与CO32-等。
②离子间反应生成气体。
如H+与CO32-、HCO3-、SO32-、HSO3-等
③离子间能生成弱电解质。
如HCO3-与OH-、NH4+与OH-、CH3COO-与H+、H+与OH-等
④多元弱酸酸式根离子(如HCO3—、HSO3—、HS—、H2PO4—等)
与OH—、H+均不能大量共存
(2)注意附加的隐含条件
①无色透明的溶液中,不存在有色离子。如Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO 4- (紫红色)等。
[注:澄清透明溶液指“不浑浊”,可以 “有色”]
②强酸性溶液
不存在与H+起反应的离子。
PH < 7的溶液
使石蕊试纸变红的溶液
③强碱性溶液
PH > 7的溶液
使酚酞试纸变红的溶液
不存在与OH-起反应的离子
归纳总结:
1.离子反应:有离子参加或生成的反应。
2.离子反应的特点:
向着降低某些离子数目的方向进行。
4.复分解型离子反应发生的条件:
产生难溶性的物质、易挥发性的物质、难电离的物质
沉 淀
气 体
弱电解质
课 堂小 结
3.离子方程式:
(1)离子方程式的书写步骤:写,拆,删,查
(2)离子方程式的意义:
用实际参加反应的离子符号来表示离子反应的式子
①表示某一个具体的化学反应;
②表示同一类型的离子反应。
5. 离子大量共存问题
【拓展延伸】
②过量CO2:
①少量CO2:
(1)CO2气体通入氢氧化钠溶液。
与量有关的离子方程式的书写
CO2+2OH- = CO32-+H2O
CO2+OH- = HCO3-
问:CO2气体通入Ca(OH)2溶液中呢
②过量CO2:
①少量CO2:
Ca2++2OH-+CO2 =CaCO3 +H2O
CO2+OH- = HCO3-
(1)Ca(HCO3)2溶液与NaOH溶液反应
①NaOH不足: ;
这里涉及两个连续的离子反应
解析:
1 : 1
+ OH—
HCO3—
CO32—+H2O
①
CO32—+Ca2+
= CaCO3↓
②
解题技巧:
“少定多变”法
少定
:量少的反应物按化学式配比将量定为“1”
多变
:过量的反应物其离子数目按反应需要的量确定,不受化学式离子比例的制约
若NaOH不足,则NaOH定为“1”
1份OH—需要1份HCO3—
+ OH—
HCO3—
CO32—+H2O
反应中生成1份CO32— ,需要1份Ca2+与之反应:
CO32—+Ca2+
= CaCO3↓
总:
OH-+
HCO3—
CO32—+H2O
+Ca2+
Ca
↓
少量定1
多变
(2)酸式盐与碱的反应:
②NaOH过量: ;
(1)Ca(HCO3)2溶液与NaOH溶液反应
若NaOH过量,则Ca(HCO3)2定为“1”
2份HCO3—需要2份OH—
+ OH—
HCO3—
CO32—+ H2O
反应中生成2份CO32— ,但只有1份Ca2+与之反应:
CO32—+Ca2+
= CaCO3↓
其中含1份Ca2+和2份HCO3—
2 2 2 2
Ca2++2HCO3— +2OH-=CO32—+2H2O+CaCO3↓
总:
因此CO32—多余一份没有形成沉淀
Ca2++2HCO3—
少量定1
+2OH-
CO32—+ 2H2O
2
+ CaCO3↓
多变
这里涉及两个连续的离子反应
解析:
1 : 1
+ OH—
HCO3—
CO32—+H2O
①
CO32—+Ca2+
= CaCO3↓
②
(2)酸式盐与碱的反应:
Ca2++2OH-+2HCO3—===CO32—+2H2O+CaCO3↓
①NaHCO3不足:
;
②NaHCO3过量:
。
少量定1
少量定1
多变
多变
2)NaHCO3溶液与Ca(OH)2溶液反应
换Ba(OH)2呢?
思考: Ca(HCO3)2溶液与Ca(OH)2溶液反应呢?
Ca2++ OH-+ HCO3— === CaCO3↓+ H2O
(2)酸式盐与碱的反应:
Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
常设量少的物质为1,据此调整过量物质的比例
【拓展延伸】
与量有关的离子方程式的书写
(3)Ba(OH)2与NaHSO4溶液混合。
①NaHSO4溶液不足时:
②NaHSO4溶液过量时:
Ba2++OH-+H++SO42- = BaSO4↓+H2O
“少定多变”
①溶液呈中性:
②溶液呈碱性:
。
Ba(OH)2 :NaHSO4
Ba(OH)2溶液与NaHSO4溶液的反应
1 : 2
Ba2++2OH-+2H++SO42—== BaSO4↓+2H2O
Ba(OH)2过量
,NaHSO4定为1
H++SO42—+OH-+Ba2+===BaSO4↓+H2O
③ Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+恰好完全沉淀
1 : 1
Ba2++SO42—+OH-+ H+===BaSO4↓+H2O
==
[思考与练习]
写出下列反应的离子方程式:
