1.3.3氧化还原反应规律及配平 课件(共33张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.3氧化还原反应规律及配平 课件(共33张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 16:43:33 | ||
图片预览







文档简介
(共33张PPT)
复习回忆
D
课本P28
大家用双线桥法表示电子转移的方向和数目
有什么特征和规律?
-1 +1 +1 0
用双线桥法表示电子转移的方向和数目
化合价升高, 失1×2e-, 被氧化
化合价降低, 得2×e-, 被还原
-1 +1 +1 0
化合价升高, 失1×e-, 被氧化
化合价降低, 得1×e-, 被还原
甲同学
乙同学
你认为哪个同学的正确?
第三节
氧化还原反应
第一章 物质及其变化
第3课时 氧化还原反应的规律及配平
氧化还原反应规律
氧化还原反应的配平
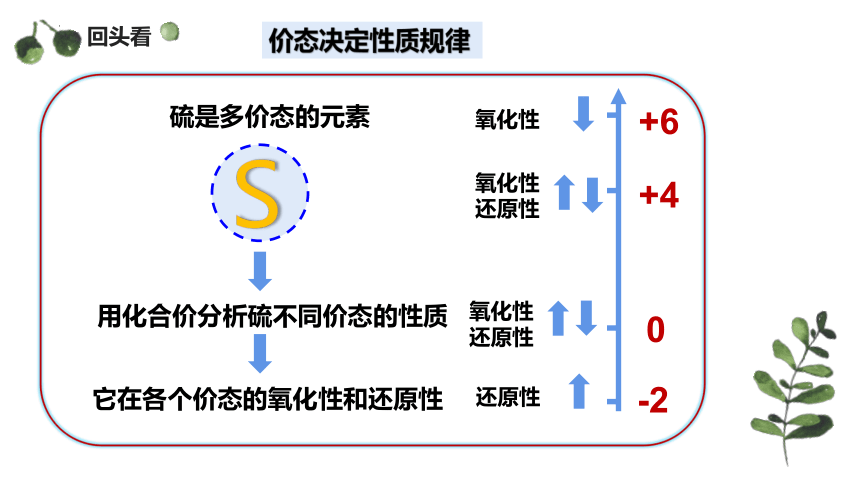
-2
0
+4
+6
S
它在各个价态的氧化性和还原性
氧化性
氧化性
还原性
氧化性
还原性
还原性
用化合价分析硫不同价态的性质
硫是多价态的元素
回头看
价态决定性质规律
01
氧化还原反应的规律
价态规律
氧化还原反应的规律
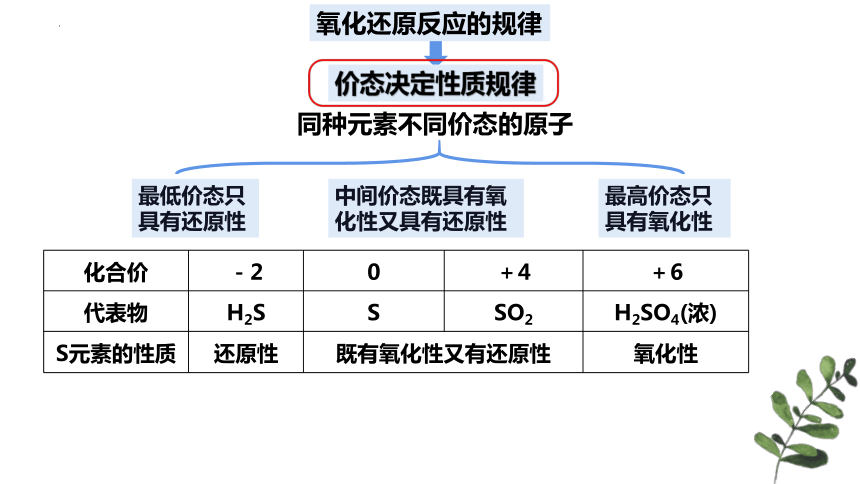
价态决定性质规律
同种元素不同价态的原子
最低价态只具有还原性
中间价态既具有氧化性又具有还原性
最高价态只具有氧化性
化合价 -2 0 +4 +6
代表物 H2S S SO2 H2SO4(浓)
S元素的性质 还原性 既有氧化性又有还原性 氧化性
学以致用
B
A
学以致用
3,下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2 D.O2、SO2、H2O
A
C
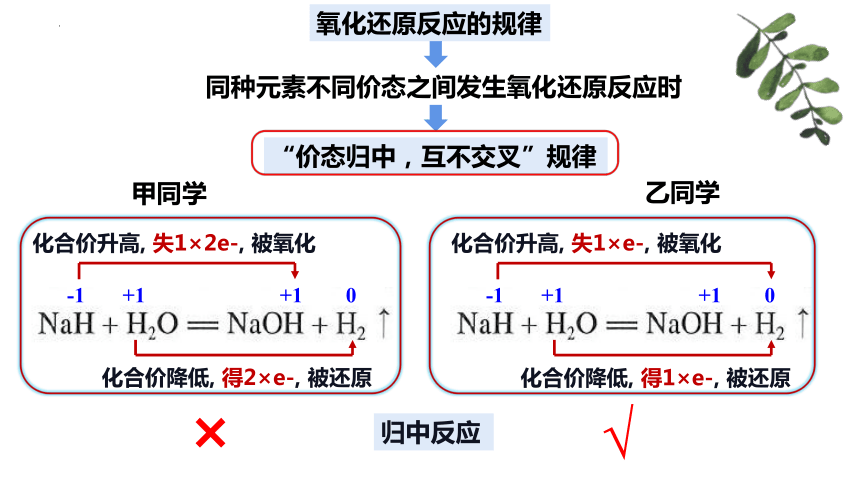
“价态归中,互不交叉”规律
同种元素不同价态之间发生氧化还原反应时
氧化还原反应的规律
-1 +1 +1 0
化合价升高, 失1×2e-, 被氧化
化合价降低, 得2×e-, 被还原
-1 +1 +1 0
化合价升高, 失1×e-, 被氧化
化合价降低, 得1×e-, 被还原
甲同学
乙同学
×
√
归中反应
深入了解
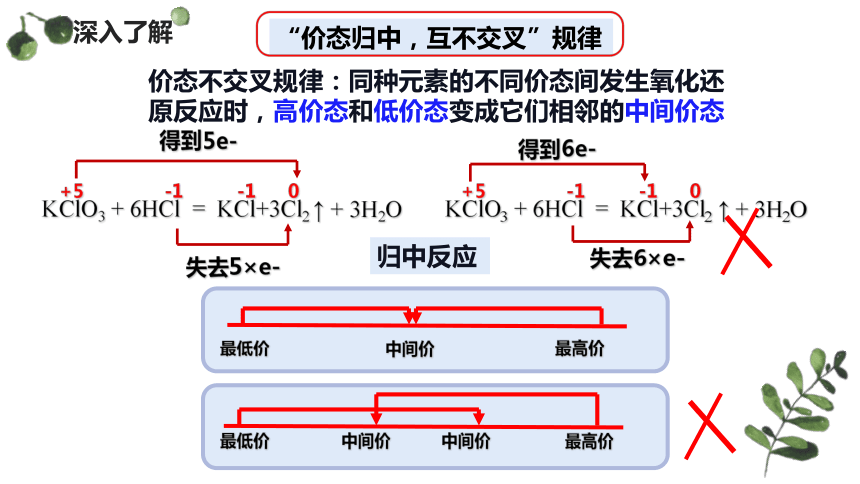
价态不交叉规律:同种元素的不同价态间发生氧化还原反应时,高价态和低价态变成它们相邻的中间价态
“价态归中,互不交叉”规律
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
得到5e-
失去5×e-
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去6×e-
得到6e-
最低价
最高价
中间价
最低价
最高价
中间价
中间价
归中反应
一、的概念
深入了解
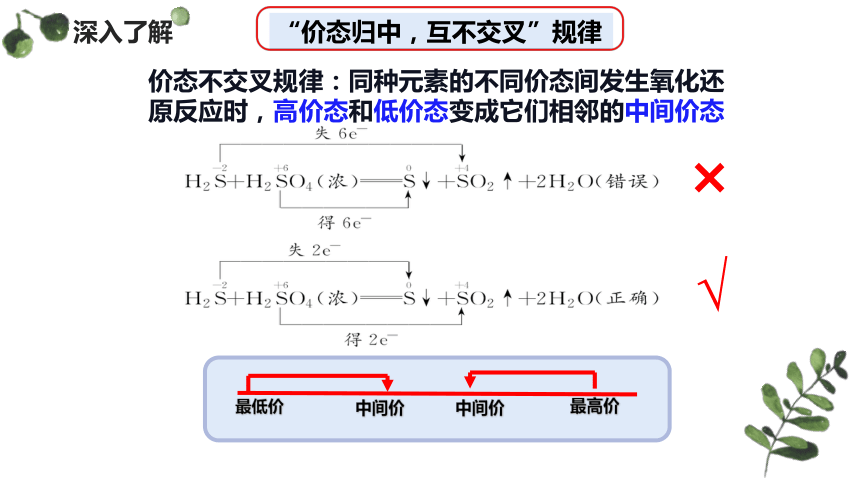
H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O
-2 +6 0 +4
失去2e-
得2e-
“价态归中,互不交叉”规律
价态不交叉规律:同种元素的不同价态间发生氧化还原反应时,高价态和低价态变成它们相邻的中间价态
×
√
最低价
最高价
中间价
中间价
学以致用
2,对反应:2H2S+SO2===3S +2H2O,被氧化的硫原子与被还原的硫原子的个数之比为( )
A.1:1 B.2:1 C.3:1 D.1:2
B
1,在反应 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,氧化产物与还原产物的质量之比为( )
A.1:6 B.6:1 C.1:5 D.5:1
D
归中反应
价态歧化规律
同一反应物中同种元素原子的化合价既升高又降低
Cl2 + 2NaOH= NaCl + NaClO + H2O
0 -1 +1
失去1×e-
得到1×e-
+4 +5 +2
学以致用
用双线桥法表示电子转移的方向和数目
失去2×e-
得到1×2e-
深入了解
歧化反应
02
氧化还原反应的规律
强弱规律
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
还原剂 + 氧化剂 = 氧化产物 + 还原产物
强弱规律
氧化还原反应的规律
较强还原性的还原剂跟较强氧化性的氧化剂反应,生成弱氧化性的氧化产物和弱还原性的还原产物。
比较粒子氧化性或还原性强弱;
判断氧化还原反应在一定条件下能否发生;
选择合适的氧化剂或还原剂制备物质。
应用
学以致用
1,根据下列反应:
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
3FeCl2+4HNO3==2FeCl3 + NO↑+ 2H2O +Fe(NO3)3
判断有关物质还原性由强到弱的顺序是( )
A.H2SO3> I- >Fe2+>NO B. I- >Fe2+>H2SO3> NO
C.Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3> I-
A
学以致用
2,已知:X2、Y2、Z2、W2四种物质的氧化强弱顺序为W2>Z2>X2>Y2,
下列氧化还原反应能发生的是( )
A.2NaW+Z2=2NaZ+W2 B.2NaX+Z2=2NaZ+X2
C.2NaY+W2=2NaW+Y2 D.2NaZ+X2=2NaX+Z2
BC
03
氧化还原反应的规律
先后规律
先后规律
氧化还原反应的规律
当一种氧化剂遇到几种还原剂,若均能反应,先跟还原性强的反应。
当一种还原剂遇到几种氧化剂,若均能反应,先跟氧化性强的反应。
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量的锌粉,首先置换出来的是( )
A.Mg B.Cu C.Ag D.H2
C
0
+1
失去2×e-,化合价升高,被氧化
-1
0
得到2×e-,化合价降低,被还原
2Na + Cl2 2NaCl
回头看
氧化还原反应的表示方法
氧化剂得电子总数=还原剂失电子总数
守恒规律
04
氧化还原反应的规律
守恒规律
守恒规律
氧化还原反应的规律
氧化剂得电子总数=还原剂失电子总数
化合价降低总数=化合价升高总数
应用
有关氧化还原反应的计算
配平氧化还原反应方程式
05
氧化还原反应方程式的配平
基本反应类型
氧化还原反应方程式的配平
基本原则
电子守恒原则
质量守恒原则
电荷守恒原则
氧化剂得电子总数=还原剂失电子总数
反应前后,元素种类和原子个数守恒
反应前后,阴阳离子所带电荷总数守恒
标价态
列得失
求总数
配系数
查守恒
一般步骤
深入了解
示例:
①标价态——标出变化的元素化合价
Zn+ HNO3 Zn(NO3)2+ NO + H2O
0 +5 +2 +2
②列得失——标出化合价的变化值(双线桥法)
Zn+ HNO3 Zn(NO3)2+ NO + H2O
0 +5 +2 +2
得3e-
失2e-
③求总数——求出得失电子的最小公倍数
Zn+ HNO3 Zn(NO3)2+ NO + H2O
0 +5 +2 +2
得3e-
失2e-
×3
×2
④配系数——确定氧化剂、还原剂、氧化产物和还原产物的系数,
再根据质量守恒配平其他物质
Zn+ HNO3 Zn(NO3)2+ NO + H2O
0 +5 +2 +2
得3e-
失2e-
×3
×2
3 2 3 2 4
⑤查守恒——检查电子、电荷、质量守恒
+5
没有变价的氮原子 2×3
+6
8
氧化还原反应方程式的配平
示例:
列变化
0
+5
+2
+2
化合价升高 2
化合价升高 3
求总数
化合价升高 2×3
化合价升高 3×2
0
+5
+2
+2
配系数
化合价升高 2×3
化合价升高 3×2
0
+5
+2
+2
查守恒
学以致用
学以致用
BC
课后练氧化还原反应的方程式
① I2 + KOH — KI + KIO3 + H2O
② NH3 + NO2 — N2 + H2O
③ C2H6 + O2 — CO2 + H2O
④ KMnO4 + HCl — KCl + MnCl2 + H2O + Cl2↑
学以致用
答案:
① 1 I2 + 6 KOH — 5 KI +1 KIO3 + 3 H2O
② 8 NH3 + 6 NO2 —7 N2 + 12 H2O
③ 2 C2H6 +7 O2 — 4 CO2 + 6 H2O
④2KMnO4 +16HCl —2KCl + 2MnCl2 +8H2O +5Cl2↑
谢谢观看
复习回忆
D
课本P28
大家用双线桥法表示电子转移的方向和数目
有什么特征和规律?
-1 +1 +1 0
用双线桥法表示电子转移的方向和数目
化合价升高, 失1×2e-, 被氧化
化合价降低, 得2×e-, 被还原
-1 +1 +1 0
化合价升高, 失1×e-, 被氧化
化合价降低, 得1×e-, 被还原
甲同学
乙同学
你认为哪个同学的正确?
第三节
氧化还原反应
第一章 物质及其变化
第3课时 氧化还原反应的规律及配平
氧化还原反应规律
氧化还原反应的配平
-2
0
+4
+6
S
它在各个价态的氧化性和还原性
氧化性
氧化性
还原性
氧化性
还原性
还原性
用化合价分析硫不同价态的性质
硫是多价态的元素
回头看
价态决定性质规律
01
氧化还原反应的规律
价态规律
氧化还原反应的规律
价态决定性质规律
同种元素不同价态的原子
最低价态只具有还原性
中间价态既具有氧化性又具有还原性
最高价态只具有氧化性
化合价 -2 0 +4 +6
代表物 H2S S SO2 H2SO4(浓)
S元素的性质 还原性 既有氧化性又有还原性 氧化性
学以致用
B
A
学以致用
3,下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2 D.O2、SO2、H2O
A
C
“价态归中,互不交叉”规律
同种元素不同价态之间发生氧化还原反应时
氧化还原反应的规律
-1 +1 +1 0
化合价升高, 失1×2e-, 被氧化
化合价降低, 得2×e-, 被还原
-1 +1 +1 0
化合价升高, 失1×e-, 被氧化
化合价降低, 得1×e-, 被还原
甲同学
乙同学
×
√
归中反应
深入了解
价态不交叉规律:同种元素的不同价态间发生氧化还原反应时,高价态和低价态变成它们相邻的中间价态
“价态归中,互不交叉”规律
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
得到5e-
失去5×e-
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去6×e-
得到6e-
最低价
最高价
中间价
最低价
最高价
中间价
中间价
归中反应
一、的概念
深入了解
H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O
-2 +6 0 +4
失去2e-
得2e-
“价态归中,互不交叉”规律
价态不交叉规律:同种元素的不同价态间发生氧化还原反应时,高价态和低价态变成它们相邻的中间价态
×
√
最低价
最高价
中间价
中间价
学以致用
2,对反应:2H2S+SO2===3S +2H2O,被氧化的硫原子与被还原的硫原子的个数之比为( )
A.1:1 B.2:1 C.3:1 D.1:2
B
1,在反应 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,氧化产物与还原产物的质量之比为( )
A.1:6 B.6:1 C.1:5 D.5:1
D
归中反应
价态歧化规律
同一反应物中同种元素原子的化合价既升高又降低
Cl2 + 2NaOH= NaCl + NaClO + H2O
0 -1 +1
失去1×e-
得到1×e-
+4 +5 +2
学以致用
用双线桥法表示电子转移的方向和数目
失去2×e-
得到1×2e-
深入了解
歧化反应
02
氧化还原反应的规律
强弱规律
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
还原剂 + 氧化剂 = 氧化产物 + 还原产物
强弱规律
氧化还原反应的规律
较强还原性的还原剂跟较强氧化性的氧化剂反应,生成弱氧化性的氧化产物和弱还原性的还原产物。
比较粒子氧化性或还原性强弱;
判断氧化还原反应在一定条件下能否发生;
选择合适的氧化剂或还原剂制备物质。
应用
学以致用
1,根据下列反应:
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
3FeCl2+4HNO3==2FeCl3 + NO↑+ 2H2O +Fe(NO3)3
判断有关物质还原性由强到弱的顺序是( )
A.H2SO3> I- >Fe2+>NO B. I- >Fe2+>H2SO3> NO
C.Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3> I-
A
学以致用
2,已知:X2、Y2、Z2、W2四种物质的氧化强弱顺序为W2>Z2>X2>Y2,
下列氧化还原反应能发生的是( )
A.2NaW+Z2=2NaZ+W2 B.2NaX+Z2=2NaZ+X2
C.2NaY+W2=2NaW+Y2 D.2NaZ+X2=2NaX+Z2
BC
03
氧化还原反应的规律
先后规律
先后规律
氧化还原反应的规律
当一种氧化剂遇到几种还原剂,若均能反应,先跟还原性强的反应。
当一种还原剂遇到几种氧化剂,若均能反应,先跟氧化性强的反应。
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量的锌粉,首先置换出来的是( )
A.Mg B.Cu C.Ag D.H2
C
0
+1
失去2×e-,化合价升高,被氧化
-1
0
得到2×e-,化合价降低,被还原
2Na + Cl2 2NaCl
回头看
氧化还原反应的表示方法
氧化剂得电子总数=还原剂失电子总数
守恒规律
04
氧化还原反应的规律
守恒规律
守恒规律
氧化还原反应的规律
氧化剂得电子总数=还原剂失电子总数
化合价降低总数=化合价升高总数
应用
有关氧化还原反应的计算
配平氧化还原反应方程式
05
氧化还原反应方程式的配平
基本反应类型
氧化还原反应方程式的配平
基本原则
电子守恒原则
质量守恒原则
电荷守恒原则
氧化剂得电子总数=还原剂失电子总数
反应前后,元素种类和原子个数守恒
反应前后,阴阳离子所带电荷总数守恒
标价态
列得失
求总数
配系数
查守恒
一般步骤
深入了解
示例:
①标价态——标出变化的元素化合价
Zn+ HNO3 Zn(NO3)2+ NO + H2O
0 +5 +2 +2
②列得失——标出化合价的变化值(双线桥法)
Zn+ HNO3 Zn(NO3)2+ NO + H2O
0 +5 +2 +2
得3e-
失2e-
③求总数——求出得失电子的最小公倍数
Zn+ HNO3 Zn(NO3)2+ NO + H2O
0 +5 +2 +2
得3e-
失2e-
×3
×2
④配系数——确定氧化剂、还原剂、氧化产物和还原产物的系数,
再根据质量守恒配平其他物质
Zn+ HNO3 Zn(NO3)2+ NO + H2O
0 +5 +2 +2
得3e-
失2e-
×3
×2
3 2 3 2 4
⑤查守恒——检查电子、电荷、质量守恒
+5
没有变价的氮原子 2×3
+6
8
氧化还原反应方程式的配平
示例:
列变化
0
+5
+2
+2
化合价升高 2
化合价升高 3
求总数
化合价升高 2×3
化合价升高 3×2
0
+5
+2
+2
配系数
化合价升高 2×3
化合价升高 3×2
0
+5
+2
+2
查守恒
学以致用
学以致用
BC
课后练氧化还原反应的方程式
① I2 + KOH — KI + KIO3 + H2O
② NH3 + NO2 — N2 + H2O
③ C2H6 + O2 — CO2 + H2O
④ KMnO4 + HCl — KCl + MnCl2 + H2O + Cl2↑
学以致用
答案:
① 1 I2 + 6 KOH — 5 KI +1 KIO3 + 3 H2O
② 8 NH3 + 6 NO2 —7 N2 + 12 H2O
③ 2 C2H6 +7 O2 — 4 CO2 + 6 H2O
④2KMnO4 +16HCl —2KCl + 2MnCl2 +8H2O +5Cl2↑
谢谢观看
