化学(沪教版)九年级上册综合练习:3.1 构成物质的基本微粒(第2课时)(含解析)
文档属性
| 名称 | 化学(沪教版)九年级上册综合练习:3.1 构成物质的基本微粒(第2课时)(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 87.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 16:13:28 | ||
图片预览



文档简介
3.1 构成物质的基本微粒
(第2课时 原子)
一、单选题
1.下列说法错误的是
A.原子核由质子、中子构成 B.花香四溢主要是分子之间有间隔
C.保持水化学性质的微粒是水分子 D.催化剂在化学反应前后其质量和化学性质都不变
2.疫情期间,同学们由于上网课用眼增多,容易引发近视。科学家通过研究发现青少年近视还可能与体内缺少微量元素铬有关。铬原子的相对原子质量是52,核电荷数是24,则铬原子的核外电子数为
A.24 B.28 C.52 D.76
3.下列对分子、原子、离子的认识,不正确的是
A.分子都是由原子构成的 B.原子通过得失电子形成离子
C.带电荷的微粒一定是离子 D.分子、原子、离子都可以直接构成物质
4.下列各图中“○”和“●”分别表示两种质子数不同的原子,其中能表示混合物的图是
A. B.
C. D.
5.下列关于原子的叙述正确的是
A.物质都是由原子直接构成的 B.任何一种原子都含有质子、中子和电子
C.原子是由质子和中子构成的 D.原子是由原子核和核外电子构成的
6.原子呈中性的原因是
A.构成原子的各种微粒都不带电
B.原子核外的电子数大于核内的质子数
C.原子核所带电量与核外电子所带电量相等,电性相反
D.核内质子数等于核电荷数
7.下列说法错误的是
A.在原子中,质子数=核外电子数=核电荷数
B.由分子构成的物质,分子是保持物质化学性质的最小粒子
C.分子可以构成物质,而原子只能构成分子
D.在化学变化中,分子可以分成原子,而原子不能再分
8.下列关于分子和原子的说法正确的是
A.水分子比氢原子、氧原子大,所以分子比原子大
B.分子可以分,原子不可分
C.同种原子可以构成不同分子
D.分子是保持物质性质的一种粒子
9.一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如图。①、②、③表示水在不同时刻的存在状态,下列有关判断正确的是
A.水分子间的间隔:①>③ B.水分子的运动速率:①<②
C.状态③的水分子静止不动 D.①→②发生了化学变化
10.对Fe3+、Fe2+、Fe三种粒子的判断,说法正确的是
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤质子数相等
A.①③④ B.①③⑤ C.①④⑤ D.②③④
11.考古学家通过检测碳14原子判断文物年代,这种碳原子的核电荷数为6,中子数为8,而普通碳原子核电荷数为6,中子数也为6,则关于这种碳14原子说法正确的是
A.电子数为14 B.质子数为6
C.相对原子质量为14 g D.与普通碳原子质量相同
二、填空题
12.在①分子;②原子;③原子核;④质子;⑤中子;⑥电子等粒子中,找出符合下列条件的粒子的序号填在相应的横线上。
(1)能构成纯净物的粒子是___________;
(2)质量最小的粒子是________;
(3)能保持物质化学性质的粒子是_______;
(4)带正电荷的粒子是________;
(5)化学变化中的最小粒子是___________;
(6)不显电性的粒子是________;
(7)在同一原子中数目相等的粒子是___________。
13.对于物质微观构成的了解,有助于对物质性质、用途的认识。
(1)如图是表示气体分子的示意图,图中和分别表示两种不同质子数的原子。
①属于纯净物的有_______(填字母,下同);
②属于单质的_______;
③属于混合物的有_______。
(2)用微粒的观点解释下列问题:
①保持水的化学性质的微粒是:_______;
②用抹布擦过的黑板,一段时间后变干的原因_______。
(3)用“分子”“原子”“离子”填空:食盐是由_______构成;金属铜是由_______构成;氢气是由_______构成。
三、实验题
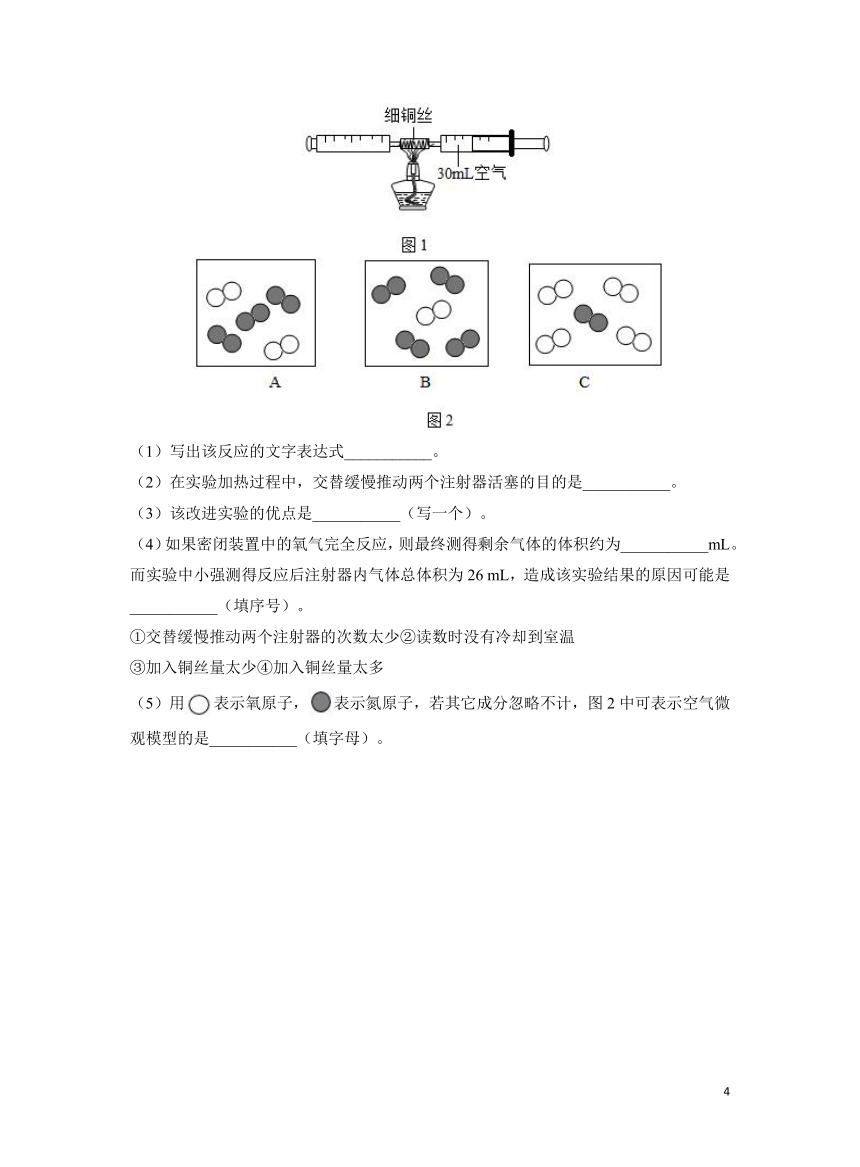
14.如图1所示是某同学改进教材中测定空气中氧气含量的装置,在由两个注射器组成的密闭系统中留有30 mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞。
(1)写出该反应的文字表达式___________。
(2)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是___________。
(3)该改进实验的优点是___________(写一个)。
(4)如果密闭装置中的氧气完全反应,则最终测得剩余气体的体积约为___________mL。而实验中小强测得反应后注射器内气体总体积为26 mL,造成该实验结果的原因可能是___________(填序号)。
①交替缓慢推动两个注射器的次数太少②读数时没有冷却到室温
③加入铜丝量太少④加入铜丝量太多
(5)用表示氧原子,表示氮原子,若其它成分忽略不计,图2中可表示空气微观模型的是___________(填字母)。
参考答案
一、单选题
1.【答案】B
【详解】
A.原子核是由质子、中子构成,选项A正确;
B.花香四溢主要是因为分子在不断运动,选项B错误;
C.分子是保持物质化学性质的最小粒子,所以保持水化学性质的微粒是水分子,选项C正确;
D.催化剂能改变化学反应的速率,而在化学反应前后其本身的质量和化学性质都不发生改变,选项D正确。
故选:B
2.【答案】A
【分析】
原子中:质子数=电子数=核电荷数;相对原子质量=质子数+中子数。
【详解】
在原子中:质子数=电子数=核电荷数,可知铬原子的核外电子数为24。
故选A。
3.【答案】C
【详解】
A.分子是由原子构成的,不符合题意;
B.原子可通过得失电子形成离子,不符合题意;
C.带电荷的微粒不一定是离子,如质子和电子,符合题意;
D.分子、原子、离子都是构成物质的微粒,如水由水分子构成,铁由铁原子构成,氯化钠由钠离子和氯离子构成,不符合题意。
故选C。
4.【答案】B
【详解】
A.由图可知,图中只有一种分子,即图中只含有一种物质,属于纯净物,选项错误;
B.由图可知,图中含有三种分子,即图中含有三种物质,属于混合物,选项正确;
C.由图可知,图中只含有一种原子,即图中只含有一种由原子直接构成的物质,属于纯净物,选项错误;
D.由图可知,图中只含有一种分子,即图中只含有一种物质,属于纯净物,选项错误。
故选B。
5.【答案】D
【详解】
A.构成物质的微粒有原子、分子、离子,有的物质是由分子和离子构成的,故A不正确;
B.氢原子没有中子,故B不正确;
C.原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,故C不正确;
D.原子是由原子核和核外电子构成的,故D正确。
故选D。
6.【答案】C
【详解】
A.原子是由带正电荷的原子核和带负电荷的电子构成的,故A错误;
B.原子中,核内的质子数=核外的电子数,故B错误;
C.原子核带正电荷,电子带负电荷,且数值相等,所以原子呈中性,故C正确;
D.核内质子数等于核电荷数,但不能说明原子是否呈中性,故D错误。
故选C。
7.【答案】C
【详解】
A.在原子中,质子数=核外电子数=核电荷数,选项正确,不符合题意;
B.由分子构成的物质,分子是保持物质化学性质的最小粒子,选项正确,不符合题意;
C.分子可以构成物质,原子也可以构成物质,如水由水分子构成,铁由铁原子构成,选项错误,符合题意;
D.在化学变化中,分子可以分成原子,而原子不能再分,选项正确,不符合题意。
故选C。
8.【答案】C
【详解】
A.水分子比氢原子、氧原子大,但是分子不一定比原子大,如氢分子小于铁原子,不符合题意;
B.在化学变化中,分子可以分,原子不可分,原子还可分为原子核和核外电子,不符合题意;
C.同种原子可以构成不同分子,如氧原子可构成氧分子和臭氧分子,符合题意;
D.由分子构成的物质,分子是保持物质化学性质的最小粒子,不符合题意。
故选C。
9.【答案】A
【详解】
A.①是水蒸气状态,③是冰的状态,水分子间的间隔:①>③,故A正确;
B.状态①的温度较高,在状态①时水分子的运动速率大于状态②,故B不正确;
C.构成物质的分子在不停地运动,则状态③的水分子仍在运动,故C不正确;
D.①→②是水的状态发生变化,没有产生新物质,是物理变化,故D不正确。
故选A。
10.【答案】C
【详解】
①Fe3+、Fe2+、Fe三种粒子均是铁元素的不同微粒,则核电荷数相同,故正确;
②Fe3+、Fe2+是均是铁原子失去电子形成的,核外电子数不相等,故不正确;
③Fe3+、Fe2+是均是铁原子失去电子形成的,电子层结构不相同,故不正确;
④电子的质量很小,则质量几乎相等,故正确;
⑤Fe3+、Fe2+、Fe三种粒子均是铁元素的不同微粒,则质子数相等,故正确。
故选C。
11.【答案】B
【详解】
A.原子钟核电荷数=质子数=核外电子数,所以电子数为6。错误;
B.质子数为6,正确;
C.相对原子质量约为14,相对原子质量的单位是1不是g。错误;
D.与普通碳原子的中子数不同,质子数相同,所以与普通碳原子的质量不同。错误。
故选B。
二、填空题
12.【答案】
(1)①②
(2)⑥
(3)①②
(4)③④
(5)②
(6)①②⑤
(7)④⑥
【分析】
(1)分子和原子都可以直接构成物质,故填①②;
(2)电子是质量最小的微粒,故填⑥;
(3)由分子构成的物质,分子保持物质的化学性质;由原子构成的物质,原子保持物质的化学性质,故填①②;
(4)原子核、质子带正电荷,故填③④;
(5)原子是化学变化中最小的粒子,故填②;
(6)分子、原子、中子不显电性,故填①②⑤;
(7)在原子中,核内质子数=核外电子数,故填④⑥。
13.【答案】
(1)AC A BD
(2)水分子 分子在不断运动
(3)离子 原子 分子
【分析】
(1)①AC图示中都只由一种分子构成,都属于纯净物;
②A中由一种原子构成,属于单质;
③BD图示中都至少有两种分子构成,都属于混合物;
(2)①水是由水分子构成的,故保持水的化学性质的微粒是水分子;
②用湿抹布擦过的桌面,一段时间后变干的原因是分子不断运动,水分子扩散到空气中去了;
(3)食盐的主要成分是氯化钠,是由离子构成;金属铜是金属单质,是由原子构成;氢气是由分子构成。
三、实验题
14.【答案】
(1)铜+氧气氧化铜
(2)使装置中的氧气完全反应
(3)实验结果更准确或更环保等
(4)24 ①②③
(5)B
【分析】
(1)铜和氧气加热条件下反应生成氧化铜,文字表达式为。
(2)交替缓慢推动两个注射器活塞的目的是使氧气与铜充分接触,使装置中的氧气完全反应。
(3)该改进实验不会生成五氧化二磷污染物,更环保。不用打开装置避免气体逸出,实验结果更准确。
(4)氧气约占空气体积的五分之一。所以最终测得剩余气体的体积约为30 mL×=
24 mL。结果偏大。可能①交替缓慢推动两个注射器的次数太少,氧气未充分消耗。 ②读数时没有冷却到室温,气体膨胀体积偏大。③加入铜丝量太少 未能将氧气完全消耗。故选①②③。
(5)氧气占空气体积分数的21%,氮气占78%,所以空气微观模型每1个氧气分子对应有4个氮气分子,故选B。
1
(第2课时 原子)
一、单选题
1.下列说法错误的是
A.原子核由质子、中子构成 B.花香四溢主要是分子之间有间隔
C.保持水化学性质的微粒是水分子 D.催化剂在化学反应前后其质量和化学性质都不变
2.疫情期间,同学们由于上网课用眼增多,容易引发近视。科学家通过研究发现青少年近视还可能与体内缺少微量元素铬有关。铬原子的相对原子质量是52,核电荷数是24,则铬原子的核外电子数为
A.24 B.28 C.52 D.76
3.下列对分子、原子、离子的认识,不正确的是
A.分子都是由原子构成的 B.原子通过得失电子形成离子
C.带电荷的微粒一定是离子 D.分子、原子、离子都可以直接构成物质
4.下列各图中“○”和“●”分别表示两种质子数不同的原子,其中能表示混合物的图是
A. B.
C. D.
5.下列关于原子的叙述正确的是
A.物质都是由原子直接构成的 B.任何一种原子都含有质子、中子和电子
C.原子是由质子和中子构成的 D.原子是由原子核和核外电子构成的
6.原子呈中性的原因是
A.构成原子的各种微粒都不带电
B.原子核外的电子数大于核内的质子数
C.原子核所带电量与核外电子所带电量相等,电性相反
D.核内质子数等于核电荷数
7.下列说法错误的是
A.在原子中,质子数=核外电子数=核电荷数
B.由分子构成的物质,分子是保持物质化学性质的最小粒子
C.分子可以构成物质,而原子只能构成分子
D.在化学变化中,分子可以分成原子,而原子不能再分
8.下列关于分子和原子的说法正确的是
A.水分子比氢原子、氧原子大,所以分子比原子大
B.分子可以分,原子不可分
C.同种原子可以构成不同分子
D.分子是保持物质性质的一种粒子
9.一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如图。①、②、③表示水在不同时刻的存在状态,下列有关判断正确的是
A.水分子间的间隔:①>③ B.水分子的运动速率:①<②
C.状态③的水分子静止不动 D.①→②发生了化学变化
10.对Fe3+、Fe2+、Fe三种粒子的判断,说法正确的是
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤质子数相等
A.①③④ B.①③⑤ C.①④⑤ D.②③④
11.考古学家通过检测碳14原子判断文物年代,这种碳原子的核电荷数为6,中子数为8,而普通碳原子核电荷数为6,中子数也为6,则关于这种碳14原子说法正确的是
A.电子数为14 B.质子数为6
C.相对原子质量为14 g D.与普通碳原子质量相同
二、填空题
12.在①分子;②原子;③原子核;④质子;⑤中子;⑥电子等粒子中,找出符合下列条件的粒子的序号填在相应的横线上。
(1)能构成纯净物的粒子是___________;
(2)质量最小的粒子是________;
(3)能保持物质化学性质的粒子是_______;
(4)带正电荷的粒子是________;
(5)化学变化中的最小粒子是___________;
(6)不显电性的粒子是________;
(7)在同一原子中数目相等的粒子是___________。
13.对于物质微观构成的了解,有助于对物质性质、用途的认识。
(1)如图是表示气体分子的示意图,图中和分别表示两种不同质子数的原子。
①属于纯净物的有_______(填字母,下同);
②属于单质的_______;
③属于混合物的有_______。
(2)用微粒的观点解释下列问题:
①保持水的化学性质的微粒是:_______;
②用抹布擦过的黑板,一段时间后变干的原因_______。
(3)用“分子”“原子”“离子”填空:食盐是由_______构成;金属铜是由_______构成;氢气是由_______构成。
三、实验题
14.如图1所示是某同学改进教材中测定空气中氧气含量的装置,在由两个注射器组成的密闭系统中留有30 mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞。
(1)写出该反应的文字表达式___________。
(2)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是___________。
(3)该改进实验的优点是___________(写一个)。
(4)如果密闭装置中的氧气完全反应,则最终测得剩余气体的体积约为___________mL。而实验中小强测得反应后注射器内气体总体积为26 mL,造成该实验结果的原因可能是___________(填序号)。
①交替缓慢推动两个注射器的次数太少②读数时没有冷却到室温
③加入铜丝量太少④加入铜丝量太多
(5)用表示氧原子,表示氮原子,若其它成分忽略不计,图2中可表示空气微观模型的是___________(填字母)。
参考答案
一、单选题
1.【答案】B
【详解】
A.原子核是由质子、中子构成,选项A正确;
B.花香四溢主要是因为分子在不断运动,选项B错误;
C.分子是保持物质化学性质的最小粒子,所以保持水化学性质的微粒是水分子,选项C正确;
D.催化剂能改变化学反应的速率,而在化学反应前后其本身的质量和化学性质都不发生改变,选项D正确。
故选:B
2.【答案】A
【分析】
原子中:质子数=电子数=核电荷数;相对原子质量=质子数+中子数。
【详解】
在原子中:质子数=电子数=核电荷数,可知铬原子的核外电子数为24。
故选A。
3.【答案】C
【详解】
A.分子是由原子构成的,不符合题意;
B.原子可通过得失电子形成离子,不符合题意;
C.带电荷的微粒不一定是离子,如质子和电子,符合题意;
D.分子、原子、离子都是构成物质的微粒,如水由水分子构成,铁由铁原子构成,氯化钠由钠离子和氯离子构成,不符合题意。
故选C。
4.【答案】B
【详解】
A.由图可知,图中只有一种分子,即图中只含有一种物质,属于纯净物,选项错误;
B.由图可知,图中含有三种分子,即图中含有三种物质,属于混合物,选项正确;
C.由图可知,图中只含有一种原子,即图中只含有一种由原子直接构成的物质,属于纯净物,选项错误;
D.由图可知,图中只含有一种分子,即图中只含有一种物质,属于纯净物,选项错误。
故选B。
5.【答案】D
【详解】
A.构成物质的微粒有原子、分子、离子,有的物质是由分子和离子构成的,故A不正确;
B.氢原子没有中子,故B不正确;
C.原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,故C不正确;
D.原子是由原子核和核外电子构成的,故D正确。
故选D。
6.【答案】C
【详解】
A.原子是由带正电荷的原子核和带负电荷的电子构成的,故A错误;
B.原子中,核内的质子数=核外的电子数,故B错误;
C.原子核带正电荷,电子带负电荷,且数值相等,所以原子呈中性,故C正确;
D.核内质子数等于核电荷数,但不能说明原子是否呈中性,故D错误。
故选C。
7.【答案】C
【详解】
A.在原子中,质子数=核外电子数=核电荷数,选项正确,不符合题意;
B.由分子构成的物质,分子是保持物质化学性质的最小粒子,选项正确,不符合题意;
C.分子可以构成物质,原子也可以构成物质,如水由水分子构成,铁由铁原子构成,选项错误,符合题意;
D.在化学变化中,分子可以分成原子,而原子不能再分,选项正确,不符合题意。
故选C。
8.【答案】C
【详解】
A.水分子比氢原子、氧原子大,但是分子不一定比原子大,如氢分子小于铁原子,不符合题意;
B.在化学变化中,分子可以分,原子不可分,原子还可分为原子核和核外电子,不符合题意;
C.同种原子可以构成不同分子,如氧原子可构成氧分子和臭氧分子,符合题意;
D.由分子构成的物质,分子是保持物质化学性质的最小粒子,不符合题意。
故选C。
9.【答案】A
【详解】
A.①是水蒸气状态,③是冰的状态,水分子间的间隔:①>③,故A正确;
B.状态①的温度较高,在状态①时水分子的运动速率大于状态②,故B不正确;
C.构成物质的分子在不停地运动,则状态③的水分子仍在运动,故C不正确;
D.①→②是水的状态发生变化,没有产生新物质,是物理变化,故D不正确。
故选A。
10.【答案】C
【详解】
①Fe3+、Fe2+、Fe三种粒子均是铁元素的不同微粒,则核电荷数相同,故正确;
②Fe3+、Fe2+是均是铁原子失去电子形成的,核外电子数不相等,故不正确;
③Fe3+、Fe2+是均是铁原子失去电子形成的,电子层结构不相同,故不正确;
④电子的质量很小,则质量几乎相等,故正确;
⑤Fe3+、Fe2+、Fe三种粒子均是铁元素的不同微粒,则质子数相等,故正确。
故选C。
11.【答案】B
【详解】
A.原子钟核电荷数=质子数=核外电子数,所以电子数为6。错误;
B.质子数为6,正确;
C.相对原子质量约为14,相对原子质量的单位是1不是g。错误;
D.与普通碳原子的中子数不同,质子数相同,所以与普通碳原子的质量不同。错误。
故选B。
二、填空题
12.【答案】
(1)①②
(2)⑥
(3)①②
(4)③④
(5)②
(6)①②⑤
(7)④⑥
【分析】
(1)分子和原子都可以直接构成物质,故填①②;
(2)电子是质量最小的微粒,故填⑥;
(3)由分子构成的物质,分子保持物质的化学性质;由原子构成的物质,原子保持物质的化学性质,故填①②;
(4)原子核、质子带正电荷,故填③④;
(5)原子是化学变化中最小的粒子,故填②;
(6)分子、原子、中子不显电性,故填①②⑤;
(7)在原子中,核内质子数=核外电子数,故填④⑥。
13.【答案】
(1)AC A BD
(2)水分子 分子在不断运动
(3)离子 原子 分子
【分析】
(1)①AC图示中都只由一种分子构成,都属于纯净物;
②A中由一种原子构成,属于单质;
③BD图示中都至少有两种分子构成,都属于混合物;
(2)①水是由水分子构成的,故保持水的化学性质的微粒是水分子;
②用湿抹布擦过的桌面,一段时间后变干的原因是分子不断运动,水分子扩散到空气中去了;
(3)食盐的主要成分是氯化钠,是由离子构成;金属铜是金属单质,是由原子构成;氢气是由分子构成。
三、实验题
14.【答案】
(1)铜+氧气氧化铜
(2)使装置中的氧气完全反应
(3)实验结果更准确或更环保等
(4)24 ①②③
(5)B
【分析】
(1)铜和氧气加热条件下反应生成氧化铜,文字表达式为。
(2)交替缓慢推动两个注射器活塞的目的是使氧气与铜充分接触,使装置中的氧气完全反应。
(3)该改进实验不会生成五氧化二磷污染物,更环保。不用打开装置避免气体逸出,实验结果更准确。
(4)氧气约占空气体积的五分之一。所以最终测得剩余气体的体积约为30 mL×=
24 mL。结果偏大。可能①交替缓慢推动两个注射器的次数太少,氧气未充分消耗。 ②读数时没有冷却到室温,气体膨胀体积偏大。③加入铜丝量太少 未能将氧气完全消耗。故选①②③。
(5)氧气占空气体积分数的21%,氮气占78%,所以空气微观模型每1个氧气分子对应有4个氮气分子,故选B。
1
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
