化学沪教版九年级上册 :3.1 构成物质的基本微粒(第4课时)课件(共23张PPT)
文档属性
| 名称 | 化学沪教版九年级上册 :3.1 构成物质的基本微粒(第4课时)课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 18:37:33 | ||
图片预览


文档简介
(共23张PPT)
离子
构成物质的基本微粒
第三章 物质构成的奥秘
科学史话
1913年,玻尔(是卢瑟福的学生)在有核模型的基础上,提出原子轨道模型,认为当原子只有一个电子时,电子沿特定球形轨道运行;当原子有多个电子时,电子将分层排布,在不同的轨道上运行,按能量高低而距核远近不同。
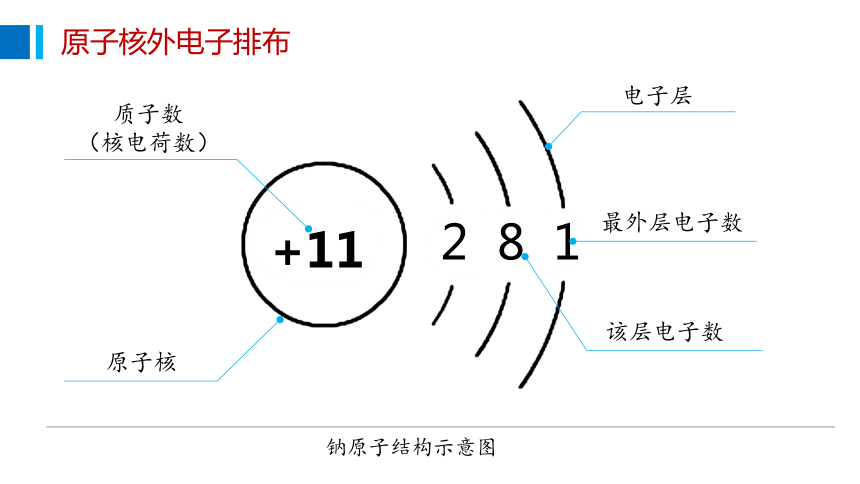
+11
2 8 1
钠原子结构示意图
质子数
(核电荷数)
原子核
电子层
最外层电子数
该层电子数
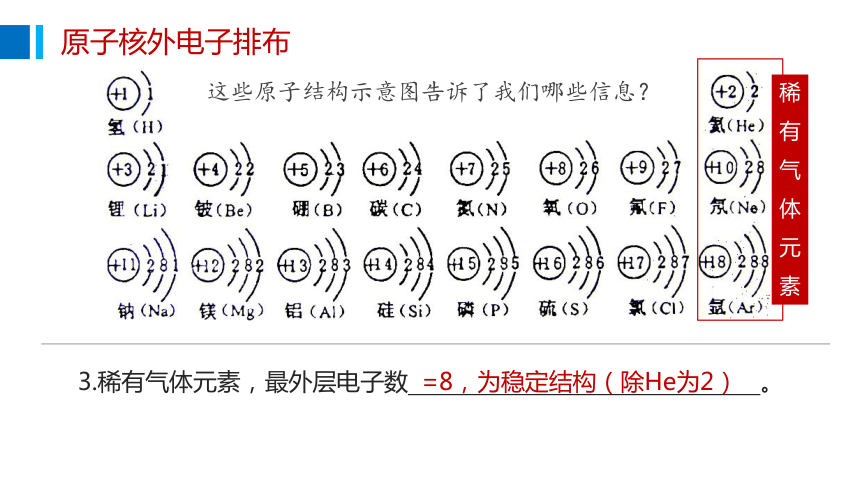
原子核外电子排布
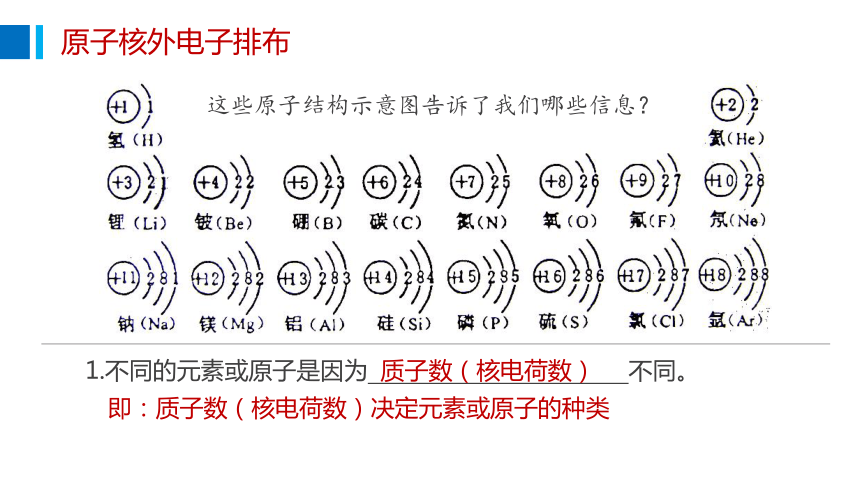
这些原子结构示意图告诉了我们哪些信息?
原子核外电子排布
1.不同的元素或原子是因为 不同。
质子数(核电荷数)
即:质子数(核电荷数)决定元素或原子的种类
原子核外电子排布
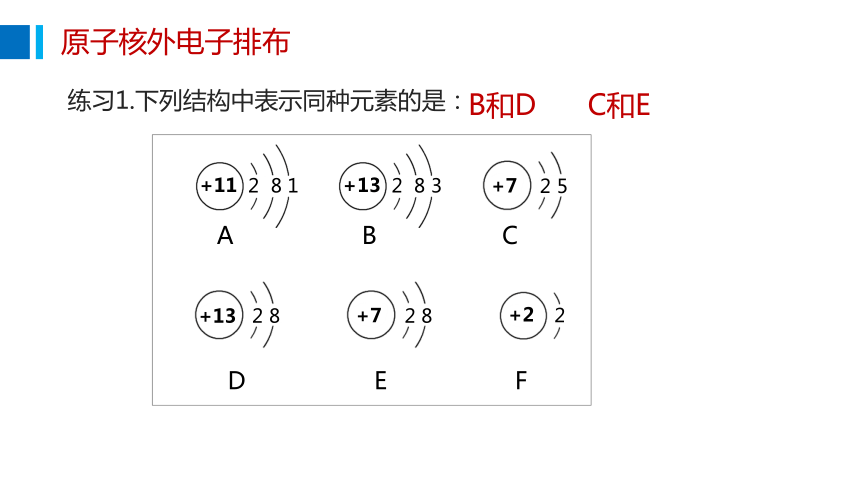
练习1.下列结构中表示同种元素的是:
B和D C和E
+11
2 8 1
A
+13
2 8 3
+7
2 5
+13
2 8
+7
2 8
+2
2
B
C
D
E
F
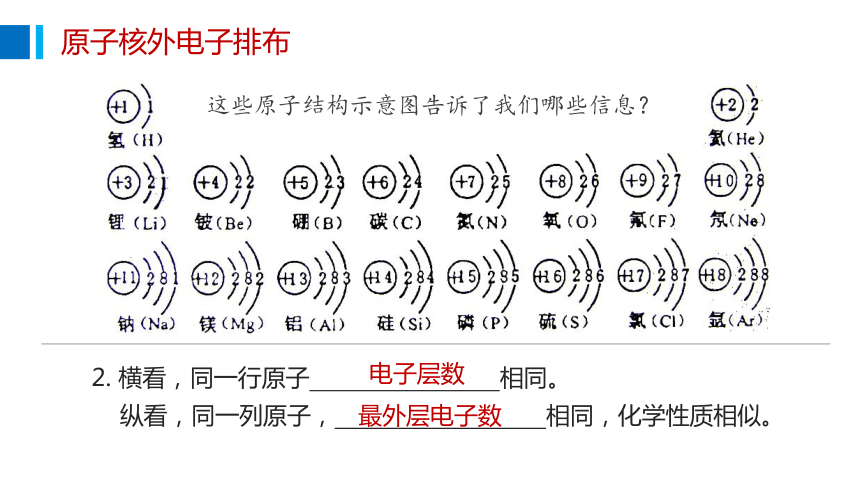
这些原子结构示意图告诉了我们哪些信息?
原子核外电子排布
纵看,同一列原子, 相同,化学性质相似。
最外层电子数
2. 横看,同一行原子 相同。
电子层数
这些原子结构示意图告诉了我们哪些信息?
原子核外电子排布
3.稀有气体元素,最外层电子数 。
=8,为稳定结构(除He为2)
稀
有
气
体
元
素
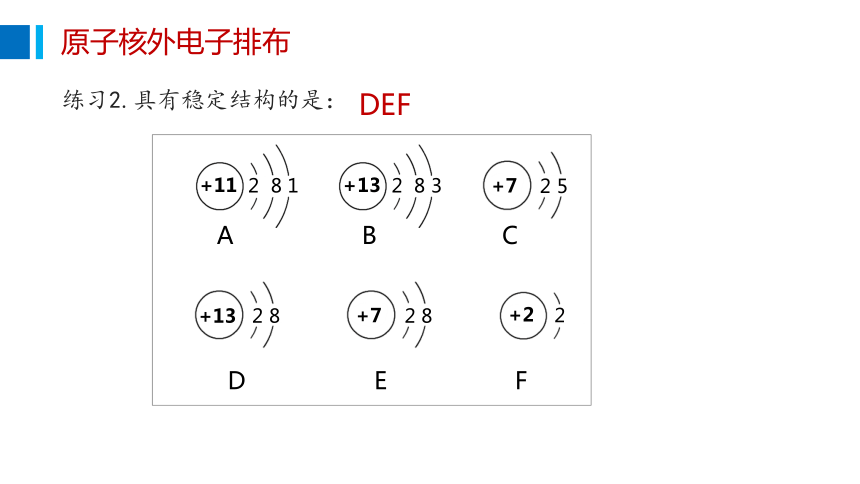
练习2.具有稳定结构的是:
原子核外电子排布
+11
2 8 1
A
+13
2 8 3
+7
2 5
+13
2 8
+7
2 8
+2
2
B
C
D
E
F
DEF
原子核外电子排布
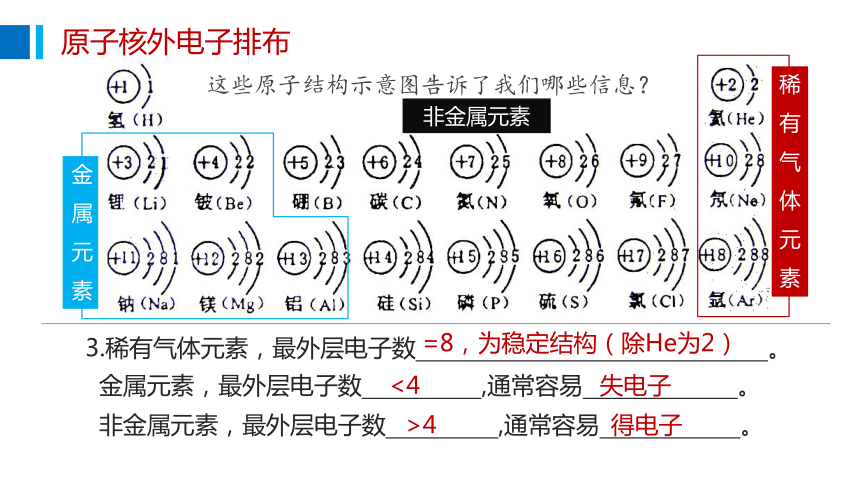
这些原子结构示意图告诉了我们哪些信息?
金
属
元
素
稀
有
气
体
元
素
非金属元素
3.稀有气体元素,最外层电子数 。
=8,为稳定结构(除He为2)
金属元素,最外层电子数 ,通常容易 。
<4
失电子
非金属元素,最外层电子数 ,通常容易 。
>4
得电子
原子核外电子排布
下列金属元素的原子要怎样才能达到稳定结构?
金属元素的原子
一般通过失去最外层电子,
使次外层成为最外层,
来达到稳定结构
失去1个电子
失去2个电子
失去3个电子
原子核外电子排布
下列非金属元素的原子要怎样才能达到稳定结构?
非金属元素的原子,
一般通过最外层得到电子
来达到稳定结构
得到2个电子
得到1个电子
原子核外电子排布
练习3
+x
2
8
18
8
2
X=?
该原子容易得失几个电子?
属于何种元素?
X=38
该原子容易失去两个电子
属于金属元素
原子核外电子排布
钠原子
氯原子
e-
电子
失电子
得电子
阅读P71
钠离子
+
氯离子
—
离子
氯化钠的形成
离子也是构成物质的一种微粒
金属元素原子容易失去电子形成阳离子,
非金属元素原子容易得到电子形成阴离子
在化学反应中原子得到或失去电子变成离子
元素的化学性质与原子的最外层电子数有关
离子
阳离子:带正电的离子
阴离子:带负电的离子
钠离子Na+
氯离子Cl-
离子
离子
(带电的原子)
质子数 电子数
质子数 电子数
>
<
离子的形成:电中性的原子 形成离子
得到或失去电子
有以下四种微粒结构示意图:
表示原子的是 ,
表示阳离子的是 ,
表示阴离子的是 。
离子
A B C D
AD
B
C
离子
常见的离子
Na+ H+
Al3+ Fe3+
Ca2+ Mg2+ Zn2+
Cl
-
O
2-
S
2-
N
3-
离子符号的书写:
在元素符号的 标注离子所带的 和 .
右上角
电量
电性
+x
2 8 18 8 3
上图为In元素的原子结构示意图,
x= ,该元素属于 元素,
在化学反应中容易 电子,形成离子的符号为 。
39
金属
失
In3+
离子
离子
阴离子
原子
阳离子
得到电子
失去电子
失去电子
得到电子
原子得失电子形成离子,形成的离子还可以重新变为原子吗?
分子 原子 离子
构成
构成
结合
分裂
得失电子
失得电子
物质
分子
构 成
原子
离子
元素周期表是学习和研究化学的重要工具,它的内容十分丰富。 下表是依据元素周期表画出的1~18号元素的原子结构示意图。请对它进行研究:
原子核外电子排布
(1)上图中硫元素的核电荷数z= ;氯元素的原子最外层
电子数y= ,与氯元素化学性质最相似的元素是 。
16
7
氟
原子核外电子排布
(2)上图的元素排列具有一定的规律:
① 同一纵行中各元素的原子在结构上的相同点是 ,不同点是 。
② 同一横行中各元素的原子在结构上的相同点是 ,
不同点是 。
最外层电子数相同
电子层数不同
电子层数相同
最外层电子数不同
离子
构成物质的基本微粒
第三章 物质构成的奥秘
科学史话
1913年,玻尔(是卢瑟福的学生)在有核模型的基础上,提出原子轨道模型,认为当原子只有一个电子时,电子沿特定球形轨道运行;当原子有多个电子时,电子将分层排布,在不同的轨道上运行,按能量高低而距核远近不同。
+11
2 8 1
钠原子结构示意图
质子数
(核电荷数)
原子核
电子层
最外层电子数
该层电子数
原子核外电子排布
这些原子结构示意图告诉了我们哪些信息?
原子核外电子排布
1.不同的元素或原子是因为 不同。
质子数(核电荷数)
即:质子数(核电荷数)决定元素或原子的种类
原子核外电子排布
练习1.下列结构中表示同种元素的是:
B和D C和E
+11
2 8 1
A
+13
2 8 3
+7
2 5
+13
2 8
+7
2 8
+2
2
B
C
D
E
F
这些原子结构示意图告诉了我们哪些信息?
原子核外电子排布
纵看,同一列原子, 相同,化学性质相似。
最外层电子数
2. 横看,同一行原子 相同。
电子层数
这些原子结构示意图告诉了我们哪些信息?
原子核外电子排布
3.稀有气体元素,最外层电子数 。
=8,为稳定结构(除He为2)
稀
有
气
体
元
素
练习2.具有稳定结构的是:
原子核外电子排布
+11
2 8 1
A
+13
2 8 3
+7
2 5
+13
2 8
+7
2 8
+2
2
B
C
D
E
F
DEF
原子核外电子排布
这些原子结构示意图告诉了我们哪些信息?
金
属
元
素
稀
有
气
体
元
素
非金属元素
3.稀有气体元素,最外层电子数 。
=8,为稳定结构(除He为2)
金属元素,最外层电子数 ,通常容易 。
<4
失电子
非金属元素,最外层电子数 ,通常容易 。
>4
得电子
原子核外电子排布
下列金属元素的原子要怎样才能达到稳定结构?
金属元素的原子
一般通过失去最外层电子,
使次外层成为最外层,
来达到稳定结构
失去1个电子
失去2个电子
失去3个电子
原子核外电子排布
下列非金属元素的原子要怎样才能达到稳定结构?
非金属元素的原子,
一般通过最外层得到电子
来达到稳定结构
得到2个电子
得到1个电子
原子核外电子排布
练习3
+x
2
8
18
8
2
X=?
该原子容易得失几个电子?
属于何种元素?
X=38
该原子容易失去两个电子
属于金属元素
原子核外电子排布
钠原子
氯原子
e-
电子
失电子
得电子
阅读P71
钠离子
+
氯离子
—
离子
氯化钠的形成
离子也是构成物质的一种微粒
金属元素原子容易失去电子形成阳离子,
非金属元素原子容易得到电子形成阴离子
在化学反应中原子得到或失去电子变成离子
元素的化学性质与原子的最外层电子数有关
离子
阳离子:带正电的离子
阴离子:带负电的离子
钠离子Na+
氯离子Cl-
离子
离子
(带电的原子)
质子数 电子数
质子数 电子数
>
<
离子的形成:电中性的原子 形成离子
得到或失去电子
有以下四种微粒结构示意图:
表示原子的是 ,
表示阳离子的是 ,
表示阴离子的是 。
离子
A B C D
AD
B
C
离子
常见的离子
Na+ H+
Al3+ Fe3+
Ca2+ Mg2+ Zn2+
Cl
-
O
2-
S
2-
N
3-
离子符号的书写:
在元素符号的 标注离子所带的 和 .
右上角
电量
电性
+x
2 8 18 8 3
上图为In元素的原子结构示意图,
x= ,该元素属于 元素,
在化学反应中容易 电子,形成离子的符号为 。
39
金属
失
In3+
离子
离子
阴离子
原子
阳离子
得到电子
失去电子
失去电子
得到电子
原子得失电子形成离子,形成的离子还可以重新变为原子吗?
分子 原子 离子
构成
构成
结合
分裂
得失电子
失得电子
物质
分子
构 成
原子
离子
元素周期表是学习和研究化学的重要工具,它的内容十分丰富。 下表是依据元素周期表画出的1~18号元素的原子结构示意图。请对它进行研究:
原子核外电子排布
(1)上图中硫元素的核电荷数z= ;氯元素的原子最外层
电子数y= ,与氯元素化学性质最相似的元素是 。
16
7
氟
原子核外电子排布
(2)上图的元素排列具有一定的规律:
① 同一纵行中各元素的原子在结构上的相同点是 ,不同点是 。
② 同一横行中各元素的原子在结构上的相同点是 ,
不同点是 。
最外层电子数相同
电子层数不同
电子层数相同
最外层电子数不同
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
