化学沪教版九年级上册参考课件:4.3 化学方程式的书写与应用(第2课时)(共23张PPT)
文档属性
| 名称 | 化学沪教版九年级上册参考课件:4.3 化学方程式的书写与应用(第2课时)(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 21:15:05 | ||
图片预览






文档简介
(共23张PPT)
书写与应用
Writing and application of chemical equation
化学方程式的
第二课时
说一说化学方程式的含义
客观事实
微粒的数量比
物质的质量比
2 ∶ 1 ∶ 2
2×2 :16×2 :2×18
2 H2 + O2 2H2O
点燃
化学方程式不仅表明了化学反应中的反应物和生成物,还揭示了反应中物质之间的质量关系
意义
化学方程式的含义
读法
微粒的数量比
物质的质量比
等于 分子个数比=化学计量数(υ)之比
气体体积比
反应物在某条件下生成生成物
“+” 读“和” “=”读“生成了”
化学计量数( υ )之比
相对质量( υ ×Mr )之比
(只有气体才可算体积比)
甲烷加氧气在点燃条件下生成二氧化碳加水
CH4+ 2O2 CO2 + 2H2O
点燃
每1个甲烷分子和2个氧分子反应生成1个二氧化碳分子和2个水分子
每1份质量的甲烷与2份质量的氧气反应生成1份质量的二氧化碳和2份质量的水
每16份质量的甲烷与64份质量的氧气反应生成44份质量的二氧化碳和36份质量的水
每1份体积的甲烷与2份体积的氧气反应生成1份体积的二氧化碳和2份体积的水
判断方程式的含义正误
点燃
2 H2+ O2 2H2O
2×2 : 32 : 2×18
4 : 32 : 36
若 4 g : 32 g : g
若 8 g : g : g
若 g : g : 18 g
若 g : 8 g : g
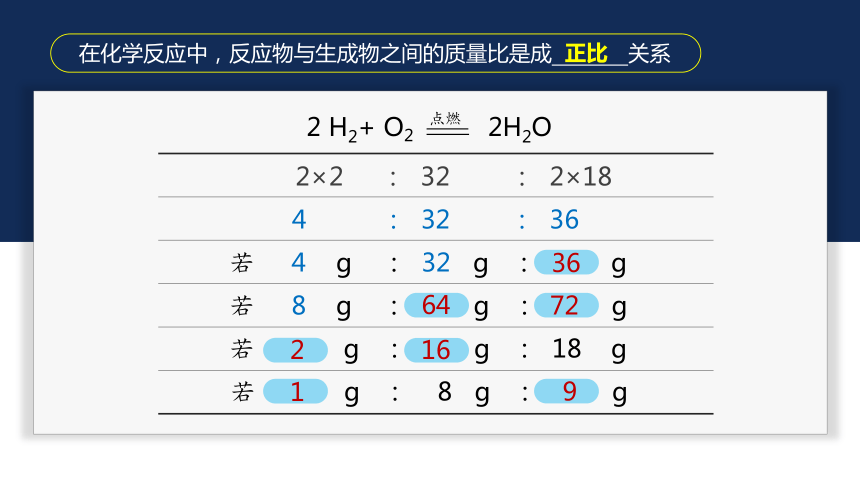
在化学反应中,反应物与生成物之间的质量比是成 关系
36
64
72
2
16
1
9
正比
点燃
2 H2+ O2 2H2O
2×2 : 32 : 2×18
4 : 32 : 36
若 4 g : 32 g : g
若 8 g : g : g
若 g : g : 18 g
若 g : 8 g : g
36
64
72
2
16
1
9
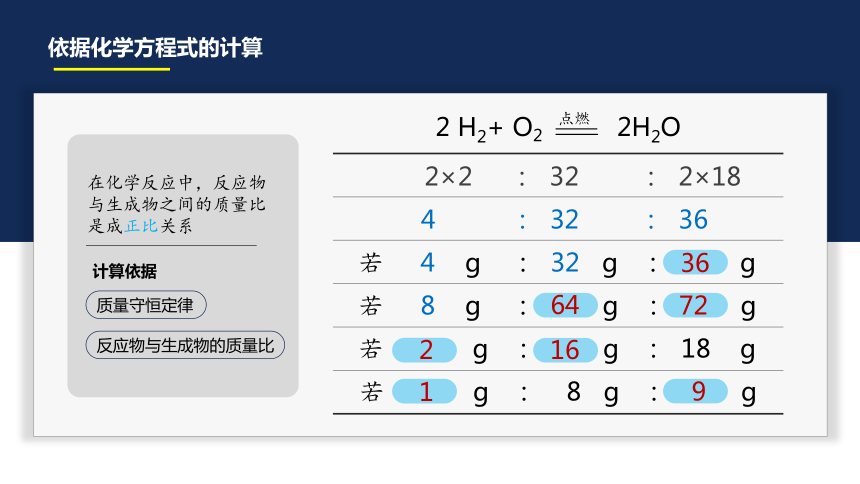
依据化学方程式的计算
计算依据
在化学反应中,反应物与生成物之间的质量比是成正比关系
质量守恒定律
反应物与生成物的质量比
点燃
2 H2+ O2 2H2O
2×2 : 32 : 2×18
4 : 32 : 36
若 2 g : 8 g : g
若 2 g : 0 g : g
注意:将参加反应的物质质量代入计算
9
0
依据化学方程式的计算
计算步骤及格式
例:碳酸钙与盐酸反应生成二氧化碳:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
若需制备二氧化碳 8.8 g,至少需要碳酸钙多少克?
解答格式
解:设需碳酸钙的质量为 x
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 44
x 8.8 g
100 44
x 8.8 g
x = 20 g
答:至少需碳酸钙 20 g
分析过程
按题意设未知数
写出题中反应的化学方程式
找出反应物和生成物的质量关系
建立已知量和未知量的比例关系
计算 x,并作答
计算步骤及格式
分析过程
按题意设未知数
写出题中反应的化学方程式
找出反应物和生成物的质量关系
建立已知量和未知量的比例关系
计算 x,并作答
相对质量
实际质量
相对质量=分子个数×相对分子质量
实际质量:数据要带单位
反应物和生成物的质量关系
已知量和未知量的比例关系
上下相比
比值相等
大家来纠错
小明同学的解题过程如下:
若采用含氯化氢14.6 g的稀盐酸,最多可制得二氧化碳多少克
CaCO3 + HCl CaCl +H2O+ CO2↑
73
36.5
44
14.6
m
36.5
44
14.6
m
m =
2
g
73
g
g
17.6
8.8
g
答:最多可制得二氧化碳8.8g。
解:
(H-1,Cl-35.5)
设最多可制得二氧化碳质量为m
2
练习
课本P112:第7题(1)
高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。现煅烧含有500 kg碳酸钙的贝壳,最多可以得到氧化钙多少千克?
提示:煅烧碳酸钙的方程式:
相对原子质量Ca-40,C-12,O-16
高温
CaCO3 CaO + CO2↑
练习
学会分析有用数据
例2:现有石灰石10g,其中含碳酸钙80%,将其放入足量的50g某浓度的稀盐酸中,最多可获得二氧化碳多少克
m(CaCO3)=10gx80% =8g
含碳酸钙80%
石灰石10g
足量
混合物
即:过量
即反应后有剩余
学会分析有用数据
例2:现有石灰石10g,其中含碳酸钙80%,将其放入足量的50g某浓度的稀盐酸中,
最多可获得二氧化碳多少克
含碳酸钙80%
石灰石10g
足量
CaCO3+2HCl =CaCl2+H2O+CO2↑
100 44
10gx80% m
100 44
10gx80% m
m=3.52g
答:最多可获得二氧化碳3.52g
解:设最多可获得二氧化碳质量为m
练习
100g含锌65%锌铜合金与200g足量的稀硫酸反应,可以生成标准状况下多少升氢气?
Zn + H2SO4 = ZnSO4 + H2↑
65
2
100g×65%=65g
m
65
65g
2
m
=
m=2g
V(H2)=
2g
0.0899g/L
=22.2L
①铜不与稀硫酸反应
②氢气密度为0.0899g/L
已知:
Zn + H2SO4 = ZnSO4 + H2 ↑
③
Ar: Zn-65 H-1 S-32 O-16
解:
可以生成氢气质量为m
答:可以生成成标准状况下氢气22.2L
例
——差量法
为测定某石灰石样品中碳酸钙的质量分数,取22.2g石灰石样品放入质量为146g有足量稀盐酸的烧杯中,充分反应后(杂质不反应),称得烧杯内物质的总质量为159.4g。求石灰石中碳酸钙的质量分数。
分析:
CaCO3+2HCl = CaCl2+H2O+ CO2↑
159.4g
22.2g+146g-159.4g
=8.8g
22.2g
石灰石
146g
稀盐酸
CO2
例
——差量法
为测定某石灰石样品中碳酸钙的质量分数,取22.2 g石灰石样品放入质量为146 g有足量稀盐酸的烧杯中,充分反应后(杂质不反应),称得烧杯内物质的总质量为159.4 g。求石灰石中碳酸钙的质量分数。
解:
CaCO3+2HCl = CaCl2+H2O+ CO2↑
8.8g
100
m
44
100
m
44
8.8g
=
m=20 g
w(CaCO3)=
20g
22.2g
=90.1%
答:石灰石中碳酸钙的质量分数为90.1%。
m(碳酸钙)
×100%
m(CO2)=22.2 g+146 g-159.4 g=8.8 g
设石灰石中碳酸钙的质量为m
m(石灰石)
练习
——差量法
在某过氧化氢溶液42.5 g中,加入1 g MnO2,完全反应后称得剩余物的质量为41.9 g,求:
(1)反应中放出氧气的质量;
(2)参加反应的过氧化氢的质量
分析:
41.9g
42.5 g+1 g- 41.9 g
=1.6 g
过氧化氢溶42.5 g
MnO2 1 g
O2
2H2O2 2H2O+ O2↑
MnO2
练习
——差量法
在某过氧化氢溶液42.5 g中,加入1g MnO2,完全反应后称得剩余物的质量为41.9 g,求:
(1)反应中放出氧气的质量;
(2)参加反应的过氧化氢的质量
2H2O2 2H2O+ O2↑
MnO2
解:
参加反应的过氧化氢的质量为m
68
32
m
68
m
32
1.6 g
=
m=3.4 g
答:参加反应的过氧化氢的质量为3.4 g。
42.5 g+1 g- 41.9 g=1.6 g
例
——表格数据题
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第1次 10 5.5
第2次 10 m
第3次 10 1.2
第4次 10 1.2
小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8 g这种石灰石样品,把40 g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。请计算:
(1)8 g石灰石样品中含有杂质多少克?(2)样品中碳酸钙的质量分数是多少?
(3)表中m的数值应该为多少?(4)在四次实验中,第 次石灰石过量,第 次稀盐酸过量。
例
——表格数据题
石灰石样品
碳酸钙
杂质
(不参与反应)
加稀盐酸
碳酸钙质量变少
杂质质量不变
反应剩余的碳酸钙
杂质(不参与反应)
剩余固体
CaCO3+2HCl = CaCl2+H2O+ CO2↑
第 次反应中,石灰石过量
第 次反应中,盐酸有剩余
例
——表格数据题
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第1次 10 5.5
第2次 10 m
第3次 10 1.2
第4次 10 1.2
反应前样品:8 g
-2.5 g
-2.5 g
=3
-1.8 g
0
1、2
3、4
例
——表格数据题
有一种石灰石样品,其中含有的杂质是二氧化硅(一种不溶于水和盐酸且耐高温的固体)。某学生想测定该样品的纯度,他取用2克这种石灰石样品,把20克稀盐酸分4次加入,充分反应后剩余固体的质量见下表。
稀盐酸用量 第1次加入5 g 第1次加入5 g 第1次加入5 g 第1次加入5 g
剩余固体质量 1.5 g 1.0 g 0.5 g 0.3 g
求:
(1)从以上数据可知,这四次实验中,第 次石灰石中的碳酸钙已完全反应。
(2)该石灰石样品中碳酸钙的质量分数是多少?
实验室用15.8 g的高锰酸钾制取氧气,
最多可以产生氧气的质量为多少?
(相对原子质量:K-39 Mn-55 O-16 相对分子质量: KMnO4-158)
书写与应用
Writing and application of chemical equation
化学方程式的
第二课时
说一说化学方程式的含义
客观事实
微粒的数量比
物质的质量比
2 ∶ 1 ∶ 2
2×2 :16×2 :2×18
2 H2 + O2 2H2O
点燃
化学方程式不仅表明了化学反应中的反应物和生成物,还揭示了反应中物质之间的质量关系
意义
化学方程式的含义
读法
微粒的数量比
物质的质量比
等于 分子个数比=化学计量数(υ)之比
气体体积比
反应物在某条件下生成生成物
“+” 读“和” “=”读“生成了”
化学计量数( υ )之比
相对质量( υ ×Mr )之比
(只有气体才可算体积比)
甲烷加氧气在点燃条件下生成二氧化碳加水
CH4+ 2O2 CO2 + 2H2O
点燃
每1个甲烷分子和2个氧分子反应生成1个二氧化碳分子和2个水分子
每1份质量的甲烷与2份质量的氧气反应生成1份质量的二氧化碳和2份质量的水
每16份质量的甲烷与64份质量的氧气反应生成44份质量的二氧化碳和36份质量的水
每1份体积的甲烷与2份体积的氧气反应生成1份体积的二氧化碳和2份体积的水
判断方程式的含义正误
点燃
2 H2+ O2 2H2O
2×2 : 32 : 2×18
4 : 32 : 36
若 4 g : 32 g : g
若 8 g : g : g
若 g : g : 18 g
若 g : 8 g : g
在化学反应中,反应物与生成物之间的质量比是成 关系
36
64
72
2
16
1
9
正比
点燃
2 H2+ O2 2H2O
2×2 : 32 : 2×18
4 : 32 : 36
若 4 g : 32 g : g
若 8 g : g : g
若 g : g : 18 g
若 g : 8 g : g
36
64
72
2
16
1
9
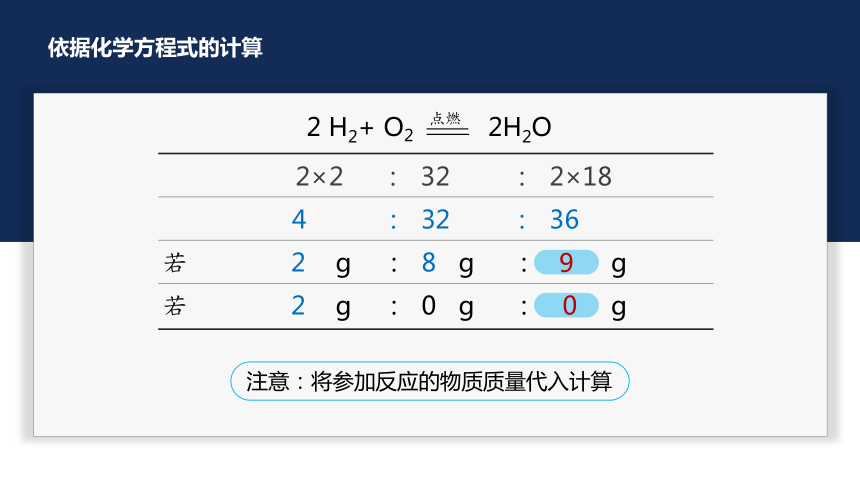
依据化学方程式的计算
计算依据
在化学反应中,反应物与生成物之间的质量比是成正比关系
质量守恒定律
反应物与生成物的质量比
点燃
2 H2+ O2 2H2O
2×2 : 32 : 2×18
4 : 32 : 36
若 2 g : 8 g : g
若 2 g : 0 g : g
注意:将参加反应的物质质量代入计算
9
0
依据化学方程式的计算
计算步骤及格式
例:碳酸钙与盐酸反应生成二氧化碳:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
若需制备二氧化碳 8.8 g,至少需要碳酸钙多少克?
解答格式
解:设需碳酸钙的质量为 x
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 44
x 8.8 g
100 44
x 8.8 g
x = 20 g
答:至少需碳酸钙 20 g
分析过程
按题意设未知数
写出题中反应的化学方程式
找出反应物和生成物的质量关系
建立已知量和未知量的比例关系
计算 x,并作答
计算步骤及格式
分析过程
按题意设未知数
写出题中反应的化学方程式
找出反应物和生成物的质量关系
建立已知量和未知量的比例关系
计算 x,并作答
相对质量
实际质量
相对质量=分子个数×相对分子质量
实际质量:数据要带单位
反应物和生成物的质量关系
已知量和未知量的比例关系
上下相比
比值相等
大家来纠错
小明同学的解题过程如下:
若采用含氯化氢14.6 g的稀盐酸,最多可制得二氧化碳多少克
CaCO3 + HCl CaCl +H2O+ CO2↑
73
36.5
44
14.6
m
36.5
44
14.6
m
m =
2
g
73
g
g
17.6
8.8
g
答:最多可制得二氧化碳8.8g。
解:
(H-1,Cl-35.5)
设最多可制得二氧化碳质量为m
2
练习
课本P112:第7题(1)
高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。现煅烧含有500 kg碳酸钙的贝壳,最多可以得到氧化钙多少千克?
提示:煅烧碳酸钙的方程式:
相对原子质量Ca-40,C-12,O-16
高温
CaCO3 CaO + CO2↑
练习
学会分析有用数据
例2:现有石灰石10g,其中含碳酸钙80%,将其放入足量的50g某浓度的稀盐酸中,最多可获得二氧化碳多少克
m(CaCO3)=10gx80% =8g
含碳酸钙80%
石灰石10g
足量
混合物
即:过量
即反应后有剩余
学会分析有用数据
例2:现有石灰石10g,其中含碳酸钙80%,将其放入足量的50g某浓度的稀盐酸中,
最多可获得二氧化碳多少克
含碳酸钙80%
石灰石10g
足量
CaCO3+2HCl =CaCl2+H2O+CO2↑
100 44
10gx80% m
100 44
10gx80% m
m=3.52g
答:最多可获得二氧化碳3.52g
解:设最多可获得二氧化碳质量为m
练习
100g含锌65%锌铜合金与200g足量的稀硫酸反应,可以生成标准状况下多少升氢气?
Zn + H2SO4 = ZnSO4 + H2↑
65
2
100g×65%=65g
m
65
65g
2
m
=
m=2g
V(H2)=
2g
0.0899g/L
=22.2L
①铜不与稀硫酸反应
②氢气密度为0.0899g/L
已知:
Zn + H2SO4 = ZnSO4 + H2 ↑
③
Ar: Zn-65 H-1 S-32 O-16
解:
可以生成氢气质量为m
答:可以生成成标准状况下氢气22.2L
例
——差量法
为测定某石灰石样品中碳酸钙的质量分数,取22.2g石灰石样品放入质量为146g有足量稀盐酸的烧杯中,充分反应后(杂质不反应),称得烧杯内物质的总质量为159.4g。求石灰石中碳酸钙的质量分数。
分析:
CaCO3+2HCl = CaCl2+H2O+ CO2↑
159.4g
22.2g+146g-159.4g
=8.8g
22.2g
石灰石
146g
稀盐酸
CO2
例
——差量法
为测定某石灰石样品中碳酸钙的质量分数,取22.2 g石灰石样品放入质量为146 g有足量稀盐酸的烧杯中,充分反应后(杂质不反应),称得烧杯内物质的总质量为159.4 g。求石灰石中碳酸钙的质量分数。
解:
CaCO3+2HCl = CaCl2+H2O+ CO2↑
8.8g
100
m
44
100
m
44
8.8g
=
m=20 g
w(CaCO3)=
20g
22.2g
=90.1%
答:石灰石中碳酸钙的质量分数为90.1%。
m(碳酸钙)
×100%
m(CO2)=22.2 g+146 g-159.4 g=8.8 g
设石灰石中碳酸钙的质量为m
m(石灰石)
练习
——差量法
在某过氧化氢溶液42.5 g中,加入1 g MnO2,完全反应后称得剩余物的质量为41.9 g,求:
(1)反应中放出氧气的质量;
(2)参加反应的过氧化氢的质量
分析:
41.9g
42.5 g+1 g- 41.9 g
=1.6 g
过氧化氢溶42.5 g
MnO2 1 g
O2
2H2O2 2H2O+ O2↑
MnO2
练习
——差量法
在某过氧化氢溶液42.5 g中,加入1g MnO2,完全反应后称得剩余物的质量为41.9 g,求:
(1)反应中放出氧气的质量;
(2)参加反应的过氧化氢的质量
2H2O2 2H2O+ O2↑
MnO2
解:
参加反应的过氧化氢的质量为m
68
32
m
68
m
32
1.6 g
=
m=3.4 g
答:参加反应的过氧化氢的质量为3.4 g。
42.5 g+1 g- 41.9 g=1.6 g
例
——表格数据题
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第1次 10 5.5
第2次 10 m
第3次 10 1.2
第4次 10 1.2
小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8 g这种石灰石样品,把40 g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。请计算:
(1)8 g石灰石样品中含有杂质多少克?(2)样品中碳酸钙的质量分数是多少?
(3)表中m的数值应该为多少?(4)在四次实验中,第 次石灰石过量,第 次稀盐酸过量。
例
——表格数据题
石灰石样品
碳酸钙
杂质
(不参与反应)
加稀盐酸
碳酸钙质量变少
杂质质量不变
反应剩余的碳酸钙
杂质(不参与反应)
剩余固体
CaCO3+2HCl = CaCl2+H2O+ CO2↑
第 次反应中,石灰石过量
第 次反应中,盐酸有剩余
例
——表格数据题
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第1次 10 5.5
第2次 10 m
第3次 10 1.2
第4次 10 1.2
反应前样品:8 g
-2.5 g
-2.5 g
=3
-1.8 g
0
1、2
3、4
例
——表格数据题
有一种石灰石样品,其中含有的杂质是二氧化硅(一种不溶于水和盐酸且耐高温的固体)。某学生想测定该样品的纯度,他取用2克这种石灰石样品,把20克稀盐酸分4次加入,充分反应后剩余固体的质量见下表。
稀盐酸用量 第1次加入5 g 第1次加入5 g 第1次加入5 g 第1次加入5 g
剩余固体质量 1.5 g 1.0 g 0.5 g 0.3 g
求:
(1)从以上数据可知,这四次实验中,第 次石灰石中的碳酸钙已完全反应。
(2)该石灰石样品中碳酸钙的质量分数是多少?
实验室用15.8 g的高锰酸钾制取氧气,
最多可以产生氧气的质量为多少?
(相对原子质量:K-39 Mn-55 O-16 相对分子质量: KMnO4-158)
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
