4.1.1原子结构与元素周期表 课件(共28张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.1原子结构与元素周期表 课件(共28张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 58.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 17:05:13 | ||
图片预览








文档简介
(共28张PPT)
第一节 原子结构与元素周期律
第四章 物质结构 元素周期律
第一课时 原子结构与元素周期表
目录
CONTENT
一、原子结构
二、元素周期表
第四章 物质结构 元素周期律
1.
2.
3.
4.
学习目标
认识原子的组成及微粒之间的数量关系
学会核外电子的排布规律与应用
了解元素周期表的结构和规律
能从元素和原子水平上认识物质的组成和结构
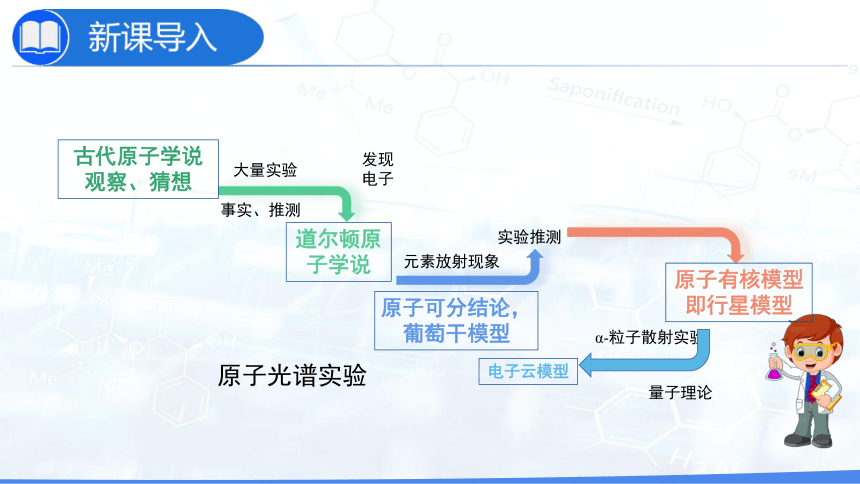
古人关于万物构成的思考:
惠施(战国)的十个命题,主要是对自然界的分析,其中有些含有辩证的因素。他说:“至大无外,谓之大一;至小无内,谓之小一。”“大一”是说整个空间大到无所不包,不再有外部;“小一”是说物质最小的单位,小到不可再分割,不再有内部。
古希腊哲学家德谟克利特(Democritus,约公元前460—公元前370)曾经指出,物质是由不可分割的微粒(也称为“原子”)构成的。
原子真的是不可分割的球体吗?
古代原子学说观察、猜想
道尔顿原子学说
大量实验
事实、推测
发现电子
元素放射现象
α-粒子散射实验
实验推测
原子光谱实验
量子理论
原子可分结论,葡萄干模型
原子有核模型即行星模型
电子云模型
一、原子结构
1.构成原子的微粒及其性质
正
1
1
负
一、原子结构
2.质量数
(1)概念:将原子核内所有_____和_____的相对质量取近似___________,所得的数值叫做质量数,常用____表示。
(2)构成原子的粒子间的两个关系
①质量数(A)=__________+__________。
②质子数=核电荷数=____________。
质子
中子
整数值相加
A
质子数(Z)
中子数(N)
核外电子数
一个质子或中子的质量与12C原子质量的1/12(约1.66×10-27 kg)相比较所得的数值。
(1)原子呈电中性是因为中子不带电( )
(2)质子数和中子数决定原子的质量( )
(3)原子的质量数就是原子的相对原子质量( )
(4)微粒中的质子数与核外电子数一定相等( )
(5)某种氯原子的中子数是18,则其质量数是35,核外电子数是17( )
×
√
判断正误
×
×
√
3.核外电子排布
一、原子结构
(1)电子层
①概念:在含有多个电子的原子里,电子分别在__________的区域内运动。我们把不同的区域简化为_____________,也称作电子层。
②不同电子层的表示及能量关系
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 ___ ___ ___ ___ ___ ___ ___
离核远近 由___到___ 能量高低 由___到___ 能量不同
不连续的壳层
K
L
M
N
O
P
Q
近
远
低
高
一、原子结构
思考与讨论
电子一般总是先从内层排起,当一层充满后再填充下一层。下表是稀有气体元素原子的电子层排布,从中你能发现什么规律 请思考并讨论下列问题。
一、原子结构
(2)核外电子排布规律
①电子总是尽可能先从_____排起,当一层_____后再填充下一层,依次为1、2、3、4、5、6、7或K、L、M、N、O、P、Q。
②K层为最外层时最多容纳的电子数为___,除K层外,其他各层为最外层时,最多容纳的电子数为___。
③K层为次外层时,所排电子数为___,除K层外,其他各层为次外层时,最多容纳的电子数为____。第n层最多容纳电子数为2n2
内层
充满
2
8
2
18
(3)核外电子排布的表示方法——原子结构示意图
钠的原子结构示意图:
一、原子结构
在练习本上依次画出1~18号元素的原子结构示意图,分析总结它们的核外电子排布特点(填元素符号):
(1)最外层电子数为1的原子有___________;最外层电子数为2的原子有_____________。
(2)最外层电子数与次外层电子数相等的原子有________。
(3)最外层电子数是次外层电子数2倍的原子有____,3倍的原子有____。
(4)次外层电子数是最外层电子数2倍的原子有______。
(5)电子层数与最外层电子数相等的原子有__________。
(6)最外层电子数是电子层数2倍的原子有__________。
H、Li、Na
He、Be、Mg
Be、Ar
C
O
Li、Si
H、Be、Al
He、C、S
(1)简单离子中,质子数与核外电子数的关系
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
(2)与Ne电子层结构相同的阳离子有:Na+、Mg2+、Al3+;阴离子有:F-、O2-、N3-等。
(3)核外有18个电子的粒子。
分子或原子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4等
阳离子:K+、Ca2+ 阴离子:P3-、S2-、HS-、Cl-
二、元素周期表
1.元素周期表的发展历程
1789年,法国化学家拉瓦锡在其写就的《化学概要》里,列出了第一张化学元素表,元素被分为简单金属物质、非金属物质等四大类。
二、元素周期表
2.元素周期表的编排原则
(1)原子序数:按照元素__________________给元素编的序号。
(2)原子序数=__________=_______=____________。
(3)横行原则:把___________相同的元素,按_______________的顺序从左到右排列。
(4)纵列原则:把不同横行中_____________相同的元素,按___________
___的顺序由上而下排列。
在周期表中的顺序
核电荷数
质子数
核外电子数
电子层数目
原子序数递增
最外层电子数
电子层数递
增
二、元素周期表
短周期
长周期
变化原因?
变化原因?
结论: 周期序数=电子层数
3.元素周期表的结构
二、元素周期表
2
8
8
18
18
32
32
思考:为什么按原子的核电荷数排而不是按相对原子质量排? (提示,仔细观察现行元素周期表,你能找到答案吗?)
按质子数排更加科学。若按相对原子质量排,部分元素位置发生颠倒。如Ar和K,又如Te和I。
二、元素周期表
族
个数 元素周期表中有___个纵列,共有____个族 特点 主族元素的族序数=_____________ 分类 主族 共有___个,包括第________________________________
____族
副族 共有___个,包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族
Ⅷ族 包括第__________三个纵列
0族 占据元素周期表的第___纵列,最外层电子数为__(He为2)
18
16
最外层电子数
7
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、
ⅦA
7
8、9、10
18
8
二、元素周期表
常见族的别称
族 别名
第ⅠA族(除氢外) _______元素
第ⅦA族 _____元素
0族 稀有气体元素
碱金属
卤族
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
二、元素周期表
4.元素周期表方格中的符号的意义
原子序数
元素符号
元素名称
相对
原子质量
1.下列说法中正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内运动
B.核外电子总是先排在能量低的电子层上,例如只有M层排满后才排N层
C.某原子M层电子数为L层电子数的4倍
D.某离子的核电荷数与其最外层电子数相等
D
2.某元素原子的原子核外有三个电子层,最外层电子数是4。该原子核内的质子数是( )
A.14 B.15 C.16 D.17
A
4.如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为( )
A.5x+10 B.5x+11
C.5x+14 D.5x+16
A
3.在周期表中,所含元素种类最多的是( )
A.第Ⅷ族 B.第ⅠA族
C.0族 D.第ⅢB族
D
5.已知A、B、C三种元素的原子中,质子数为A(1)三种元素的元素符号:
A________;B________;C________。
(2)画出三种元素的原子结构示意图:
A________;B________;C_________。
1
2
3
4
C
Si
Cl
谢谢
第一节 原子结构与元素周期律
第四章 物质结构 元素周期律
第一课时 原子结构与元素周期表
目录
CONTENT
一、原子结构
二、元素周期表
第四章 物质结构 元素周期律
1.
2.
3.
4.
学习目标
认识原子的组成及微粒之间的数量关系
学会核外电子的排布规律与应用
了解元素周期表的结构和规律
能从元素和原子水平上认识物质的组成和结构
古人关于万物构成的思考:
惠施(战国)的十个命题,主要是对自然界的分析,其中有些含有辩证的因素。他说:“至大无外,谓之大一;至小无内,谓之小一。”“大一”是说整个空间大到无所不包,不再有外部;“小一”是说物质最小的单位,小到不可再分割,不再有内部。
古希腊哲学家德谟克利特(Democritus,约公元前460—公元前370)曾经指出,物质是由不可分割的微粒(也称为“原子”)构成的。
原子真的是不可分割的球体吗?
古代原子学说观察、猜想
道尔顿原子学说
大量实验
事实、推测
发现电子
元素放射现象
α-粒子散射实验
实验推测
原子光谱实验
量子理论
原子可分结论,葡萄干模型
原子有核模型即行星模型
电子云模型
一、原子结构
1.构成原子的微粒及其性质
正
1
1
负
一、原子结构
2.质量数
(1)概念:将原子核内所有_____和_____的相对质量取近似___________,所得的数值叫做质量数,常用____表示。
(2)构成原子的粒子间的两个关系
①质量数(A)=__________+__________。
②质子数=核电荷数=____________。
质子
中子
整数值相加
A
质子数(Z)
中子数(N)
核外电子数
一个质子或中子的质量与12C原子质量的1/12(约1.66×10-27 kg)相比较所得的数值。
(1)原子呈电中性是因为中子不带电( )
(2)质子数和中子数决定原子的质量( )
(3)原子的质量数就是原子的相对原子质量( )
(4)微粒中的质子数与核外电子数一定相等( )
(5)某种氯原子的中子数是18,则其质量数是35,核外电子数是17( )
×
√
判断正误
×
×
√
3.核外电子排布
一、原子结构
(1)电子层
①概念:在含有多个电子的原子里,电子分别在__________的区域内运动。我们把不同的区域简化为_____________,也称作电子层。
②不同电子层的表示及能量关系
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 ___ ___ ___ ___ ___ ___ ___
离核远近 由___到___ 能量高低 由___到___ 能量不同
不连续的壳层
K
L
M
N
O
P
Q
近
远
低
高
一、原子结构
思考与讨论
电子一般总是先从内层排起,当一层充满后再填充下一层。下表是稀有气体元素原子的电子层排布,从中你能发现什么规律 请思考并讨论下列问题。
一、原子结构
(2)核外电子排布规律
①电子总是尽可能先从_____排起,当一层_____后再填充下一层,依次为1、2、3、4、5、6、7或K、L、M、N、O、P、Q。
②K层为最外层时最多容纳的电子数为___,除K层外,其他各层为最外层时,最多容纳的电子数为___。
③K层为次外层时,所排电子数为___,除K层外,其他各层为次外层时,最多容纳的电子数为____。第n层最多容纳电子数为2n2
内层
充满
2
8
2
18
(3)核外电子排布的表示方法——原子结构示意图
钠的原子结构示意图:
一、原子结构
在练习本上依次画出1~18号元素的原子结构示意图,分析总结它们的核外电子排布特点(填元素符号):
(1)最外层电子数为1的原子有___________;最外层电子数为2的原子有_____________。
(2)最外层电子数与次外层电子数相等的原子有________。
(3)最外层电子数是次外层电子数2倍的原子有____,3倍的原子有____。
(4)次外层电子数是最外层电子数2倍的原子有______。
(5)电子层数与最外层电子数相等的原子有__________。
(6)最外层电子数是电子层数2倍的原子有__________。
H、Li、Na
He、Be、Mg
Be、Ar
C
O
Li、Si
H、Be、Al
He、C、S
(1)简单离子中,质子数与核外电子数的关系
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
(2)与Ne电子层结构相同的阳离子有:Na+、Mg2+、Al3+;阴离子有:F-、O2-、N3-等。
(3)核外有18个电子的粒子。
分子或原子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4等
阳离子:K+、Ca2+ 阴离子:P3-、S2-、HS-、Cl-
二、元素周期表
1.元素周期表的发展历程
1789年,法国化学家拉瓦锡在其写就的《化学概要》里,列出了第一张化学元素表,元素被分为简单金属物质、非金属物质等四大类。
二、元素周期表
2.元素周期表的编排原则
(1)原子序数:按照元素__________________给元素编的序号。
(2)原子序数=__________=_______=____________。
(3)横行原则:把___________相同的元素,按_______________的顺序从左到右排列。
(4)纵列原则:把不同横行中_____________相同的元素,按___________
___的顺序由上而下排列。
在周期表中的顺序
核电荷数
质子数
核外电子数
电子层数目
原子序数递增
最外层电子数
电子层数递
增
二、元素周期表
短周期
长周期
变化原因?
变化原因?
结论: 周期序数=电子层数
3.元素周期表的结构
二、元素周期表
2
8
8
18
18
32
32
思考:为什么按原子的核电荷数排而不是按相对原子质量排? (提示,仔细观察现行元素周期表,你能找到答案吗?)
按质子数排更加科学。若按相对原子质量排,部分元素位置发生颠倒。如Ar和K,又如Te和I。
二、元素周期表
族
个数 元素周期表中有___个纵列,共有____个族 特点 主族元素的族序数=_____________ 分类 主族 共有___个,包括第________________________________
____族
副族 共有___个,包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族
Ⅷ族 包括第__________三个纵列
0族 占据元素周期表的第___纵列,最外层电子数为__(He为2)
18
16
最外层电子数
7
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、
ⅦA
7
8、9、10
18
8
二、元素周期表
常见族的别称
族 别名
第ⅠA族(除氢外) _______元素
第ⅦA族 _____元素
0族 稀有气体元素
碱金属
卤族
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
二、元素周期表
4.元素周期表方格中的符号的意义
原子序数
元素符号
元素名称
相对
原子质量
1.下列说法中正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内运动
B.核外电子总是先排在能量低的电子层上,例如只有M层排满后才排N层
C.某原子M层电子数为L层电子数的4倍
D.某离子的核电荷数与其最外层电子数相等
D
2.某元素原子的原子核外有三个电子层,最外层电子数是4。该原子核内的质子数是( )
A.14 B.15 C.16 D.17
A
4.如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为( )
A.5x+10 B.5x+11
C.5x+14 D.5x+16
A
3.在周期表中,所含元素种类最多的是( )
A.第Ⅷ族 B.第ⅠA族
C.0族 D.第ⅢB族
D
5.已知A、B、C三种元素的原子中,质子数为A
A________;B________;C________。
(2)画出三种元素的原子结构示意图:
A________;B________;C_________。
1
2
3
4
C
Si
Cl
谢谢
