4.3.1离子键 课件(共22张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3.1离子键 课件(共22张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 20.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 17:06:05 | ||
图片预览



文档简介
(共22张PPT)
离子键
新人教版·必修一·第四章
第三节·化学键·第一课时
宏观角度,感受化学键的存在
思考:一百多种元素怎样能够形成上亿种物质?原子之间通过什么作用形成丰富的物质?
“缘”何而“聚”?
宏观角度,感受化学键的存在
物质 导电性
干燥的NaCl 不导电
熔融的NaCl 导电
氯化钠晶体
氯化钠晶体结构
电解熔融氯化钠实验
由此可知,NaCl由Na+与Cl-直接构成
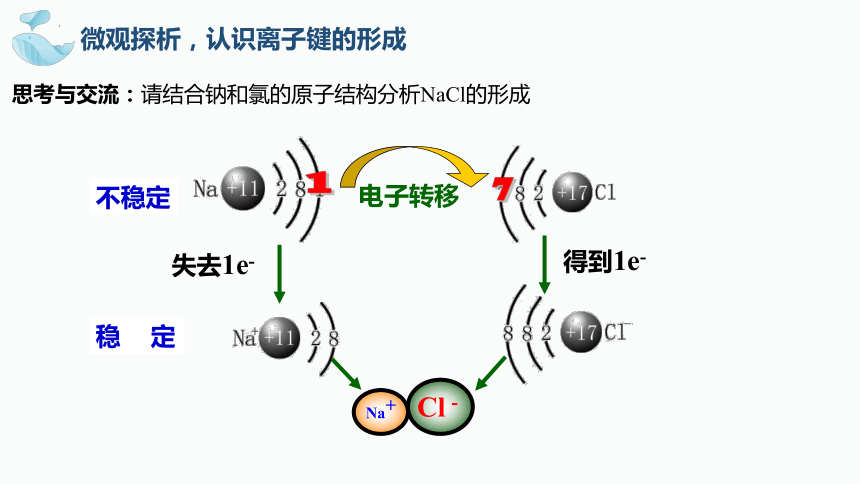
微观探析,认识离子键的形成
思考与交流:请结合钠和氯的原子结构分析NaCl的形成
Na+
Cl-
电子转移
1
不稳定
稳 定
失去1e-
得到1e-
7
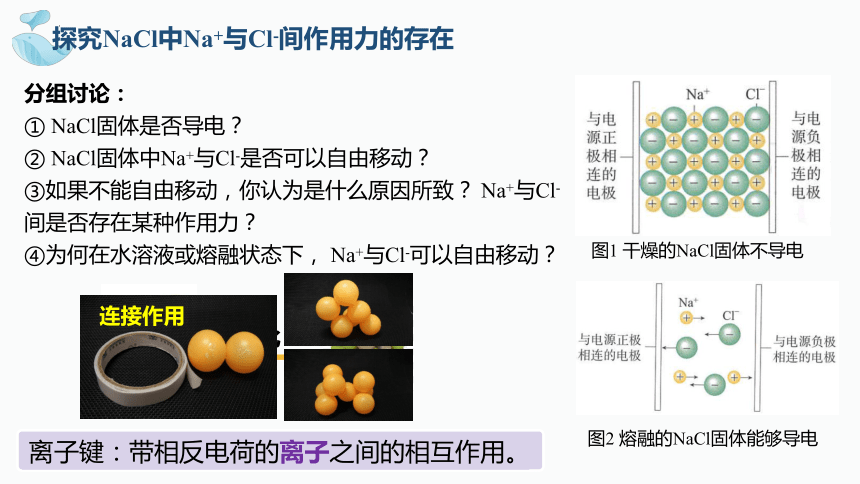
分组讨论:
① NaCl固体是否导电?
② NaCl固体中Na+与Cl-是否可以自由移动?
③如果不能自由移动,你认为是什么原因所致? Na+与Cl-间是否存在某种作用力?
④为何在水溶液或熔融状态下, Na+与Cl-可以自由移动?
图1 干燥的NaCl固体不导电
图2 熔融的NaCl固体能够导电
探究NaCl中Na+与Cl-间作用力的存在
离子键:带相反电荷的离子之间的相互作用。
乒乓球
类比
离子
连接作用
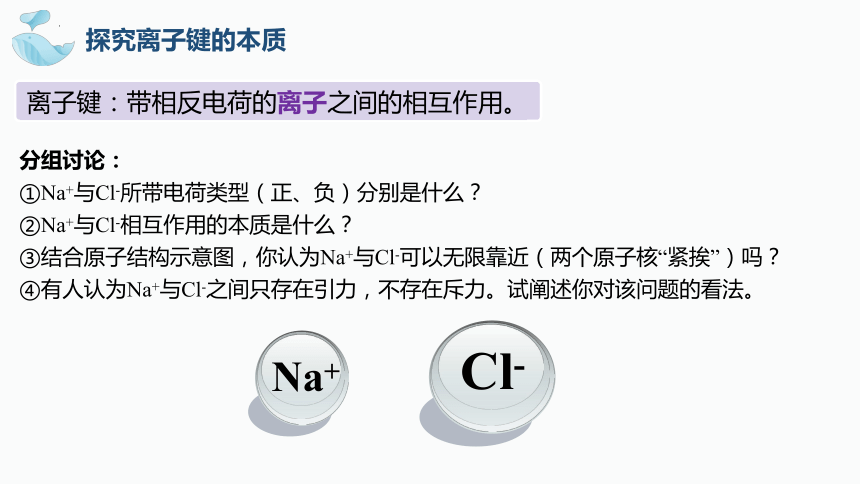
分组讨论:
①Na+与Cl-所带电荷类型(正、负)分别是什么?
②Na+与Cl-相互作用的本质是什么?
③结合原子结构示意图,你认为Na+与Cl-可以无限靠近(两个原子核“紧挨”)吗?
④有人认为Na+与Cl-之间只存在引力,不存在斥力。试阐述你对该问题的看法。
探究离子键的本质
Cl-
Na+
离子键:带相反电荷的离子之间的相互作用。
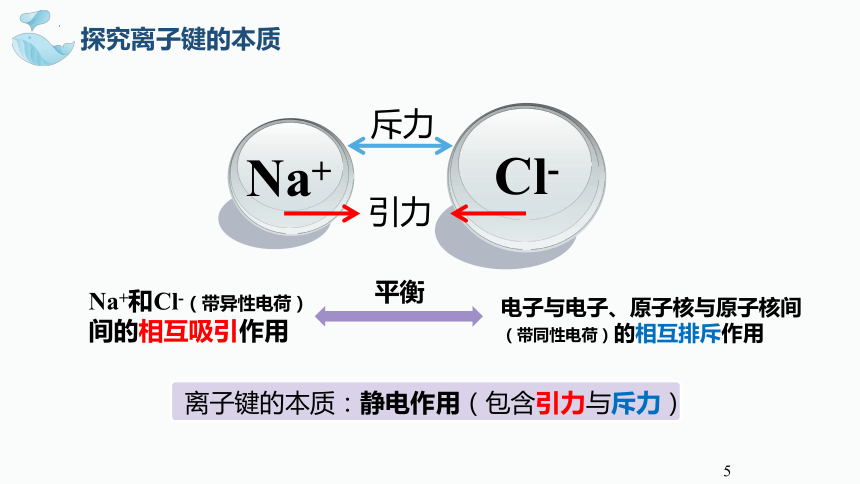
探究离子键的本质
5
+
+
+
+
+
+
+
+
+
+
+
—
—
—
—
—
—
—
—
—
—
+
+
+
+
+
+
+
+
+
—
—
—
—
—
—
—
—
—
—
+
+
+
+
+
+
+
+
—
—
—
—
—
—
—
—
Cl-
Na+
离子键的本质:静电作用(包含引力与斥力)
斥力
引力
Na+和Cl-(带异性电荷)间的相互吸引作用
电子与电子、原子核与原子核间(带同性电荷)的相互排斥作用
平衡
2
+11
8
1
探究离子键的形成意义
2
+11
8
2
+17
8
7
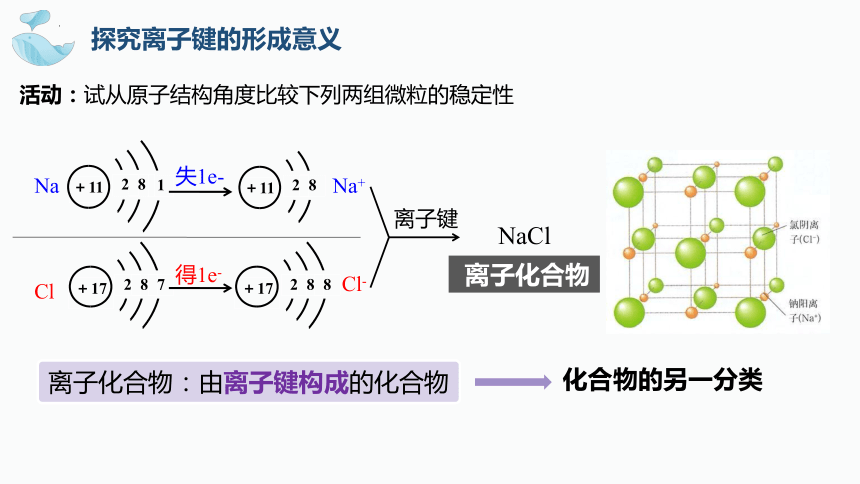
Na
Cl
Na+
Cl-
2
+17
8
8
失1e-
离子键
NaCl
离子化合物:由离子键构成的化合物
离子化合物
活动:试从原子结构角度比较下列两组微粒的稳定性
得1e-
化合物的另一分类
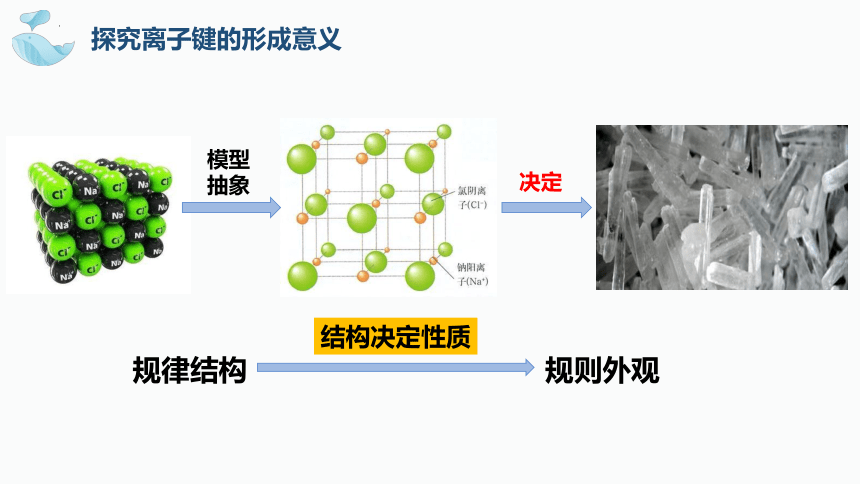
探究离子键的形成意义
模型抽象
决定
规律结构
规则外观
结构决定性质
探究离子键的形成意义
讨论:离子键的形成意义
物质由高能状态自发地转变为低能状态是自然界的普遍规律,即能量越低越稳定。
不稳定
稳定
释放能量
金属原子
非金属原子
失电子
得电子
金属离子
非金属离子
离子键
离子化合物
问题:什么元素间可形成离子键?
一般是活泼金属元素与活泼非金属元素
小结
1、下列元素原子,最难形成离子键的是
A.K B.Ca C.S D.C
思考:离子键的形成条件有哪些?
1
2
3
4
定义
5
成键粒子
成键本质
成键元素
判断
带相反电荷离子之间的相互作用
阴阳离子
静电作用
一般是活泼金属元素与活泼非金属元素
(静电引力和斥力)
探究离子键的形成条件
1. 活泼金属单质与活泼非金属单质化合
【例】NaCl MgCl2 CaO K2O NaF CaF2 Na2S K2S
思考:根据离子键的形成过程,
①金属与非金属为什么必须要求“活泼”?
②所有金属与非金属化合形成的化合物都是离子化合物吗?
讨论:以下为几种常见的金属单质和非金属单质。能形成离子键的组合已用短线相连。
①形成离子键的单质,其金属性和非金属性的强弱有何特点?试分析原因。
②判断下列物质是否为离子化合物。说明原因。
AlCl3 MgF2 CuS
K Na Mg Al Fe
Si P S Cl
金属性
非金属性
组成元素角度
探究离子键的形成条件
【例】NaOH KOH Ca(OH)2
NH4Cl CaSO4 Na2CO3 KNO3
D.CaF2中的离子键就是使Ca2+和F-结合成CaF2的静电引力
A.CaF2中存在Ca2+和F-两种离子
B.CaF2是离子化合物
C.熔融状态的CaF2可以导电
2、下列有关CaF2的说法错误的是( )
2.大部分金属阳离子(或NH4+)与带负电荷的阴离子结合。
物质类别角度
学会用电子式表示原子、离子、离子化合物
思考:① Na与Cl形成NaCl的过程中,两种原子的所有电子层都发生电子得失了吗?
②用原子结构示意图表示离子键的形成过程非常繁琐,你能提出改进的思路吗?
电子式:在元素符号周围用“·”或“×”表示原子的最外层电子(价电子)的式子。
(1)原子的电子式
Na
×
Mg
×
×
原子
电子式
Al
×
×
×
Si
·
·
·
·
P
·
·
··
·
S
·
·
··
··
Cl
·
··
··
··
··
Ar
··
··
··
Na
Mg
Al
Si
P
S
Cl
Ar
1、把最外层的电子优先分布在不同的方向上
2、每个方向上最多2个电子
先分散,后集中
学会用电子式表示原子、离子、离子化合物
⑵离子的电子式
离子
电子式
Na+
Mg2+
Al3+
S2-
Cl-
Na+
Mg2+
Al3+
[ ]
··
S
··
··
··
2-
[ ]
··
Cl
··
··
··
-
离子化合物
电子式
NaCl
MgCl2
Na2S
Na+
Mg2+
[ ]
··
S
··
··
··
2-
[ ]
··
Cl
··
··
··
-
[ ]
··
Cl
··
··
··
-
[ ]
··
Cl
··
··
··
-
Na+
Na+
⑶离子化合物的电子式
简单阳离子
简单阴离子
不但要画出最外层电子,且要用括号“[ ]”括起来,并在右上角标出离子所带电荷数(“n-”)
直接用离子符号表示
由阴、阳离子的电子式组成,相同离子不能合并
课堂练习
3.有同学认为Li原子核外有3个电子,故Li原子的电子式为 。你是否同意该同学的看法?
Li
×
×
×
4.请写出下列微粒或离子化合物的电子式。
⑴ K、Ca、O、F
⑵ K+、Ca2+、O2-、F-
⑶ KF、CaF2、K2O
K
×
Ca
×
×
··
··
·
·
O
··
··
··
·
F
K+
Ca2+
[ ]
··
··
··
··
O
2-
[ ]
··
··
··
F
··
-
K+
[ ]
··
··
··
F
··
-
[ ]
··
··
··
F
··
-
Ca2+
[ ]
··
··
··
F
··
-
[ ]
··
··
··
··
O
2-
K+
K+
了解用电子式表示离子化合物的形成过程
符号表征
思考:如何用电子式表示离子化合物的形成过程?
【例】用电子式表示NaCl 、MgCl2 、Na2S的形成过程
MgCl2
Na2S
NaCl
Na
×
+
Na+
·
Cl
··
··
··
[ ]
·
Cl
··
··
··
-
×
·
Cl
··
··
··
Cl
··
··
·
··
Mg
×
×
+
+
Mg2+
[ ]
··
Cl
··
··
·
-
×
[ ]
·
Cl
··
··
··
-
×
Na
×
+
Na
×
+
Na+
Na+
[ ]
·
S
··
··
·
2-
×
×
S
·
·
··
··
书写要点:
①左侧写原子的电子式
④右侧写化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
⑤ 左边相同原子可合并写,右边相同离子不合并
课堂练习
5.用电子式表示下列离子化合物的形成过程:KF、CaF2、K2O。
··
·
··
F
··
CaF2
K2O
Ca
×
×
+
+
Mg2+
K
×
+
K
×
+
[ ]
··
·
··
F
··
-
×
×
[ ]
·
·
··
··
O
2-
×
·
··
··
··
F
[ ]
·
··
··
··
F
-
×
··
··
·
·
O
K+
K+
KF
K
×
+
K+
·
··
··
··
F
[ ]
·
··
··
··
F
-
×
课堂练习
物质类别 常见代表物 性质特点
离子化合物 NaOH、NaCl、MgCl2、KCl、Na2SO4、NH4Cl、Na2O、MgO 强碱、大多数盐及金属氧化物 熔融态能导电
熔沸点高、硬度大、难挥发
电子
得失
得电子
阴离子
阳离子
相互
作用
离子键
离子化合物
失电子
水或熔融态
电离
阴离子
阳离子
原子
课堂练习
1、下列说法正确的是( )
A.非金属元素的原子间不能形成离子化合物
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
2、下列物质中,含硫离子的是( )
A.硫化氢 B.二硫化碳
C.硫化钙 D.二氧化硫
3、下列性质可证明某化合物中一定存在离子键的是( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
D
C
D
课后思考
合金·铁合金
铝与铝合金
新型合金
Cl
·
··
··
··
Cl
·
··
··
··
得1e-
得1e-
8e-稳定结构
8e-稳定结构
已知氯气分子中含有2个氯原子:Cl2
安全提示:上下楼梯勿拥挤
THANKS
离子键
新人教版·必修一·第四章
第三节·化学键·第一课时
宏观角度,感受化学键的存在
思考:一百多种元素怎样能够形成上亿种物质?原子之间通过什么作用形成丰富的物质?
“缘”何而“聚”?
宏观角度,感受化学键的存在
物质 导电性
干燥的NaCl 不导电
熔融的NaCl 导电
氯化钠晶体
氯化钠晶体结构
电解熔融氯化钠实验
由此可知,NaCl由Na+与Cl-直接构成
微观探析,认识离子键的形成
思考与交流:请结合钠和氯的原子结构分析NaCl的形成
Na+
Cl-
电子转移
1
不稳定
稳 定
失去1e-
得到1e-
7
分组讨论:
① NaCl固体是否导电?
② NaCl固体中Na+与Cl-是否可以自由移动?
③如果不能自由移动,你认为是什么原因所致? Na+与Cl-间是否存在某种作用力?
④为何在水溶液或熔融状态下, Na+与Cl-可以自由移动?
图1 干燥的NaCl固体不导电
图2 熔融的NaCl固体能够导电
探究NaCl中Na+与Cl-间作用力的存在
离子键:带相反电荷的离子之间的相互作用。
乒乓球
类比
离子
连接作用
分组讨论:
①Na+与Cl-所带电荷类型(正、负)分别是什么?
②Na+与Cl-相互作用的本质是什么?
③结合原子结构示意图,你认为Na+与Cl-可以无限靠近(两个原子核“紧挨”)吗?
④有人认为Na+与Cl-之间只存在引力,不存在斥力。试阐述你对该问题的看法。
探究离子键的本质
Cl-
Na+
离子键:带相反电荷的离子之间的相互作用。
探究离子键的本质
5
+
+
+
+
+
+
+
+
+
+
+
—
—
—
—
—
—
—
—
—
—
+
+
+
+
+
+
+
+
+
—
—
—
—
—
—
—
—
—
—
+
+
+
+
+
+
+
+
—
—
—
—
—
—
—
—
Cl-
Na+
离子键的本质:静电作用(包含引力与斥力)
斥力
引力
Na+和Cl-(带异性电荷)间的相互吸引作用
电子与电子、原子核与原子核间(带同性电荷)的相互排斥作用
平衡
2
+11
8
1
探究离子键的形成意义
2
+11
8
2
+17
8
7
Na
Cl
Na+
Cl-
2
+17
8
8
失1e-
离子键
NaCl
离子化合物:由离子键构成的化合物
离子化合物
活动:试从原子结构角度比较下列两组微粒的稳定性
得1e-
化合物的另一分类
探究离子键的形成意义
模型抽象
决定
规律结构
规则外观
结构决定性质
探究离子键的形成意义
讨论:离子键的形成意义
物质由高能状态自发地转变为低能状态是自然界的普遍规律,即能量越低越稳定。
不稳定
稳定
释放能量
金属原子
非金属原子
失电子
得电子
金属离子
非金属离子
离子键
离子化合物
问题:什么元素间可形成离子键?
一般是活泼金属元素与活泼非金属元素
小结
1、下列元素原子,最难形成离子键的是
A.K B.Ca C.S D.C
思考:离子键的形成条件有哪些?
1
2
3
4
定义
5
成键粒子
成键本质
成键元素
判断
带相反电荷离子之间的相互作用
阴阳离子
静电作用
一般是活泼金属元素与活泼非金属元素
(静电引力和斥力)
探究离子键的形成条件
1. 活泼金属单质与活泼非金属单质化合
【例】NaCl MgCl2 CaO K2O NaF CaF2 Na2S K2S
思考:根据离子键的形成过程,
①金属与非金属为什么必须要求“活泼”?
②所有金属与非金属化合形成的化合物都是离子化合物吗?
讨论:以下为几种常见的金属单质和非金属单质。能形成离子键的组合已用短线相连。
①形成离子键的单质,其金属性和非金属性的强弱有何特点?试分析原因。
②判断下列物质是否为离子化合物。说明原因。
AlCl3 MgF2 CuS
K Na Mg Al Fe
Si P S Cl
金属性
非金属性
组成元素角度
探究离子键的形成条件
【例】NaOH KOH Ca(OH)2
NH4Cl CaSO4 Na2CO3 KNO3
D.CaF2中的离子键就是使Ca2+和F-结合成CaF2的静电引力
A.CaF2中存在Ca2+和F-两种离子
B.CaF2是离子化合物
C.熔融状态的CaF2可以导电
2、下列有关CaF2的说法错误的是( )
2.大部分金属阳离子(或NH4+)与带负电荷的阴离子结合。
物质类别角度
学会用电子式表示原子、离子、离子化合物
思考:① Na与Cl形成NaCl的过程中,两种原子的所有电子层都发生电子得失了吗?
②用原子结构示意图表示离子键的形成过程非常繁琐,你能提出改进的思路吗?
电子式:在元素符号周围用“·”或“×”表示原子的最外层电子(价电子)的式子。
(1)原子的电子式
Na
×
Mg
×
×
原子
电子式
Al
×
×
×
Si
·
·
·
·
P
·
·
··
·
S
·
·
··
··
Cl
·
··
··
··
··
Ar
··
··
··
Na
Mg
Al
Si
P
S
Cl
Ar
1、把最外层的电子优先分布在不同的方向上
2、每个方向上最多2个电子
先分散,后集中
学会用电子式表示原子、离子、离子化合物
⑵离子的电子式
离子
电子式
Na+
Mg2+
Al3+
S2-
Cl-
Na+
Mg2+
Al3+
[ ]
··
S
··
··
··
2-
[ ]
··
Cl
··
··
··
-
离子化合物
电子式
NaCl
MgCl2
Na2S
Na+
Mg2+
[ ]
··
S
··
··
··
2-
[ ]
··
Cl
··
··
··
-
[ ]
··
Cl
··
··
··
-
[ ]
··
Cl
··
··
··
-
Na+
Na+
⑶离子化合物的电子式
简单阳离子
简单阴离子
不但要画出最外层电子,且要用括号“[ ]”括起来,并在右上角标出离子所带电荷数(“n-”)
直接用离子符号表示
由阴、阳离子的电子式组成,相同离子不能合并
课堂练习
3.有同学认为Li原子核外有3个电子,故Li原子的电子式为 。你是否同意该同学的看法?
Li
×
×
×
4.请写出下列微粒或离子化合物的电子式。
⑴ K、Ca、O、F
⑵ K+、Ca2+、O2-、F-
⑶ KF、CaF2、K2O
K
×
Ca
×
×
··
··
·
·
O
··
··
··
·
F
K+
Ca2+
[ ]
··
··
··
··
O
2-
[ ]
··
··
··
F
··
-
K+
[ ]
··
··
··
F
··
-
[ ]
··
··
··
F
··
-
Ca2+
[ ]
··
··
··
F
··
-
[ ]
··
··
··
··
O
2-
K+
K+
了解用电子式表示离子化合物的形成过程
符号表征
思考:如何用电子式表示离子化合物的形成过程?
【例】用电子式表示NaCl 、MgCl2 、Na2S的形成过程
MgCl2
Na2S
NaCl
Na
×
+
Na+
·
Cl
··
··
··
[ ]
·
Cl
··
··
··
-
×
·
Cl
··
··
··
Cl
··
··
·
··
Mg
×
×
+
+
Mg2+
[ ]
··
Cl
··
··
·
-
×
[ ]
·
Cl
··
··
··
-
×
Na
×
+
Na
×
+
Na+
Na+
[ ]
·
S
··
··
·
2-
×
×
S
·
·
··
··
书写要点:
①左侧写原子的电子式
④右侧写化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
⑤ 左边相同原子可合并写,右边相同离子不合并
课堂练习
5.用电子式表示下列离子化合物的形成过程:KF、CaF2、K2O。
··
·
··
F
··
CaF2
K2O
Ca
×
×
+
+
Mg2+
K
×
+
K
×
+
[ ]
··
·
··
F
··
-
×
×
[ ]
·
·
··
··
O
2-
×
·
··
··
··
F
[ ]
·
··
··
··
F
-
×
··
··
·
·
O
K+
K+
KF
K
×
+
K+
·
··
··
··
F
[ ]
·
··
··
··
F
-
×
课堂练习
物质类别 常见代表物 性质特点
离子化合物 NaOH、NaCl、MgCl2、KCl、Na2SO4、NH4Cl、Na2O、MgO 强碱、大多数盐及金属氧化物 熔融态能导电
熔沸点高、硬度大、难挥发
电子
得失
得电子
阴离子
阳离子
相互
作用
离子键
离子化合物
失电子
水或熔融态
电离
阴离子
阳离子
原子
课堂练习
1、下列说法正确的是( )
A.非金属元素的原子间不能形成离子化合物
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
2、下列物质中,含硫离子的是( )
A.硫化氢 B.二硫化碳
C.硫化钙 D.二氧化硫
3、下列性质可证明某化合物中一定存在离子键的是( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
D
C
D
课后思考
合金·铁合金
铝与铝合金
新型合金
Cl
·
··
··
··
Cl
·
··
··
··
得1e-
得1e-
8e-稳定结构
8e-稳定结构
已知氯气分子中含有2个氯原子:Cl2
安全提示:上下楼梯勿拥挤
THANKS
