4.2元素周期律 课件(共22张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2元素周期律 课件(共22张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 17:07:02 | ||
图片预览




文档简介
(共22张PPT)
元素周期律
新人教版·必修一·第四章
第二节·元素周期律·第一课时
情境1:钠、镁、铝电池相继问世
锂电池(1970)
问题1:为什么科学家们相继研发了钠、镁、铝电池作为替代锂的电池材料?
成本、储量、性质...
用途
性质
反映
Li、Na 同主族
Na、Mg、Al同周期
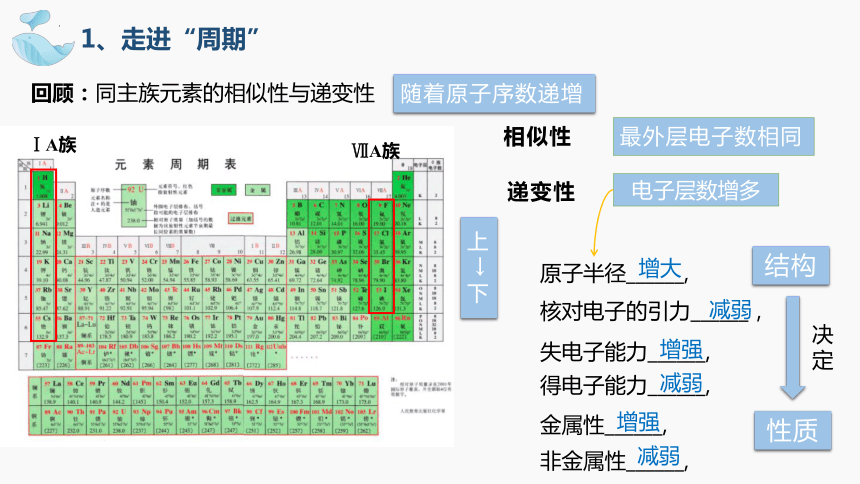
1、走进“周期”
回顾:同主族元素的相似性与递变性
相似性
递变性
最外层电子数相同
上
↓
下
ⅠA族
ⅦA族
电子层数增多
原子半径______,
失电子能力______,
得电子能力______,
金属性______,
非金属性______,
结构
性质
增大
增强
减弱
增强
减弱
随着原子序数递增
核对电子的引力______,
减弱
决定
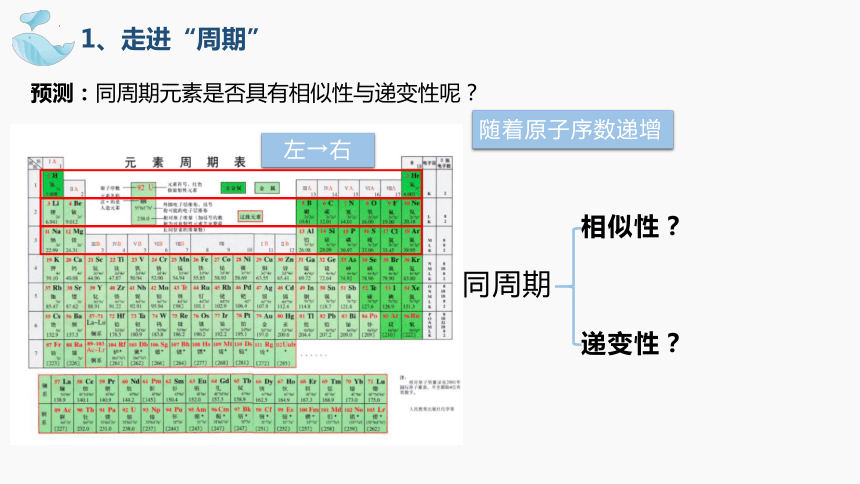
1、走进“周期”
预测:同周期元素是否具有相似性与递变性呢?
左→右
相似性?
递变性?
同周期
随着原子序数递增
1、走进“周期”
问题2:你怎么理解“周期”?
1、走进“周期”
绝非简单的重复轮回!
而是向前发展的!
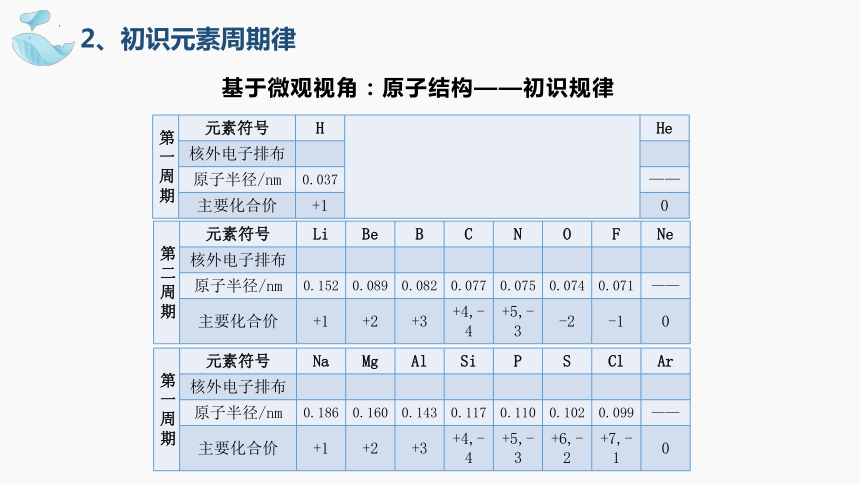
基于微观视角:原子结构——初识规律
2、初识元素周期律
第一周期 元素符号 H He
核外电子排布
原子半径/nm 0.037 ——
主要化合价 +1 0
第二周期 元素符号 Li Be B C N O F Ne
核外电子排布
原子半径/nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 ——
主要化合价 +1 +2 +3 +4,-4 +5,-3 -2 -1 0
第一周期 元素符号 Na Mg Al Si P S Cl Ar
核外电子排布
原子半径/nm 0.186 0.160 0.143 0.117 0.110 0.102 0.099 ——
主要化合价 +1 +2 +3 +4,-4 +5,-3 +6,-2 +7,-1 0
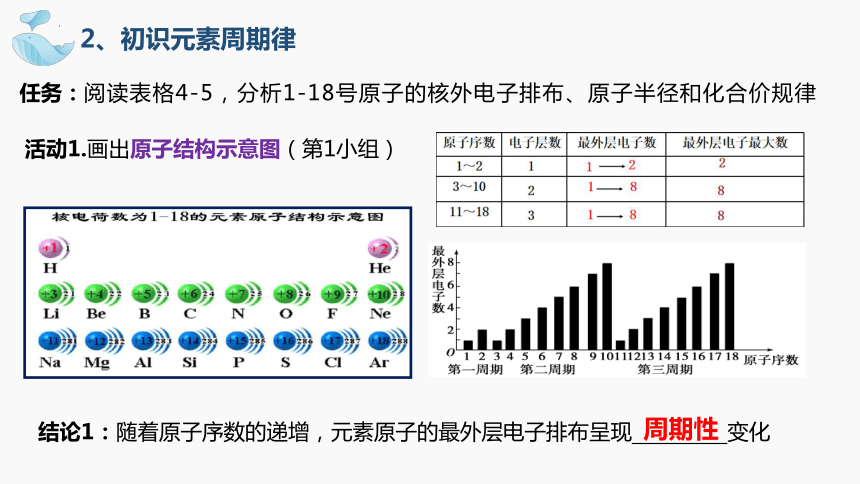
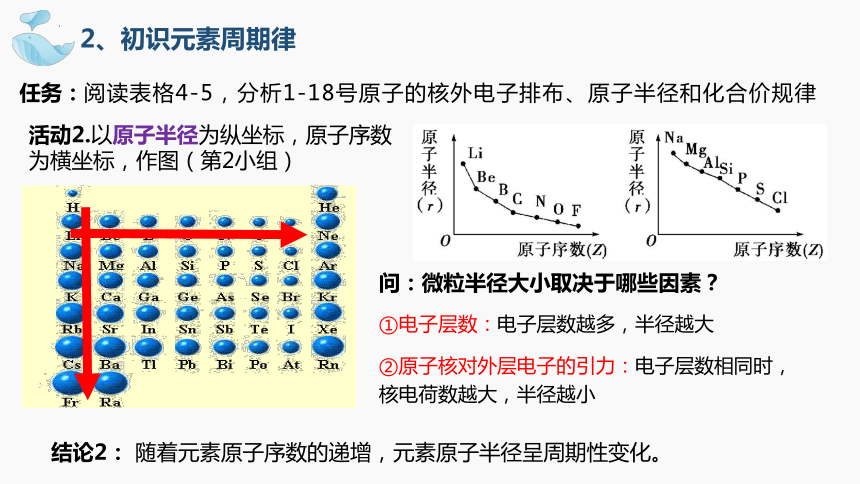
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
相似性
递变性
电子层数相同
最外层电子数______,
原子半径______,
最高正化合价______,
增多
增加
减小
最低负化合价______,
增加
活动1.画出原子结构示意图(第1小组)
活动2.以原子半径为纵坐标,原子序数为横坐标,作图(第2小组)
活动3.以最高正化合价、最低负化合价为纵坐标,原子序数为横坐标,作图(第3小组)
核电荷数增加
2、初识元素周期律
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
2、初识元素周期律
活动1.画出原子结构示意图(第1小组)
结论1:随着原子序数的递增,元素原子的最外层电子排布呈现 变化
周期性
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
2、初识元素周期律
活动2.以原子半径为纵坐标,原子序数为横坐标,作图(第2小组)
结论2: 随着元素原子序数的递增,元素原子半径呈周期性变化。
问:微粒半径大小取决于哪些因素?
①电子层数:电子层数越多,半径越大
②原子核对外层电子的引力:电子层数相同时,核电荷数越大,半径越小
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
2、初识元素周期律
活动3.以最高正化合价、最低负化合价为纵坐标,原子序数为横坐标,作图(第3小组)
最高正价=最外层电子数(除O、F无正价)
最高正价+|最低负价|= 8
结论3:随着原子序数的递增,元素的化合价呈现 的变化。
周期性
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
2、初识元素周期律
原子序数 电子层数 最外层电子数 原子半径的变化(不考虑稀有气体元素) 最高或最低化合价的变化
1~2 ———
3~10
11~18 结论 1
2
3
1
2
1
8
1
8
大→小
+1 +5
- 4→ - 1→ 0
随着原子序数的递增,元素原子的电子排布、原子半径、化合价呈现周期性变化
大→小
+1 +7
- 4→ - 1
+1
0
2、初识元素周期律
任务2:根据以上规律,预测第三周期元素金属性与非金属性的递变规律
原子半径______
减小
随着原子序数递增
(左→右)
核对电子的引力______
增强
失电子能力______
得电子能力______
金属性______
非金属性______
增强
增强
减弱
减弱
结构
性质
决定
电子层数相同
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
3、探究元素周期律
基于宏观视角:元素性质——探究规律
金属单质的化学性质:
与氧气反应
与水反应
与酸反应
单质间的置换反应
非金属单质的化学性质:
与氢气反应
单质间的置换反应
金属性
非金属性
最高价氧化物对应的水化物
的碱性强弱
最高价氧化物对应的水化物
的酸性强弱
判断依据
Na Mg Al
Si P S Cl
任务:探究第三周期元素金属性周期性变化规律 P103
3、探究元素周期律
比较Na与Mg金属性
比较Mg与Al金属性
Na与水反应 Mg与水反应
在冷水中
加热至沸腾
实验结论 浮、熔、游、响、红
无明显变化
产生大量气泡,溶液显红色
反应条件反映了发生反应的难易程度
Mg(OH)2的性质 Al(OH)3的性质
加稀盐酸
加NaOH溶液
实验结论 (实验前去除金属表面氧化膜;在水中加入酚酞溶液)
(碱的制备:利用MgCl2溶液+氨水 ; AlCl3溶液+氨水)
无明显变化
白色固体溶解
白色固体溶解
白色固体溶解
能与强碱反应,表明Al(OH)3已具有一定的非金属性
Mg与水反应比Na与水反应
对反应条件的要求更加苛刻
因此:Na的金属性比Mg强
Mg(OH)2只能溶解于酸,Al(OH)3在酸或强碱中都能溶解
因此:Mg的金属性比Al强
任务:探究第三周期元素金属性周期性变化规律 P103
3、探究元素周期律
比较Na、Mg、Al金属性
金属元素 Na Mg Al
最高价氧化物对应水化物 的碱性强弱 NaOH 强碱 Mg(OH)2 中强碱 Al(OH)3
两性氢氧化物
结论:随原子序数递增,第三周期元素金属性逐渐减弱
任务:探究第三周期元素非金属性周期性变化规律 P103
3、探究元素周期律
比较Si、P、S、Cl非金属性
非金属元素 Si P S Cl
最高价氧化物对应水化物 的酸性强弱 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4
强酸
(比H2SO4强)
结论:随原子序数递增,第三周期元素非金属性逐渐增强
4、整合元素周期律
原子序数 11 12 13 14 15 16 17 18
元素符号 Na Mg Al Si P S Cl Ar
单质和水(或酸)反应情况 冷水剧烈 热水较快 盐酸剧烈 盐酸较快
高温
磷蒸气与H2能反应
须加热
光照或点燃爆炸化合
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢
氧化物
H4SiO4
弱酸
H3PO4
中强酸
H2SO4
强酸
HClO4
最强酸
稀有气体元素
非金属单质与氢气反应
最高价氧化物对应水化物的酸碱性
金属性和非金属性递变
金属性逐渐减弱,非金属性逐渐增强
4、整合元素周期律
实质上是_____________周期性变化
导致的必然结果
元素周期律
元素的性质随着______________而呈周期性的变化
原子序数递增
核外电子排布
基于宏观视角与微观视角:解释规律
性质
结构
反映
4、整合元素周期律
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属
金属
4、整合元素周期律
1、下列说法能证明钾元素比镁元素金属性强的是( )
A.金属钾与冷水剧烈反应,镁与冷水几乎没有现象
KOH的碱性比Mg(OH)2强
金属钾与MgCl2的水溶液反应可置换出金属镁
D.在化学反应中,钾失去1个电子,镁失去2个电子
AB
2、下列说法能够证明氯元素的非金属性比硫元素强的是( )
A. HClO3的酸性比H2SO3
B. HCl的酸性比H2S强
C. HCl的稳定性比H2S强
D. 氯气与氢气化合的条件要比硫与氢气化合的条件更容易
CD
4、整合元素周期律
3、下列各组微粒半径大小比较中,不正确的是( )
r(K) > r(Na) > r(Li) B. r(Mg2+) > r(Na+) > r(F-)
r(Na+) > r(Mg2+) > r(Al3+) D. R(Cl-) > r(F-) > r(F)
B
5、短周期主族元素中,最高价氧化物的水化物酸性最强的是 。
碱性最强的是 。气态氢化物稳定性最强的是 。
NaOH
HClO4
HF
4、某元素最高价氧化物对应的水化物的化学式为H2XO3 ,这种元素的气态氢化物的化学式为( )
A. HX B.H2X C. XH3 D. XH4
D
THANKS
元素周期律
新人教版·必修一·第四章
第二节·元素周期律·第一课时
情境1:钠、镁、铝电池相继问世
锂电池(1970)
问题1:为什么科学家们相继研发了钠、镁、铝电池作为替代锂的电池材料?
成本、储量、性质...
用途
性质
反映
Li、Na 同主族
Na、Mg、Al同周期
1、走进“周期”
回顾:同主族元素的相似性与递变性
相似性
递变性
最外层电子数相同
上
↓
下
ⅠA族
ⅦA族
电子层数增多
原子半径______,
失电子能力______,
得电子能力______,
金属性______,
非金属性______,
结构
性质
增大
增强
减弱
增强
减弱
随着原子序数递增
核对电子的引力______,
减弱
决定
1、走进“周期”
预测:同周期元素是否具有相似性与递变性呢?
左→右
相似性?
递变性?
同周期
随着原子序数递增
1、走进“周期”
问题2:你怎么理解“周期”?
1、走进“周期”
绝非简单的重复轮回!
而是向前发展的!
基于微观视角:原子结构——初识规律
2、初识元素周期律
第一周期 元素符号 H He
核外电子排布
原子半径/nm 0.037 ——
主要化合价 +1 0
第二周期 元素符号 Li Be B C N O F Ne
核外电子排布
原子半径/nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 ——
主要化合价 +1 +2 +3 +4,-4 +5,-3 -2 -1 0
第一周期 元素符号 Na Mg Al Si P S Cl Ar
核外电子排布
原子半径/nm 0.186 0.160 0.143 0.117 0.110 0.102 0.099 ——
主要化合价 +1 +2 +3 +4,-4 +5,-3 +6,-2 +7,-1 0
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
相似性
递变性
电子层数相同
最外层电子数______,
原子半径______,
最高正化合价______,
增多
增加
减小
最低负化合价______,
增加
活动1.画出原子结构示意图(第1小组)
活动2.以原子半径为纵坐标,原子序数为横坐标,作图(第2小组)
活动3.以最高正化合价、最低负化合价为纵坐标,原子序数为横坐标,作图(第3小组)
核电荷数增加
2、初识元素周期律
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
2、初识元素周期律
活动1.画出原子结构示意图(第1小组)
结论1:随着原子序数的递增,元素原子的最外层电子排布呈现 变化
周期性
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
2、初识元素周期律
活动2.以原子半径为纵坐标,原子序数为横坐标,作图(第2小组)
结论2: 随着元素原子序数的递增,元素原子半径呈周期性变化。
问:微粒半径大小取决于哪些因素?
①电子层数:电子层数越多,半径越大
②原子核对外层电子的引力:电子层数相同时,核电荷数越大,半径越小
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
2、初识元素周期律
活动3.以最高正化合价、最低负化合价为纵坐标,原子序数为横坐标,作图(第3小组)
最高正价=最外层电子数(除O、F无正价)
最高正价+|最低负价|= 8
结论3:随着原子序数的递增,元素的化合价呈现 的变化。
周期性
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
2、初识元素周期律
原子序数 电子层数 最外层电子数 原子半径的变化(不考虑稀有气体元素) 最高或最低化合价的变化
1~2 ———
3~10
11~18 结论 1
2
3
1
2
1
8
1
8
大→小
+1 +5
- 4→ - 1→ 0
随着原子序数的递增,元素原子的电子排布、原子半径、化合价呈现周期性变化
大→小
+1 +7
- 4→ - 1
+1
0
2、初识元素周期律
任务2:根据以上规律,预测第三周期元素金属性与非金属性的递变规律
原子半径______
减小
随着原子序数递增
(左→右)
核对电子的引力______
增强
失电子能力______
得电子能力______
金属性______
非金属性______
增强
增强
减弱
减弱
结构
性质
决定
电子层数相同
任务:阅读表格4-5,分析1-18号原子的核外电子排布、原子半径和化合价规律
3、探究元素周期律
基于宏观视角:元素性质——探究规律
金属单质的化学性质:
与氧气反应
与水反应
与酸反应
单质间的置换反应
非金属单质的化学性质:
与氢气反应
单质间的置换反应
金属性
非金属性
最高价氧化物对应的水化物
的碱性强弱
最高价氧化物对应的水化物
的酸性强弱
判断依据
Na Mg Al
Si P S Cl
任务:探究第三周期元素金属性周期性变化规律 P103
3、探究元素周期律
比较Na与Mg金属性
比较Mg与Al金属性
Na与水反应 Mg与水反应
在冷水中
加热至沸腾
实验结论 浮、熔、游、响、红
无明显变化
产生大量气泡,溶液显红色
反应条件反映了发生反应的难易程度
Mg(OH)2的性质 Al(OH)3的性质
加稀盐酸
加NaOH溶液
实验结论 (实验前去除金属表面氧化膜;在水中加入酚酞溶液)
(碱的制备:利用MgCl2溶液+氨水 ; AlCl3溶液+氨水)
无明显变化
白色固体溶解
白色固体溶解
白色固体溶解
能与强碱反应,表明Al(OH)3已具有一定的非金属性
Mg与水反应比Na与水反应
对反应条件的要求更加苛刻
因此:Na的金属性比Mg强
Mg(OH)2只能溶解于酸,Al(OH)3在酸或强碱中都能溶解
因此:Mg的金属性比Al强
任务:探究第三周期元素金属性周期性变化规律 P103
3、探究元素周期律
比较Na、Mg、Al金属性
金属元素 Na Mg Al
最高价氧化物对应水化物 的碱性强弱 NaOH 强碱 Mg(OH)2 中强碱 Al(OH)3
两性氢氧化物
结论:随原子序数递增,第三周期元素金属性逐渐减弱
任务:探究第三周期元素非金属性周期性变化规律 P103
3、探究元素周期律
比较Si、P、S、Cl非金属性
非金属元素 Si P S Cl
最高价氧化物对应水化物 的酸性强弱 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4
强酸
(比H2SO4强)
结论:随原子序数递增,第三周期元素非金属性逐渐增强
4、整合元素周期律
原子序数 11 12 13 14 15 16 17 18
元素符号 Na Mg Al Si P S Cl Ar
单质和水(或酸)反应情况 冷水剧烈 热水较快 盐酸剧烈 盐酸较快
高温
磷蒸气与H2能反应
须加热
光照或点燃爆炸化合
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢
氧化物
H4SiO4
弱酸
H3PO4
中强酸
H2SO4
强酸
HClO4
最强酸
稀有气体元素
非金属单质与氢气反应
最高价氧化物对应水化物的酸碱性
金属性和非金属性递变
金属性逐渐减弱,非金属性逐渐增强
4、整合元素周期律
实质上是_____________周期性变化
导致的必然结果
元素周期律
元素的性质随着______________而呈周期性的变化
原子序数递增
核外电子排布
基于宏观视角与微观视角:解释规律
性质
结构
反映
4、整合元素周期律
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属
金属
4、整合元素周期律
1、下列说法能证明钾元素比镁元素金属性强的是( )
A.金属钾与冷水剧烈反应,镁与冷水几乎没有现象
KOH的碱性比Mg(OH)2强
金属钾与MgCl2的水溶液反应可置换出金属镁
D.在化学反应中,钾失去1个电子,镁失去2个电子
AB
2、下列说法能够证明氯元素的非金属性比硫元素强的是( )
A. HClO3的酸性比H2SO3
B. HCl的酸性比H2S强
C. HCl的稳定性比H2S强
D. 氯气与氢气化合的条件要比硫与氢气化合的条件更容易
CD
4、整合元素周期律
3、下列各组微粒半径大小比较中,不正确的是( )
r(K) > r(Na) > r(Li) B. r(Mg2+) > r(Na+) > r(F-)
r(Na+) > r(Mg2+) > r(Al3+) D. R(Cl-) > r(F-) > r(F)
B
5、短周期主族元素中,最高价氧化物的水化物酸性最强的是 。
碱性最强的是 。气态氢化物稳定性最强的是 。
NaOH
HClO4
HF
4、某元素最高价氧化物对应的水化物的化学式为H2XO3 ,这种元素的气态氢化物的化学式为( )
A. HX B.H2X C. XH3 D. XH4
D
THANKS
